Method Article
Verhaltensaufgaben zur Untersuchung der Identitätserkennung bei Mäusen
In diesem Artikel
Zusammenfassung
Durch die Paarung von negativ oder positiv valenzierten Erfahrungen mit individuellen sozialen Zielen entwickelten wir Verhaltensaufgaben zur Untersuchung der Identitätserkennung von C57BL/6-Mäusen. Diese Aufgaben ermöglichen die Untersuchung von Mechanismen des sozialen Gedächtnisses individueller sozialer Ziele in gesunden und krankheitsbedingten Mausmodellen mit beeinträchtigter sozialer Kognition.
Zusammenfassung
Soziale Tiere, wie Nagetiere, sind in der Lage, die Identität vertrauter Individuen zu erkennen und zu unterscheiden. Das Erkennen der Identität vertrauter Personen ist wichtig für die Entwicklung sozialer Strukturen wie Hierarchie, Verwandtschaft und Familie. Die Mechanismen, die der Anerkennung sozialer Identität zugrunde liegen, sind jedoch unklar. Die meisten Nagetierstudien zur sozialen Anerkennung basieren auf der Neigung von Nagetieren, mit einem neuen sozialen Ziel zu interagieren, ein Phänomen, das als soziale Neuheit bekannt ist. Verhaltensaufgaben zur Untersuchung sozialer Neuheit können jedoch nicht das Erkennen vertrauter Artgenossen anhand ihrer Identitäten aufzeigen. Hier werden Verhaltensaufgaben vorgestellt, die es ermöglichen, die Identitätserkennung in C57BL/6-Mäusen zu untersuchen, indem zwei vertraute Mäuse mit oder ohne valenzierte Erfahrung assoziiert werden. Die Probanden hatten Interaktionen mit zwei Mäusen, entweder ohne (neutral) oder mit einer valenzierten Erfahrung (negativ oder positiv) und machten sich mit diesen Mäusen vertraut. Die negativ valenzierte Maus war mit Schocks verbunden, während die positiv valenzierte Maus mit einer Futterbelohnung verbunden war. Nach dem Training kann das Erkennen der Identität dieser vertrauten Mäuse in einem sozialen Diskriminierungstest nachgewiesen werden, der als Präferenz für die positiv valenzierte Maus und Vermeidung der negativ valenzierten Maus im Vergleich zur neutralen Maus dargestellt wird. Verhaltensaufgaben zur Identitätserkennung könnten nützlich sein, um die Mechanismen des sozialen Gedächtnisses und die Pathophysiologie von Störungen mit beeinträchtigter sozialer Kognition, wie z.B. Autismus-Spektrum-Störung oder Schizophrenie, zu untersuchen.
Einleitung
Die Identitätserkennung oder die Fähigkeit, vertraute Individuen anhand früherer Erfahrungen zu identifizieren, ist entscheidend für das Überleben sozialer Tiere1. Bei Nagetieren sind die soziale Hierarchie, die Erkennung von Partnern und Nachkommen, die Verteidigung des Territoriums sowie die Etablierung und Aufrechterhaltung von Gruppen Verhaltensweisen, die für eine erfolgreiche Identitätserkennung erforderlich sind 2,3. Das derzeitige Verständnis des sozialen Gedächtnisses basiert auf Nagetierstudien, die in der Fähigkeit wurzeln, neue und bekannte Artgenossen zu identifizieren. Diese Aufgaben waren nützlich, um Gehirnregionen aufzudecken, von denen angenommen wird, dass sie das soziale Gedächtnis vermitteln, wie z. B. die hippokampale CA24 und die ventralen CA1-Regionen5. Solche Studien sind jedoch bei der Aufklärung der Mechanismen, die der Identitätserkennung zugrunde liegen, begrenzt, da sie auf die kategorische Anerkennung sozialer Neuheit beschränkt sind.
Identitätserkennung wurde unabhängig von sozialer Neuheit durch assoziative Lernparadigmen demonstriert, bei denen valenzierte hervorstechende Erfahrungen mit einem von zwei (oder mehr) vertrauten sozialen Zielen verbunden sind. Diese Aufgaben basieren auf der Vorstellung, dass soziale Interaktionen oft mit emotionaler Bedeutung verbunden sind, wobei negative Erfahrungen zu konfliktverhindernden Verhaltensweisen führen, während spielerische oder fördernde Interaktionen im Allgemeinen lohnend sind. Der emotionale Affekt, der mit Interaktionen verbunden ist, wird als soziale Valenz bezeichnet. Männliche Goldhamster waren in der Lage, zwischen zwei bekannten Artgenossen zu unterscheiden, wenn eines sie zuvor angegriffen hatte6. Das Wiedererkennungsgedächtnis einzelner männlicher Wistar-Ratten war auch wichtig für die Etablierung des sozialen Rangs7.
Kürzlich wurde die Identitätserkennung in C57BL/6-Mäusen, dem am weitesten verbreiteten Mausstamm in der neurowissenschaftlichen Forschung, untersucht, indem einzelne C57BL/6-Mäuse mit oder ohne appetitive Stimuli assoziiert wurden8. Bei diesem Ansatz wurden Mausen mit festem Kopf Hunderten von Trainingsversuchen unterzogen, was die Verwendung zur Untersuchung naturalistischer Verhaltensweisen bei frei beweglichen Mäusen einschränkte. In anderen Studien wurde die Identitätserkennung von C57BL/6-Mäusen durch die Präferenz von Artgenossen, die mit Ethanol verabreicht wurden, unterstützt 9,10. Nichtsdestotrotz kann die Verabreichung von Substanzen zu Verwirrungen führen. Schließlich wurden nur wenige dieser Studien verwendet, um die Identitätserkennung bei Nagetieren beiderlei Geschlechts zu untersuchen. Eine leicht anwendbare Methode, die sowohl auf männliche als auch auf weibliche C57BL/6-Mäuse anwendbar ist, ist ein entscheidendes Werkzeug für die Erforschung der Identitätserkennung.
Hier werden Identitätserkennungsparadigmen vorgestellt, die sowohl bei männlichen als auch bei weiblichen Mäusen eingesetzt werden können. Um Identität unabhängig von den Auswirkungen des Neuen zu untersuchen, werden zwei bekannte soziale Ziele verwendet, und eines dieser Ziele ist mit einer hervorstechenden emotionalen Erfahrung verbunden, von der angenommen wird, dass sie das Interaktionsverhalten beeinflusst. Für die Assoziation mit negativer sozialer Valenz wurde ein Ansatz angepasst, der der Konditionierung sozialer Angst ähnelt, um eine Vermeidung in Richtung eines bestimmten sozialen Ziels hervorzurufen11. Wenn eine negative soziale Valenz, wie z. B. ein aversiver Fußschock, mit einer Person verbunden ist, wäre eine verminderte Interaktion mit dem sozialen Ziel zu erwarten. Umgekehrt, wenn eine positive soziale Valenz, wie z. B. eine appetitive Belohnung, mit einem bestimmten Individuum verbunden ist, würde bei nachfolgenden Tests eine erhöhte Interaktion mit dieser Maus zu erwarten sein. Zusammengenommen können die skizzierten Verhaltensaufgaben in den meisten Laboratorien leicht zur Untersuchung der Identitätserkennung in C57BL/6-Mäusen und anderen Mausstämmen angewendet werden.
Protokoll
In dieser Studie wurden männliche adulte C57BL/6-Mäuse (8-10 Wochen alt; Körpergewicht: 18-25 g) verwendet. Mäuse, die als soziale Ziele verwendet wurden, wurden aus einer anderen Quelle gewonnen (siehe Materialtabelle), um sicherzustellen, dass sie aus verschiedenen Würfen stammten und den Versuchsmäusen zuvor unbekannt waren. Alle Protokolle wurden vom Facility Animal Care Committee des Douglas Research Centre genehmigt und folgten den Richtlinien des Canadian Council on Animal Care (Protokoll-Nr.: DOUG-5935).
1. Werkstoffe (siehe Abbildung 1)
- Richten Sie einen großen transparenten Käfig (24 cm x 36 cm x 19,5 cm) ein, der als neutraler Kontext im negativen sozialen Valenzexperiment dient
- Verwenden Sie eine schwarzwandige, dreieckige Schockbox (Länge jeder Seite = 46 cm; Höhe = 29 cm) als negativen Valenzkontext. Stellen Sie sicher, dass der Boden der Schockbox aus Metallgittern besteht, die mit einem verschlüsselten Gitterstromgenerator verbunden sind.
- Verwenden Sie einen großen transparenten Käfig (26 cm x 47 cm x 21 cm) als Nahrungsgewöhnungskontext für das Experiment mit positiver sozialer Valenz.
- Verwenden Sie einen großen Käfig mit schwarzen Wänden (24 cm x 36 cm x 19,5 cm) als neutralen Kontext im Experiment mit positiver sozialer Valenz.
- Verwenden Sie einen großen weißwandigen Käfig (24 cm x 36 cm x 19,5 cm) mit einer Futteröffnung als positiven sozialen Valenzkontext. Verwenden Sie als Lebensmittelanschluss ein Plastikrohr (0,5 cm Durchmesser), das durch eine Seite der Wand verläuft, und stellen Sie eine weiße Plastikschale unter das Rohr.
- Vorgeschnittene weiße Staffeleiblöcke zur Verwendung als Boden für den neutralen Kontext (neutrales Training sowohl in negativen als auch in positiven sozialen Valenzexperimenten) und positiven sozialen Valenzkontexten. Schneiden Sie das Pad etwas kleiner als die Unterseite des Kontexts, um zu verhindern, dass sich die Maus des Motivs unter dem Papier vergräbt. Setze die Staffelei-Pads zwischen die Mäuse des Versuchsobjekts ein.
- Verwenden Sie staubfreie Präzisionspellets (20 mg, Schokoladengeschmack) als Belohnungshinweis bei der Interaktion mit dem positiv bewerteten sozialen Ziel.
- Verwenden Sie eine Waage zum täglichen Wiegen der Probandenmäuse für die Dauer der positiven sozialen Valenzexperimente.
- Verwenden Sie eine Dreikammerbox (81 cm x 23 cm x 23 cm) mit Öffnungen in der mittleren Kammer, die mit der linken und der rechten Kammer verbunden sind, für die Prüfung der sozialen Diskriminierung. Verwenden Sie abnehmbare Kammertüren, um die Probandenmaus zwischen den Sitzungen in der mittleren Kammer zu halten und so Stress bei der Handhabung zu vermeiden.
- Verwenden Sie zwei identische rechteckige Plexiglasgehäuse (10 cm x 5 cm x 30 cm) sowohl für negatives als auch für positives soziales Valenztraining.
- Verwenden Sie vier runde Drahtbecher (8 cm x 8 cm x 10 cm) für den Test der sozialen Diskriminierung. Halten Sie während der 1. Sitzung des Tests zur sozialen Diskriminierung zwei Drahtbecher leer. Lege in Sitzung 2 die sozialen Ziele, die im positiven oder negativen sozialen Valenztraining verwendet werden, in die beiden anderen Drahtbecher.
HINWEIS: Beschriften Sie die Drahtbecher (z. B. mit Klebeband), um zwischen identischen Drahtbechern zu unterscheiden. Verwenden Sie die Drahtbecher innerhalb eines Experiments während der gesamten Dauer des Experiments für den gleichen Zweck. Wenn ein anderes soziales Ziel in den Drahtbecher gelegt werden muss, reinigen Sie den Drahtbecher gründlich mit Seife, Wasser und einem schnell wirkenden Desinfektionsmittel auf Wasserstoffperoxidbasis. - Stellen Sie während des Tests zur sozialen Diskriminierung zwei Glasflaschen auf die umgekippten Drahtbecher, um zu verhindern, dass die Versuchsmäuse auf die Drahtbecher klettern.
- Stellen Sie sicher, dass die Gehäuse in der Ausbildung Böden aus einem nicht leitenden Material für Experimente mit negativer sozialer Valenz haben. Verwenden Sie zum Beispiel Plastik oder Pappe, die mit Isolierband bedeckt sind, um sicherzustellen, dass das negativ valenzierte soziale Ziel während des Trainings keine Schocks erhält.
- Verwenden Sie einen stillen Timer, um externe Hinweise zu vermeiden, die in das Verhalten der Tiere eingreifen könnten.
- Verwenden Sie eine hochauflösende Webcam (1.080 p/30 fps), die an einen Laptop angeschlossen ist, um das Mausverhalten während des Trainings und des Tests zur sozialen Diskriminierung zu erfassen.
- Verwenden Sie einen Generator für weißes Rauschen, der statisches weißes Rauschen bei 60 dB erzeugt, das in der Mitte des Kontexts gemessen wird.
HINWEIS: Alle Verhaltensverfahren sollten mit statischem weißem Rauschen bei 60 dB durchgeführt werden, das in der Mitte des Kontexts gemessen wird, um Umgebungsgeräusche zu maskieren, die das Verhalten der Tiere beeinträchtigen können. - Verwenden Sie Rotlichtlampen für alle Verhaltensverfahren.
HINWEIS: Dies sorgt für dunkle Umgebungsbedingungen, die die Erkundung bei Mäusen fördern und die Visualisierung des Verhaltens von Tieren in Videoaufnahmen ermöglichen. - Reinigen Sie die Gehege, sowohl leere als auch tierhaltige, zwischen den Versuchsmäusen mit 70 % Ethanol, das schnell trocknet. Reinigen Sie Trainings- und Testkontexte zwischen Probandenmäusen mit einem schnell wirkenden Desinfektionsmittel auf Wasserstoffperoxidbasis, um potenzielle Einflüsse auf das Verhalten zu eliminieren, die auf Geruchsreize früherer Probandenmäuse zurückzuführen sind.
2. Verhaltensbezogene Verfahren
- Negative soziale Wertigkeit
- Kontext-Gewöhnung
- Statten Sie den Experimentierraum für die Dauer des Experiments mit weißem Rauschen und rotem Umgebungslicht aus.
- Bereiten Sie die Schockbox vor, indem Sie ein leeres Plexiglasgehäuse mit einem nicht leitenden Boden in der Mitte platzieren.
- Platzieren Sie die Motivmaus in einer Ecke der Schockbox und lassen Sie die Maus 5 Minuten lang frei erkunden.
- Bringen Sie die Maus des Motivs wieder in ihren Heimatkäfig zurück.
- Wiederholen Sie die Gewöhnung an die Schockbox mit den restlichen Mäusen.
- Wiederholen Sie mindestens 1 h später die Kontextgewöhnungsprozedur (Schritte 2.1.1.1-2.1.1.5) im neutralen Kontext.
- Negatives Valenztraining
- Beginnen Sie mit dem negativen Valenztraining mindestens 1 h nach der Gewöhnung an beide Kontexte.
- Bereiten Sie die Schockbox vor, indem Sie den Strom auf 0,3 mA einstellen.
HINWEIS: Die empfohlene Stromeinstellung basiert auf der von uns verwendeten Schockbox und unserem Versuchsdesign (3 Trainingstage). Diese Einstellung kann geändert werden, um sie an andere Versuchspläne anzupassen (z. B. kann ein stärkerer Strom bei Versuchsplänen mit weniger Trainingsversuchen verwendet werden). - Platzieren Sie das negativ valenzierte soziale Ziel in dem Plexiglasgehäuse mit einem nicht leitenden Boden in der Mitte der Schockbox.
- Starten Sie die Videoaufnahme und platzieren Sie die Maus des Motivs in einer Ecke der Schockbox.
- Starten Sie den Timer und lassen Sie die Maus des Motivs frei erkunden.
- Bei 4 und 4,5 min wird ein 1 s langer elektrischer Schock abgegeben.
HINWEIS: Dies ermöglicht eine ausreichende Interaktionszeit zwischen der Zielmaus und dem sozialen Ziel, bevor aversive Schocks auftreten. - Entfernen Sie die Maus des Motivs nach 5 Minuten und stoppen Sie die Aufnahme und den Timer.
- Bringen Sie die Maus des Motivs wieder in ihren Heimatkäfig zurück.
- Desinfizieren Sie die Schockbox und wiederholen Sie das negative Valenztraining mit den verbleibenden Probandenmäusen.
- Neutrales Training
- Beginnen Sie mindestens 2 Stunden nach dem negativen Valenztraining mit dem neutralen Training.
- Platzieren Sie das neutrale soziale Ziel in einem Gehäuse mit einem nicht leitenden Boden in der Mitte des Kontexts.
HINWEIS: Eine nichtleitende Unterseite wird verwendet, um sicherzustellen, dass der negative und der neutrale Kontext identische Kontexthinweise haben. Im neutralen Training wird kein Schock abgegeben. - Starten Sie die Videoaufnahme und platzieren Sie die Maus des Motivs in einer Ecke des neutralen Kontexts.
- Starten Sie den Timer und lassen Sie die Maus des Motivs frei erkunden.
- Entfernen Sie die Maus des Motivs nach 5 Minuten und stoppen Sie die Aufnahme und den Timer.
- Bringen Sie die Maus des Motivs wieder in ihren Heimatkäfig zurück.
- Reihenfolge der Ausbildung
- Tag 1: Nach der Gewöhnung beider Kontexte (Schritt 2.1.1) führen Sie das neutrale Training (Schritt 2.1.3) 2 h nach dem negativen Valenztraining (Schritt 2.1.2) durch.
- Tag 2: Wiederholen Sie das Training an Tag 2 mit einer umgekehrten Trainingsreihenfolge (Schritte 2.1.3, dann 2.1.2; d.h. führen Sie ein neutrales Training durch und dann 2 h später ein negatives Valenztraining).
- Tag 3: Wiederholen Sie das Training an Tag 3 mit umgekehrter Trainingsreihenfolge (Schritte 2.1.2, dann 2.1.3; d.h. negatives Valenztraining, gefolgt von neutralem Training 2 h später).
- Kontext-Gewöhnung
- Positive gesellschaftliche Wertigkeit
- Nahrungsentzug
- Wiegen Sie jede Probandenmaus täglich für die Dauer des Experiments.
HINWEIS: Wenn eine Probandenmaus zu irgendeinem Zeitpunkt mehr als 15 % ihres ursprünglichen Körpergewichts verliert, muss der Nahrungsentzug gestoppt werden, und die Maus sollte von weiteren Experimenten ausgeschlossen werden. - Geben Sie 1 g des normalen Mausfutters pro Versuchsmaus in den Heimkäfig.
HINWEIS: Die Versuchsmäuse sind in Gruppen untergebracht, wobei 1 g Futter pro Maus zur Verfügung steht. Wenn zum Beispiel vier Mäuse in Gruppen untergebracht sind, werden 4 g Futter in den Heimkäfig gegeben. - Wiederholen Sie den Nahrungsentzug täglich für die Dauer des positiven sozialen Valenzexperiments (d. h. nach jedem Tag der Gewöhnung an Nahrungspellets, der Kontextgewöhnung und des positiven Valenztrainings).
- Wiegen Sie jede Probandenmaus täglich für die Dauer des Experiments.
- Gewöhnung an Saccharose-Lebensmittelpellets
- Beginnen Sie mit der Gewöhnung an Futterpellets 12 Stunden nach Beginn des Nahrungsentzugs.
- Statten Sie den Experimentierraum für die Dauer des Experiments mit weißem Rauschen und rotem Umgebungslicht aus.
- Platzieren Sie die Maus des Motivs in einer Ecke des Nahrungsgewöhnungskontexts.
- Starten Sie den Timer und geben Sie 1 Saccharose-Futterpellet/min über einen Zeitraum von 10 Minuten ab.
- Entfernen Sie das Motiv nach 10 Minuten und bringen Sie die Maus in ihren Heimatkäfig zurück.
- Notieren Sie die Anzahl der Saccharose-Futterpellets, die von der Versuchsmaus verzehrt wurden.
- Wiederholen Sie die Gewöhnung mit Saccharose-Futterpellets für insgesamt 3 Tage.
HINWEIS: Es können weitere Gewöhnungstage hinzugefügt werden, wenn Mäuse nach 3 Tagen keine Saccharosefutterpellets mehr fressen. - Entfernen Sie Probanden, die während der Gewöhnung an Lebensmittelpellets keine Saccharose-Pellets konsumierten, aus der Studie.
- Kontext-Gewöhnung
- Bereiten Sie einen Tag nach der Gewöhnung an Saccharose-Lebensmittelpellets (Tag 4) den positiven Valenzkontext vor, indem Sie ein leeres Plexiglasgehäuse an einer Ecke des Kontexts platzieren.
- Platzieren Sie die Motivmaus in einer Ecke des positiven Valenzkontexts und lassen Sie die Maus 10 Minuten lang frei erkunden.
- Bringen Sie die Maus des Motivs wieder in ihren Heimatkäfig zurück.
- Wiederholen Sie die Gewöhnung an den positiven Valenzkontext mit den verbleibenden Mäusen.
- Wiederholen Sie mindestens 1 h später die Kontextgewöhnungsprozedur im neutralen Kontext.
- Positives Valenztraining
- Beginnen Sie mit dem positiven Valenztraining mindestens 1 h nach der Gewöhnung an beide Kontexte.
- Platzieren Sie das positiv valenzierte soziale Ziel im Gehege im Zentrum des positiven Valenzkontextes.
- Starten Sie die Videoaufzeichnung und platzieren Sie die Maus des Motivs in einer Ecke des positiven Valenzkontexts.
- Starten Sie den Timer und lassen Sie die Motivmaus 10 Minuten lang frei erkunden.
- Bei jeder Interaktion mit dem sozialen Ziel, das >2 s beträgt, wird 1 Saccharose-Futterpellet über den Nahrungsanschluss abgegeben. Interaktion ist definiert als Zeiträume, in denen die Nase der Versuchsmaus <2 cm von der Peripherie des Plexiglasgehäuses entfernt ist. Der Kopfwinkel des Motivs muss in Richtung des Gehäuses ausgerichtet sein.
HINWEIS: Nasenstechen und Schnüffeln können auftreten, sind aber für die Abgabe von Saccharose-Lebensmittelpellets nicht erforderlich. - Entfernen Sie die Maus des Motivs nach 10 Minuten und stoppen Sie die Aufnahme und den Timer.
- Bringen Sie die Maus des Motivs wieder in ihren Heimatkäfig zurück.
- Notieren Sie die Anzahl der über den Lebensmittelanschluss abgegebenen Saccharose-Lebensmittelpellets und die Anzahl der von der betroffenen Maus verbrauchten Pellets.
- Tauschen Sie den Boden der Staffelei aus, desinfizieren Sie den positiven Kontext und wiederholen Sie das positive Valenztraining mit den verbleibenden Probandenmäusen.
- Neutrales Training
- Beginnen Sie das neutrale Training frühestens 2 h nach dem positiven Valenztraining.
- Platzieren Sie das neutrale soziale Ziel im Gehege an einer Ecke des neutralen Kontexts.
- Starten Sie die Videoaufnahme und platzieren Sie die Maus des Motivs in einer Ecke des neutralen Kontexts.
- Starten Sie den Timer und lassen Sie die Motivmaus 10 Minuten lang frei erkunden.
- Entfernen Sie die Maus des Motivs nach 10 Minuten und stoppen Sie die Aufnahme und den Timer.
- Bringen Sie die Maus des Motivs wieder in ihren Heimatkäfig zurück.
- Tauschen Sie den Boden der Staffeleimatte aus, desinfizieren Sie die Geräte und wiederholen Sie das neutrale Training mit den verbleibenden Versuchsmäusen.
- Reihenfolge der Ausbildung
- Tage 1-3: Gewöhnung an Futterpellets (Schritt 2.2.2).
- Tag 4: Nach der Gewöhnung an beide Kontexte (Schritt 2.2.3) führen Sie zunächst ein positives Valenztraining (Schritt 2.2.4) durch, gefolgt von einem neutralen Training (Schritt 2.2.5) 2 h später.
- Tag 5: Wiederholen Sie das Training an Tag 5 mit umgekehrter Trainingsreihenfolge (Schritte 2.2.5, dann 2.2.4; d.h. neutrales Training, gefolgt von positivem Valenztraining 2 h später).
- Nahrungsentzug
- Test der sozialen Diskriminierung
- Statten Sie den Experimentierraum mit weißem Rauschen und rotem Umgebungslicht aus.
- Transportieren Sie die Probanden in den Versuchsraum und ermöglichen Sie eine ungestörte Gewöhnung an den Raum für mindestens 1 h.
HINWEIS: Stellen Sie sicher, dass soziale Ziele während der Gewöhnungsphase außerhalb des Experimentierraums bleiben. - Stellen Sie in Sitzung 1 zwei leere Drahtbecher in die gegenüberliegenden Ecken der linken und rechten Kammer der Drei-Kammer-Box für soziale Diskriminierung.
HINWEIS: Identische große, gewichtete Objekte (z. B. Glasflaschen) werden auf die Drahtbecher gelegt, um sicherzustellen, dass die Maus des Motivs nicht auf den Drahtbecher klettert. - Starten Sie die Videoaufnahme, platzieren Sie die Maus des Motivs in der Mitte der mittleren Kammer und starten Sie den Timer.
HINWEIS: Wenn möglich, verlassen Sie den Raum, um die Interferenz des Experimentators mit den Versuchsmäusen zu minimieren. - Kehren Sie nach 8 Minuten in den Testraum zurück und verwenden Sie, ohne die Probandenmaus zu berühren, die Kammertüren, um den Probanden in der mittleren Kammer einzuschließen.
- Ersetzen Sie die leeren Drahtbecher durch einen identischen, aber unterschiedlichen Satz Becher mit den sozialen Zielen.
HINWEIS: Die sozialen Ziele sind diejenigen, die im negativen oder positiven sozialen Valenztraining verwendet werden. - Entfernen Sie die Kammertüren und starten Sie den Timer, während die Maus des Motivs in Sitzung 2 die Kammer erkundet.
- Stoppen Sie nach 8 Minuten die Aufzeichnung und bringen Sie die Maus und die sozialen Ziele des Motivs in ihre jeweiligen Käfige zurück.
- Reinigen Sie die Becher mit 70% Ethanol und reinigen Sie die Arena mit Desinfektionsmittel.
- Wiederholen Sie den Test der sozialen Diskriminierung (Schritte 2.3.3-2.3.9) mit den verbleibenden Versuchsmäusen.
- Sobald die Hälfte der Kohorte die Tests abgeschlossen hat, balancieren Sie die Position des Drahtbechers aus.
HINWEIS: Soziale Ziele sollten mit ihren jeweiligen Drahtbechern bewegt werden, um widersprüchliche Geruchsreize zu vermeiden. - Reinigen Sie alle Drahtbecher mit Seife, Wasser und Desinfektionsmittel. Reinigen Sie die Dreikammer-Box für soziale Diskriminierung mit Desinfektionsmittel.
3. Verhaltensanalyse
- Ausbildung
- Analysieren Sie die Interaktionszeit mit jedem sozialen Ziel und bewerten Sie die Anzahl der Interaktionsrunden.
HINWEIS: Die Analyse kann manuell (Tierkopf <2 cm Abstand zum Gehege und Kopfwinkel von 180°) oder mit einem automatisierten Programm durchgeführt werden. - Notieren Sie die Anzahl der Nahrungspellets, die während des positiven sozialen Valenztrainings konsumiert werden, um sicherzustellen, dass Änderungen im Sozialverhalten nicht auf Unterschiede in der Motivation zum Verzehr von Nahrungsbelohnungen zurückzuführen sind.
- Analysieren Sie die Interaktionszeit mit jedem sozialen Ziel und bewerten Sie die Anzahl der Interaktionsrunden.
- Test der sozialen Diskriminierung
- Messen Sie, wie viel Zeit die Maus des Motivs jede Tasse untersucht. Eine 8-minütige ununterbrochene Dauer des Tests beginnt, sobald der Experimentator den Raum verlässt.
HINWEIS: Die Analyse kann manuell (Tierkopf <2 cm Abstand zum Umfang des Drahtbechers und Kopfwinkel von 180°) oder mit einem automatisierten Programm durchgeführt werden. - Berechnen Sie paarweise Analysen, um individuelle Änderungen innerhalb von Testsitzungen besser zu erfassen. Führen Sie zusätzlich eine Zwei-Wege-ANOVA mit wiederholten Messungen (mit den Faktoren Session und Cup) durch, um Unterschiede zwischen den Sessions bei der Exploration zu erkennen.
- Messen Sie, wie viel Zeit die Maus des Motivs jede Tasse untersucht. Eine 8-minütige ununterbrochene Dauer des Tests beginnt, sobald der Experimentator den Raum verlässt.
Ergebnisse
Wir haben die positiven und negativen sozialen Valenzaufgaben verwendet, um die Identitätserkennung in C57BL/6-Mäusen zu bewerten (Abbildung 2). Im Vergleich zu Tag 1 der Gewöhnung an Saccharose-Futterpellets (H1, Abbildung 2B) verzehrten die meisten Mäuse alle gegebenen Pellets bis zum letzten Tag der Futtergewöhnung (H3). Während der Trainingseinheiten (T1 und T2) lernten die Probandmäuse zwei CD1-Mäuse kennen: die neutrale (Neu) und die positive valenzassoziierte Maus (PV), indem sie mit ihnen getrennt in verschiedenen Kontexten interagierten. Futterbelohnungen erhielten die Versuchsmäuse erst nach der Interaktion mit Maus-PV. Während der Aufgabe zur sozialen Diskriminierung fanden wir heraus, dass trainierte Mäuse im Vergleich zur neutralen Maus bevorzugt mit der PV-Maus interagierten (* p < 0,05, gepaarter Student's t-Test). Das Verhältnis zwischen den Sitzungen zwischen der Interaktionszeit von Sitzung 2 und der Interaktion von Sitzung 1 zeigte ebenfalls eine Präferenz für die PV-Maus (* p < 0,05, gepaarter Student's t-Test).
Wir verwendeten auch die negative soziale Valenzaufgabe, um die Identifizierungserkennung zu untersuchen (Abbildung 2C). Die Probandmäuse lernten zwei CD1-Mäuse kennen: Neu und negative Valenz-assoziierte Maus (NV), indem sie mit ihnen getrennt in verschiedenen Kontexten interagierten. Gegen Ende der Interaktionssitzung mit der Maus NV wurden zwei Elektroschocks verabreicht, während nach der Interaktion mit der Neu-Maus keine Elektroschocks verabreicht wurden. Wir fanden keine Unterschiede in den Interaktionszeiten zwischen den Probandenmäusen und den Neu oder den NV Mäusen an jedem Trainingstag. Wir fanden jedoch heraus, dass die Probandenmäuse die Interaktionszeit mit der NV-Maus während des sozialen Diskriminierungstests reduzierten (* p < 0,05, gepaarter Student's t-Test). Das Verhältnis zwischen den Sitzungen zwischen der Interaktionszeit von Sitzung 2 und der Interaktion von Sitzung 1 zeigte ebenfalls eine Präferenz für die Neu-Maus (* p < 0,05, gepaarter Student's t-Test).

Abbildung 1: Apparatur für Aufgaben zur Identitätserkennung. (A) Neutraler Valenzkontext für negative soziale Valenztests. Ein weißer Staffeleiblock wird am unteren Rand des Kontexts platziert. (B) Positiver sozialer Valenzkontext. Beachten Sie den Lebensmittelanschluss (Pfeil) in der unteren Mitte der Box. (C) Neutraler Valenzkontext für positive soziale Valenztests. (D) Kontext der Lebensmittelgewöhnung. Auf der rechten Seite der Box befindet sich ein Anschluss für die Essensausgabe, wie in E (gestrichelter Kreis) und F (vergrößert) zu sehen ist. (G) Stoßdämpfer-Box. (H) Gehäuse aus Plexiglas. (I) Drahtbecher. (J) Drei-Kammer-Box für die Prüfung der sozialen Diskriminierung. Abnehmbare Kammertüren, in denen die Motivmaus in der mittleren Kammer untergebracht werden kann, sind in K (Pfeilspitzen) dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
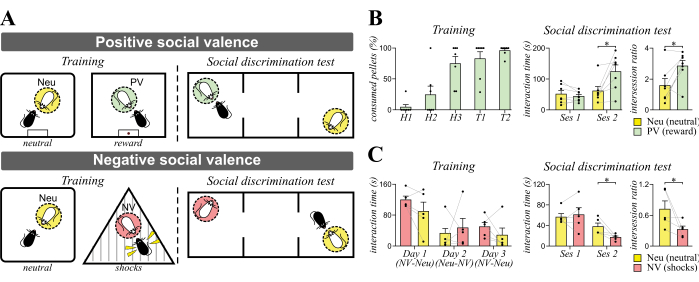
Abbildung 2: Design und erwartete Ergebnisse von Identitätserkennungsaufgaben. (A) Schematische Diagramme der positiven (oben) und negativen Versionen der sozialen Valenz von Identitätserkennungsaufgaben (unten). C57BL/6 Mäuse wurden darauf trainiert, täglich mit den neutralen (Maus Neu) und valenzassoziierten sozialen Zielen (Maus PV oder NV) zu interagieren. Einen Tag nach dem Training wurden die Probandenmäuse für den Test der sozialen Diskriminierung in ein Dreikammergerät gelegt. Wir erwarten, dass Probandmäuse nach positivem und negativem sozialem Valenztraining eine Präferenz und Vermeidung gegenüber positiv valenzierten (grün, Maus-PV) bzw. negativ valenzierten Mäusen (rot, Maus NV) zeigen. (B) Repräsentative Daten aus einem Experiment zum Training positiver sozialer Valenz. Die Probandenmäuse wurden trainiert, 2 Tage lang täglich mit der positiv valenzierten Maus (Maus PV) und der neutralen Maus (Maus Neu) zu interagieren. Die Reihenfolge der Interaktion wurde an Tag 2 umgekehrt. Links: Histogramme zeigen den prozentualen Anteil der verzehrten Saccharose-Futterpellets während der Gewöhnung (H1–3, die die Gewöhnungstage 1–3 repräsentieren) und des Trainings (T1–2, die die Trainingstage 1–2 darstellen) mit Maus-PV. Rechts: Histogramme zeigen die Zunahme der sozialen Interaktionszeit mit der positiv valenzierten Maus-PV während des sozialen Diskriminierungstests. Das Intersession-Verhältnis (Interaktionszeit 2 / Interaktionszeit 1 von Session 1) zeigte die Präferenz für das positiv valenzierte Maus-PV. * p < 0,05, gepaarter t-Test des Schülers. (C) Repräsentative Daten aus einem negativen Experiment zum Training sozialer Valenz. Die Probandenmäuse wurden darauf trainiert, 3 Tage lang täglich mit der negativ valenzierten Maus (Maus NV) und der neutralen Maus (Maus Neu) zu interagieren. Die Reihenfolge der Interaktion wurde täglich umgekehrt. Links: Histogramme zeigen die Interaktionszeit mit Maus Neu und NV an verschiedenen Trainingstagen. Rechts: Histogramme zeigen die Abnahme der sozialen Interaktionszeit mit der negativ valenzierten Maus NV während des sozialen Diskriminierungstests. Das Intersession-Verhältnis zeigte die Vermeidung des negativ valenzierten Maus-NV. * p < 0,05, gepaarter t-Test des Schülers. Abkürzungen: Neu = neutral; PV = positive Valenz; NV = negative Valenz; H = Gewöhnung; T = Training. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Paradigmen der Identitätserkennung wurden so konzipiert, dass sie in Laboren mit minimaler Spezialausrüstung und wenigen Schulungen innerhalb einer Woche einfach implementiert werden können. Alternative valenzierte Erfahrungen können je nach verfügbaren Ressourcen und der gewünschten Forschungsfrage genutzt werden. So wurde beispielsweise die negativ valenzierte Identitätserkennung nach Angriffen durch ein aggressives soziales Ziel erstmals bei Goldhamstern beschrieben und in unserem Modell an Mäuse angepasst 6,12.
Die valenzierten Identitätserkennungsparadigmen können breitere Anwendungen im Bereich des sozialen Gedächtnisses haben. Diese Aufgaben können nicht nur zur weiteren Untersuchung des sozialen Gedächtnisses oder der sozialen Valenzmechanismen verwendet werden, sondern sie können auch bei der Untersuchung von Krankheitsmodellen helfen, von denen bekannt ist, dass sie Beeinträchtigungen der sozialen Erkennung aufweisen. Beeinträchtigungen der Identitätserkennung liegen den Defiziten des Sozialverhaltens bei Störungen wie Schizophrenie 13,14,15 und Autismus-Spektrum-Störung 16,17,18 zugrunde, wobei geschätzt wird, dass ein Drittel der Erwachsenen mit Autismus Schwierigkeiten hat, sich der individuellen Identitätserkennung zu stellen 19. Zum Beispiel sind Shank3-Knockout-Mäuse und Df(16)A+/- Mausmodelle für Autismus-Spektrum-Störungen und Schizophrenie, von denen bekannt ist, dass sie eine beeinträchtigte soziale Kognition aufweisen 20,21,22. Unsere neuen Paradigmen können Defizite des sozialen Gedächtnisses rekapitulieren und für die Charakterisierung von Krankheitsmodellen und die Identifizierung von Manipulationen oder Behandlungen zur Verbesserung von Defiziten im Sozialverhalten verwendet werden. Unbelebte Objekte können auch als Ersatz für soziale Ziele untersucht werden, um die Mechanismen, die Objekte unterstützen, im Vergleich zur sozialen Anerkennung weiter zu analysieren12.
Die in Abbildung 1 verwendeten sozialen Ziele sind gleichgeschlechtliche CD1-Stammmäuse, aber wir haben eine vergleichbare valenzierte Identitätserkennung mit Zielen des gleichen Stammes C57BL/6 erreicht. Daher haben wir eine leicht anwendbare Methode entwickelt, die für die weitere Untersuchung der sozialen Valenzverarbeitung, der sozialen Identität und der Defizite dieser sozialen kognitiven Funktionen in Tiermodellen von Hirnerkrankungen eingesetzt werden kann.
Paradigmen zur Identitätserkennung betrachten das Gedächtnis für bestimmte Individuen. Bei der Konzeption der Experimente muss darauf geachtet werden, dass die Trainings- und Testsitzungen völlig unterschiedlich sind und dass der einzige Anhaltspunkt, der konstant bleibt, die Identität der sozialen Zielgruppen ist. Zum Beispiel müssen die Räume, in denen Schulungen und Tests durchgeführt werden, die Gehege, in denen sich die sozialen Ziele befinden, und die Hinweise, die mit den Schulungs- und Testkontexten verbunden sind, unterschiedlich sein.
Die vier Drahtschalen müssen identisch zueinander, aber so unterschiedlich wie möglich zu den Plexiglasgehäusen sein. Die Drahtbecher und Gehäuse müssen sich in Bezug auf Material (z. B. Plexiglas vs. Metall), Form (z. B. rechteckig vs. kreisförmig) und Farbe (z. B. transparent vs. Roségold) unterscheiden. Dies geschieht, um sicherzustellen, dass der einzige Hinweis, der das Erkundungsverhalten während des Tests beeinflusst, die Identität der sozialen Ziele ist.
Die Kontextgewöhnung wird an Tag 1 des Trainings durchgeführt. Dies geschieht, um die Erkundung sozialer Ziele während des Trainings zu fördern und nicht den Kontext, der der Probandenmaus bereits bekannt ist. Darüber hinaus wird eine Wartezeit von mindestens 2 h zwischen valenzierten und neutralen Trainingseinheiten empfohlen. Es wird angenommen, dass die Bereitstellung von Zeit zwischen den Trainingseinheiten für die Versuchsmäuse die Verallgemeinerung reduziert, da Erfahrungen, die zeitlich näher zugeordnet sind, mit größerer Wahrscheinlichkeit miteinander verknüpft sind23. Aus dem gleichen Grund wird das Training an den folgenden Tagen wiederholt, aber der Reihe nach ausgeglichen. Es wird angenommen, dass die Wiederholung die weitere Assoziation des Erlebten mit dem jeweiligen sozialen Ziel fördert. Im Idealfall kann mehr Zeit zwischen den Trainingseinheiten es den Versuchsmäusen außerdem ermöglichen, zu lernen, das soziale Ziel mit ihrer jeweiligen valenzierten Erfahrung zu verknüpfen. Aus praktischen Gründen wurde die Wartezeit auf 2 Stunden festgelegt, da so sowohl neutrale als auch valenzierte Trainingseinheiten an einem Tag in einer Kohorte von 8-12 Mäusen stattfinden konnten. Zum Beispiel kann das Training von 12 Mäusen ungefähr 2 Stunden dauern, dann wäre die Versuchsmaus, die zuerst trainiert wurde, bereit, mit der nächsten Trainingssitzung zu beginnen. Natürlich kann eine Verlängerung der Wartezeit die Leistung der Probandenmäuse verbessern, ist aber für den Experimentator zeitaufwändiger.
Versuchsmäuse und soziale Zielpersonen sollten mindestens 7 Tage vor Beginn des Verhaltenstrainings in der Tiereinrichtung eintreffen, um den Einfluss von Transportstress zu minimieren. Soziale Zielgruppen sollten in einem einzigen Haus untergebracht werden, da olfaktorische Signale von Käfigen die Identitätserkennung beeinträchtigen können. Die gleichen beiden sozialen Ziele können für eine Kohorte von bis zu 12 Probandenmäusen verwendet werden. Wichtig ist, dass die sozialen Ziele während jeder Reinigungs- und Einrichtungsphase zwischen den Versuchsmäusen in ihren Heimatkäfig zurückgebracht werden müssen. Es ist wichtig, die sozialen Ziele in ihre Heimatkäfige zurückzubringen, da eine längere Gefangenschaft in den Gehegen ihr Verhalten verändern und wiederum die Entscheidung der Versuchsmäuse zur Interaktion beeinflussen kann.
Probandmäuse und soziale Ziele können Artgenossen desselben oder verschiedener Stämme sein. Wenn soziale Ziele desselben Stammes verwendet werden, ist es entscheidend, dass sie nicht aus demselben Wurf wie die Versuchsmäuse stammen und die sozialen Ziele einander nicht bekannt sind. Dies kann sichergestellt werden, indem Probandmäuse und soziale Ziele von verschiedenen Tierlieferanten bestellt werden oder Tiere leicht unterschiedlichen Alters (d. h. 8 Wochen alte Versuchsmäuse und 7 Wochen alte soziale Ziele). Wenn Ear-Tagging-Verfahren erforderlich sind, sollten diese mindestens 24 Stunden vor Beginn des Verhaltenstrainings durchgeführt werden. Dies dient dazu, den Einfluss externer Stressoren auf das Verhalten der Maus zu minimieren. Für alle Verhaltenstrainings und -tests wird empfohlen, jeweils mit einer Probandenmaus zu arbeiten. Obwohl das gleichzeitige Training und Testen mehrerer Probandenmäuse Zeit sparen kann, erhöht es auch die olfaktorischen Signale im Versuchsraum, die die Kodierung oder den Abruf der Identitätserkennung beeinflussen können. Daher empfehlen wir Kohorten von 8-12 Probandenmäusen. Für positive Experimente mit sozialer Valenz wird empfohlen, die Tiere täglich vor dem Training zu behandeln, um den Handhabungsstress zu minimieren, der den Verzehr neuartiger Lebensmittel abschrecken kann. Es wird auch empfohlen, 2-3 Saccharose-Futterpellets pro Maus 3 Tage vor der Gewöhnung in den Heimkäfig zu legen, um den Gewöhnungsprozess zu erleichtern.
Obwohl die vorgestellten Daten manuell bewertet wurden, existieren benutzerfreundliche und automatisierte Optionen zur Verhaltensanalyse, die für ein effizienteres Scoring sozialer Interaktionen in Trainings- und Testvideos eingesetzt werden können. Zum Beispiel ist DeepLabCut eine Software, die benutzertrainierte neuronale Netze für die markerlose Annotation der Tierposition einsetzt und für die präzise Identifizierung von Frames optimiert werden kann, die dem Untersuchungsverhaltenentsprechen 24.
Weitere Kontrollexperimente können eingesetzt werden, um zu überprüfen, ob erfolgreiche Identitätserkennungsprotokolle erreicht wurden12. Die Umkehrung der Trainingsreihenfolge sollte weiterhin eine Identitätserkennung hervorrufen und bestätigen, dass die Ergebnisse nicht auf die Reihenfolge des valenzierten und neutralen Trainings zurückzuführen sind. Das Training kann auch wie beschrieben durchgeführt werden, aber Tests können mit dem neutralen und einem neuartigen sozialen Ziel stattfinden, wobei eine erhöhte Interaktion mit dem neuartigen Ziel darauf hindeuten würde, dass die Versuchsmäuse ein soziales Gedächtnis für das neutrale Ziel haben und erkannt haben, dass es vertraut ist. In ähnlicher Weise können Tests mit zwei neuartigen Probandenmäusen durchgeführt werden, um zu bestätigen, dass das Vermeidungs- oder Annäherungsverhalten tatsächlich spezifisch für die negativ bzw. positiv valenzierten sozialen Ziele ist. Obwohl es derzeit nicht getestet ist, ob ein und dieselbe Versuchsmaus sowohl negatives als auch positives soziales Valenztraining durchlaufen kann, glauben wir, dass dies möglich ist, wenn die Experimentatoren Zugang zu mehreren sozialen Zielstämmen oder Trainingskontexten haben. Die Verwendung desselben Stammes sozialer Ziele für positive und negative Valenzexperimente kann die Assoziation eines Stammes mit einer bestimmten Valenz erschweren. Wenn möglich, kann die Verwendung verschiedener sozialer Zielstämme die Erkundung fördern und eine Verallgemeinerung zwischen positiven und negativen Erfahrungen vermeiden. In ähnlicher Weise würde die Wiederverwendung derselben Trainingskontexte die Generalisierung zwischen gegensätzlich valenzierten Erfahrungen erhöhen und durch die Verwendung unterschiedlicher Kontexte für das Training minimiert werden. Wenn es der experimentelle Zeitplan zulässt, wäre auch zu empfehlen, die positiven und negativen Valenzexperimente um einige Wochen voneinander zu trennen.
Für den Fall, dass es Schwierigkeiten bei der Einrichtung der Identitätserkennungsprotokolle gibt, schlagen wir Lösungen für häufig auftretende Probleme vor, mit denen wir konfrontiert sind. Mäuse, die in einer Gruppe untergebracht sind, können als Extinktionstraining fungieren, da die mit einem sozialen Ziel verbundene Valenz nach normaler Cagemate-Interaktion ausstirbt25, ist aber notwendig, da soziale Isolation das soziale Gedächtnis beeinträchtigt und das Sozialverhalten verändert26,27. Tatsächlich fanden wir heraus, dass die Einzelhaltung bei männlichen Mäusen keine Identitätserkennung hervorrief. Eine Einzelhaltung kann jedoch erforderlich sein, wenn sich die Tiere von stereotaktischen Operationen erholen oder intrakranielle Implantate haben, die empfindlich auf Ablösung reagieren können. In solchen Fällen haben wir Mäuse erfolgreich paarweise in großen Käfigen untergebracht, die durch eine perforierte Trennwand getrennt waren, und die Identitätserkennung in dieser Bedingung repliziert12.
Für die Aufgabe der positiven sozialen Valenz ist es üblich, dass Mäuse zögern, neuartige Saccharose-Pellets zu konsumieren. Um dieses Problem zu lösen, ist es hilfreich, die Zeit des Nahrungsentzugs zu verlängern oder die Mäuse mit den Pellets vertraut zu machen, indem Sie einige Pellets 2-3 Tage vor der Gewöhnungssitzung in ihren Heimkäfig legen. In einigen Situationen, in denen die Mehrheit der Mäuse keine Futterpellets zu sich nimmt, kann es auch hilfreich sein, die Anzahl der Gewöhnungssitzungen zu erhöhen. Obwohl wir festgestellt haben, dass männliche Mäuse während der Gewöhnung an Futterpellets im Allgemeinen weniger aßen als weibliche Mäuse, hat dies keinen Einfluss auf ihre Fähigkeit, das positiv valenzierte soziale Ziel zu erkennen.
Schließlich können die Parameter der Identitätserkennungsaufgaben geändert werden, um die Schwierigkeit der Aufgabe zu verringern oder zu erhöhen. Um beispielsweise den subtilen Einfluss biologischer Faktoren auf die Identitätserkennung aufzudecken, können die Trainingszeit und die Anzahl der Trainingseinheiten reduziert werden, um die Schwierigkeit der Aufgabe zu erhöhen.
Die Verhaltensaufgaben, die wir in diesem Protokoll vorgestellt haben, sind einfach, leicht einzurichten und können an männliche und weibliche Mäuse angepasst werden, um die Identitätserkennung zu untersuchen. Der flexible Einsatz von entweder appetitiven oder aversiven Reizen in diesen Aufgaben ermöglicht es auch, die Rolle der sozialen Valenz bei der Identitätserkennung zu untersuchen. Diese Aufgaben werden nützlich sein, um biologische Mechanismen der Identitätserkennung bei gesunden Mäusen oder Defizite in diesen Mechanismen in krankheitsbedingten Mausmodellen zu untersuchen, die eine soziale Beeinträchtigung aufweisen.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Wir danken Frau Alice Wong für die technische Unterstützung und Dr. J. Quinn Lee für den Bau des Schockgeräts. Wir danken und würdigen unsere Finanzierungsquellen: Natural Sciences and Engineering Research Council of Canada (RGPIN-2021-03739), Canadian Institutes of Health Research (PJ8 179866) und Fonds de recherche du Québec – Nature et technologies (326838).
Materialien
| Name | Company | Catalog Number | Comments |
| 70% ethanol | |||
| Black-walled cage (24 cm x 36 cm x 19.5 cm) | neutral context, positive social valence experiment | ||
| C57BL/6 mice | Charles River, Jackson Laboratory | Social targets from Jackson Laboratory | |
| Dustless precision pellets | BioServ | F05301 | 20 mg, chocolate flavor |
| Electric tape | |||
| Glass bottles (2) | |||
| hydrogen peroxide-based disinfectant | |||
| Plastic or cardboard | Non-conductive material for enclosure floor | ||
| Rectangular plexiglass enclosures (2, 10 cm x 5 cm x 30 cm) | Identical | ||
| Shock box (triangular, length of each side = 46 cm; height = 29 cm) | |||
| Silent timer | |||
| Single Output Scrambled Animal Shocker | Lafayette Instrument | HSCK100AP | |
| three-chamber box (81 cm x 23 cm x 23 cm), with openings in the middle chamber that connect to the left and the right chambers | social discrimination testing | ||
| Transparent cage (24 cm x 36 cm x 19.5 cm) | Negative social valence | ||
| Transparent cage (26 cm x 47 cm x 21 cm) | Food habituation (positive social valence) | ||
| Webcam | Logitech | C920x | |
| Weighing scale | |||
| white easel pad papers | floor of the neutral context | ||
| White noise generator | 60 dB | ||
| White, plastic dish | |||
| White-walled cage (24 cm x 36 cm x 19.5 cm) with a 1 cm diameter plastic tube as food port | positive social valence context | ||
| Wire cups (circular, four, 8 cm x 8 cm x 10 cm) | |||
Referenzen
- Van Der Kooij, M. A., Sandi, C. Social memories in rodents: Methods, mechanisms and modulation by stress. Neurosci Biobehav Rev. 36 (7), 1763-1772 (2012).
- Ferguson, J. N., Young, L. J., Insel, T. R. The neuroendocrine basis of social recognition. Front Neuroendocrinol. 23 (2), 200-224 (2002).
- Tibbetts, E. A., Dale, J. Individual recognition: It is good to be different. Trends Ecol Evol. 22 (10), 529-537 (2007).
- Hitti, F. L., Siegelbaum, S. A. The hippocampal ca2 region is essential for social memory. Nature. 508 (7494), 88-92 (2014).
- Okuyama, T., Kitamura, T., Roy, D. S., Itohara, S., Tonegawa, S. Ventral ca1 neurons store social memory. Science. 353 (6307), 1536-1541 (2016).
- Lai, W. S., Ramiro, L. L., Yu, H. A., Johnston, R. E. Recognition of familiar individuals in golden hamsters: A new method and functional neuroanatomy. J Neurosci. 25 (49), 11239-11247 (2005).
- Cordero, M. I., Sandi, C. Stress amplifies memory for social hierarchy. Front Neurosci. 1 (1), 175-184 (2007).
- Kong, E., Lee, K. H., Do, J., Kim, P., Lee, D. Dynamic and stable hippocampal representations of social identity and reward expectation support associative social memory in male mice. Nat Commun. 14 (1), 2597 (2023).
- Kent, K., Butler, K., Wood, R. I. Ethanol induces conditioned social preference in male mice. Alcohol Clin Exp Res. 38 (4), 1184-1192 (2014).
- Wood, R. I., Rice, R. Ethanol-induced conditioned partner preference in female mice. Behav Brain Res. 243, 273-277 (2013).
- Toth, I., Neumann, I. D., Slattery, D. A. Social fear conditioning: A novel and specific animal model to study social anxiety disorder. Neuropsychopharmacology. 37 (6), 1433-1443 (2012).
- Larosa, A., et al. Social valence dictates sex differences in identity recognition. bioRxiv. , (2024).
- Marwick, K., Hall, J. Social cognition in schizophrenia: A review of face processing. Br Med Bull. 88 (1), 43-58 (2008).
- Sachs, G., Steger-Wuchse, D., Kryspin-Exner, I., Gur, R. C., Katschnig, H. Facial recognition deficits and cognition in schizophrenia. Schizophr Res. 68 (1), 27-35 (2004).
- Whittaker, J. F., Deakin, J. F., Tomenson, B. Face processing in schizophrenia: Defining the deficit. Psychol Med. 31 (3), 499-507 (2001).
- Griffin, J. W., Bauer, R., Scherf, K. S. A quantitative meta-analysis of face recognition deficits in autism: 40 years of research. Psychol Bull. 147 (3), 268-292 (2021).
- Carver, L. J., Dawson, G. Development and neural bases of face recognition in autism. Mol Psychiatry. 7 Suppl 2, S18-S20 (2002).
- Klin, A., et al. A normed study of face recognition in autism and related disorders. J Autism Dev Disord. 29 (6), 499-508 (1999).
- Minio-Paluello, I., Porciello, G., Pascual-Leone, A., Baron-Cohen, S. Face individual identity recognition: A potential endophenotype in autism. Mol Autism. 11 (1), 81 (2020).
- Peca, J., et al. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction. Nature. 472 (7344), 437-442 (2011).
- Piskorowski, R. A., et al. Age-dependent specific changes in area ca2 of the hippocampus and social memory deficit in a mouse model of the 22q11.2 deletion syndrome. Neuron. 89 (1), 163-176 (2016).
- Xu, Q. W., Larosa, A., Wong, T. P. Roles of ampa receptors in social behaviors. Front Synaptic Neurosci. 16, 1405510 (2024).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Mathis, A., et al. Deeplabcut: Markerless pose estimation of user-defined body parts with deep learning. Nat Neurosci. 21 (9), 1281-1289 (2018).
- Zoicas, I., Slattery, D. A., Neumann, I. D. Brain oxytocin in social fear conditioning and its extinction: Involvement of the lateral septum. Neuropsychopharmacology. 39 (13), 3027-3035 (2014).
- Ieraci, A., Mallei, A., Popoli, M. Social isolation stress induces anxious-depressive-like behavior and alterations of neuroplasticity-related genes in adult male mice. Neural Plast. 2016, 6212983 (2016).
- Kogan, J. H., Frankland, P. W., Silva, A. J. Long-term memory underlying hippocampus-dependent social recognition in mice. Hippocampus. 10 (1), 47-56 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten