ELISPOT-Assay: Nachweis von IFN-γ-sezernierenden Splenozyten
Überblick
Quelle: Tonya J. Webb1
1 Department of Microbiology and Immunology, University of Maryland School of Medicine and the Marlene and Stewart Greenebaum Comprehensive Cancer Center, Baltimore, Maryland 21201
ELISPOT ist ein standardisierter, reproduzierbarer Assay, der verwendet wird, um zelluläre Immunantworten zu erkennen. Der Test nutzt eine enzymgebundene Immunosorbent Assay (ELISA)-basierte Methode, um einzellige Immunreaktionen zu erkennen, die durch Flecken visualisiert werden können, daher der Name ELISPOT. ELISPOT wurde erstmals 1983 von Czerkinsky als Methode zur Aufzählung der Anzahl von B-Zell-Hybridomen beschrieben, die antigenspezifische Immunglobuline produzieren (1). Dieselbe Gruppe entwickelte den Assay weiter, um die Häufigkeit von Zytokin produzierenden T-Lymphozyten zu messen. Jetzt ist ELISPOT zu einem Goldstandard für die Messung der antigenspezifischen T-Zell-Immunität in klinischen Studien und Impfstoffkandidaten geworden. Zum Beispiel sezernieren Plasmazellen und Speicher-B-Zellen nach der Impfung oder während einer Infektion Antikörper, die Schutz bieten. Typischerweise werden diese B-Zell-Antworten durch Messung von Serumtitern antigenspezifischer Antikörper bewertet. Diese Art der Analyse, die in der Regel mit ELISA gemessen wird, kann jedoch keine Speicher-B-Zellen enthalten, die auch ohne nachweisbare Serumantikörpervorhanden sein können. Darüber hinaus ist es erwiesen, dass zirkulierende Gedächtnis-B-Zellen für die schnelle und schützende Antikörperreaktion wichtig sind, die nach der erneuten Exposition von Erregern beobachtet wird, daher ist es wichtig, diese Zellen erkennen zu können. Daher sollten zur eindeutigen Beurteilung antigenspezifischer Speicher-B-Zell-Antworten sowohl ELISA als auch ELISPOT verwendet werden (2).
ELISPOT Assay verwendet eine Platte mit membrangefütterten Brunnen, die mit Antikörpern beschichtet sind, um sezernierte Proteine von Interesse zu erfassen. Dann wird die Platte mit Zellen und Reizen beladen, um die Proteinproduktion zu induzieren. Die sezernierten Proteine werden von den an der Oberfläche beschichteten Antikörpern erfasst. Nach entsprechender Inkubationszeit werden Zellen entfernt und das sezernierte Molekül wird mit einem biotinylierten Antikörper nachgewiesen, der im Vergleich zum Capture-Antikörper spezifisch für ein anderes Epitop ist. Als nächstes wird Streptavidinperoxidase hinzugefügt, gefolgt von der Zugabe eines Substrats, das die Detektion der Flecken ermöglicht (Abbildung 1). Die Stärke dieses Assays ist, dass es einem erlaubt, die Anzahl der Zellen zu quantitieren, die das Protein von Interesse produzieren. Wichtig ist, dass man beurteilen kann, ob sich die Gesamtzahl der Zellen, die ein bestimmtes Protein produzieren, verändert oder ob einzelne Zellen innerhalb einer Population mehr Protein produzieren. Darüber hinaus kann es Informationen über Kinetik liefern und kann verwendet werden, um die allgemeine Immunaktivierung (Mitogen-Stimulation) relativ zu antigenspezifischen Reaktionen (Antigensimulation) zu bewerten. Der ELISPOT-Test ermöglicht den Nachweis einer aktivierten Zelle unter 300.000 Zellen nach mitogener oder antigenspezifischer Aktivierung.
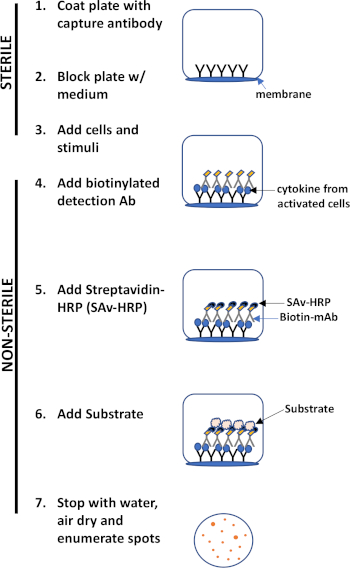
Abbildung 1: ELISPOT-Protokollübersicht.
Die Hauptvorteile dieses Assays sind seine- a. Einfachheit- das Protokoll ist relativ einfach und unkompliziert. Es erfordert keine technische Expertise, b. Sensitivität- es ermöglicht den Nachweis von Immunzellen auf einzelzellebener Ebene und erfordert sehr wenige Zellen im Vergleich zu anderen Methoden wie Durchflusszytometrie, c. Funktionalität - es liefert quantitative Daten über Immunzellen funktion.
Diese Übungseinheit zeigt das ELISPOT-Protokoll zum Nachweis von IFN-Sezersplenozyten, aber wie oben erwähnt, kann dieser Test auch zur Beurteilung der Antikörpersekretion durch B-Zellen verwendet werden (3).
Verfahren
1. Einrichtung
Puffer und Reagenzien
- Sterile Phosphat-gepufferte Saline (PBS) ohne Calcium oder Magnesium
- Beschichtungspuffer - entweder steriles PBS oder Karbonatpuffer
- Assay Verdünner - 10% fetales Rinderserum (FBS) in PBS
- Zellkultur mittel- RPMI 1640 mit 10% FBS, Penicillin/Streptomycin, & L-Glutamin
- Waschpuffer- PBS mit 0,05% Tween20
- Doppelt destilliertes Wasser (ddH2O)
- Nachweis substrat- 100 mg AEC (3-Amino-9-ethyl-carbazol) in 10 ml DMF (N,N, Dimethylformamid).
ausrüstung
- Laminare Durchflusshaube
- Befeuchtter Inkubator (eingestellt auf 37°C, 5% CO2)
- Automatisiertes ELISPOT-Lesegerät oder Sezieren von Mikroskop
Materialien
- ELISPOT-Platten
- Sterile und nichtsterile Reservoirs
- Pipettierer und Spitzen
- Sterile serologische Pipetten
- Sterile, konische Polypropylenrohre
- Zwei Squeeze-Flaschen zum Plattenwaschen
Assay Spezifische Reagenzien
- Zellen - Primärzellen oder Zelllinien (hier wurden Splenozyten von C57BL/6-Mäusen verwendet)
- Stimulanzien- Mitogen oder Antigen (hier wurden phorbol 12-Myristate 13-Acetat (PMA, 50 ng/ml) und Ionomycin (1 m) verwendet)
- Primärer Antikörper- biotinylatierter Antizytokin-Detektionsantikörper (verdünnt auf 2 g/ml in Assay-Verdünnungsmittel)
- Sekundäre Antikörper- Streptavidin-Meerrettichperoxidase (SAv-HRP)
2. Verfahren
überzug
- Um die Bedingungen steril und in einer laminaren Durchflusshaube zu halten, verdünnen Sie den gereinigten Antizytokin-Capture-Antikörper auf eine Endkonzentration von 0,5-4,0 g/ml im sterilen Beschichtungspuffer. (Hinweis: für IFN- - und IL-6 verwenden Sie 5 g/ml).
- Übertragen Sie die Capture-Antikörperlösung, 100 l/well, auf die ELISPOT-Platte.
- Bedecken Sie die Platte mit einer Plattenabdeckung und versiegeln Sie sie, um Verdunstung zu verhindern.
- Inkubieren Sie die Platte über Nacht bei 4°C.
Blockieren
- Am nächsten Tag entdecken Sie die ELISPOT-Platte in der laminaren Strömungshaube. Um die Platte schnell auf sterile Tücher umzukehren, um die Capture-Antikörperlösung aus jedem Brunnen zu entfernen.
- Fügen Sie dann jedem Brunnen 200 L Zellkulturmedium hinzu. Dieser Schritt blockiert die unspezifische Bindung während des Testes.
- Ersetzen Sie die Plattenabdeckung und inkubieren Sie die Platte für 2 Stunden bei 37°C.
Beschichtungs- und Aktivierungszellen
- Während der Inkubation der Platte, bereiten Sie eine 2X Mitogen-Lösung mit 50 ng/ml PMA und 1 M Ionomycin in Zellkultur Medium.
- Bereiten Sie dann Zielzellsuspensionen auf eine Lagerkonzentration von 2 x 106 Zellen/ml vor.
- Nachdem die Inkubation abgeschlossen ist, entfernen Sie das Zellkulturmedium aus jedem Brunnen, indem Sie die Platte schnell auf sterile Tücher in der laminaren Strömungshaube umkehren.
- Als Nächstes generieren Sie eine 2x serielle Verdünnung der Stammzellsuspensionslösung. Dazu fügen Sie zunächst 200 l der vorbereiteten zellulären Suspensionsstocklösung in die Brunnen in der oberen Reihe der ELISPOT-Platte ein.
- Fügen Sie dann 100 L des mediums einfache Zellkultur zu den nächsten fünf Reihen der Platte unter den Reihen hinzu, die eine zelluläre Stammlösung enthalten.
- Führen Sie danach eine 2-fache serielle Verdünnung durch, indem Sie 100 l der Zellsuspension aus der oberen Reihe in die Reihe direkt darunter pipetieren. Sorgen Sie für eine ordnungsgemäße Durchmischung, indem Sie diese Lösung vorsichtig nach oben und unten pipetieren, um eine gleichmäßige Verteilung der Zellen zu gewährleisten.
- Wiederholen Sie diesen Vorgang für die verbleibenden vier Zeilen.
- Lassen Sie die sechste Reihe nur mit dem Kulturmedium. Es wird als experimentelle Kontrolle dienen.
- Als nächstes fügen Sie 100 l der vorbereiteten Mitogenlösung in die Versuchsbrunnen der ersten fünf Reihen der Platte ein. In den Kontrollbrunnen und der sechsten Reihe fügen Sie 100 L der Zellkulturmedien ohne Mitogen hinzu.
- Ersetzen Sie die Plattenabdeckung und inkubieren Platte bei 37°C, 5%CO2 in einem Inkubator für 20-48 Stunden. (Hinweis: 20-24 Stunden sind in der Regel ausreichend, um IL-2 und TNF- zu erkennen, während 48 Stunden optimal für IL-4 und IFN-A sind).
entdeckung
Primärer Antikörper
- Bereiten Sie den biotinylierten Antizytokin-Detektionsantikörper auf eine Konzentration von 2 g/ml in Assay-Verdünnungsmittel vor.
- Bereiten Sie 20-25 ml Waschpuffer zu diesem Zeitpunkt durch Mischen von 0,05% Tween-20 in PBS.
- Nachdem die Inkubation abgeschlossen ist, entkappen Sie die Platte und kehren Sie sie schnell über eine Spüle um, um alle Flüssigkeit aus den Brunnen zu entfernen. (Hinweis: Nach diesem Punkt muss die Platte nicht mehr steril gehalten werden).
- Dann waschen Sie die Platte, indem Sie jedem Brunnen einen Waschpuffer von 200 L hinzufügen. Vertreiben Sie diese Flüssigkeit, indem Sie die Platte schnell umkehren und über eine Spüle flicken. Wiederholen Sie diesen Vorgang für insgesamt fünf Wähbe.
- Als nächstes fügen Sie jedem Brunnen 100 l der verdünnten biotinylierten Antizytokin-Erkennungslösung hinzu. Bei Raumtemperatur 2 Stunden bei Raumtemperatur oder über Nacht bei 4°C inkubieren.
Sekundärer Antikörper
- Nachdem die Inkubation abgeschlossen ist, vertreiben Sie den Detektionsantikörper, indem Sie die Platte umkehren und über das Waschbecken flicken.
- Waschen Sie die Platte wie bisher 5 Mal mit einem Waschpuffer von 200 l, wodurch die Flüssigkeit zwischen den einzelnen Waschanlagen ausgegart ist.
- Als nächstes fügen Sie jedem Brunnen 100 l verdünnte Streu-Meerrettich-Peroxidase-Lösung hinzu (verdünnt auf ihre vorbestimmte optimale Konzentration im Assay-Verdünnungsmittel).
- Ersetzen Sie die Plattenabdeckung und inkubieren Sie bei Raumtemperatur 1,5-2 Stunden bei 37°C.
Substrat
- Nach der Inkubation, nicht mehr als 15 Minuten vor Gebrauch, aktivieren Sie zuerst AEC Substratlösung nach Herstelleranweisungen.
- Als nächstes entsorgen Sie den Inhalt der Brunnen und waschen Sie die Platte fünfmal mit Waschpuffer, wie zuvor.
- Dann fügen Sie sofort 100 l vorbereitete AEC-Substratlösung in jeden Brunnen ein.
- Inkubieren Sie die Platte bei Raumtemperatur für 10-20 Minuten, während Sie die Punktentwicklung überwachen.
- Stoppen Sie die Reaktion, indem Sie die Platte mit Wasser abspülen und die Platte über das Waschbecken streichen.
- Bloten Sie die Platte auf Papiertücher und lassen Sie die Platte über Nacht trocknen oder bis sie vollständig trocken ist. Das Entfernen der Kunststoffschale unter der Platte erleichtert das Trocknen.
3. Datenerfassung und -analyse
- Nach dem Trocknen können die Spots mit einem automatisierten Plattenleser gezählt werden. Hier wird der CTL Immunospot Reader verwendet, aber dieses Protokoll kann für jeden Leser angepasst werden.
- Schalten Sie zuerst das Gerät ein, dann den Computer. Öffnen Sie dann das CTL-Programm und klicken Sie auf "Scananzahl".
- Drücken Sie "Auswurf" für das Fach, um sich von der Maschine zu erstrecken. Entfernen Sie dann den Kunststoffadapter und richten Sie die Reihe "A" auf der ELISPOT-Platte und dem Adapter aus.
- Wählen Sie einen Dateinamen und Speicherort für die zu speichernde Datei aus, und laden Sie die Platte auf das Fach.
- Klicken Sie dann auf "Laden" auf die Software und schließen Sie die Tür auf der Seite der Maschine.
- Drücken Sie "Start- nach dem Zählen". Stellen Sie sicher, dass die Datei gespeichert ist, und öffnen Sie dann die Software "QC" der Qualitätskontrolle, um die Daten zu analysieren und die Anzahl der Spots zu zählen.
Notizen:
- Die Mindestanzahl der Zellen sollte in Vorversuchen bestimmt werden. Die optimale Anzahl von Spots ist 50 €/gut. Wenn zu viele Zellen geladen werden, ist es schwierig, einzelne Stellen zu erkennen. Darüber hinaus überlappen sich die Zellen und bilden möglicherweise keine Monoschicht auf der Membran, so dass der Nachweisgrad reduziert werden kann.
- Berücksichtigen Sie bei der Optimierung des Experiments den erwarteten Expressionsgrad des Zielproteins. Je niedriger der Ausdruck, desto höher ist die Anzahl der Zellen, die pro Bohrkörper benötigt werden.
- Im Gegensatz zu ELISA ist es besser, die Platte von Hand zu waschen, als eine Plattenwäscherin zu verwenden. ELISPOT Platten sind empfindlicher und man sollte vermeiden, die PVDF-Membran zu punktieren.
- Man sollte die Bewegung der Platte während der Inkubationszeit begrenzen, da es dazu führen kann, dass die Flecken verschmieren.
- Platten sollten im Dunkeln gelagert werden, da die Exposition gegenüber direktem Licht dazu führt, dass Flecken verblassen.
Ergebnisse
In diesem ELISPOT-Assay wurden milden Leukozyten von Wildtyp- und tumortragenden Mäusen auf IFN-A analysiert. Abbildung 2 A zeigt das visuelle Bild des Assay-Ergebnisses. Die Zahlen in der grünen Farbe geben die Anzahl der Flecken pro Bohrkörper an (TNTC gibt "zu zahlreich an, um zu zählen"). Beachten Sie, dass die Anzahl der Flecken mit abnehmender Zellkonzentration abnimmt.
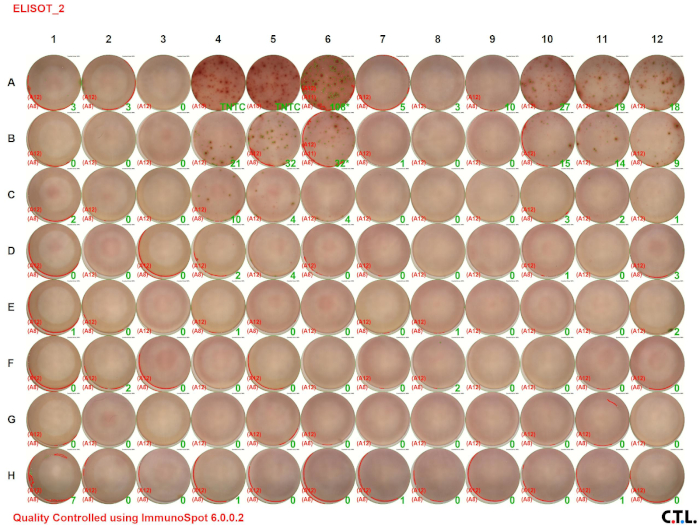
Abbildung 2A: Verminderte Immunantworten bei tumortragenden Mäusen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
In der Regel werden ELISPOT-Daten als Anzahl der Spotzahlen pro Anzahl der plattierten Zellen dargestellt. In Abbildung 2 B wird die Anzahl der Flecken in einem Balkendiagramm angezeigt, wobei die jeweilige Zellkonzentration auf der X-Achse aufgeführt ist. Für Graphikzwecke wurde 150 verwendet, um die maximale Anzahl von Spots anzugeben. Die Zahl der IFN--N, die murine Milzleukozyten bei tumortragenden Tieren produzieren, ist geringer als die der wilden Tiere.
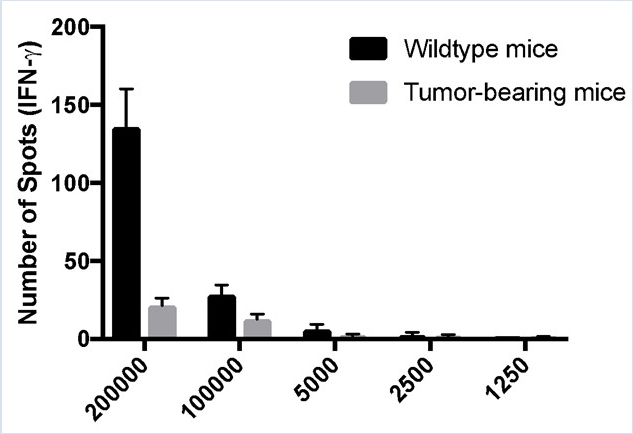
Abbildung 2B: Verminderte Immunantworten bei tumortragenden Mäusen. Splenozyten wurden von der Kontrolle C57BL/6 (Wildtyp) und tumortragenden Mäusen geerntet und 48 Stunden lang mit PMA/Ionomycin stimuliert. ELISPOT-Assays wurden verwendet, um die Anzahl der IFN--produzierenden Milzleukozyten zu quantifizieren. (A) Visuelle und (B) grafische Darstellung der Daten. TNTC gibt an, dass zu zahlreich gezählt werden kann. Für Graphikzwecke wurde 150 verwendet, um die maximale Anzahl von Spots anzugeben. Die grünen Zahlen geben die Anzahl der gezählten Spots pro Brunnen an. Die roten Zahlen geben die Referenzbrunnen an, die verwendet wurden, um zu bestimmen, welche Flecken Zellen waren und welche Flecken Trümmer, Artefakte oder Kanteneffekte waren und von der Analyse ausgeschlossen werden sollten.
Anwendung und Zusammenfassung
Der ELISPOT-Assay ermöglicht es, die Aktivierung von Immunzellen zu bewerten, indem die Anzahl der Zellen bestimmt wird, die einen bestimmten Analyten absondern. Die Größe und Intensität der Flecken gibt Auskunft über die Menge an Analyt, die von jeder Zelle produziert wird. Das oben beschriebene Protokoll beschreibt den Nachweis eines einzelnen Zytokins. Die jüngsten Entwicklungen haben jedoch den Nutzen dieses Assays verbessert. Derzeit kann man fluoreszierende Detektionsfarbstoffe verwenden, um mehrere Analyten in einem Brunnen zu erkennen. Dies ermöglicht die Detektion verschiedener Subpopulationen von Zellen, die entweder ein oder beide Analyten absondern.
Referenzen
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., & Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods, 65 (1), 109-121(1983).
- Wahid, R., Simon, J. K., Picking, W. L., Kotloff, K. L., Levine, M. M., & Sztein, M. B. Shigella antigen-specific B memory cells are associated with decreased disease severity in subjects challenged with wild-type Shigella flexneri 2a. Clinical Immunology, 148 (1), 35-43 (2013).
- Roberts, T. J., Lin, Y., Spence, P. M., Van Kaer, L., & Brutkiewicz, R. R. CD1d1-dependent control of the magnitude of an acute antiviral immune response. The Journal of Immunology, 172, 3454-3461 (2004).
pringen zu...
Videos aus dieser Sammlung:

Now Playing
ELISPOT-Assay: Nachweis von IFN-γ-sezernierenden Splenozyten
Immunology
28.5K Ansichten

Durchflusszytometrie und fluoreszenzaktivierte Zellsortierung (FACS): Isolierung von B-Lymphozyten
Immunology
92.9K Ansichten

Magnetaktivierte Zellsortierung (MACS): Isolierung von T-Lymphozyten
Immunology
22.9K Ansichten

ELISA-Test: Indirekt, Sandwich und kompetitiv
Immunology
238.3K Ansichten

Immunhistochemie und Immunzytochemie: Gewebebildgebung mittels Lichtmikroskopie
Immunology
78.9K Ansichten

Antikörper-Generierung: Herstellung monoklonaler Antikörper mit Hybridomen
Immunology
43.5K Ansichten

Immunfluoreszenzmikroskopie: Immunfluoreszenzfärbung paraffin-embedded Tissue Sections
Immunology
53.8K Ansichten

Konfokale Fluoreszenzmikroskopie: Eine Technik zur Bestimmung der Lokalisierung von Proteinen in Maus-Fibroblasten
Immunology
43.2K Ansichten

Immunprecipitation-basierte Techniken: Reinigung endogener Proteine mit Agarose-Perlen
Immunology
87.7K Ansichten

Zellzyklusanalyse: Bewertung der Proliferation von CD4- und CD8-T-Zellen nach Stimulation mit CFSE-Färbung und Durchflusszytometrie
Immunology
24.2K Ansichten

Adoptivzelltransfer: Spendermaus-Splenozyten einer Host-Maus einführen und Erfolg über FACS bewerten
Immunology
22.3K Ansichten

Assay für Zelltod: Chrom Release Assay der zytotoxischen Fähigkeit
Immunology
151.4K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten