Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La cuantificación de γH2AX focos en respuesta a la radiación ionizante
En este artículo
Resumen
La cuantificación de ADN de doble filamento con la formación de estrías γH2AX como un marcador molecular se ha convertido en una herramienta indispensable en la biología de la radiación. Aquí se demuestra el uso de un ensayo de inmunofluorescencia para la cuantificación de γH2AX focos después de la exposición de las células a la radiación.
Resumen
ADN de doble filamento se rompe (DSBs), que son inducidas por cualquiera de los procesos metabólicos endógenos o por causas exógenas, son una de las lesiones del ADN más críticos con respecto a la supervivencia y la preservación de la integridad genómica. Una primera respuesta a la inducción de DSBs es la fosforilación de la variante de la histona H2A, H2AX, en la serina-139 de residuos, en el altamente conservadas C-terminal motivo SQEY, formando γH2AX
Protocolo
Preparación de células
- Queratinocitos humanos (FEP-1811) se cultivaron en los queratinocitos-Serum medio libre (K-SFM, Invitrogen) suplementado con factor de crecimiento epidérmico, el extracto de pituitaria bovina y 20 mg / ml de gentamicina, a 37 ° C y CO 2 al 5%.
- Una suspensión de células individuales ha sido preparado por separar con tripsina-EDTA (0,05% v / v)
- Las células fueron sembradas en 8 y Laboratorio de diapositivas Tek II microcámara (10.000 células / pocillo) y las diapositivas se incubaron durante 3 días a 37 º C y 5% CO 2.
Irradiación
- Las células fueron irradiados en el hielo con 2 Gy utilizando una fuente de 137 Cs (Gammacell 1000 irradiador Elite; Nordion Internacional, ON, Canadá; 20,6 segundos / Gy)
- El control no irradiado y 2 Gy células irradiadas se incubaron durante 1 hora a 37 ° C y 5% CO 2.
La tinción de inmunofluorescencia
- Los medios de comunicación fue avisado y se lavaron las células con 300μl de PBS (w / o Ca 2 + o Mg 2 +) por pozo y se gira en un mezclador orbital durante 5 minutos.
- El buffer fue advertido y 100μl de recién preparada 4% (v / v) paraformaldehído se añadió a cada pocillo y las diapositivas se incubaron a temperatura ambiente durante 10 minutos.
Todas las incubaciones se realizaron en un canal de tinción humidificado - Las células fueron lavadas con PBS (w / o Ca 2 + o Mg 2 +). Las láminas fueron colocadas en un frasco de Coplin y se gira en un mezclador orbital durante 5 minutos. Esta etapa de lavado se repitió otras dos veces.
- El buffer fue advertido y el exceso de PBS fue borrada suavemente.
- Las células fueron permeabilized con 100 ml de Triton X-100 (0,1% v / v) por pozo y una incubación de 10 minutos a temperatura ambiente.
- Las células fueron lavadas con PBS (w / o Ca 2 + o Mg 2 +) como se describe en los pasos 3 y 4 anteriores.
- La unión no específica de proteínas fue bloqueado con 100 ml de BSA (1% v / v) por pozo y 20 minutos de incubación a temperatura ambiente.
- El exceso de BSA fue advertido y 100μl de la principal del ratón monoclonal anti-fosfo-histona H2AX de anticuerpos (diluido 1:500, en el 1% de BSA, Millipore), se añadió a cada pocillo de una incubación de 1 hora a temperatura ambiente.
- Las células fueron lavadas con PBS (w / o Ca 2 + o Mg 2 +) como se describe en los pasos 3 y 4 y se incubaron con 100μl del anticuerpo secundario (Alexa Fluor 488 cabra anti-ratón IgG diluido 1:500, en el 1% de BSA ; Invitrogen) por pocillo durante 45 minutos a temperatura ambiente en la oscuridad. (Anticuerpo diluido se mantuvo en la oscuridad durante todo el procedimiento)
- Las células fueron lavadas con PBS (w / o Ca 2 + o Mg 2 +) como se describe en los pasos 3 y 4 anteriores. Sin embargo, la exposición a la luz se redujo al mínimo el uso de aluminio.
- Contratinción nuclear se realizó con 100 ml TOPRO3 (diluido 1:500; Invitrogen) por pozo y una incubación de 10 minutos a temperatura ambiente
- Las células fueron lavadas con PBS (w / o Ca 2 + o Mg 2 +) como se describe en el paso 10.
- Las cámaras fueron cuidadosamente removidos de las diapositivas, el exceso de humedad se borró y las diapositivas se deja secar al aire.
- Una gota de prolongar GOLD anti-fade solución (Invitrogen) se añadió por pocillo y diapositivas montadas fueron (22x50 mm cubreobjetos) y el exceso de líquido alrededor de los bordes de la diapositiva se borró.
- Las diapositivas fueron mantenidos en la oscuridad durante 30 minutos a temperatura ambiente antes de sellar con esmalte de uñas.
- Las diapositivas fueron almacenados durante la noche a 4 ° C en la oscuridad, antes del análisis.
Microscopía / Análisis
- Zeiss LSM510 Meta Confocal Microscpe utiliza para adquirir imágenes con la GFP estándar (por γH2AX - Alexa Fluor 488 cabra anti-IgG de ratón) y el láser rojo lejano (por TOPRO-3). Típicamente, un aceite de 63 x lente objetivo de inmersión se usa.
Las imágenes se adquieren en un modelo de la serie Z con un tamaño de paso de 0,5 micras. Un tamaño de paso de 0.5 micras fue elegida para minimizar la pérdida de los actuales focos en diferentes planos en los núcleos. Durante el análisis, los planos individuales son deconvoluted y apilados para producir una imagen proyectada máxima para minimizar la superposición de los focos (Top-hat filtro aplicado). - Metamorph (Molecular Devices, EE.UU.) se utilizó para analizar el número de focos.
El programa cuantifica el número de focos en cada celda después de que el umbral se ha aplicado para excluir a fondo. La información se registra en una hoja de cálculo Microsoft Excel para su posterior análisis.

Figura 1. Visualización de inmunofluorescencia γH2AX focos (verde) en queratinocitos humanos no tratados y en las células irradiadas con 2 Gy y se incubó durante 1 hora a 37 ° C, 5% de CO 2. ADN fue manchado con TOPRO-3 (azul). Las imágenes fueron adquiridas con un Zeiss LSM 510 microscopio confocal Meta. Bar = 10 micras.
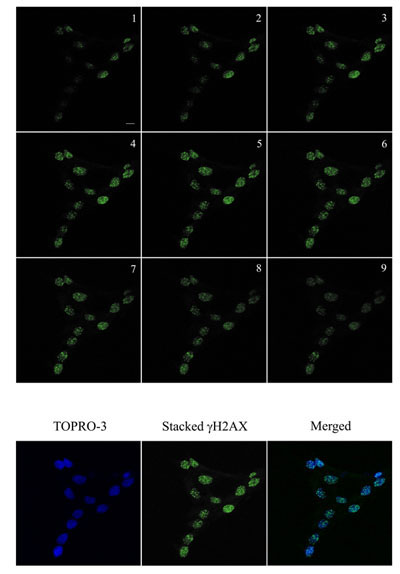
Figura 2. Inmunofluorescencia visualización de γH2AX focos (verde) en los queratinocitos humanos y en células irradiadas con 2 Gy y se incubó durante 1 hora a 37 ° C, 5% de CO 2. Las imágenes fueron adquiridas con un Zeiss LSM 510 microscopio confocal Meta con 0,5 micras Z-corte (1-9) para asegurar que todos los focos se han desarrollado. Las imágenes se apilan entonces para la cuantificación utilizando Metamorph. ADN fue manchado con TOPRO-3 (azul). El γH2AX apilados y las imágenes fueron apilados azul para la visualización. Bar = 10 micras.
Discusión
Después de la exposición a la radiación ionizante (rayos γ), γH2AX forma rápida los focos y los números de focos de alcanzar un máximo entre los 30-60 minutos 2. Por lo tanto, nuestra una hora después de la irradiación punto del tiempo refleja la formación inicial del OSD. Hemos utilizado la dosis de radiación clínicamente relevante de 2 Gy para nuestro experimento. Sin embargo, el método puede ser utilizado para la dosis de radiación hasta 4 Gy para la detección de la formación inicial del O...
Divulgaciones
Agradecimientos
El apoyo del Instituto Australiano de Ciencia Nuclear e Ingeniería se reconoce. TCK es el ganador de premios AINSE. Laboratorio de Medicina epigenómico el apoyo de la Nacional de Salud y Consejo de Investigación Médica de Australia (566.559). LM con el apoyo de Melbourne de Investigación (Universidad de Melbourne) y de Imágenes Biomédicas becas complementarias CRC. El apoyo de Monash Micro Imaging (Drs. Stephen Cody y Carmichael Iska) fue muy valiosa para este trabajo.
Materiales
| Name | Company | Catalog Number | Comments | |
| Keratinocyte-Serum Free Medium (K-SFM) | Media | Invitrogen | 17005042 | Keratinocyte media supplemented with human recombinant Epidermal Growth Factor 1-53 (EGF 1-53), and Bovine Pituitary Extract (BPE). |
| Lab Tek lI Chamber Slides (8-well) | Chamber Slides | Nalge Nunc international | NUN154534 | |
| Coverslips (22x50mm) | Coverslips | Menzel-Glaser | CS2250100 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7906 | BSA (1%) is used to block any non-specific antibody binding. Primary and secondary antibodies are diluted in BSA. | |
| PBS (without Ca2+ and Mg2+) | Invitrogen | 17-517Q | ||
| 0.5% Trypsin-EDTA x10 | Invitrogen | 15400-054 | Trypsin-EDTA (0.05%) used to detach cells from culture flasks. | |
| Triton X-100 | Reagent | Sigma-Aldrich | T8787 | Triton X-100 (0.1%) used to permeabilise cells. |
| Paraformaldehyde | Reagent | Sigma-Aldrich | 158127 | Paraformaldehyde (4%) used to fix cells. |
| Mouse monoclonal anti-phospho histone-H2AX antibody | Primary Antibody | EMD Millipore | 16193 | Dilution of primary antibody (1:500), in 1% BSA. |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) | Secondary Antibody | Invitrogen | 11029 | Dilution of secondary antibody (1:500), in 1% BSA. |
| TOPRO3 | DNA Stain | Invitrogen | T3605 | DNA stain commonly used: 4,6-diamidino-2-phenylindole dihydrochloride (DAPI). Can only be used with microscopes with the appropriate excitation laser. |
| ProLong Gold | Anti-fade solution | Invitrogen | P36930 | Refractive index of 1.42 at 20°C. |
| Tissue Culture Flask, Vented Cap | Culture Flask | BD Biosciences | 353112 | |
| Tissue Culture Dish (150x25mm) | Petridish | BD Biosciences | 353025 | |
| Coplin Jar, glass | Grale Scientific P/L | 1771-OG | ||
| Staining Trough | Grale Scientific P/L | V1991.99 | ||
| Gammacell 1000 Elite Irradiator | Gamma Irradiator | Nordion International Inc. | ||
| Zeiss LSM 510 Meta Confocal | Confocal Microscope | |||
| Metamorph | Software for Imaging analysis | Molecular Devices |
Referencias
- Rogakou, E. P., Boon, C., Redon, C., Bonner, W. M. Megabase chromatin domains involved in DNA double-strand breaks in vivo. J. Cell Biol. 146, 905-916 (1999).
- Bonner, W. M. Gamma H2AX and cancer. Nature Reviews Cancer. 8 (12), 957-967 (2008).
- Savic, V. Formation of Dynamic [gamma]-H2AX Domains along Broken DNA Strands Is Distinctly Regulated by ATM and MDC1 and Dependent upon H2AX Densities in Chromatin. Molecular Cell. 34 (3), 298-310 (2009).
- Downs, J. Binding of chromatin-modifying activities to phosphorylated histone H2A at DNA damage sites. Mol Cell. 16 (6), 979-990 (2004).
- Chowdhury, D. [gamma]-H2AX Dephosphorylation by Protein Phosphatase 2A Facilitates DNA Double-Strand Break Repair. Molecular Cell. 20 (5), 801-809 (2005).
- Nakada, S., Chen, G., Gingras, A., Durocher, D. PP4 is a gamma H2AX phosphatase required for recovery from the DNA damage checkpoint. EMBO Rep. 9 (10), 1019-1026 (2008).
- Altaf, M., Auger, A., Covic, M., Côté, J. Connection between histone H2A variants and chromatin remodeling complexes. Biochem Cell Biol. 87 (1), 35-50 (2009).
- Kusch, T. Acetylation by Tip60 Is Required for Selective Histone Variant Exchange at DNA Lesions. Science. 306, 2084-2087 (2004).
- Hurlin, P. Progression of human papillomavirus type 18-immortalized human keratinocytes to a malignant phenotype. Proc Natl Acad Sci U S A. 88 (2), 570-574 (1991).
- Dickey, J. H2AX: functional roles and potential applications. Chromosoma. , (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados