Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Quantifizierung der γH2AX Foci in Response to ionisierender Strahlung
In diesem Artikel
Zusammenfassung
Die Quantifizierung der DNA-Doppelstrang Streifen mit γH2AX Bildung als einen molekularen Marker hat sich zu einem wertvollen Werkzeug in der Strahlenbiologie. Hier zeigen wir die Verwendung eines Immunfluoreszenztest zur Quantifizierung von γH2AX Foci nach Exposition von Zellen gegenüber Strahlung.
Zusammenfassung
DNA-Doppelstrangbrüche (DSB), die entweder durch endogene Stoffwechselprozesse oder durch exogene Quellen hervorgerufen werden, sind eines der wichtigsten DNA-Schäden in Bezug auf das Überleben und die Erhaltung der genomischen Integrität. Eine frühe Reaktion auf die Induktion von DSB ist die Phosphorylierung des H2A Histon-Variante H2AX, bei der Serin-139-Rest, in der hoch konservierten C-terminalen SQEY Motiv bilden γH2AX
Protokoll
Cell Preparation
- Menschliche Keratinozyten (FEP-1811) wurden in Keratinozyten-Serum-freiem Medium gewachsen (K-SFM; Invitrogen), ergänzt mit epidermal growth factor-, Rinder-Hypophysen-Extrakt und 20 pg / ml Gentamicin, bei 37 ° C und 5% CO 2.
- Eine einzelne Zelle Suspension wurde durch Ablösen mit Trypsin-EDTA (0,05% v / v) vorbereitet
- Die Zellen wurden in 8-Well-Lab Tek II Mikrokammer Objektträger ausgesät (10.000 Zellen / well) und Dias wurden für 3 Tage bei 37 ° C und 5% CO 2 inkubiert.
Bestrahlung
- Die Zellen wurden auf Eis mit 2 Gy mit einer 137 Cs-Quelle (; Nordion International, ON, Canada; Gammacell 1000 Elite Strahler 20,6 Sekunden / Gy) bestrahlt
- Unbestrahltes Steuerung und 2 Gy bestrahlten Zellen wurden für 1 Stunde bei 37 ° C und 5% CO 2 inkubiert.
Immunfluoreszenzfärbung
- Media wurde gekippt off und die Zellen wurden mit 300μl PBS (w / o Ca 2 + oder Mg 2 +) pro Vertiefung gewaschen und gedreht und auf eine orbitale Mischer für 5 Minuten.
- Der Puffer wurde gekippt off und 100 &mgr; l an frisch zubereiteten 4% (v / v) Paraformaldehyd in jede Vertiefung gegeben wurde und Objektträger wurden bei Raumtemperatur für 10 Minuten inkubiert.
Alle Inkubationen wurden in einem befeuchteten Färbetrog durchgeführt - Die Zellen wurden dann mit PBS (w / o Ca 2 + oder Mg 2 +) gewaschen. Objektträger wurden in einer Coplin Glas und gedreht und auf eine orbitale Mischer für 5 Minuten gesetzt. Dieser Waschschritt wurde noch zweimal wiederholt.
- Der Puffer wurde gekippt off und überschüssiges PBS wurde vorsichtig abgetupft.
- Die Zellen wurden permeabilisiert mit 100ml Triton X-100 (0,1% v / v) pro Vertiefung und eine 10-minütige Inkubation bei Raumtemperatur.
- Die Zellen wurden mit PBS gewaschen (w / o Ca 2 + oder Mg 2 +) wie in den Schritten 3 und 4 beschrieben.
- Nicht-spezifische Protein-Bindung wurde mit 100 ml BSA (1% v / v) pro Vertiefung und 20 Minuten Inkubation bei Raumtemperatur blockiert.
- Überschüssiges BSA wurde gekippt off und 100 &mgr; l der primären monoklonalen Maus-anti-phospho Histon-H2AX Antikörper (1:500 verdünnt in 1% BSA; Millipore), wurde zu jeder Vertiefung für eine 1-stündige Inkubation bei Raumtemperatur zugegeben.
- Die Zellen wurden mit PBS gewaschen (w / o Ca 2 + oder Mg 2 +) wie in den Schritten 3 und 4 oben beschrieben inkubiert und mit 100 &mgr; l des sekundären Antikörper (Alexa Fluor 488 Ziege anti-Maus IgG 1:500 verdünnt in 1% BSA ; Invitrogen) pro Well für 45 Minuten bei Raumtemperatur im Dunkeln. (Verwässert Antikörper wurde in der Dunkelheit während des gesamten Verfahrens aufbewahrt)
- Die Zellen wurden mit PBS gewaschen (w / o Ca 2 + oder Mg 2 +) wie in den Schritten 3 und 4 beschrieben. Allerdings war Lichteinfall minimiert mit Folie.
- Pro Well und eine 10-minütige Inkubation bei Raumtemperatur; Nuclear Gegenfärbung wurde mit 100ml TOPRO3 (Invitrogen verdünnt 1:500) durchgeführt
- Die Zellen wurden mit PBS (w / o Ca 2 + oder Mg 2 +) gewaschen wie in Schritt 10 beschrieben.
- Die Kammern wurden sorgfältig von den Folien entfernt, überschüssige Feuchtigkeit geblottet und Objektträger wurden an der Luft getrocknet.
- Ein Tropfen ProLong GOLD Anti-Fade-Lösung (Invitrogen) wurde pro Vertiefung zugegeben und Objektträger wurden montiert (22X50 mm Deckglas) und überschüssige Flüssigkeit an den Rändern der Objektträger wurde ausgelöscht.
- Die Folien wurden im Dunkeln für weitere 30 Minuten bei Raumtemperatur vor dem Versiegeln mit Lack gehalten.
- Die Objektträger wurden über Nacht bei 4 ° C im Dunkeln vor der Analyse.
Mikroskopie / Analysis
- Zeiss LSM510 Meta Confocal Microscpe verwendet, um Bilder mit dem Standard-GFP zu erwerben (für γH2AX - Alexa Fluor 488 Ziege anti-Maus IgG) und weit roten Laser (für TOPRO-3). Typischerweise wird eine 63 x Ölimmersionsobjektiv verwendeten Objektiv.
Die Bilder werden in einer Z-Serie Muster mit einer Schrittweite von 0,5 mu m erworben. Einer Schrittweite von 0,5 mu m wurde gewählt, um den Verlust von Herden in verschiedenen Ebenen zu minimieren, die Kerne. Während der Analyse werden die einzelnen Ebenen zerlegt und gestapelt, um eine maximale projizierte Bild, um die Überlappung der Herde (Top-Hat-Filter angewendet) zu minimieren produzieren. - Metamorph (Molecular Devices, USA) wurde verwendet, um Zahl der Herde zu analysieren.
Das Programm quantifiziert die Zahl der Herde in jeder Zelle nach dem Schwellenwert angewendet worden, um Kenntnisse und Schutzrechte ausschließen. Die Informationen werden in einer Microsoft Excel-Tabelle zur weiteren Analyse protokolliert.

Abbildung 1. Immunfluoreszenz Visualisierung von γH2AX Brennpunkte (grün) in unbehandelten humanen Keratinozyten und in Zellen mit 2 Gy bestrahlt und inkubiert noch 1 Stunde bei 37 ° C, 5% CO 2. DNA wurde mit TOPRO-3 (blau) gefärbt. Bilder wurden mit einem Zeiss LSM 510 Meta konfokale Mikroskop. Bar = 10 pm.
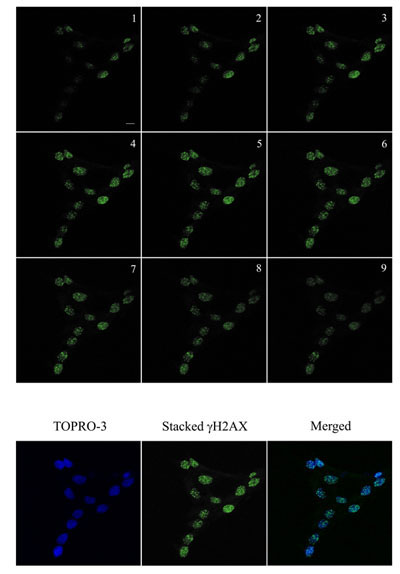
Abbildung 2. Immunfluoreszenz Visualisierung von γH2AX Brennpunkte (grün) in humanen Keratinozyten und in Zellen mit 2 Gy bestrahlt und inkubiert noch 1 Stunde bei 37 ° C, 5% CO 2. Bilder wurden mit einem Zeiss LSM 510 Meta konfokale Mikroskop mit 0,5 um Z-Schnitte (1-9), um sicherzustellen, dass alle Schwerpunkte erworben wurden. Die Bilder wurde dann zur Quantifizierung mit Metamorph gestapelt. DNA wurde mit TOPRO-3 (blau) gefärbt. Die gestapelten γH2AX und blaue Bilder wurden für die Visualisierung gestapelt. Bar = 10 pm.
Diskussion
Nach Exposition gegenüber ionisierender Strahlung (γ-Strahlen), γH2AX Brennpunkte bilden sich rasch und Schwerpunkte Zahlen erreichen ein Maximum zwischen 30-60 Minuten 2. Daher spiegelt unsere 1 Stunde nach der Bestrahlung Zeitpunkt anfänglichen DSB Bildung. Wir haben die klinisch relevante Strahlendosis von 2 Gy für unser Experiment verwendet. Allerdings kann das Verfahren zur Strahlendosis eingesetzt werden bis zu 4 Gy für den Nachweis von anfänglichen DSB Bildung; erhebliche Überschneidungen der H...
Offenlegungen
Danksagungen
Die Unterstützung des Australian Institute of Nuclear Science and Engineering anerkannt wird. TCK war der Empfänger der AINSE Auszeichnungen. Epigenomischen Medicine Lab wird von der National Health and Medical Research Council of Australia (566559) unterstützt. LM wird von Melbourne Research (University of Melbourne) und Biomedical Imaging CRC zusätzliche Stipendien unterstützt. Die Unterstützung der Monash Micro Imaging (Drs. Stephen Cody und Iska Carmichael) war von unschätzbarem Wert für diese Arbeit.
Materialien
| Name | Company | Catalog Number | Comments | |
| Keratinocyte-Serum Free Medium (K-SFM) | Media | Invitrogen | 17005042 | Keratinocyte media supplemented with human recombinant Epidermal Growth Factor 1-53 (EGF 1-53), and Bovine Pituitary Extract (BPE). |
| Lab Tek lI Chamber Slides (8-well) | Chamber Slides | Nalge Nunc international | NUN154534 | |
| Coverslips (22x50mm) | Coverslips | Menzel-Glaser | CS2250100 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7906 | BSA (1%) is used to block any non-specific antibody binding. Primary and secondary antibodies are diluted in BSA. | |
| PBS (without Ca2+ and Mg2+) | Invitrogen | 17-517Q | ||
| 0.5% Trypsin-EDTA x10 | Invitrogen | 15400-054 | Trypsin-EDTA (0.05%) used to detach cells from culture flasks. | |
| Triton X-100 | Reagent | Sigma-Aldrich | T8787 | Triton X-100 (0.1%) used to permeabilise cells. |
| Paraformaldehyde | Reagent | Sigma-Aldrich | 158127 | Paraformaldehyde (4%) used to fix cells. |
| Mouse monoclonal anti-phospho histone-H2AX antibody | Primary Antibody | EMD Millipore | 16193 | Dilution of primary antibody (1:500), in 1% BSA. |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) | Secondary Antibody | Invitrogen | 11029 | Dilution of secondary antibody (1:500), in 1% BSA. |
| TOPRO3 | DNA Stain | Invitrogen | T3605 | DNA stain commonly used: 4,6-diamidino-2-phenylindole dihydrochloride (DAPI). Can only be used with microscopes with the appropriate excitation laser. |
| ProLong Gold | Anti-fade solution | Invitrogen | P36930 | Refractive index of 1.42 at 20°C. |
| Tissue Culture Flask, Vented Cap | Culture Flask | BD Biosciences | 353112 | |
| Tissue Culture Dish (150x25mm) | Petridish | BD Biosciences | 353025 | |
| Coplin Jar, glass | Grale Scientific P/L | 1771-OG | ||
| Staining Trough | Grale Scientific P/L | V1991.99 | ||
| Gammacell 1000 Elite Irradiator | Gamma Irradiator | Nordion International Inc. | ||
| Zeiss LSM 510 Meta Confocal | Confocal Microscope | |||
| Metamorph | Software for Imaging analysis | Molecular Devices |
Referenzen
- Rogakou, E. P., Boon, C., Redon, C., Bonner, W. M. Megabase chromatin domains involved in DNA double-strand breaks in vivo. J. Cell Biol. 146, 905-916 (1999).
- Bonner, W. M. Gamma H2AX and cancer. Nature Reviews Cancer. 8 (12), 957-967 (2008).
- Savic, V. Formation of Dynamic [gamma]-H2AX Domains along Broken DNA Strands Is Distinctly Regulated by ATM and MDC1 and Dependent upon H2AX Densities in Chromatin. Molecular Cell. 34 (3), 298-310 (2009).
- Downs, J. Binding of chromatin-modifying activities to phosphorylated histone H2A at DNA damage sites. Mol Cell. 16 (6), 979-990 (2004).
- Chowdhury, D. [gamma]-H2AX Dephosphorylation by Protein Phosphatase 2A Facilitates DNA Double-Strand Break Repair. Molecular Cell. 20 (5), 801-809 (2005).
- Nakada, S., Chen, G., Gingras, A., Durocher, D. PP4 is a gamma H2AX phosphatase required for recovery from the DNA damage checkpoint. EMBO Rep. 9 (10), 1019-1026 (2008).
- Altaf, M., Auger, A., Covic, M., Côté, J. Connection between histone H2A variants and chromatin remodeling complexes. Biochem Cell Biol. 87 (1), 35-50 (2009).
- Kusch, T. Acetylation by Tip60 Is Required for Selective Histone Variant Exchange at DNA Lesions. Science. 306, 2084-2087 (2004).
- Hurlin, P. Progression of human papillomavirus type 18-immortalized human keratinocytes to a malignant phenotype. Proc Natl Acad Sci U S A. 88 (2), 570-574 (1991).
- Dickey, J. H2AX: functional roles and potential applications. Chromosoma. , (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten