このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
電離放射線への応答でγH2AX病巣の定量化
要約
分子マーカーとしてγH2AX形成を用いてDNA二本鎖縞の定量化は、放射線生物学における非常に貴重なツールとなっています。ここでは、放射線に対する細胞の曝露後のγH2AX病巣の定量化のための免疫蛍光アッセイの使用方法を示しています。
要約
内因性の代謝プロセスによって、または外因性の要因によって誘発されるDNA二重鎖切断(DSB)は、ゲノムの完全性の生存と保全に関して、最も重要なDNA損傷の一つです。 DSBが誘導に早期の反応はγH2AXを形成し、高度に保存されたC末端SQEYモチーフに、セリン- 139残基において、H2Aヒストンバリアント、H2AXのリン酸化です。
プロトコル
細胞の準備
- ℃、5%CO 2で37、上皮成長因子、ウシ下垂体抽出物と20μg/ mlのゲンタマイシンを補った、ヒトケラチノサイト(FEP - 1811)は、ケラチノサイト、無血清培地(Invitrogen社製K - SFM)で増殖させた。
- 単一の細胞懸濁液をトリプシン- EDTA(0.05%v / v)で切り離すことによって調製した
- 細胞は8ウェルラボテックIIマイクロチャンバースライドに播種(10,000細胞/ウェル)とスライドは、37℃、5%CO 2で3日間インキュベートした。
照射
- 細胞は、137 Csのソース(; Nordionインターナショナル、カナダ、ON、20.6秒/ GyをGammacell 1000年エリート照射器)を用いて、2 Gyで氷の上に照射された
- 非照射コントロールと2 Gyの照射された細胞は37℃、5%CO 2で1時間インキュベートした。
免疫蛍光染色
- メディアは、オフチップを渡したし、細胞をウェルあたりPBSの300μl(W / OのCa 2 +またはMg 2 +)で洗浄し、5分間オービタルミキサー上で回転であった。
- バッファはオフチップを渡したとパラホルムアルデヒドを各ウェルに添加し、スライドを室温で10分間インキュベートし、新たに調製した4%(v / v)を100μlのした。
すべてのインキュベーションは加湿染色トラフで実施された - 次いで、細胞をPBS(W / OのCa 2 +またはMg 2 +)で洗浄した。スライドを5分間軌道ミキサーにコプリンジャーと回転に置かれた。この洗浄ステップは、さらに2回繰り返した。
- バッファはオフチップを渡したされ、過剰のPBSを穏やかにブロットした。
- 細胞は100ミリリットルトリトンX - 100(0.1%v / v)のウェル当たり、室温で10分間のインキュベーションを用いて透過処理された。
- 細胞をPBSで洗浄し(W / OのCa 2 +またはMg 2 +)として手順3および4で説明されている。
- 非特異的タンパク質の結合は室温でウェルあたりBSAの100ミリリットル(1%v / v)を、20分間のインキュベーションでブロックした。
- 過剰BSAは、オフチップを渡したされ、一次マウスモノクローナル抗リン酸化ヒストン- H2AX抗体(1%BSAで、1:500に希釈し、ミリポア)100μlのは、室温で1時間のインキュベーションのために各ウェルに添加した。
- 細胞をPBSで洗浄し(W / OのCa 2 +またはMg 2 +)として、上記の手順3と4で説明されていると二次抗体液100μl(のAlexa Fluor ® 488ヤギ抗マウスIgGとインキュベートは1%BSAで、1:500に希釈、暗所で室温にて45分間、ウェルあたりInvitrogen社)。 (希薄化抗体は、プロシージャ全体に暗所で保管された)
- 細胞をPBSで洗浄し(W / O カルシウムイオン又はMg 2 +)として手順3および4で説明されている。しかし、光への曝露は、箔を用いて最小化した。
- 核の対比は、100ミリリットルTOPRO3(1:500に希釈;インビトロジェン社)を用いて行ったウェルあたり、室温で10分間のインキュベーション
- 細胞は、上記の手順10で説明されているPBS(W / OのCa 2 +またはMg 2 +)で洗浄した。
- チャンバーを慎重にスライドから削除された、余分な水分を吸い取りされ、スライドを空気乾燥された。
- GOLD抗フェード液(Invitrogen)を褪色の一滴ごとによく添加し、スライドがマウントされた(22x50ミリメートルカバー)とスライドのエッジの周りに余分な液体をブロットした。
- スライドはマニキュアで密封する前に、さらに室温で30分間暗所に格納されていました。
- スライドは4℃で一晩保存した° C分析の前に暗闇の中で。
顕微鏡/分析
- ツァイスLSM510メタ焦点標準GFPを使って画像を取得するために使用されるMicroscpe(γH2AXのための - のAlexa Fluor ® 488ヤギ抗マウスIgG)と遠赤色レーザー(TOPRO - 3)。通常は、63 ×油浸対物レンズが使用されます。
画像は、0.5μmのステップサイズとZシリーズのパターンで取得されています。 0.5μmのステップサイズは、核内の別の面での焦点の現在の損失を最小限に抑えるために選ばれました。分析中に、個々の平面は巣(トップハットフィルタが適用された)の重複を最小限に抑えるために最大限の投影画像を生成するデコンボリューションと積層される。 - Metamorph(Molecular Devices社、米国)は、病巣の数を分析するために使用されました。
しきい値がバックグラウンドを排除するために適用された後のプログラムは、各セル内の病巣の数をquantitates。情報をさらに分析するためのMicrosoft Excelスプレッドシートに記録されます。

図1未治療のヒトケラチノサイトにおいて、2 Gyで照射し、37℃でさらに1時間インキュベートした細胞でγH2AX病巣(緑)の免疫蛍光可視化° C、5%CO 2。 DNAはTOPRO - 3(青)で染色した。画像は、ツァイスLSM 510メタ共焦点顕微鏡を用いて取得した。バー= 10μmの。
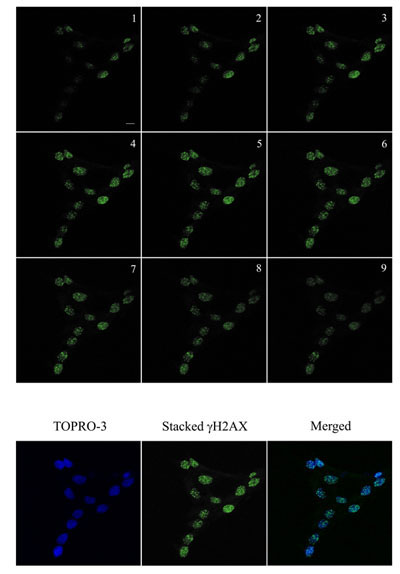
図2ヒトケラチノサイトにおいて、2 Gyで照射し、37℃でさらに1時間インキュベートした細胞でγH2AX病巣(緑)の免疫蛍光可視化° C、5%CO 2。画像は、巣が取得されたすべてを確実にするために、Z -セクショニング(1-9)は0.5μmを使用してツァイスLSM 510メタ共焦点顕微鏡を用いて取得した。画像はMetamorphを使用して定量化に積層した。 DNAはTOPRO - 3(青)で染色した。スタックγH2AXと青のイメージが可視化のために積層した。バー= 10μmの。
ディスカッション
電離放射線(γ線)、急速にγH2AX巣の形と巣の番号への曝露後には30〜60分2との間で最大に達する。したがって、私たちの1時間照射後の時点では、初期のDSBの形成を反映している。我々は我々の実験に2 Gyの臨床的に関連する放射線量を使用している。しかし、方法は、初期のDSBの形成の検出を4 Gyに被曝線量のために、最大使用することができます。巣の大幅なオーバーラップは高用?...
開示事項
謝辞
オーストラリア原子科学技術学会のサポートが認められています。 TCKはAINSE賞を受賞しました。エピ医学研究所は、国立保健オーストラリアの医学研究評議会(566559)でサポートされています。 LMは、メルボルン研究所(メルボルン大学)と医学のCRCの補助金によってサポートされています。モナッシュマイクロイメージング(博士スティーブンコーディとISKAカーマイケル)のサポートは、この仕事のための非常に貴重でした。
資料
| Name | Company | Catalog Number | Comments | |
| Keratinocyte-Serum Free Medium (K-SFM) | Media | Invitrogen | 17005042 | Keratinocyte media supplemented with human recombinant Epidermal Growth Factor 1-53 (EGF 1-53), and Bovine Pituitary Extract (BPE). |
| Lab Tek lI Chamber Slides (8-well) | Chamber Slides | Nalge Nunc international | NUN154534 | |
| Coverslips (22x50mm) | Coverslips | Menzel-Glaser | CS2250100 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7906 | BSA (1%) is used to block any non-specific antibody binding. Primary and secondary antibodies are diluted in BSA. | |
| PBS (without Ca2+ and Mg2+) | Invitrogen | 17-517Q | ||
| 0.5% Trypsin-EDTA x10 | Invitrogen | 15400-054 | Trypsin-EDTA (0.05%) used to detach cells from culture flasks. | |
| Triton X-100 | Reagent | Sigma-Aldrich | T8787 | Triton X-100 (0.1%) used to permeabilise cells. |
| Paraformaldehyde | Reagent | Sigma-Aldrich | 158127 | Paraformaldehyde (4%) used to fix cells. |
| Mouse monoclonal anti-phospho histone-H2AX antibody | Primary Antibody | EMD Millipore | 16193 | Dilution of primary antibody (1:500), in 1% BSA. |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) | Secondary Antibody | Invitrogen | 11029 | Dilution of secondary antibody (1:500), in 1% BSA. |
| TOPRO3 | DNA Stain | Invitrogen | T3605 | DNA stain commonly used: 4,6-diamidino-2-phenylindole dihydrochloride (DAPI). Can only be used with microscopes with the appropriate excitation laser. |
| ProLong Gold | Anti-fade solution | Invitrogen | P36930 | Refractive index of 1.42 at 20°C. |
| Tissue Culture Flask, Vented Cap | Culture Flask | BD Biosciences | 353112 | |
| Tissue Culture Dish (150x25mm) | Petridish | BD Biosciences | 353025 | |
| Coplin Jar, glass | Grale Scientific P/L | 1771-OG | ||
| Staining Trough | Grale Scientific P/L | V1991.99 | ||
| Gammacell 1000 Elite Irradiator | Gamma Irradiator | Nordion International Inc. | ||
| Zeiss LSM 510 Meta Confocal | Confocal Microscope | |||
| Metamorph | Software for Imaging analysis | Molecular Devices |
参考文献
- Rogakou, E. P., Boon, C., Redon, C., Bonner, W. M. Megabase chromatin domains involved in DNA double-strand breaks in vivo. J. Cell Biol. 146, 905-916 (1999).
- Bonner, W. M. Gamma H2AX and cancer. Nature Reviews Cancer. 8 (12), 957-967 (2008).
- Savic, V. Formation of Dynamic [gamma]-H2AX Domains along Broken DNA Strands Is Distinctly Regulated by ATM and MDC1 and Dependent upon H2AX Densities in Chromatin. Molecular Cell. 34 (3), 298-310 (2009).
- Downs, J. Binding of chromatin-modifying activities to phosphorylated histone H2A at DNA damage sites. Mol Cell. 16 (6), 979-990 (2004).
- Chowdhury, D. [gamma]-H2AX Dephosphorylation by Protein Phosphatase 2A Facilitates DNA Double-Strand Break Repair. Molecular Cell. 20 (5), 801-809 (2005).
- Nakada, S., Chen, G., Gingras, A., Durocher, D. PP4 is a gamma H2AX phosphatase required for recovery from the DNA damage checkpoint. EMBO Rep. 9 (10), 1019-1026 (2008).
- Altaf, M., Auger, A., Covic, M., Côté, J. Connection between histone H2A variants and chromatin remodeling complexes. Biochem Cell Biol. 87 (1), 35-50 (2009).
- Kusch, T. Acetylation by Tip60 Is Required for Selective Histone Variant Exchange at DNA Lesions. Science. 306, 2084-2087 (2004).
- Hurlin, P. Progression of human papillomavirus type 18-immortalized human keratinocytes to a malignant phenotype. Proc Natl Acad Sci U S A. 88 (2), 570-574 (1991).
- Dickey, J. H2AX: functional roles and potential applications. Chromosoma. , (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved