Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Focalización de estructuras profundas del cerebro con microinyecciones de entrega de medicamentos, vectores virales, o trasplantes de células
En este artículo
Resumen
En este artículo, se muestra un método para fabricar agujas capilar de vidrio con una luz de 50 micras. Esta técnica reduce significativamente el daño cerebral, minimiza la difusión pasiva de las drogas y permite una segmentación precisa en el cerebro de roedores.
Resumen
Microinyecciones en el parénquima cerebral son procedimientos importantes para llevar medicamentos, vectores virales o los trasplantes de células. La lesión cerebral que produce una aguja de la inyección durante su trayectoria es una gran preocupación especialmente en el cerebro del ratón, no sólo para el cerebro es pequeño, pero también a veces se necesitan múltiples inyecciones. Mostramos aquí un método para producir agujas capilar de vidrio con una luz de 50 m que reduce significativamente el daño cerebral y permite una segmentación precisa en el cerebro de roedores. Este método permite una entrega de volúmenes pequeños (20 a 100 nl), reduce los riesgos de sangrado y reduce al mínimo la difusión pasiva de drogas en el parénquima cerebral. Mediante el uso de diferentes tamaños de tubos capilares, o cambiar la luz de aguja, varios tipos de sustancias y las células se pueden inyectar. Microinyecciones con un tubo capilar de vidrio representan una mejora significativa en las técnicas de inyección y cerebral profunda orientación con mínimo daño colateral en los roedores pequeños.
Protocolo
- Hacen que las agujas de vidrio antes de la cirugía del ratón:
- Coloque el tubo capilar de vidrio en un extractor de micropipeta.
- Calentar la mitad del tubo de vidrio para suavizar el tubo de vidrio en el área localizada.
- Estire el tubo de vidrio a lo largo de su eje longitudinal por una distancia inicial suficiente para causar una reducción en el diámetro del tubo de vidrio en el área localizada.
- Mantenga el estiramiento del tubo de vidrio hasta que se rompe. De esta manera, dos agujas idénticas barril se obtienen.
- Coloque la aguja de vidrio en un microforge. Un ángulo de 30 ° es suficiente para bisel de la punta.
- Compruebe con el microscopio que cada aguja tiene el diámetro interior correcto. Para la mayoría de los fármacos hidrófilos un diámetro de 30-50 micras interior es ideal (figura 1).
- Llene la aguja con aceite mineral de la más amplia extremo de la aguja de vidrio. Deje que el aceite mineral (MSDS, cat. M7700) entra por capilaridad hasta que llega a aproximadamente el 50% de la longitud del tubo capilar. Ponga la grasa de alto vacío (Dow Corning, cat. 05054-AB) alrededor del pistón para sellar el extremo más ancho de la aguja.
- Inserte el émbolo por el extremo más ancho de la aguja y presione suavemente el aceite mineral hasta que una pequeña gota de aceite se ve saliendo de la punta de la aguja de vidrio.
- Asegurar la aguja de vidrio en el titular de la microinyector.
- Anestesiar el ratón con el 2,5% Avertin (2,2,2-tribromoetanol + terc-amil alcohol, 1:1 w / v). Dosis de 25 30μL por gramo intraperitoneal.
- Ponga una almohadilla de calefacción en el dispositivo de estereotaxia para mantener la temperatura corporal del animal a 37 ° C.
- Colocar y fijar la cabeza del ratón en el dispositivo de estereotaxia con barras de oído y un soporte para los dientes.
- Limpie la cabeza del ratón con una solución de clorhexidina al 0,1% de gluconato, seguido por el 70% de etanol y 0,1% de gluconato de clorhexidina por segunda vez.
- Incisión en la piel con una hoja de bisturí # 15 de las orejas del ratón a la línea del cráneo Lamba.
- Pulir el cráneo con un algodón para secar la piel y tirar hacia fuera del campo quirúrgico.
- Use la punta de la aguja de vidrio a punto en el vértice de la sutura Bregma. No tienes que definir la posición inicial del inyector (la coordenada "cero").
- Establecer el punto de ser perforado por el movimiento de la "X" e "Y" eje del dispositivo de estereotaxia sobre el cráneo.
- Taladro con mucho cuidado los agujeros en la coordenada seleccionada. Microdrills y otras herramientas de metal fueron esterilizadas previamente a 250 ° C durante 60 segundos con un paño seco de cuentas de vidrio esterilizador (Cole Palmer, cat. N º EW-10779-00).
- Con unas pinzas finas retirar con cuidado la capa más profunda de los huesos y romper la membrana duramatter (verá un poco de líquido cefalorraquídeo se escape).
- Confirmar que la aguja se puede ir a través de los agujeros perforados.
- Pipeta de 1 l de la droga que desee inyectar y lo puso en un pequeño trozo de parafilm.
- Coloque la parafina en el cráneo.
- Aspirar la droga haciendo girar la rueda microinyector, mientras se revisa bajo el microscopio que el líquido se va para arriba en la aguja de vidrio.
- Retire la parafina y volver a configurar el sistema de cero.
- Mover la aguja de las coordenadas seleccionadas, por el titular hasta que la punta de la aguja de vidrio tocar suavemente la superficie del cerebro y establecer la "Z" coordinar a cero.
- Introducir la aguja de vidrio en el parénquima cerebral a una profundidad seleccionada.
- Se inyectan la droga lentamente a una velocidad de ~ 1 nl / seg.
- Cuando se inyecta el volumen deseo, dejar que el medicamento difusa en el parénquima durante 2 min. A continuación, proceder a retirar la aguja suavemente y poco a poco.
- Cola de la herida quirúrgica y remover al animal del dispositivo de estereotaxia y el sacrificio del animal en una jaula de pre-calentado que contiene una cama limpia para la recuperación de la anestesia.
- Para proporcionar analgesia postoperatoria todos los animales recibieron 5 mg / kg por vía subcutánea cada hora Ketorolaco 12 por 24 h.
Los resultados representativos:
Cuando se sigue este protocolo, una inyección muy precisa y se obtiene un trayecto de la aguja muy estrecha minimiza la lesión cerebral. Como un resultado representativo de este método, se inyectan lisofosfatidil colina (lisolecitina) en el cuerpo calloso que produce la desmielinización de los tractos de sustancia blanca 1-4. Para minimizar el daño cerebral producido por la aguja de vidrio, se inyecta sólo el 20 nl de lisolecitina en el cuerpo calloso, pero si los volúmenes necesarios mayores de hasta 200 nl se puede inyectar con el mismo método. Desmielinización se detecta por la ausencia de expresión de proteína básica de mielina en los tractos de sustancia blanca (Figura 2).

Figura 1. Una aguja de vidrio con un diámetro de 50 micras. Distancia entre dos ticks cortoen la escala representa una longitud de 50 micras.
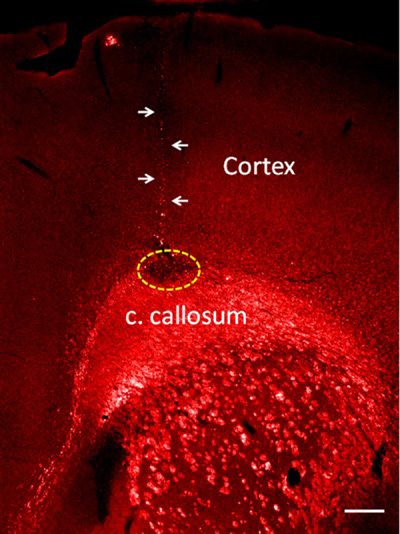
Figura 2. Lisolecitina inyección en el cuerpo calloso. Desmielinización se muestra como una expresión de la proteína básica de mielina no (área punteada). Tenga en cuenta el pequeño tamaño del trayecto de la aguja de cristal (flechas). Bar = 100 m
Discusión
El método demostró en este video es muy útil para proporcionar la mayor parte de los fármacos o vectores virales en lugares muy precisos en el cerebro. Algunas de las principales ventajas de esta técnica son la confiabilidad del punto de focalización, la exactitud de las inyecciones y el pequeño tamaño de la lesión cerebral y daños en las vías 1, 2, 5, 6. Una vez que la técnica se estandarizó el rango de mala focalización que 50 micras o menos 1, 2. Los trasplantes de células tambié...
Divulgaciones
Agradecimientos
OG-P fue apoyado por CONACyT s de subvención (CB-2008 a 101.476) y FRABA (686 décimos). AQ-H el apoyo del Instituto Nacional de Salud, el Instituto Médico Howard Hughes, la Fundación Robert Wood Johnson y la Fundación Madre Maryland celular.
Materiales
| Name | Company | Catalog Number | Comments |
| Capillary glass tube | Wiretrol I | 5-000-1001 | |
| Micropipette puller | Kopf Instruments | Model 730 | |
| Microforge | World Precision Instruments, Inc. | Model 48000 | |
| Mineral oil | MSDS | M7700 | |
| High-vacuum grease | Dow Corning | 05054-AB | |
| Anesthesia: 2.5% Avertin | 2,2,2-tribrom–thanol + tert-amyl alcohol, 1:1 w/v | ||
| Heater pad | Mastex | Model 900 | |
| Stereotactic device | Kopf Instruments | Model Kopf-900 | |
| Surgical scalpel blade # 15 | Medi-Cut | ||
| Micro driller | Ideal Micro Drill | 67-1000 | |
| Fine forceps | Fine Science Tools | ||
| 1-μL Micropipette | Rainin | ||
| Parafilm M. | |||
| Surgical microscope | Carl Zeiss, Inc. | Vasiorkop with Contraves system | |
| Microinjector | Narishige International | Model MO-10 |
Referencias
- Menn, B. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26, 7907-7918 (2006).
- Gonzalez-Perez, O., Romero-Rodriguez, R., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Epidermal Growth Factor Induces the Progeny of Subventricular Zone Type B Cells to Migrate and Differentiate into Oligodendrocytes. Stem Cells. 27, 2032-2043 (2009).
- Hall, S. M. Some aspects of remyelination after demyelination produced by the intraneural injection of lysophosphatidyl choline. J Cell Sci. 13, 461-477 (1973).
- Webster, G. R., Thompson, R. H. Observations on the presence of lysolecithin in nervous tissues. Biochim Biophys Acta. 63, 38-45 (1962).
- Doetsch, F., Caille, I., Lim, D. A., García-Verdugo, J. M., Alvarez-Buylla, A. Subventricular Zone Astrocytes Are Neural Stem Cells in the Adult mammalian Brain. Cell. 97, 1-20 (1999).
- Doetsch, F., Petreanu, L., Caille, I., Garcia-Verdugo, J. M., Alvarez-Buylla, A. EGF converts transit-amplifying neurogenic precursors in the adult brain into multipotent stem cells. Neuron. 36, 1021-1034 (2002).
- Baraban, S. C. Reduction of seizures by transplantation of cortical GABAergic interneuron precursors into Kv1.1 mutant mice. Proc Natl Acad Sci U S A. 106, 15472-15477 (2009).
- Richardson, R. M., Barbaro, N. M., Alvarez-Buylla, A., Baraban, S. C. Developing cell transplantation for temporal lobe epilepsy. Neurosurg Focus. 24, E17-E17 (2008).
- Alvarez-Dolado, M. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain. J Neurosci. 26, 7380-7389 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados