É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Segmentação de estruturas cerebrais profundas com Microinjeções para entrega de drogas, vetores virais, ou Transplantes de Células
Neste Artigo
Resumo
Neste artigo, vamos mostrar um método para fazer agulhas capilar de vidro com um lúmen 50 mícrons. Esta técnica reduz significativamente os danos cerebrais, minimiza difusão passiva de drogas e permite uma segmentação precisa no cérebro de roedores.
Resumo
Microinjeções no parênquima cerebral são procedimentos importantes para entregar drogas, vetores virais ou transplantes de células. A lesão cerebral que uma agulha de injeção produz durante sua trajetória é uma grande preocupação, especialmente no cérebro do rato, não só para o cérebro é pequeno, mas às vezes também de múltiplas injeções são necessárias. Mostramos aqui um método para produzir agulhas capilar de vidro com um lúmen 50 mícrons, que reduz significativamente os danos cerebrais e permite uma segmentação precisa no cérebro de roedores. Este método permite uma entrega de pequenos volumes (20-100 nl), reduz os riscos de sangramento, e minimiza a difusão passiva de drogas dentro do parênquima cerebral. Usando diferentes tamanhos de tubos capilares de vidro, ou mudando o lúmen da agulha, vários tipos de substâncias e células pode ser injetado. Microinjeções com um tubo de vidro capilar representam uma melhoria significativa nas técnicas de injeção e cerebral profunda segmentação com danos colaterais mínimos em pequenos roedores.
Protocolo
- Fazer agulhas de vidro antes da cirurgia mouse:
- Coloque o tubo de vidro capilar em um extrator de micropipeta.
- O calor do meio do tubo de vidro para suavizar o tubo de vidro na área localizada.
- Estique o tubo de vidro ao longo de seu eixo longitudinal por uma distância inicial suficiente para causar uma redução no diâmetro do tubo de vidro na área localizada.
- Mantenha o tubo de vidro que se estende até que quebre. Desta forma, dois idênticos agulhas único barril são obtidos.
- Coloque a agulha de vidro em uma microforge. Um ângulo de 30 ° é suficiente para chanfrar a ponta.
- Verifique sob o microscópio que cada agulha tem o diâmetro correto interior. Para a maioria das drogas hidrofílicas um diâmetro 30-50 mM interior é ideal (figura 1).
- Encha-se a agulha com óleo mineral a partir da maior final de agulha de vidro. Deixe que o óleo mineral (MSDS, Cat. M7700) entra por capilaridade, até atingir ~ 50% do comprimento do tubo capilar. Coloque a vácuo de alta gordura (Dow Corning, Cat. 05054-AB) em todo o êmbolo para selar o maior ponta da agulha.
- Insira o êmbolo pelo maior ponta da agulha e empurre delicadamente o óleo mineral até que uma pequena gota de óleo é visto saindo da ponta da agulha de vidro.
- Segura a agulha de vidro no suporte do microinjetor.
- Anestesiar o rato com Avertin 2,5% (2,2,2-tribromoetanol + terc-amil álcool, 01:01 w / v). Dose de 25 30μL por grama intraperitoneal.
- Coloque uma almofada de aquecimento no aparelho estereotáxico para manter a temperatura corporal do animal a 37 ° C.
- Lugar e segura a cabeça do rato no dispositivo estereotáxico usando barras de ouvido e um suporte de dentes.
- Limpe a cabeça do rato com a solução de gluconato de clorexidina 0,1%, seguido por etanol 70% e gluconato de clorexidina 0,1% pela segunda vez.
- Inciso a pele com uma lâmina cirúrgica # 15 de orelhas de rato para a linha do crânio Lamba.
- Polonês do crânio com um cotonete para secar o produto e puxar a pele para fora do campo cirúrgico.
- Use a ponta da agulha de vidro para apontar para o vértice da sutura bregma. Lá você tem que definir a posição inicial do injetor (a coordenada "zero").
- Definir o ponto a ser perfurado, movendo o "X" e "Y" eixo do dispositivo estereotáxico sobre o crânio.
- Broca com muito cuidado buracos na coordenada selecionada. Microdrills e ferramentas de outros metais foram previamente esterilizado a 250 ° C por 60 segundos com um pano seco de contas de vidro esterilizador (Cole Palmer, Cat. No. EW-10779-00).
- Com uma pinça fina remover com cuidado a camada mais profunda do osso e romper a membrana duramatter (você vai ver algum fluido cérebro-espinhal vazando).
- Confirmar que a agulha pode passar por buracos perfurados.
- Pipetar 1 mL da droga você quer injetar e colocá-lo em um pequeno pedaço de parafilme.
- Coloque o parafilme sobre o crânio.
- Sugam a droga girando a roda microinjetor, enquanto verifica sob o microscópio que o fluido está subindo para dentro da agulha de vidro.
- Remover o parafilme e re-definir a coordenar zero.
- Mover a agulha para as coordenadas selecionado, o porta até que a ponta da agulha de vidro tocar suavemente na superfície do cérebro e definir a "Z" coordenar a zero.
- Introduzir a agulha de vidro para o parênquima cerebral em profundidade selecionada.
- Injetar a droga lentamente a uma taxa de ~ 1 nl / sec.
- Quando o volume desejo é injetado, deixe o difuso de drogas dentro do parênquima por 2 min. Em seguida, avance para remover a agulha suavemente e lentamente.
- Cola a ferida cirúrgica e remover o animal a partir do dispositivo estereotáxico e colocar o animal em uma gaiola pré-aquecido contendo uma cama limpa para a recuperação da anestesia.
- Para fornecer analgesia pós-operatória todos os animais receberam 5 mg / kg subcutânea Ketorolac cada hora de 12 para 24 h.
Resultados representativos:
Ao seguir este protocolo, uma injeção muito precisa é obtida e uma faixa muito estreita agulha minimiza lesão cerebral. Como resultado representante deste método, injetamos lysophosphatidyl colina (lysolecithin) no corpo caloso, que produz desmielinização de tratos de substância branca 1-4. Para minimizar a lesão cerebral produzido pela agulha de vidro, injetou apenas 20 nl de lysolecithin no corpo caloso, mas se necessário maior volume de até 200 nl pode ser injetado com o mesmo método. Desmielinização é detectada pela ausência de mielina expressão da proteína básica na tratos de substância branca (Figura 2).

Figura 1. Uma agulha de vidro com um diâmetro de 50 mícrons. Distância entre dois ticks curtana escala representa um comprimento de 50 mícrons.
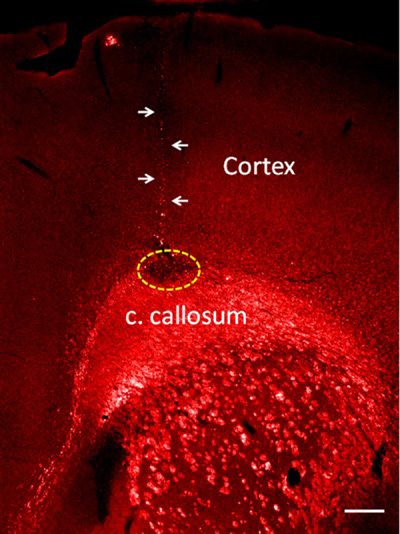
Figura injeção Lysolecithin 2. No corpo caloso. Desmielinização é mostrado como um não a expressão da proteína básica de mielina (área pontilhada). Observe o pequeno tamanho do vidro do trato agulha (setas). Bar = 100 mm
Discussão
O método mostrou neste vídeo é muito útil para entregar a maioria das drogas ou vetores virais em lugares muito precisos para o cérebro. Algumas das principais vantagens desta técnica são a confiabilidade do ponto de focalização, a precisão das injeções eo pequeno tamanho da lesão cerebral e danos trato 1, 2, 5, 6. Uma vez que a técnica é padronizada a faixa de 50 mm deve mistargeting ou menos 1, 2. Transplantes de células também pode ser feito usando mais amplo, 100-150 mM 7-...
Divulgações
Agradecimentos
OG-P foi apoiada por CONACyT s subvenção (CB-2008-101476) e Fraba (686/10). AQ-H apoiado pelo Instituto Nacional de Saúde, o Howard Hughes Medical Institute, da Robert Wood Johnson Foundation e da Fundação Maryland células-tronco.
Materiais
| Name | Company | Catalog Number | Comments |
| Capillary glass tube | Wiretrol I | 5-000-1001 | |
| Micropipette puller | Kopf Instruments | Model 730 | |
| Microforge | World Precision Instruments, Inc. | Model 48000 | |
| Mineral oil | MSDS | M7700 | |
| High-vacuum grease | Dow Corning | 05054-AB | |
| Anesthesia: 2.5% Avertin | 2,2,2-tribrom–thanol + tert-amyl alcohol, 1:1 w/v | ||
| Heater pad | Mastex | Model 900 | |
| Stereotactic device | Kopf Instruments | Model Kopf-900 | |
| Surgical scalpel blade # 15 | Medi-Cut | ||
| Micro driller | Ideal Micro Drill | 67-1000 | |
| Fine forceps | Fine Science Tools | ||
| 1-μL Micropipette | Rainin | ||
| Parafilm M. | |||
| Surgical microscope | Carl Zeiss, Inc. | Vasiorkop with Contraves system | |
| Microinjector | Narishige International | Model MO-10 |
Referências
- Menn, B. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26, 7907-7918 (2006).
- Gonzalez-Perez, O., Romero-Rodriguez, R., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Epidermal Growth Factor Induces the Progeny of Subventricular Zone Type B Cells to Migrate and Differentiate into Oligodendrocytes. Stem Cells. 27, 2032-2043 (2009).
- Hall, S. M. Some aspects of remyelination after demyelination produced by the intraneural injection of lysophosphatidyl choline. J Cell Sci. 13, 461-477 (1973).
- Webster, G. R., Thompson, R. H. Observations on the presence of lysolecithin in nervous tissues. Biochim Biophys Acta. 63, 38-45 (1962).
- Doetsch, F., Caille, I., Lim, D. A., García-Verdugo, J. M., Alvarez-Buylla, A. Subventricular Zone Astrocytes Are Neural Stem Cells in the Adult mammalian Brain. Cell. 97, 1-20 (1999).
- Doetsch, F., Petreanu, L., Caille, I., Garcia-Verdugo, J. M., Alvarez-Buylla, A. EGF converts transit-amplifying neurogenic precursors in the adult brain into multipotent stem cells. Neuron. 36, 1021-1034 (2002).
- Baraban, S. C. Reduction of seizures by transplantation of cortical GABAergic interneuron precursors into Kv1.1 mutant mice. Proc Natl Acad Sci U S A. 106, 15472-15477 (2009).
- Richardson, R. M., Barbaro, N. M., Alvarez-Buylla, A., Baraban, S. C. Developing cell transplantation for temporal lobe epilepsy. Neurosurg Focus. 24, E17-E17 (2008).
- Alvarez-Dolado, M. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain. J Neurosci. 26, 7380-7389 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados