Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Ориентация глубинных структур мозга с Микроинъекции для доставки лекарственных средств, вирусные векторы, или клеточных трансплантатов
В этой статье
Резюме
В этой статье мы покажем способ сделать стеклянный капилляр иглы с 50-мкм просвет. Этот метод значительно сокращает повреждение головного мозга, снижает пассивной диффузии лекарственных препаратов и позволяет точного прицеливания в грызун мозга.
Аннотация
Микроинъекции в паренхимы мозга важны процедуры доставки лекарств, вирусных векторов или клеточных трансплантатов. Поражение головного мозга, что инъекционные иглы производит во время его траектория представляет собой серьезную проблему, особенно в мозге мыши не только мозг маленький, но также иногда многократные инъекции необходимы. Мы покажем здесь метод получения стеклянных капиллярных игл с 50-мкм просвета что значительно сокращает повреждение головного мозга и позволяет точного прицеливания в грызун мозга. Этот метод позволяет доставка небольших объемах (от 20 до 100 п), уменьшает кровотечение риски и свести к минимуму пассивной диффузии препаратов в мозг паренхимы. При использовании различных размеров капилляров стекло, или изменения просвета иглы, несколько типов веществ и клеток может быть введен. Микроинъекции со стеклянной капиллярной трубке представляют собой значительное улучшение инъекционным методикам и глубокие мозга ориентации с минимальным сопутствующим ущербом в мелких грызунов.
протокол
- Сделайте стекло иглы перед мыши хирургии:
- Положите капиллярной стеклянной трубки в съемник микропипетки.
- Тепло середине стеклянной трубки, чтобы смягчить стеклянной трубки в локализованной области.
- Стретч стеклянную трубку вдоль его продольной оси на начальное расстояние достаточно, чтобы вызвать сокращение диаметр стеклянной трубки в локализованной области.
- Держите растяжку стеклянную трубку, пока его разрыва. Таким образом, два одинаковых одной иглы баррель получаются.
- Положите стекло иголку в microforge. Углом 30 ° достаточно конических наконечника.
- Проверьте под микроскопом, что каждая игла имеет правильный внутреннего диаметра. Для большинства из гидрофильных препаратов 30-50 мкм, внутренний диаметр идеально (рис. 1).
- Заполнение иглы с минеральным маслом из самого широкого конца стеклянной иглы. Пусть это минеральное масло (MSDS, кат. M7700) входит по капиллярности, пока не достигнет ~ 50% от длины капилляра. Положите высоковакуумной смазкой (Dow Corning, Кат. 05054-AB) вокруг плунжера для герметизации широкого конце иглы.
- Вставьте поршень на широкий конец иглы и нажмите мягко минеральное масло, пока маленькая капля масла видел выход из кончик стеклянной иглы.
- Безопасные стеклянные иглу в держатель microinjector.
- Обезболить мышь с 2,5% Avertin (2,2,2-tribromoethanol + трет-амиловый спирт, 1:1 в / о). DOSIS 25-30μL на грамм внутрибрюшинно.
- Положите нагреватель накладка на стереотаксической устройство держать температуру тела животного при температуре 37 ° C.
- Место и безопасный мыши головой в стереотаксической устройства с помощью уха баров и зубы держателя.
- Чистая мыши головой с 0,1% раствором хлоргексидина глюконата, а затем на 70% этанола и 0,1% хлоргексидина глюконата для второй раз.
- Надрезать кожу хирургические лезвия № 15 от мыши уши, чтобы линия черепа Ламба.
- Польские черепа с хлопком своп для сухой его и вытащить из кожи операционного поля.
- Используйте кончик стеклянной иглы в точку в вершине шва брегмы. Там вы должны установить начальное положение инжектора (координата "ноль").
- Выберите точку для бурения путем перемещения "X" и "Y" оси стереотаксической устройства через череп.
- Дрель очень тщательно отверстия в выбранных координат. Microdrills и другим металлическим инструментом, ранее стерилизуют при 250 ° С в течение 60 секунд и сухих стеклянных бус стерилизатор (Cole Palmer, Кат. EW-10779-00).
- С тонкой пинцетом осторожно удалить глубокий слой кости и разрыв duramatter мембраны (вы увидите некоторые спинномозговую жидкость утечки).
- Убедитесь, что игла может пройти через просверленные отверстия.
- Внесите 1 мкл препарат нужно вводить и положил его на маленький кусочек парафильмом.
- Положите парафильмом на черепе.
- Соси в состав препарата, крутя колесо microinjector, в то время как вы проверяете под микроскопом, что жидкость идет вверх в стеклянную иглу.
- Удалить парафильмом и повторно установить нулевую координату.
- Перемещение иглы выбраны координаты, вплоть до держателя кончик стеклянной иглы осторожно прикасаться к поверхности мозга и установить "Z" координат в нуле.
- Ввести иглу в стекло паренхимы мозга на выбранной глубине.
- Вводите препарат медленно со скоростью ~ 1 п / с.
- При желании объем вводят, не говоря наркотиков диффундировать в паренхиму в течение 2 мин. Затем переходите к удалить иглу плавно и медленно.
- Клей хирургических ран и снять животное от стереотаксической устройства и положил животное в подогретого клетку содержащую чистую постель для наркоза.
- Для обеспечения послеоперационного обезболивания все животные получали 5 мг / кг подкожного Кеторолак каждые 12 часа в течение 24 ч.
Представитель Результаты:
Когда после этого протокола, очень точный впрыск получается и очень узкие иглы трек сводит к минимуму повреждения мозга. Как представитель результате этого метода, мы вводили lysophosphatidyl холин (лизолецитин) в мозолистое тело, которое производит демиелинизации белого путей дело 1-4. Чтобы свести к минимуму травмы головного мозга производства стеклянной иглы, мы вводили только 20 п о лизолецитина в мозолистого тела, а при необходимости увеличения объемов до 200 п может быть введен с тем же методом. Демиелинизации обнаруживается отсутствие миелина основных экспрессии белка в белом участки материи (рис. 2).

Рисунок 1. Стеклянной иглы с 50-мкм в диаметре. Расстояние между двумя короткими клещейв масштабе представляет собой 50-мкм длиной.
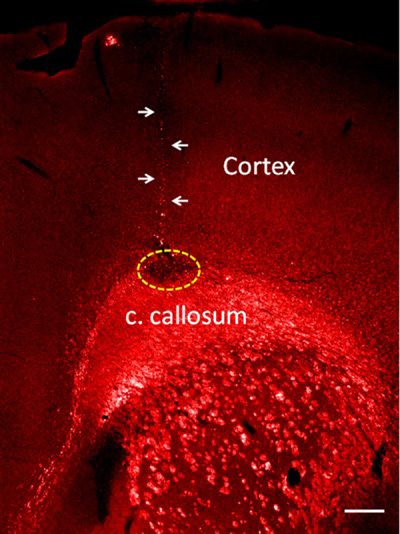
Рисунок 2. Лизолецитина инъекций в мозолистое тело. Демиелинизации показан как не миелина основных экспрессии белка (пунктирная область). Обратите внимание на небольшие размеры стеклянных иглу-кишечного тракта (стрелки). Бар = 100 мкм
Обсуждение
Метод показал в этом видео очень полезно для доставки большинства лекарств или вирусных векторов в очень точные места в мозгу. Некоторые из основных преимуществ этого метода являются надежность ориентации точки, точность инъекций и небольшие размеры поражения мозга и повреждение пут...
Раскрытие информации
Благодарности
ОГ-Р была поддержана КОНАСИТ с гранта (CB-2008-101476) и FRABA (686/10). AQ-H при поддержке Национального института здравоохранения, Медицинского института Говарда Хьюза, Роберта Вуда Джонсона Фонда и сотовый Мэриленд Стволовые Foundation.
Материалы
| Name | Company | Catalog Number | Comments |
| Capillary glass tube | Wiretrol I | 5-000-1001 | |
| Micropipette puller | Kopf Instruments | Model 730 | |
| Microforge | World Precision Instruments, Inc. | Model 48000 | |
| Mineral oil | MSDS | M7700 | |
| High-vacuum grease | Dow Corning | 05054-AB | |
| Anesthesia: 2.5% Avertin | 2,2,2-tribrom–thanol + tert-amyl alcohol, 1:1 w/v | ||
| Heater pad | Mastex | Model 900 | |
| Stereotactic device | Kopf Instruments | Model Kopf-900 | |
| Surgical scalpel blade # 15 | Medi-Cut | ||
| Micro driller | Ideal Micro Drill | 67-1000 | |
| Fine forceps | Fine Science Tools | ||
| 1-μL Micropipette | Rainin | ||
| Parafilm M. | |||
| Surgical microscope | Carl Zeiss, Inc. | Vasiorkop with Contraves system | |
| Microinjector | Narishige International | Model MO-10 |
Ссылки
- Menn, B. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26, 7907-7918 (2006).
- Gonzalez-Perez, O., Romero-Rodriguez, R., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Epidermal Growth Factor Induces the Progeny of Subventricular Zone Type B Cells to Migrate and Differentiate into Oligodendrocytes. Stem Cells. 27, 2032-2043 (2009).
- Hall, S. M. Some aspects of remyelination after demyelination produced by the intraneural injection of lysophosphatidyl choline. J Cell Sci. 13, 461-477 (1973).
- Webster, G. R., Thompson, R. H. Observations on the presence of lysolecithin in nervous tissues. Biochim Biophys Acta. 63, 38-45 (1962).
- Doetsch, F., Caille, I., Lim, D. A., García-Verdugo, J. M., Alvarez-Buylla, A. Subventricular Zone Astrocytes Are Neural Stem Cells in the Adult mammalian Brain. Cell. 97, 1-20 (1999).
- Doetsch, F., Petreanu, L., Caille, I., Garcia-Verdugo, J. M., Alvarez-Buylla, A. EGF converts transit-amplifying neurogenic precursors in the adult brain into multipotent stem cells. Neuron. 36, 1021-1034 (2002).
- Baraban, S. C. Reduction of seizures by transplantation of cortical GABAergic interneuron precursors into Kv1.1 mutant mice. Proc Natl Acad Sci U S A. 106, 15472-15477 (2009).
- Richardson, R. M., Barbaro, N. M., Alvarez-Buylla, A., Baraban, S. C. Developing cell transplantation for temporal lobe epilepsy. Neurosurg Focus. 24, E17-E17 (2008).
- Alvarez-Dolado, M. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain. J Neurosci. 26, 7380-7389 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены