Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Ciblage des structures cérébrales profondes avec des microinjections de livraison des médicaments, des vecteurs viraux, ou de cellules
Dans cet article
Résumé
Dans cet article, nous montrons une méthode pour faire des aiguilles capillaires en verre avec une lumière de 50 um. Cette technique réduit considérablement les dommages au cerveau, minimise la diffusion passive des médicaments et permet un ciblage précis dans le cerveau des rongeurs.
Résumé
Microinjections dans le parenchyme cérébral sont importantes procédures pour délivrer des médicaments, des vecteurs viraux ou des greffes de cellules. La lésion du cerveau qui produit une aiguille injectant au cours de sa trajectoire est une préoccupation majeure en particulier dans le cerveau de souris pour non seulement le cerveau est petit, mais aussi parfois de multiples injections sont nécessaires. Nous montrons ici une méthode pour produire des aiguilles capillaires en verre avec une lumière de 50 um ce qui réduit considérablement les dommages au cerveau et permet un ciblage précis dans le cerveau des rongeurs. Cette méthode permet une livraison de petits volumes (de 20 à 100 nl), réduit les risques hémorragiques, et minimise la diffusion passive des médicaments dans le parenchyme cérébral. En utilisant différentes tailles de tubes capillaires en verre, ou en changeant la lumière aiguille, plusieurs types de substances et de cellules peuvent être injectées. Microinjections avec un tube capillaire en verre représentent une amélioration significative dans les techniques d'injection et cérébrale profonde ciblage avec un minimum de dommages collatéraux chez les petits rongeurs.
Protocole
- Faire des aiguilles de verre avant la chirurgie de la souris:
- Placer le tube capillaire en verre dans un extracteur micropipette.
- Chauffer le milieu du tube de verre pour ramollir le tube en verre dans la zone localisée.
- Étirer le tube de verre long de son axe longitudinal par une distance initiale suffisante pour provoquer une réduction du diamètre du tube de verre dans la zone localisée.
- Gardez étirement du tube de verre jusqu'à ce qu'il casse. De cette façon, les deux aiguilles identiques seul baril sont obtenus.
- Mettez l'aiguille de verre dans un microforge. Un angle de 30 ° est suffisant pour la pointe conique.
- Vérifiez sous le microscope que chaque aiguille est le diamètre intérieur correct. Pour la plupart des médicaments hydrophiles d'un diamètre de 30 à 50 um intérieure est idéale (figure 1).
- Remplissez l'aiguille avec de l'huile minérale de l'extrémité la plus large de l'aiguille de verre. Laissez que l'huile minérale (FDS, Cat. M7700) pénètre par capillarité jusqu'à ce qu'il atteigne environ 50% de la longueur du tube capillaire. Mettez de la graisse à vide poussé (Dow Corning, cat. 05054-AB) autour du plongeur pour sceller l'extrémité la plus large de l'aiguille.
- Insérez le piston par l'extrémité la plus large de l'aiguille et poussez doucement l'huile minérale jusqu'à ce qu'une petite goutte d'huile est vu sortir de la pointe de l'aiguille de verre.
- Fixez l'aiguille de verre dans le titulaire de la microinjecteur.
- Anesthésier la souris avec 2,5% Avertin (2,2,2-tribromoéthanol + tert-amylique, 1:01 p / v). Dosis 25-30μL par gramme intrapéritonéale.
- Mettez un coussin chauffant sur l'appareil de stéréotaxie pour maintenir la température du corps animal à 37 ° C.
- Lieu et sécuriser la tête de la souris dans l'appareil de stéréotaxie l'aide de barres d'oreille et un porte-dents.
- Nettoyez la tête de la souris avec une solution de chlorhexidine gluconate de 0,1%, suivie par 70% d'éthanol et de gluconate de chlorhexidine 0,1% pour une deuxième fois.
- Inciser la peau avec une lame chirurgicale # 15 des oreilles de souris sur la ligne du crâne Lamba.
- Polonaise le crâne avec un coton pour le sécher et retirer la peau du champ opératoire.
- Utilisez la pointe de l'aiguille de verre au point au sommet de la suture bregma. Il faut définir la position initiale de l'injecteur (la coordonnée "zéro").
- Définissez le point d'être percés en déplaçant le "X" et "Y" l'axe du dispositif de stéréotaxie sur le crâne.
- Percez des trous très soigneusement à la coordonnée choisie. Microdrills et d'autres outils métalliques ont été préalablement stérilisés à 250 ° C pendant 60 secondes avec un chiffon sec en verre stérilisateur à billes (Cole Palmer, No. de cat. EW-10779-00).
- Avec une pince fine enlever soigneusement couche la plus profonde de l'os et de briser la membrane duramatter (vous verrez quelques liquide céphalo-rachidien fuites).
- Vérifiez que l'aiguille peut passer par des trous percés.
- Pipeter 1 pl de la drogue que vous voulez injecter et à les mettre sur un petit morceau de parafilm.
- Mettez le parafilm sur le crâne.
- Aspirez le médicament en faisant tourner la roue microinjecteur, pendant que vous vérifiez sous le microscope que le fluide qui se passe dans l'aiguille de verre.
- Retirez le parafilm et re-régler les coordonnées de zéro.
- Déplacer l'aiguille pour les coordonnées choisies, le porte-jusqu'à la pointe de l'aiguille de verre toucher doucement la surface du cerveau et de régler le "Z" de coordonner à zéro.
- Introduire l'aiguille de verre dans le parenchyme cérébral à la profondeur choisie.
- Injecter le médicament lentement au rythme d'environ 1 nl / sec.
- Lorsque le volume désir est injecté, laisser le médicament diffuse dans le parenchyme pendant 2 min. Ensuite, passez à retirer l'aiguille en douceur et lentement.
- Collez la plaie chirurgicale et enlever l'animal de l'appareil de stéréotaxie et de mettre l'animal dans une cage de pré-chauffée contenant un lit propre pour la reprise d'anesthésie.
- Pour fournir l'analgésie postopératoire tous les animaux ont reçu 5 mg / kg sous-cutanée toutes les heures kétorolac 12 pendant 24 h.
Les résultats représentatifs:
En suivant ce protocole, une injection très précise est obtenue et une piste d'aiguilles très étroite minimise les lésions cérébrales. Comme un résultat représentatif de cette méthode, nous avons injecté lysophosphatidylcholine (lysolécithine) dans le corps calleux qui produit une démyélinisation des faisceaux de matière blanche 1-4. Afin de minimiser les lésions cérébrales produites par l'aiguille de verre, nous avons injecté seulement 20 nl d'lysolécithine dans le corps calleux, mais si nécessaire des volumes plus élevés jusqu'à 200 nl peut être injecté avec la même méthode. La démyélinisation est détectée par l'absence d'expression de protéines de myéline de base dans les faisceaux de matière blanche (figure 2).

Figure 1. Une aiguille de verre d'un diamètre de 50 um. Distance entre deux ticks courtedans l'échelle représente une longueur de 50 um.
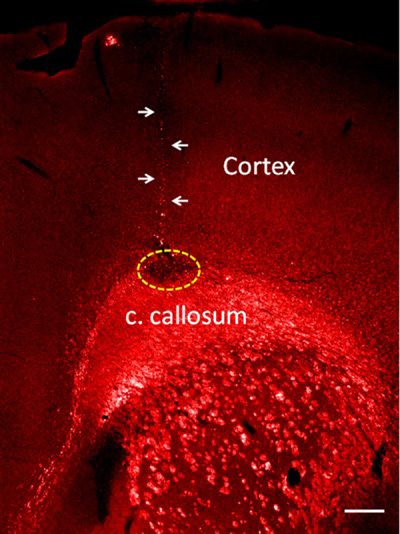
Injection de lysolécithine Figure 2. Dans le corps calleux. La démyélinisation est montré comme une expression sans protéine de myéline de base (zone pointillée). Notez la petite taille des voies aiguille de verre (flèches). Barre = 100 um
Discussion
La méthode a montré dans cette vidéo est très utile pour fournir la plupart des médicaments ou des vecteurs viraux dans des endroits très précis dans le cerveau. Certains des principaux avantages de cette technique sont la fiabilité du point de ciblage, de l'exactitude des injections et la petite taille de la lésion cérébrale et 1 dommages voies, 2, 5, 6. Une fois la technique standardisée de la gamme des erreurs de ciblage devrait 50 microns ou moins 1, 2. Greffes de cel...
Déclarations de divulgation
Remerciements
OG-P a été soutenue par le CONACyT s subvention (CB-2008-101476) et FRABA (686/10). AQ-H soutenue par le National Institute of Health, le Howard Hughes Medical Institute, la Fondation Robert Wood Johnson Foundation et le Maryland, les cellules souches.
matériels
| Name | Company | Catalog Number | Comments |
| Capillary glass tube | Wiretrol I | 5-000-1001 | |
| Micropipette puller | Kopf Instruments | Model 730 | |
| Microforge | World Precision Instruments, Inc. | Model 48000 | |
| Mineral oil | MSDS | M7700 | |
| High-vacuum grease | Dow Corning | 05054-AB | |
| Anesthesia: 2.5% Avertin | 2,2,2-tribrom–thanol + tert-amyl alcohol, 1:1 w/v | ||
| Heater pad | Mastex | Model 900 | |
| Stereotactic device | Kopf Instruments | Model Kopf-900 | |
| Surgical scalpel blade # 15 | Medi-Cut | ||
| Micro driller | Ideal Micro Drill | 67-1000 | |
| Fine forceps | Fine Science Tools | ||
| 1-μL Micropipette | Rainin | ||
| Parafilm M. | |||
| Surgical microscope | Carl Zeiss, Inc. | Vasiorkop with Contraves system | |
| Microinjector | Narishige International | Model MO-10 |
Références
- Menn, B. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26, 7907-7918 (2006).
- Gonzalez-Perez, O., Romero-Rodriguez, R., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Epidermal Growth Factor Induces the Progeny of Subventricular Zone Type B Cells to Migrate and Differentiate into Oligodendrocytes. Stem Cells. 27, 2032-2043 (2009).
- Hall, S. M. Some aspects of remyelination after demyelination produced by the intraneural injection of lysophosphatidyl choline. J Cell Sci. 13, 461-477 (1973).
- Webster, G. R., Thompson, R. H. Observations on the presence of lysolecithin in nervous tissues. Biochim Biophys Acta. 63, 38-45 (1962).
- Doetsch, F., Caille, I., Lim, D. A., García-Verdugo, J. M., Alvarez-Buylla, A. Subventricular Zone Astrocytes Are Neural Stem Cells in the Adult mammalian Brain. Cell. 97, 1-20 (1999).
- Doetsch, F., Petreanu, L., Caille, I., Garcia-Verdugo, J. M., Alvarez-Buylla, A. EGF converts transit-amplifying neurogenic precursors in the adult brain into multipotent stem cells. Neuron. 36, 1021-1034 (2002).
- Baraban, S. C. Reduction of seizures by transplantation of cortical GABAergic interneuron precursors into Kv1.1 mutant mice. Proc Natl Acad Sci U S A. 106, 15472-15477 (2009).
- Richardson, R. M., Barbaro, N. M., Alvarez-Buylla, A., Baraban, S. C. Developing cell transplantation for temporal lobe epilepsy. Neurosurg Focus. 24, E17-E17 (2008).
- Alvarez-Dolado, M. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain. J Neurosci. 26, 7380-7389 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon