Method Article
Generación de células T Multivirus específicos para prevenir / tratar las infecciones virales después de trasplante alogénico de células madre hematopoyéticas
En este artículo
Resumen
Un protocolo de forma rápida, sencilla y rentable para la generación de donantes de origen multivirus CTL específicos (RCTL) para la perfusión del trasplante alogénico de células madre hematopoyéticas de trasplante (HSCT) con riesgo de desarrollar infecciones por CMV, EBV o Adv. Este proceso de fabricación es conforme a las GMP y debe garantizar la aplicación más amplia de células T inmunoterapia más allá de los centros especializados.
Resumen
Infecciones virales causan morbilidad y mortalidad en trasplante alogénico de células madre hematopoyéticas (HSCT). Nosotros y otros han generado con éxito y se infunden las células T específicas para el virus de Epstein Barr (EBV), citomegalovirus (CMV) y el adenovirus (ADV) con los monocitos y VEB-transformado células linfoblásticas (EBV-LCL) modificadas genéticamente con un vector de adenovirus como células presentadoras de antígeno (APC). Tan sólo 5 2x10 / kg trivirus específicas linfocitos T citotóxicos (CTL) multiplicado por varios registros después de la infusión y apareció para prevenir y tratar las enfermedades virales, incluso graves resistentes a otros tratamientos disponibles. La aplicación más amplia de este enfoque alentador es limitada por altos costos de producción, la complejidad de la fabricación y el tiempo prolongado (4-6 semanas para el VEB-LCL generación, y 4-8 semanas para la fabricación de CTL - total 10 a 14 semanas) para la preparación. Para superar estas limitaciones, hemos desarrollado un nuevo GMP protocolo de producción de CTL. En primer lugar, en lugar de adenovectores para estimular las células T que utilizan las células dendríticas (DC) nucleofected con el ADN de plásmidos que codifican LMP2, EBNA1 y BZLF1 (EBV), Hexon y Penton (Avanzado), y pp65 y IE1 (CMV) como presentadoras de antígeno las células. Estos vehículos blindados reactivar las células T específicas para todos los antígenos estimulantes. Segundo cultivo, de las células T activadas en presencia de IL-4 (1.000 U / ml) e IL-7 (10ng/ml) se incrementa y mantiene el repertorio y la frecuencia de células T específicas en nuestras líneas. En tercer lugar, hemos utilizado un nuevo dispositivo, la cultura de gas permeable (G-Rex), que promueve la expansión y la supervivencia de los números de células grandes después de una estimulación única, eliminando así la necesidad de EBV-LCLs y reducir la intervención del técnico. Mediante la implementación de estos cambios se pueden producir ahora CTL multiespecíficos objetivo EBV, CMV, y Adv a un costo por cada 10 6 células que se reduce> 90%, y en sólo 10 días en lugar de 10 semanas utilizando un enfoque que puede extenderse a otros protección antígenos virales. Nuestro enfoque aprobado por la FDA deben ser de valor para las aplicaciones de profilácticos y de tratamiento para los receptores de alto riesgo TCPH alogénicos.
Protocolo
1. DC nucleofection
- Cosecha de los países en desarrollo derivados de los monocitos, que se han enriquecido con la adhesión de plástico, cultivadas durante 5 días con Cell Genix medios suplementados con IL-4 (1000U/ml), GMCSF (800IU/ml) y además con una maduración de 24 horas de uso de las citocinas IL-4 maduración de las DC (1000U / ml), GMCSF (800IU/ml), IL6100ng/ml, TNF-α 10ng/ml, IL1-β 10ng/ml y PGE2 (1μg/ml) 1, por la resuspensión suave con una pipeta de transferencia de 3 ml.
- Contar con los países en desarrollo viable con azul tripán, la transferencia en tubos de 15 ml 3 veces con no menos de 0.5x10 6 y no más de 2x10 6 células / tubo.
- Centrífuga para los países en desarrollo 10 minutos @ 200g. Durante este tiempo de pre-calentamiento celular Genix medios suplementados con las citoquinas maduración de las DC (DC maduración de los medios de comunicación) - 2ml/well en tres pozos de un cultivo de tejidos de 12 pocillos tratados en una placa de 37 ° C / 5% CO 2 incubadora.
- Una vez que las células han terminado de girar, aspirar el sobrenadante y añadir los plásmidos de ADN correspondientes a cada uno de los tubos en una concentración final de ADN 5μg / tubo. En este caso, añadir el plásmido que codifica IE1-pp65 al tubo # 1, Hexon-Penton al tubo # 2, y EBNA1-LMP2-BZLF1 al tubo # 3.
- Resuspender los países en desarrollo y el ADN con 100μl de solución nucloefection Amaxa, mezclar bien y la transferencia de las cubetas nucleofection.
- Cubetas lugar en el nucleofector 4D, elegir el programa CB150 (Amaxa / Lonza), y pulse Iniciar.
- Inmediatamente después de añadir 500μl nucleofection del 2 ml precalentado celular medios de maduración Genix DC a la cubeta, mezclar suavemente pipeteando arriba y abajo de 3.2 veces, y los países en desarrollo la transferencia de nucleofected el preparado de 12 y placa que contiene los restantes 1,5 ml de precalentado DC medios de maduración. Traslado a los 37 ° C / 5% CO 2 incubadora por un período de 12-18hrs.
2. La estimulación de células T
- La cosecha y el recuento de los países en desarrollo nucleofected, e irradiar a 30Gy. Lavar una vez con 10 ml de medio de CTL (45% RPMI, 45% EHAA clics, el 10% de SFB, 2 mM Glutamax) y resuspender @ 3 x 10 5 países en desarrollo por ml de los medios de CTL.
- Piscina con un mínimo de 7.5x10 5 (2,5 ml) y un máximo de 15x10 5 (5 ml) de los países en desarrollo que contiene cada uno de los plásmidos y transferencia de los centros de distribución en común para el dispositivo G-Rex que luego serán colocados en la incubadora.
- Para la preparación de células de respuesta utilizar PBMCs previamente congelados o no adherentes células mononucleares que quedan después de la selección de CC (adherencia o la selección de CD14). Descongelar las células, la transferencia al medio de cultivo precalentado, lavar una vez con los medios de comunicación CTL. Resuspender las células en los medios de comunicación CTL, el recuento de las células y llevarlos a una concentración de 2x10 6 células por ml. Tome 15x10 6 células o 7.5ml y complementar con 30000U IL4 (1000U/ml -. Conc final) y 300ng IL7 (10ng/ml - conc final.).
- Transferencia 7.5ml de PBMC (15x10 6 células) a la G-Rex y rellene el biorreactor con los medios de comunicación CTL para un volumen total de 30ml.
- La cultura del G-Rex durante 6-7 días en un 37 ° C / 5% CO 2 humidificado incubadora.
3. La expansión de células T
- En el día 06/07, 10 ml de aspirado de los medios de comunicación, a continuación, mezclar las células en el resto de los medios de 20ml con una pipeta de 10 ml y el recuento de células viables con azul de tripano. Si hay <50x10 6 llenar con medio fresco + citoquinas. Si hay> 50x10 6 células retirar 10 ml de suspensión celular, la transferencia a un nuevo G-Rex, y luego alimentar el G-Rexs con los medios de comunicación fresca CTL + citoquinas.
- Cultura por un período adicional de 4-6 días. Una vez que suficientes células se han ampliado, lleve a cabo la caracterización fenotípica y funcional de la Franquicia del CTL y criopreservar para uso futuro.
4. Los resultados representativos:
Un esquema de nuestra aprobado por la FDA multivirus específico proceso de generación de CTL se muestra en la Figura 1. A diferencia de la convención multivirus CTL protocolos que utilizan los adenovectores y LCL EBV-para estimular la reacción virus de las células T 2 se han sustituido materiales virus infeccioso con plásmidos de ADN que codifican antígenos múltiples derivados de cada uno de los tres virus. Para estimular CTL trivirus hemos diseñado tres multicistronic plásmidos que codifican Hexon y Penton de adenovirus, IE1 y pp65 de CMV, y EBNA1, LMP2, y BZLF1 de EBV. Estos antígenos fueron seleccionados con base en el fomento de los resultados clínicos de los nuestros y de otros grupos que muestran que las células T dirigidas contra las proteínas ADV-hexón y pentón 2,4-6, y CMV-1E1 y CMV-pp65 tienen un efecto protector en vivo 7. Para el VEB, EBNA1 es un inmuno-CD4 + de células T antígeno diana se expresa en todas las neoplasias asociadas al VEB en las células normales y B infectados por EBV 8,9, es inmunogénica LMP2 entre los tipos de HLA múltiples y se expresa en la mayoría de los tumores EBV, 10,11, mientras que BZLF1 codifica una inmunodominantes, inmediata antígeno temprano del ciclo lítico que estimula tanto CD4 + y CD8 + T en la mayoría de las personas y es probable importante para la cooperaciónntrol de reproducción de las células del virus 12. Para optimizar aún más nuestros métodos de fabricación que colaboró con la tecnología de la naturaleza que genera minimizada, sin antibióticos (compatible con la FDA) plásmidos para la estimulación CTL 13,14. Utilizando esta estrategia de forma consistente lograr eficiencias nucleofection de> 35%, mientras que el mantenimiento de la viabilidad celular alta (datos no mostrados) 3. La figura 2 muestra que la frecuencia de células T específicas del virus en respuesta a plásmidos de ADN optimizados medida por IFN ELISPOT, fue mayor que en respuesta a las convencionales plásmidos de expresión pShuttle basado en expresar los mismos antígenos (n = 8 Adenovirus, CMV n = 4 y n = 2 EBV). La relación óptima de DC: PBMC fue importante para el estímulo potente de las células T, como se muestra en la figura 3, donde una proporción de 1:50 produjo debajo del nivel óptimo de activación en comparación con S 01:20: cociente R (n = 2 donantes). La producción de suficientes números de CTL con especificidad de antígeno amplia es un requisito previo para la eficacia clínica contra los tres virus. Esto se logra mediante el cultivo CTL en el G-Rex, que apoya la expansión de células T superiores en comparación con los convencionales de 24 y placas (Figura 4) 15, mientras que la adición de IL-4 y IL7 a los aumentos de las culturas del repertorio y la especificidad, como se muestra en la Figura 4B donde la frecuencia de las células T reactivas contra el CMV-pp65 derivados de HLA-A2 resticted NLV péptido se evaluó en cultivos generados en la presencia o ausencia de IL-4 y / o 16,17 IL7. Para evaluar la capacidad y el fenotipo funcional de las células que amplió el análisis de citometría de flujo, intracelular de citoquinas ELISPOT tinción / IFN, y Cr 51 ensayos de liberación en el producto final para la criopreservación / infusión. Normalmente las células se generan policlonales con una población mixta de células CD4 + y CD8 + T con el antígeno-específico detectable en los dos compartimentos de las células T. Los CTL son capaces de matar a antígenos virales que expresan las células diana, pero no virus parcialmente negativa-HLA objetivos encontrados, lo que indica que no debe inducir de injerto contra huésped (EICH) in vivo (Figura 5).
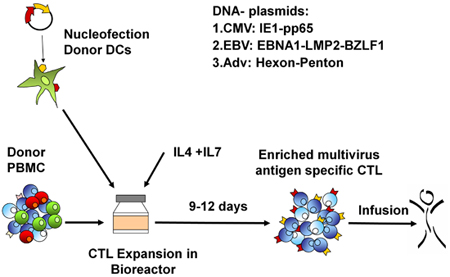
Figura 1. Protocolo RCTL generación. En primer lugar, los países en desarrollo son nucleofected con la codificación de antígeno viral plásmidos y luego se mezcla con PBMC autólogo en un R: S de 10 o 20:01. Las células se expanden en el G-Rex durante 10-14 días en presencia de IL-4 y IL7, luego cosechadas, contados, la prueba de la función, la identidad y la esterilidad, y luego criopreservados para su uso clínico.

Figura 2. Plásmidos de ADN optimizados inducir la activación de células T superiores in vitro. Países en desarrollo se nucleofected con optimizado, compatible con la FDA Hexon plásmidos que codifican y Penton (Avanzado), IE1 y pp65 (CMV), y EBNA1, LMP2, y BZLF1 (EBV) o plásmidos convencionales pShuttle codificación de los mismos antígenos. Estos fueron utilizados para estimular las células T y la especificidad fue analizada por ELISPOT IFN 10 días después de la estimulación.
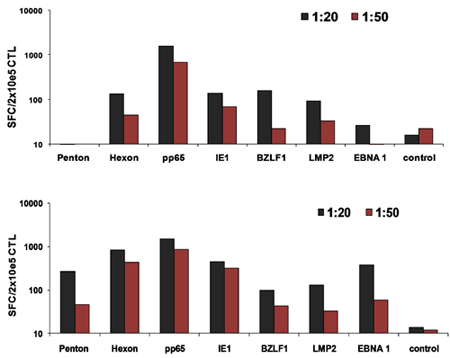
Figura 3 DC óptimo:. Ratios de células T para la activación de CTL. Los países en desarrollo a partir de 2 donantes nucleofected con los tres plásmidos optimizados y luego se utiliza para estimular la PBMCs autólogas a las 1:20 o 1:50 DC: relación de PBMC. La frecuencia de las células T reactiva se evaluó en el día 10 de IFN ELISPOT.
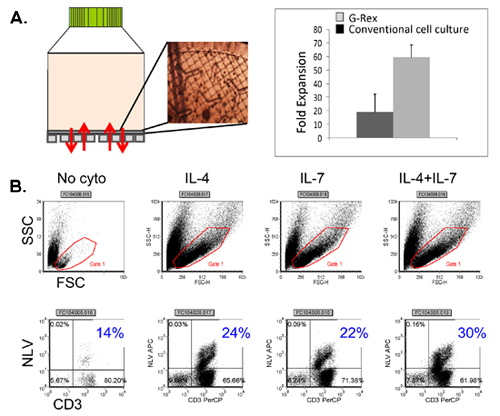
Figura 4. Expansión de células T en el G-Rex con la mejora de las citoquinas. El panel A muestra el dispositivo G-Rex, así como la apariencia CTL en la membrana de gas permeable, evaluadas por microscopía. Una comparación entre la producción de células en cultivo de tejidos logrado convención tratados placas vs G-Rex también se indica. El panel B muestra la frecuencia de CMV CTL pentámero positivos logrados en las culturas se expandió en la presencia de ninguna de citocinas, IL-4 solo, solo y IL7 IL4 IL7 +.
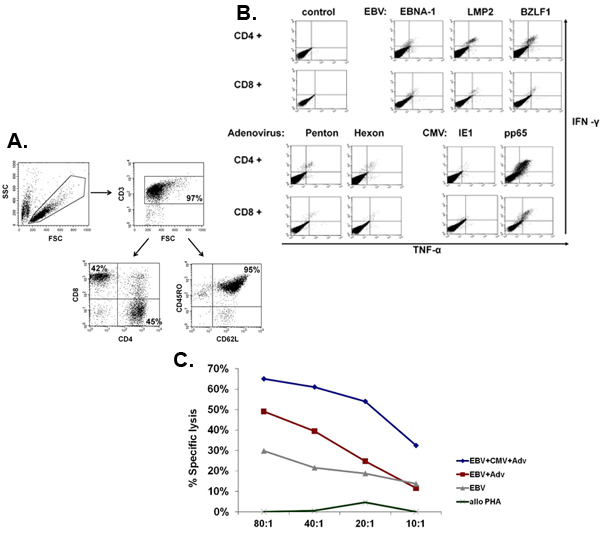
Figura 5. Fenotipo y la función de CTL ampliado. El panel A muestra un ejemplo representativo del fenotipo de la ampliación del CTL multivirus, que son policlonales con una mezcla de células CD4 + (45% - helper) y CD8 + (42% - citotóxicos), las células T, de los cuales la mayoría (95%) expresó la memoria marcador CD45RO + / CD62L +. El panel B muestra que estas células son específicas para todos los antígenos estimulantes y son polifuncionales, como evaluación de la tinción intracelular de citoquinas para detectar la producción de IFN y TNF después de la estimulación antigénica. Panel C muestra que el CTL ampliado son funcionales medida Cr 51 por ensayo. Autólogo LCL, ya sea solo o transducidas con un vector nulo o un vector adenoviral que expresa CMV-pp65 fueron utilizados como el alquitránse. Alorreactividad se evaluó mediante trasplante alogénico explosiones PHA como un objetivo.
Discusión
Las infecciones virales representan una importante morbilidad y mortalidad en pacientes inmunodeprimidos por su enfermedad o su tratamiento. Después de TPH, por ejemplo, infecciones causadas por herpesvirus persistentes, tales como EBV y CMV, así como por virus respiratorios como el virus sincitial respiratorio (VSR), son bien conocidos, mientras que la importancia de las infecciones causadas por ADV, virus BK, y los derechos humanos virus del herpes (HHV) -6 más recientemente, han sido apreciados. Mientras que los agentes farmacológicos son la terapia estándar para algunas infecciones, tienen efectos tóxicos importantes, generar variedades resistentes, y con frecuencia ineficaz. En contraste, el virus de las células T específicas derivadas de donantes de células madre han demostrado ser seguros y eficaces para la prevención y el tratamiento de la infección viral o enfermedad en el trasplante de células madre hematopoyéticas (TCPH) configuración 2,5,6,18-21. Sin embargo, la aplicación más amplia de la inmunoterapia de células T es en última instancia, limitada por el costo, la complejidad y el tiempo requerido para la producción de CTL.
Nuestro enfoque novedoso y rápido para generar multivirus CTL, descrito en el manuscrito actual, deberían aumentar considerablemente la viabilidad de la terapia de células T citotóxicas para las enfermedades virales, permitiendo que la estrategia para convertirse en un estándar de atención para el huésped inmunocomprometido. El uso de un plásmido DC nucleofected como APC permite la presentación de antígenos en ambos MHC de clase I y II sin la competencia de los vectores virales o de hecho a partir de múltiples antígenos virales se expresan dentro de una célula ya que las diferentes poblaciones de DC se utilizan para cada plásmido 3. El uso de IL-4 / 7 aumenta la supervivencia de las células T y la proliferación, lo que en consecuencia ayuda a aumentar la frecuencia y el repertorio de la respuesta del antígeno específico de células T 16,17. Por último, la cultura en el G-Rex reduce la apoptosis de las células T durante el cultivo. El intercambio de gases (O2 y CO 2) se produce a través de una membrana de gas permeable de silicona en la base del frasco, la prevención de la hipoxia al tiempo que permite una mayor profundidad de medio por encima de las células, proporcionando mayor cantidad de nutrientes y la dilución de los productos de desecho. Esta plataforma también puede ser ampliado a los virus adicionales como antígenos protectores cuando se identifican.
Divulgaciones
Agradecimientos
Este trabajo es apoyado por una ayuda a la producción de terapias celulares (contrato de NIH-NHLBI (HB-10-03) HHSN26820100000C) (CMR), un Centro Especializado para terapia basada en células subvención del NIH-NHLBI 1 U54 HL081007 (CMR), un ASBMT Premio al Investigador Joven (UG y JV), Miembro Sociedad de Leucemia y Linfoma Especial en el Premio de Investigación Clínica (UG), y una Amy Strelzer Scholar Award Manasevit (AML).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
|---|---|---|---|
| CellGenix | CellGenix | 2005 | |
| IL4 | I + D de Sistemas | 204-IL/CF | |
| IL7 | Peprotech | 200-15 | |
| Hyclone RPMI 1640 | Thermo Scientific | SH30096.01 | |
| Suero humano AB | Valle Biomedical Inc. | HP1022 | |
| Nucleofector | Amaxa / Lonza | AAF-1001B y AAF-1001X | |
| Nucleofection Kit | Amaxa / Lonza | V4XP-3012 | |
| Plásmidos | NTC | n / a | |
| GM-CSF | I + D | 215-GM/CF | |
| IL1 | I + D | 201-LB-025 | |
| IL6 | I + D | 206-IL-CF | |
| TNF | I + D | 210-TA-010 | |
| PGE2 | Sigma | P6532-1mg | |
| G-Rex | Wilson Lobo de fabricación | AY11-00027 |
Referencias
- Kaka, A. S., Foster, A. E., Weiss, H. L., Rooney, C. M., Leen, A. M. Using dendritic cell maturation and IL-12 producing capacity as markers of function: a cautionary tale. J Immunother. 31, 359-369 (2008).
- Leen, A. M., Myers, G. D., Sili, U., Huls, M. H., Weiss, H., Leung, K. S., Carrum, G., Krance, R. A., Chang, C. C., Molldrem, J. J. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1166 (2006).
- Gerdemann, U., Christin, A. S., Vera, J. F., Ramos, C. A., Fujita, Y., Liu, H., Dilloo, D., Heslop, H. E., Brenner, M. K., Rooney, C. M., Leen, A. M. Nucleofection of DCs to generate Multivirus-specific T cells for prevention or treatment of viral infections in the immunocompromised host. Mol. Ther. 17, 1616-1625 (2009).
- Leen, A. M., Christin, A., Khalil, M., Weiss, H., Gee, A. P., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Identification of hexon-specific CD4 and CD8 T-cell epitopes for vaccine and immunotherapy. J Virol. 82, 546-554 (2008).
- Leen, A. M., Christin, A., Myers, G. D., Liu, H., Cruz, C. R., Hanley, P. J., Kennedy-Nasser, A. A., Leung, K. S., Gee, A. P., Krance, R. A., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Cytotoxic T lymphocyte therapy with donor T cells prevents and treats adenovirus and Epstein-Barr virus infections after haploidentical and matched unrelated stem cell transplantation. Blood. 114, 4283-4292 (2009).
- Feuchtinger, T., Matthes-Martin, S., Richard, C., Lion, T., Fuhrer, M., Hamprecht, K., Handgretinger, R., Peters, C., Schuster, F. R., Beck, R., Schumm, M., Lotfi, R., Jahn, G., Lang, P. Safe adoptive transfer of virus-specific T-cell immunity for the treatment of systemic adenovirus infection after allogeneic stem cell transplantation. Br J Haematol. 134, 64-76 (2006).
- Bunde, T., Kirchner, A., Hoffmeister, B., Habedank, D., Hetzer, R., Cherepnev, G., Proesch, S., Reinke, P., Volk, H. D., Lehmkuhl, H., Kern, F. Protection from cytomegalovirus after transplantation is correlated with immediate early 1-specific CD8 T cells. J. Exp. Med. 201, 1031-1036 (2005).
- Leen, A., Meij, P., Redchenko, I., Middeldorp, J., Bloemena, E., Rickinson, A., Blake, N. Differential immunogenicity of Epstein-Barr virus latent-cycle proteins for human CD4(+) T-helper 1 responses. J Virol. 75, 8649-8659 (2001).
- Bickham, K., Munz, C., Tsang, M. L., Larsson, M., Fonteneau, J. F., Bhardwaj, N., Steinman, R. EBNA1-specific CD4+ T cells in healthy carriers of Epstein-Barr virus are primarily Th1 in function. J. Clin. Invest. 107, 121-130 (2001).
- Straathof, K. C., Leen, A. M., Buza, E. L., Taylor, G., Huls, M. H., Heslop, H. E., Rooney, C. M., Bollard, C. M. Characterization of latent membrane protein 2 specificity in CTL lines from patients with EBV-positive nasopharyngeal carcinoma and lymphoma. J. Immunol. 175, 4137-4147 (2005).
- Hislop, A. D., Taylor, G. S., Sauce, D., Rickinson, A. B. Cellular responses to viral infection in humans: lessons from Epstein-Barr virus. Annu. Rev. Immunol. 25, 587-617 (2007).
- Steven, N. M., Annels, N. E., Kumar, A., Leese, A. M., Kurilla, M. G., Rickinson, A. B. Immediate early and early lytic cycle proteins are frequent targets of the Epstein-Barr virus-induced cytotoxic T cell response. J. Exp. Med. 185, 1605-1617 (1997).
- Luke, J., Carnes, A. E., Hodgson, C. P., Williams, J. A. Improved antibiotic-free DNA vaccine vectors utilizing a novel RNA based plasmid selection system. Vaccine. 27, 6454-6459 (2009).
- Williams, J. A., Luke, J., Johnson, L., Hodgson, C. pDNAVACCultra vector family: high throughput intracellular targeting DNA vaccine plasmids. Vaccine. 24, 4671-4676 (2006).
- Vera, J. F., Brenner, L. J., Gerdemann, U., Ngo, M. C., Sili, U., Liu, H., Wilson, J., Dotti, G., Heslop, H. E., Leen, A. M., Rooney, C. M. Accelerated production of antigen-specific T-cells for pre-clinical and clinical applications using Gas-permeable Rapid Expansion cultureware (G-Rex. Journal of Immunotherapy. , (2009).
- Vella, A. T., Dow, S., Potter, T. A., Kappler, J., Marrack, P. Cytokine-induced survival of activated T cells in vitro and in vivo. Proc. Natl. Acad. Sci. U. S. A. 95, 3810-3815 (1998).
- Vella, A., Teague, T. K., Ihle, J., Kappler, J., Marrack, P. Interleukin 4 (IL-4) or IL-7 prevents the death of resting T cells: stat6 is probably not required for the effect of IL-4. J. Exp. Med. 186, 325-330 (1997).
- Heslop, H. E., Ng, C., Li, Y. C., Smith, C., A, C., Loftin, S. K., Krance, R. A., Brenner, M. K., Rooney, C. M. Long-term restoration of immunity against Epstein-Barr virus infection by adoptive transfer of gene-modified virus-specific T lymphocytes. Nature Medicine. 2, 551-555 (1996).
- Rooney, C. M., Smith, C. A., Ng, C., Loftin, S. K., Li, C., Krance, R. A., Brenner, M. K., Heslop, H. E. Use of gene-modified virus-specific T lymphocytes to control Epstein-Barr virus-related lymphoproliferation. Lancet. 345, 9-13 (1995).
- Einsele, H., Roosnek, E., Rufer, N., Sinzger, C., Riegler, S., Loffler, J., Grigoleit, U., Moris, A., Rammensee, H. G., Kanz, L., Kleihauer, A., Frank, F., Jahn, G., Hebart, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916-3922 (2002).
- Walter, E. A., Greenberg, P. D., Gilbert, M. J., Finch, R. J., Watanabe, K. S., Thomas, E. D., Riddell, S. R. Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N. Engl. J. Med. 333, 1038-1044 (1995).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados