Method Article
Geração de células T específicas Multivirus para Prevenir / tratar infecções virais após transplante de células-tronco hematopoéticas alogênico
Neste Artigo
Resumo
Um protocolo rápido, simples e de baixo custo para a geração de doador-derivado multivirus específico CTLs (rctl) para infusão de células-tronco hematopoéticas alogênico transplante (TCTH) destinatários em risco de desenvolver infecções CMV, EBV ou Adv. Este processo de fabricação é compatível com GMP e deve garantir a mais ampla implementação de T-cell imunoterapia além de centros especializados.
Resumo
Infecções virais causar morbidade e mortalidade em transplante de células-tronco hematopoéticas alogênico (TCTH) destinatários. Nós e os outros têm gerado com sucesso e infundida células T específicas para Epstein Barr (EBV), citomegalovírus (CMV) e adenovírus (Adv), utilizando monócitos e células EBV-transformadas linfoblastóides (EBV-LCL) gene modificado com um vetor de adenovírus como células apresentadoras de antígenos (APCs). Sómente 2x10 5 / kg trivirus específicos linfócitos T citotóxicos (CTL) proliferaram por vários registros após a infusão e apareceu para prevenir e tratar a doença viral grave ainda resistentes a outras terapias disponíveis. Quanto mais ampla a implementação desta abordagem é limitada pela encorajando altos custos de produção, a complexidade de produção e tempo prolongado (4-6 semanas para EBV-LCL geração, e 4-8 semanas para a fabricação de CTL - total 10-14 semanas) para a preparação. Para superar essas limitações, temos desenvolvido um novo protocolo de GMP-compliant produção CTL. Em primeiro lugar, no lugar de adenovectors para estimular as células T que usamos células dendríticas (DCs) nucleofected com DNA de codificação de plasmídeos LMP2, EBNA1 e BZLF1 (EBV), hexon e Penton (Adv), e pp65 e IE1 (CMV), como apresentadoras de antígenos células. Estes APCs reativar células T específicas para todos os antígenos estimulante. Cultura, segundo células T ativadas na presença de IL-4 (1000 U / ml) e IL-7 (10ng/ml) aumenta e sustenta o repertório ea freqüência de células T específicas em nossas linhas. Terceiro, temos utilizado um novo dispositivo de cultura de gás permeável (G-Rex), que promove a expansão ea sobrevivência de números de grandes células, após um estímulo único, eliminando assim a necessidade de EBV-LCLS e reduzindo a intervenção do técnico. Ao implementar essas mudanças nós podemos agora produzir CTL multiespecífico segmentação EBV, CMV, e Adv, a um custo por 10 6 células que é reduzida em> 90%, e em apenas 10 dias em vez de 10 semanas, utilizando uma abordagem que pode ser alargado a mais proteção antígenos virais. Nossa abordagem FDA-approved deve ser de valor para aplicações profiláticas e de tratamento para os destinatários de alto risco HSCT alogênico.
Protocolo
1. Nucleofection DC
- Colheita derivados de monócitos DCs, que foram enriquecidas com a adesão de plástico, cultivadas por cinco dias usando celular Genix Mídia suplementado com IL4 (1000U/ml), GMCSF (800IU/ml) e ainda venceu por 24 horas usando a maturação citocinas IL4 DC (1000U / ml), GMCSF (800IU/ml), IL6100ng/ml, TNF-α 10ng/ml, IL1-β 10ng/ml e PGE2 (1μg/ml) 1, pela ressuspensão gentil com uma pipeta de 3 ml.
- Contar DCs viável usando azul de tripano, transferência para tubos 15ml 3x com nada menos que 0.5x10 6 e não mais do que 2x10 6 células / tubo.
- Centrífuga DCs para 10mins @ 200g. Durante este período pré-aquecer celular Genix meio suplementado com as citocinas maturação DC (DC meios de maturação) - 2ml/well em três poços de uma cultura de tecidos de 12 bem tratado em uma placa de 37 ° C / 5% CO 2 incubadora.
- Uma vez que células terminar spinning, aspirar o sobrenadante e adicionar os plasmídeos DNA relevantes para cada um dos tubos em uma concentração final de DNA 5μg / tubo. Neste caso, adicione o plasmídeo IE1-pp65 ao tubo n º 1, hexon-Penton ao tubo # 2, e EBNA1-LMP2-BZLF1 ao tubo n º 3.
- Ressuspender DCs e DNA com 100μl de solução Amaxa nucloefection, misture bem e transferir para o cubetas nucleofection.
- Cubetas lugar no nucleofector 4D, escolher programa CB150 (Amaxa / Lonza), e pressione o começo.
- Imediatamente após nucleofection adicionar 500μl do 2ml pré-aquecido celular Genix meio de maturação DC para a cubeta, misturar suavemente por pipetagem cima e para baixo 2-3 vezes, e DCs nucleofected transferência para a chapa 12 bem preparados contendo os 1,5 ml restantes de pré-aquecida maturação media DC. Transferência para a 37 ° C / 5% CO 2 incubadora por mais 12-18hrs.
2. Estimulação das células T
- Colheita e contagem de DCs nucleofected, e irradiar a 30Gy. Lavar uma vez com 10ml de meio de CTL (45% RPMI, Cliques 45% EHAA, 10% FBS, 2mM Glutamax) e @ 3 ressuspender x 10 5 DCs por ml de mídia CTL.
- Piscina um mínimo de 7.5x10 5 (2,5 ml) e um máximo de 15x10 5 (5ml) de DCs contendo cada um dos plasmídeos e transferir os DCs agrupados ao dispositivo G-Rex, que será então colocado na incubadora.
- Para a preparação de células de resposta usar PBMCs anteriormente congelados ou não aderente células mononucleares que permanecem após a seleção DC (adesão ou CD14 seleção). Descongelar as células, a transferência para meio de cultura pré-aquecida, lave uma vez com a mídia CTL. Ressuspender as células em Media CTL, a contagem das células e levá-los a uma concentração de 2x10 6 células por ml. Leve 15x10 6 células ou 7.5ml e suplementar com 30000U IL4 (1000U/ml -. Conc final) e 300ng IL7 (10ng/ml - conc final.).
- Transferência 7.5ml de PBMC (15x10 6 células) para o G-Rex e superior até o biorreator com a mídia CTL para um volume total de 30ml.
- Cultura do G-Rex por 6-7 dias a 37 ° C / 5% CO 2 incubadora umidificada.
3. T expansão celular
- No dia 07/06, aspirar 10ml de mídia, então misturar as células do 20ml restantes de mídia com uma pipeta de 10 ml e contagem de células viáveis com azul de tripano. Se houver <50x10 6 repor com novas mídias + citocinas. Se houver> 50x10 6 células remover 10ml de suspensão celular, a transferência para um novo G-Rex, e depois alimentar tanto G-Rexs com novas mídias CTL + citocinas.
- Cultura para um adicional de 4-6 dias. Uma vez que células suficientes foram ampliados, realizar uma caracterização fenotípica e funcional do excesso de CTL e criopreservar para uso futuro.
4. Resultados representativos:
Um esquema de nosso FDA-approved processo de geração de multivirus específicas CTL é mostrado na Figura 1. Em contraste com protocolos convenção multivirus CTL que usam adenovectors e EBV-LCL para estimular as células-vírus reativa T 2 temos substituído material de vírus infeccioso com plasmídeos DNA que codificam antígenos derivados de cada um dos três vírus. Para estimular a CTL trivirus nós projetamos três multicistronic plasmídeos codificando hexon e Penton de adenovírus, IE1 e pp65 do CMV, e EBNA1, LMP2, e BZLF1 de EBV. Estes antígenos foram escolhidos com base em resultados encorajadores clínica de nossas próprias e de outros grupos mostrando que as células T dirigidos contra Adv-hexon e Penton 2,4-6, e CMV-1E1 e CMV pp65-são protetores in vivo 7. Para EBV, EBNA1 é um CD4 + T imunodominantes antígeno alvo celular expressa em todas as neoplasias malignas associadas ao EBV e em células normais infectadas pelo EBV B 8,9, LMP2 é imunogênica em vários tipos de HLA múltiplas e expressa na maioria dos tumores malignos EBV, 10,11 enquanto BZLF1 codifica uma imunodominantes, antígeno precoce imediato ciclo lítico que estimula tanto CD4 + e CD8 + T da maioria dos indivíduos e é provável que importantes para o control de células replicação do vírus 12. Para otimizar ainda mais os nossos métodos de fabricação que colaborou com Tecnologia Nature que gerou minimizado, sem antibiótico (FDA-compliant) plasmídeos para a estimulação CTL 13,14. Usando esta estratégia que consistentemente alcançar eficiências nucleofection de> 35%, mantendo a viabilidade das células de alta (dados não mostrados) 3. A Figura 2 mostra que a freqüência de células T-vírus específico em resposta a cosmídeos otimizado medida pelo IFNγ ELISPOT, foi maior que em resposta a convencional plasmídeos pShuttle baseado expressão expressando os mesmos antígenos (n = 8 Adenovirus, n = 4 CMV e EBV n = 2). O melhor rácio de DC: PBMC foi importante para a estimulação das células T potente como mostrado na Figura 3, onde uma proporção de 1:50 produzidos sub-ótimo de ativação em comparação com um S 1:20: R ratio (n = 2 doadores). Produção de suficientes números CTL com a especificidade do antígeno larga é um pré-requisito para a eficácia clínica contra os três vírus. Isto é conseguido pela cultura CTL no G-Rex, que apóia a expansão de células T superiores quando comparados com os placas de 24 poços (Figura 4A) 15, enquanto a adição de IL4 e IL7 a aumentos culturas do repertório e especificidade, como mostrado na Figura 4B onde a freqüência de células T reativas contra o CMV-pp65 derivados HLA-A2 RESTRIÇÕES NLV peptídeo foi avaliada em culturas gerado na presença ou ausência de IL4 e / ou IL7 16,17. Para avaliar a capacidade fenótipo e funcional das células expandidas realizamos análise de citometria de fluxo, intracelular de citocinas coloração / IFNγ ELISPOT, e 51 testes de liberação de Cr sobre o produto final para a criopreservação / perfusão. Normalmente as células geradas são policlonais com uma população mista de células CD4 + e CD8 + T com antígeno especificidade detectáveis nos dois compartimentos da célula T. O CTL são capazes de matar antígeno viral expressando as células-alvo, mas não do vírus negativos parcialmente HLA alvos combinados, indicando que eles não devem induzir enxerto-versus-hospedeiro (GVHD) in vivo (Figura 5).
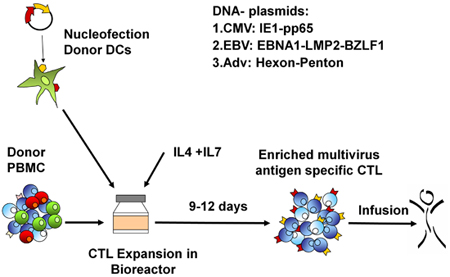
Figura 1. Rctl protocolo geração. Primeiro, DCs são nucleofected com o antígeno viral codificação de plasmídeos e então misturado com PBMCs autólogo em um R: S de 10 ou 20:1. Células são expandidas no G-Rex por 10-14 dias, na presença de IL4 e IL7, então colhidos, contados, testado para a identidade de função, e esterilidade, e depois criopreservados para uso clínico.

Figura 2. Cosmídeos Optimized induzem ativação de células T in vitro superiores. DCs foram nucleofected com otimizado, FDA-compliant plasmídeos codificando hexon e Penton (Adv), IE1 e pp65 (CMV), e EBNA1, LMP2, e BZLF1 (EBV) ou plasmídeos pShuttle convencionais de codificação os mesmos antígenos. Estes foram usados para estimular as células T e especificidade foi analisada pelo IFNγ ELISPOT 10 dias pós-estimulação.
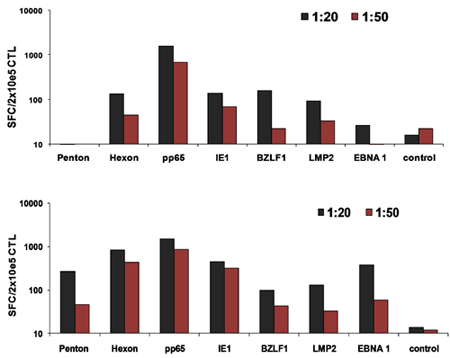
Figura 3 DC ideal:. Proporções de células T para a ativação do CTL. DCs de 2 doadores foram nucleofected com todos os três plasmídeos otimizado e, em seguida, utilizado para estimular PBMCs autólogo em 1:20 ou 1:50 DC: relação de PBMC. A freqüência de células T reativada foi avaliada no dia 10 de IFNγ ELISPOT.
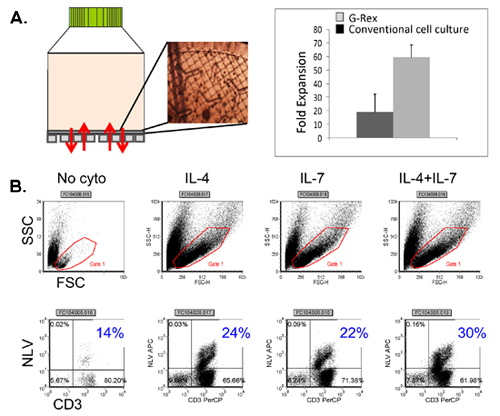
Figura 4. Expansão de células T no G-Rex usando citocinas melhorando. Um painel mostra o dispositivo G-Rex, bem como aparência CTL na membrana gás permeável, avaliados por microscopia. Uma comparação entre a saída de células alcançado na convenção de cultura de tecidos tratados placas vs G-Rex também é mostrada. Painel B mostra a freqüência de CMV CTL pentâmero positivos alcançados nas culturas expandiu na presença de nenhum de citocinas, IL4 sozinho, IL7 sozinho e IL4 + IL7.
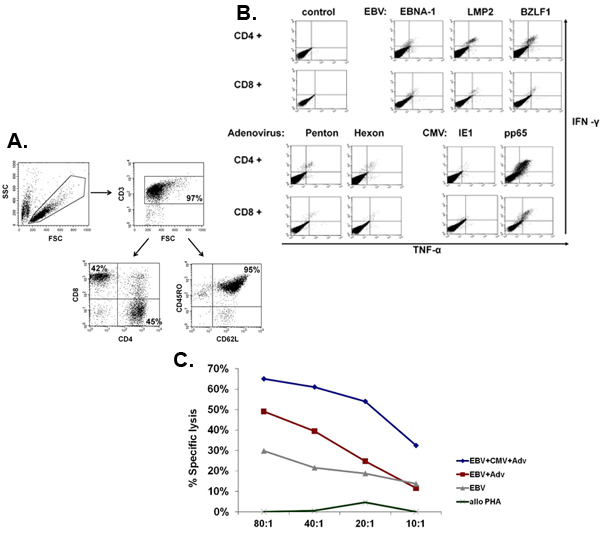
Figura 5. Fenótipo e função de CTL expandida. Um painel mostra um exemplo representativo do fenótipo do CTL multivirus expandido, que são policlonais com uma mistura de CD4 + (45% - helper) e CD8 + (42% - citotóxicos), as células T, dos quais a maioria (95%) expressou o memória marcador CD45RO + / CD62L + Panel. B mostra que essas células são específicos para todos os antígenos estimulante e são polifuncionais, avaliada pela coloração de citocinas intracelulares para detectar a produção de IFNΓ e TNFa após a estimulação antigênica. Painel C mostra que a CTL expandida são funcionais medida por Cr ensaio 51. Autólogo LCL, sozinho ou transduzidas com um vetor nulo ou um vetor adenoviral expressando-CMV pp65 foram usados como alcatrãofica. Alloreactivity foi avaliada através explosões alogênico PHA como um alvo.
Discussão
Infecções virais são responsáveis por significativa morbidade e mortalidade em pacientes que são imunocomprometidos por sua doença ou seu tratamento. Após o transplante, por exemplo, infecções causadas por herpesvírus persistentes, como EBV e CMV, bem como por vírus respiratórios, tais como Vírus Sincicial Respiratório (VSR), são bem conhecidos, enquanto a importância de infecções causadas por Adv, vírus BK, e humanos herpesvirus (HHV) -6 tem mais recentemente sido apreciado. Enquanto agentes farmacológicos são a terapia padrão para algumas infecções, eles têm toxicidade substancial, gerar variantes resistentes, e são frequentemente ineficazes. Em contraste, as células T-vírus específicos derivados de doadores de células-tronco se mostraram seguros e eficazes para a prevenção e tratamento da infecção viral ou doença no transplante de células-tronco hematopoiéticas (TCTH) definição 2,5,6,18-21. No entanto, a mais ampla implementação de T imunoterapia celular é finalmente limitado pelo custo, complexidade e tempo necessário para a produção de CTL.
Nosso romance e uma abordagem rápida para gerar multivirus CTL, descrito no manuscrito atual, deve aumentar substancialmente a possibilidade de terapia com células T citotóxicas para doenças virais, permitindo que a estratégia para se tornar um padrão de atendimento para o hospedeiro imunocomprometido. O uso de plasmídeos DCs nucleofected como APCs permite apresentação de antígenos em ambos MHC classe I e II sem a concorrência de vetores virais ou mesmo de vários antígenos virais sendo expresso em uma única célula desde diferentes populações DC são utilizados para cada três plasmídeo. O uso de IL-4 / 7 aumenta a sobrevida das células T e proliferação, o que ajuda a aumentar correspondentemente a freqüência eo repertório de responder células T antígeno-específicos 16,17. Finalmente, a cultura no G-Rex reduz drasticamente a apoptose de células T durante a cultura. Troca gasosa (O 2 e CO 2) ocorre através de uma membrana de silício de gás permeáveis na base do frasco, evitando a hipóxia, permitindo uma maior profundidade de médio acima das células, fornecendo mais nutrientes e diluição de resíduos. Esta plataforma também pode ser estendido aos vírus adicionais como quando antígenos protetores são identificados.
Divulgações
Agradecimentos
Este trabalho é apoiado por uma assistência de produção de terapias celulares (contrato NIH-NHLBI (HB-10-03) HHSN26820100000C) (CMR), uma Centros Especializados de Terapia Celular Grant NIH-NHLBI uma U54 HL081007 (CMR), uma ASBMT Young Investigator Award (UG e JV), um Fellow da Sociedade Leucemia e Linfoma especial em Prêmio Pesquisa Clínica (UG), e uma Amy Strelzer Scholar Award Manasevit (AML).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
|---|---|---|---|
| CellGenix | CellGenix | 2005 | |
| IL4 | R + D Systems | 204-IL/CF | |
| IL7 | Peprotech | 200-15 | |
| Hyclone RPMI 1640 | Thermo Scientific | SH30096.01 | |
| AB soro humano | Vale Biomedical Inc. | HP1022 | |
| Nucleofector | Amaxa / Lonza | AAF-1001B & AAF-1001X | |
| Kit Nucleofection | Amaxa / Lonza | V4XP-3012 | |
| Plasmídeos | NTC | n / a | |
| GM-CSF | R & D | 215-GM/CF | |
| IL1 | R & D | LB-201-025 | |
| IL6 | R & D | 206-IL-CF | |
| TNFa | R & D | 210-TA-010 | |
| PGE2 | Sigma | P6532-1MG | |
| G-Rex | Wilson Lobo Manufacturing | AY11-00027 |
Referências
- Kaka, A. S., Foster, A. E., Weiss, H. L., Rooney, C. M., Leen, A. M. Using dendritic cell maturation and IL-12 producing capacity as markers of function: a cautionary tale. J Immunother. 31, 359-369 (2008).
- Leen, A. M., Myers, G. D., Sili, U., Huls, M. H., Weiss, H., Leung, K. S., Carrum, G., Krance, R. A., Chang, C. C., Molldrem, J. J. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1166 (2006).
- Gerdemann, U., Christin, A. S., Vera, J. F., Ramos, C. A., Fujita, Y., Liu, H., Dilloo, D., Heslop, H. E., Brenner, M. K., Rooney, C. M., Leen, A. M. Nucleofection of DCs to generate Multivirus-specific T cells for prevention or treatment of viral infections in the immunocompromised host. Mol. Ther. 17, 1616-1625 (2009).
- Leen, A. M., Christin, A., Khalil, M., Weiss, H., Gee, A. P., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Identification of hexon-specific CD4 and CD8 T-cell epitopes for vaccine and immunotherapy. J Virol. 82, 546-554 (2008).
- Leen, A. M., Christin, A., Myers, G. D., Liu, H., Cruz, C. R., Hanley, P. J., Kennedy-Nasser, A. A., Leung, K. S., Gee, A. P., Krance, R. A., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Cytotoxic T lymphocyte therapy with donor T cells prevents and treats adenovirus and Epstein-Barr virus infections after haploidentical and matched unrelated stem cell transplantation. Blood. 114, 4283-4292 (2009).
- Feuchtinger, T., Matthes-Martin, S., Richard, C., Lion, T., Fuhrer, M., Hamprecht, K., Handgretinger, R., Peters, C., Schuster, F. R., Beck, R., Schumm, M., Lotfi, R., Jahn, G., Lang, P. Safe adoptive transfer of virus-specific T-cell immunity for the treatment of systemic adenovirus infection after allogeneic stem cell transplantation. Br J Haematol. 134, 64-76 (2006).
- Bunde, T., Kirchner, A., Hoffmeister, B., Habedank, D., Hetzer, R., Cherepnev, G., Proesch, S., Reinke, P., Volk, H. D., Lehmkuhl, H., Kern, F. Protection from cytomegalovirus after transplantation is correlated with immediate early 1-specific CD8 T cells. J. Exp. Med. 201, 1031-1036 (2005).
- Leen, A., Meij, P., Redchenko, I., Middeldorp, J., Bloemena, E., Rickinson, A., Blake, N. Differential immunogenicity of Epstein-Barr virus latent-cycle proteins for human CD4(+) T-helper 1 responses. J Virol. 75, 8649-8659 (2001).
- Bickham, K., Munz, C., Tsang, M. L., Larsson, M., Fonteneau, J. F., Bhardwaj, N., Steinman, R. EBNA1-specific CD4+ T cells in healthy carriers of Epstein-Barr virus are primarily Th1 in function. J. Clin. Invest. 107, 121-130 (2001).
- Straathof, K. C., Leen, A. M., Buza, E. L., Taylor, G., Huls, M. H., Heslop, H. E., Rooney, C. M., Bollard, C. M. Characterization of latent membrane protein 2 specificity in CTL lines from patients with EBV-positive nasopharyngeal carcinoma and lymphoma. J. Immunol. 175, 4137-4147 (2005).
- Hislop, A. D., Taylor, G. S., Sauce, D., Rickinson, A. B. Cellular responses to viral infection in humans: lessons from Epstein-Barr virus. Annu. Rev. Immunol. 25, 587-617 (2007).
- Steven, N. M., Annels, N. E., Kumar, A., Leese, A. M., Kurilla, M. G., Rickinson, A. B. Immediate early and early lytic cycle proteins are frequent targets of the Epstein-Barr virus-induced cytotoxic T cell response. J. Exp. Med. 185, 1605-1617 (1997).
- Luke, J., Carnes, A. E., Hodgson, C. P., Williams, J. A. Improved antibiotic-free DNA vaccine vectors utilizing a novel RNA based plasmid selection system. Vaccine. 27, 6454-6459 (2009).
- Williams, J. A., Luke, J., Johnson, L., Hodgson, C. pDNAVACCultra vector family: high throughput intracellular targeting DNA vaccine plasmids. Vaccine. 24, 4671-4676 (2006).
- Vera, J. F., Brenner, L. J., Gerdemann, U., Ngo, M. C., Sili, U., Liu, H., Wilson, J., Dotti, G., Heslop, H. E., Leen, A. M., Rooney, C. M. Accelerated production of antigen-specific T-cells for pre-clinical and clinical applications using Gas-permeable Rapid Expansion cultureware (G-Rex. Journal of Immunotherapy. , (2009).
- Vella, A. T., Dow, S., Potter, T. A., Kappler, J., Marrack, P. Cytokine-induced survival of activated T cells in vitro and in vivo. Proc. Natl. Acad. Sci. U. S. A. 95, 3810-3815 (1998).
- Vella, A., Teague, T. K., Ihle, J., Kappler, J., Marrack, P. Interleukin 4 (IL-4) or IL-7 prevents the death of resting T cells: stat6 is probably not required for the effect of IL-4. J. Exp. Med. 186, 325-330 (1997).
- Heslop, H. E., Ng, C., Li, Y. C., Smith, C., A, C., Loftin, S. K., Krance, R. A., Brenner, M. K., Rooney, C. M. Long-term restoration of immunity against Epstein-Barr virus infection by adoptive transfer of gene-modified virus-specific T lymphocytes. Nature Medicine. 2, 551-555 (1996).
- Rooney, C. M., Smith, C. A., Ng, C., Loftin, S. K., Li, C., Krance, R. A., Brenner, M. K., Heslop, H. E. Use of gene-modified virus-specific T lymphocytes to control Epstein-Barr virus-related lymphoproliferation. Lancet. 345, 9-13 (1995).
- Einsele, H., Roosnek, E., Rufer, N., Sinzger, C., Riegler, S., Loffler, J., Grigoleit, U., Moris, A., Rammensee, H. G., Kanz, L., Kleihauer, A., Frank, F., Jahn, G., Hebart, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916-3922 (2002).
- Walter, E. A., Greenberg, P. D., Gilbert, M. J., Finch, R. J., Watanabe, K. S., Thomas, E. D., Riddell, S. R. Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N. Engl. J. Med. 333, 1038-1044 (1995).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados