Method Article
Multivirus 특정 T 세포 생성 Allogeneic 조혈 줄기 세포 이식 후 바이러스 감염을 예방 / 치료
요약
의 생성에 대한 신속, 간단하고 비용 효율적인 프로토콜 기증자 파생 CMV, EBV 감염 또는 교수실을 개발하는 위험 allogeneic 조혈 줄기 세포 이식 (HSCT) 수신자에게 주입을위한 multivirus 특정 CTLs (rCTL을). 이 제조 과정은 GMP 준수하고 전문 센터 이외 T - 세포 immunotherapy의 광범위한 구현을 보장한다.
초록
바이러스성 감염은 allogeneic 조혈 줄기 세포 이식 (HSCT) 수신자의 병적 상태와 사망률의 원인이됩니다. 우리와 다른 사람이 성공적으로 생성되고 엡스타인 바 바이러스 (EBV), 사이토 메갈로 바이러스 (CMV)와 monocytes와를 사용하여 아데노 바이러스 (교수실)에 대한 T - 세포를 특정 주입이 EBV - 변환 lymphoblastoid 셀 (EBV - LCL) 아데노 바이러스 벡터와 마찬가지로 유전자 - 수정 항원 제시 세포 (APCs). 마찬가지로 몇 가지 2x10으로 5 / kg trivirus 특정 세포 독성 T의 lymphocytes (CTL)은 주입 후 몇 가지 로그의 확산 및 다른 가능한 치료에 내성도 심각한 바이러스성 질병을 예방하고 치료 나타났다. 준비 -이 장려 접근법의 광범위한 구현은 높은 생산 비용, 제조의 복잡 성과 연장 시간 (총 10-14주 CTL 제조 EBV - LCL의 생성 및 4~8주에 대한 4~6주)에 의해 제한됩니다. 이러한 한계를 극복하기 위해 우리는 새로운 GMP 준수 CTL 생산 프로토콜을 개발했습니다. 첫째, 우리는 항원 제시와 같은 DNA plasmids 인코딩 LMP2, EBNA1 및 BZLF1 (EBV), Hexon 및 펜톤 (교수실), 그리고 pp65 및 IE1 (CMV)와 nucleofected 돌기 세포 (DCS)를 사용하여 T - 세포를 자극하는 adenovectors 대신에 세포. 이러한 APCs는 모든 자극 항원에 대한 T 세포가 특정 재활 성화. 둘째, 문화는 IL - 4의 존재에 T - 세포를 활성화 (1,000 U / ML)와 IL - 7 (10ng/ml)은 증가 및 라인에서 특정 T 세포의 레퍼토리와 주파수를 부양하고 있습니다. 셋째, 우리는 따라서 EBV - LCLs에 대한 요구 사항을 제거하고 기술자의 개입을 줄이고, 하나의 자극 후 대형 세포 숫자의 확장과 생존을 촉진 새로운 가스 투과 문화 장치를 (G - 렉스) 사용하고 있습니다. 이러한 변경 사항을 구현함으로써 우리는 지금> 90%에 의해 줄어 듭니다 10 6 세포 당 비용 EBV, CMV 및 교수실을 대상으로 multispecific CTL를 생산하고, 수있는 추가로 연장할 수 있습니다 접근법을 사용 단 십일 오히려 10 주 보호 바이러스 항원. 우리의 FDA 승인 접근 방식은 높은 위험 allogeneic HSCT받는 사람에 대한 예방 및 치료 응용 프로그램에 가치가 있어야합니다.
프로토콜
1. 직류 nucleofection
- 셀 Genix IL4 (1000U/ml)와 보충 미디어 GMCSF (800IU/ml)와 추가 DC의 성숙의 크린 시토킨 IL4을 (1000U 사용하여 24 시간을위한 성숙을 사용하여 오일에 대한 교양 플라스틱 준수를 사용하여 풍부한되었습니다 하베스트 단핵구 - 파생 DC가, 3ml 전송 피펫과 부드러운 resuspension로 / ML), GMCSF (800IU/ml), IL6100ng/ml, TNF - α 10ng/ml, IL1 - β 10ng/ml 및 PGE2 (1μg/ml) 1.
- trypan 파랑, 노 적은 6 0.5x10 이상과 배 15ml 튜브로 전송하고 더 이상 6 2x10 이상의 셀 / 튜브를 사용 가능한 DC가를 계산합니다.
- 상업 중심지 @ 200g에 대한 DC가를 원심 분리기. 37 ° C / 5% CO 2 배양기에서 번호판을 처리 12 잘 조직 문화의 세 우물에 2ml/well -이 기간 동안 사전에 따뜻한 셀 Genix 미디어는 DC의 성숙의 크린 시토킨 (DC의 성숙 미디어)과 보완.
- 일단 세포가 스피닝 완료, 뜨는을 기음과 DNA 5μg / 튜브의 최종 농도에 튜브의 각 관련 유전자 plasmids를 추가합니다. 이 경우에는 플라스미드 인코딩 튜브에 IE1 - pp65 # 1, 튜브에 Hexon - 펜톤 # 2, # 3 관 EBNA1 - LMP2 - BZLF1를 추가합니다.
- Amaxa의 nucloefection 솔루션의 100μl와 Resuspend DCS 및 DNA가 잘 혼합하고 nucleofection의 cuvettes로 전송할 수 있습니다.
- 4D nucleofector의 장소 cuvettes는, 프로그램 CB150 (Amaxa / Lonza)를 선택하고 시작을 누르십시오.
- nucleofection가 쿠베트에 2ml 미리 예열 셀 Genix DC의 성숙 미디어의 500μl 추가 직후, prewarmed의 나머지 1.5 ML를 포함하는 준비된 12 잘 판에 2-3 시간, 전송 nucleofected DC가 아래로 pipetting과로 부드럽게 혼합 DC의 성숙 미디어. 37에 전송 ° C / 5% CO 2 배양기를 추가로 12 18hrs하십시오.
2. T 세포 자극
- 수확 및 30Gy에서 nucleofected DC가를 계산하고, 비추다. CTL 매체 10ml (45 % RPMI, 45 % 클릭수 EHAA 10 % FBS, 2mM Glutamax)과 CTL 미디어 ML 당 resuspend @ 3 X 10 5 DC가 함께 한 번 씻으십시오.
- 풀 7.5x10 5 (2.5ml)와 plasmids 각을 포함하는 DC가의 15x10 5 (5ml)의 최대 최소 그리고 보육에 배치됩니다 G - 렉스 장치에 DC가 풀링을 전송.
- 응답 세포의 준비를 위해 이전에 냉동 PBMCs 또는 DC의 선택 (부착 또는 CD14 선택) 이후 유지 비 점착 성의 mononuclear 세포 중 하나를 사용합니다. 세포를 해동, prewarmed 문화 매체 전송, CTL 매체와 한 번 씻는다. CTL 미디어의 세포를 Resuspend, 세포를 포함하고 ML 당 2x10 6 세포의 농도로 끌고 오너라. 와 300ng IL7 (10ng/ml - 최종 CONC.) - 30000U IL4 (. 최종 CONC 1000U/ml)와 15x10 6 셀 또는 7.5ml 및 보충 가져가라.
- G - 렉스와 30ml의 총 볼륨 CTL 매체와 생물 반응기까지 가기 PBMC의 7.5ml을 (15x10 6 셀) 전송합니다.
- 문화 37 6~7일을위한 G - 렉스 ° C / 5% humidified CO 2 배양기.
3. T 세포 확장
- 일 6-7 일, 미디어의 대기음의 10ml, 그때 10ml 피펫과 함께 미디어의 남은 20ml에 세포를 혼합하고 trypan 파랑을 사용 가능한 세포를 계산합니다. 있다면 <50x10 6 새로운 미디어 + 크린 시토킨과 보충. > 50x10 6 세포가있다면 세포 현탁액의 10ml를 제거, 새로운 G - 렉스로 전송하고 신선한 CTL 미디어 + 크린 시토킨과 함께 모두 G - 렉스스 먹이.
- 추가 4-6일을위한 문화. 일단 충분한 세포는 나중에 사용하기 위해 CTL과 cryopreserve 초과 phenotypic과 기능 특성을 수행 확장되었습니다.
4. 대표 결과 :
우리의 FDA 승인 multivirus 특정 CTL 생성 과정의 개략도는 그림 1에 표시됩니다. 바이러스 반응 T 세포를 자극 adenovectors과 EBV - LCL를 사용하여 대회 multivirus CTL 프로토콜과는 달리 2 우리의 DNA plasmids과 전염성 바이러스 자료를 교체했습니다 그 바이러스 3 각에서 파생된 여러 항원을 인코딩. trivirus의 CTL을 자극하기 위해 우리는 EBV 세 multicistronic plasmids 인코딩 Hexon과 펜톤 아데노 바이러스의 IE1 및 pp65 CMV, 그리고 EBNA1, LMP2 및 BZLF1을 설계했습니다. 이러한 항원들은 우리 자신과 T 세포가 교수실 hexon과 펜톤 2,4-6에 대한 감독 및 CMV - 1E1과 CMV - pp65은 생체내 7 보호 아르에게 보여주는 다른 그룹의 임상 결과를 장려하고 기반으로 선정되었습니다. EBV 들어, EBNA1는 immunodominant CD4 + 모든 EBV - 관련 malignancies 및 일반 EBV에 감염된 B 세포 표현 T 세포의 대상 항원이다 8,9, LMP2 여러 HLA 유형에 걸쳐 immunogenic이며, 대부분의 EBV malignancies로 표현, 10,11 BZLF1 동안 대부분의 개인에서 모두 CD4 +와 CD8 + T 세포를 자극하고 공동에 대한 가능성이 중요합니다 immunodominant, 즉각적인 초기 lytic 순환 항원을 인코딩바이러스 12 복제 세포 ntrol. 추가로 우리의 제조 방법을 최적화하기 위해 우리는 CTL 자극 13,14에 대한 minimalized, 항생제없는 (FDA 호환) plasmids를 생성 자연 기술과 협력. 같은 IFNγ ELIspot에 의해 측정된 최적의 DNA plasmids에 대한 응답으로 바이러스 구체적인 T 세포의 빈도가 큰 것을 높은 세포 생존 (데이터가 표시되지 않음) 3. 그림 2 프로그램을 유지하면서이 전략을 사용하면 우리는 지속적으로> 35%의 nucleofection 효율성을 달성 동일한 항원 (N = 8 아데노 바이러스, N = 4 CMV하고, N = 2 EBV)를 표현하는 기존 pShuttle 기반 표현 plasmids에 대한 응답으로보다. DC의 최적 비율 : R 비율 (N = 2 기증자) : PBMC는 1시 50분의 비율이 1시 20분 S에 비해 하위 최적 활성화를 생산 그림 3과 같이 강력한 T 세포 자극에 중요했다. 광범위한 항원 특이성과 충분한 CTL 숫자의 생산 세 바이러스에 대한 임상 효능을위한 필수 조건입니다. 문화 증가 IL4과 IL7의 덧셈으로 레퍼토리와 특이성이 그림 4B에 표시하면서 이것은, 종래의 24 잘 접시 (그림 4A) 15와 비교하여 우수한 T 세포 확장을 지원하는 G - 렉스에 CTL 문화에 의해 이루어집니다 CMV - pp65 - 파생 HLA - A2에 대한 반응 T 세포의 빈도가 resticted 어디 NLV 펩타이드는 IL4 및 / 또는 IL7 16,17의 존재 또는 부재에서 생성된 문화에 평가되었다. cryopreservation / 주입을위한 최종 제품에 우리가 흐름 cytometric 분석을 수행 확장 세포, 세포 시토킨 얼룩 / IFNγ ELIspot 및 CR 51 릴리스 assays의 표현형 및 기능적 능력을 평가합니다. 일반적으로 생성된 세포가 CD4 + 두 T 세포 구획에 감지 항원 특이성과 CD8 + T 세포의 혼합 인구 polyclonal 있습니다. CTL들은 생체내 (그림 5)에 이식 - 대 - 호스트 질병 (GvHD)을 유발해서는 안 나타냅니다, 바이러스 부분 - HLA 일치 목표 부정하지 바이러스성 항원 표현 대상 세포를 죽일하지만 수 있습니다.
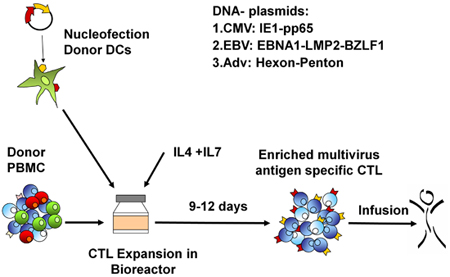
그림 1. rCTL 생성 프로토콜. 첫째, DC가이 바이러스 항원 - 인코딩 plasmids와 nucleofected 그리고 R에 autologous PBMCs와 혼합 : 10 20시 1분의 S. 전지는 다음 수확 집계, 기능, 정체성과 불임에 대한 검사, 그리고 임상 사용을위한 cryopreserved IL4과 IL7의 면전에서 10~14일에 대한 G - 렉스로 확장됩니다.

그림 2. 최적의 DNA plasmids은 체외에서 우수한 T 세포 활성화를 유도. DC가이 최적화, FDA 준수 plasmids 인코딩 Hexon와 펜톤 (교수실), IE1 및 pp65 (CMV) 및 EBNA1, LMP2 및 BZLF1 (EBV) 또는 동일한 항원을 인코딩 기존 pShuttle의 plasmids과 nucleofected되었습니다. 이들은 T 세포를 자극하는 데 사용되었습니다과 특이성은 IFNγ ELIspot 10 일 이후의 자극에 의해 분석되었다.
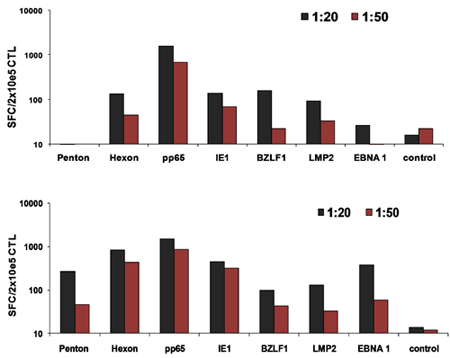
그림 3 최적의 DC :. CTL 활성화를위한 T 세포의 비율. 이 기증자의 DC가 세 개 모두 최적화 plasmids와 nucleofected 후 1시 20분 또는 1시 50분 DC에서 autologous PBMCs을 자극하는 데 사용되었습니다 PBMC 비율. 활성화 T 세포의 빈도가 IFNγ에 의해 ELIspot 일 10 일 평가했다.
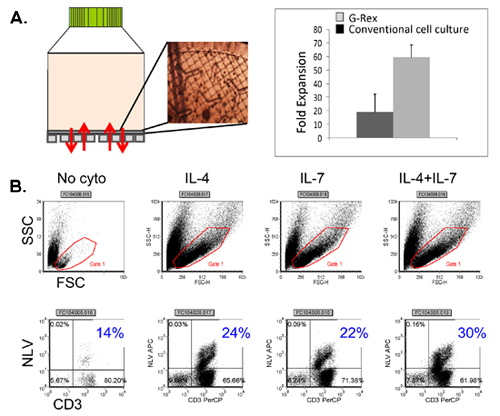
그림 4. 향상 크린 시토킨를 사용하여 G - 렉스의 T 세포 확장. 패널 A는 G - 렉스 장치뿐만 아니라 현미경으로 평가 가스 침투성 막에 CTL 외관을 보여줍니다. 접시 VS G - 렉스를 취급 대회 조직 문화 달성 셀 출력 비교도 표시됩니다. 패널 B는 아니 시토킨 혼자 IL4, IL7 혼자하고 IL4 + IL7의 존재의 확장 문화에 달성 CMV pentamer 긍정적인 CTL의 빈도를 보여줍니다.
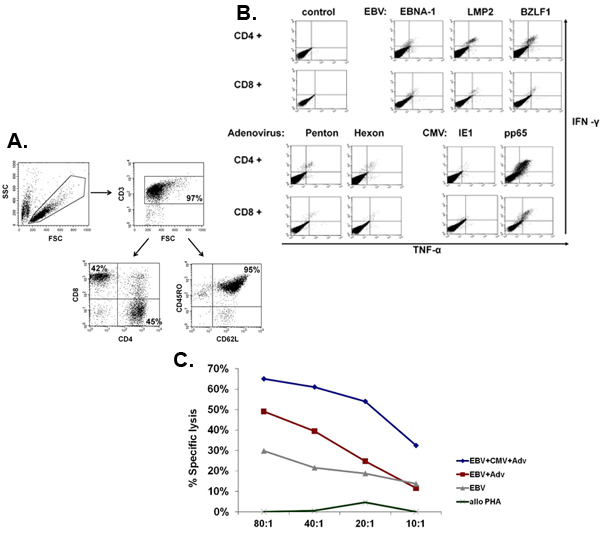
그림 5. 표현형 및 확장 CTL의 기능을 수행합니다. 와 CD8 + - 패널 A는 CD4 + (도우미 45 %)의 혼합물로 polyclonal있는 확장 multivirus의 CTL의 표현형의 대표 예를 나타냅니다 (42 % - 세포 독성) 대부분 (95 %)을 표현하는 T 세포, 메모리 마커 CD45RO + / CD62L +. 패널 B는 이러한 세포가 모든 자극 항원에 대한 특정하고 IFNΓ의 생산과 항원 자극 후 TNFα를 감지하는 세포 시토킨 얼룩에 의해 평가로 polyfunctional 것을 보여줍니다. 패널 C는 확장 CTL가 측정으로 작동되는 보여줍니다 CR 51 분석에 의해. Autologous LCL, 단독으로 또는 CMV - pp65을 표현 NULL 벡터 또는 adenoviral 벡터와 transduced는 타르로 사용되었습니다도착. Alloreactivity은 대상으로 allogeneic PHA의 폭발을 사용하여 평가되었다.
토론
바이러스성 감염은 자신의 질병 또는 치료에 의해 immunocompromised 아르 환자에서 상당한 병적 상태와 사망률을 차지합니다. HSCT 후, 예를 들어, EBV와 CMV뿐만 아니라 호흡 Syncytial 바이러스 (RSV)와 같은 호흡기 바이러스와 같은 영구 herpesviruses에 의한 감염은 잘 알려진 반면 교수실, BK 바이러스에 의한 감염의 중요성, 인간 herpesvirus는 (HHV) -6 더 최근에는 감사하고 있습니다. 약리 대리인 어떤 감염에 대한 표준 치료하는 동안, 그들은 실질적인 toxicities을 가지고, 강한 변종을 생성하고, 자주 비효 있습니다. 대조적으로, 줄기 세포 기증자에서 파생된 바이러스 구체적인 T 세포는 hemopoietic 줄기 세포 이식에 바이러스 감염 또는 질병 (HSCT) 설정 2,5,6,18-21의 예방 및 치료에 안전하고 효과적인 입증했습니다. 그러나 T 세포 immunotherapy의 광범위한 구현 궁극적으로 CTL 생산에 필요한 비용, 복잡하고 시간에 따라 제한됩니다.
현재 원고에 기술된 multivirus CTL을 생성하기 위해 우리의 소설과 빠른 접근 방식은 실질적으로 immunocompromised 호스트에 대한 치료의 표준이 될 수있는 전략을 사용, 바이러스성 질환에 대한 세포 독성 T 세포 치료의 가능성을 증가한다. APCs로 플라스미드 nucleofected DC가의 사용은 다른 DC의 집단은 각각의 플라스미드 3 활용되기 때문에 하나의 셀 안에 표시되고 여러 바이러스 항원의 바이러스성 벡터는 물론 경쟁없이는 MHC 클래스 I 및 II 모두에서 항원 프레 젠 테이션을 수 있습니다. correspondingly 16,17 항원에 특정한 T 세포 응답의 주파수와 레퍼토리을 높일 수 있습니다 IL - 7분의 4 증가 T 세포 생존과 확산의 사용합니다. 마지막으로, G - 렉스의 문화는 크게 문화 중 T 세포 apoptosis을 줄일 수 있습니다. 가스 교환 (에서 O 2, CO 2 아웃)가 더 많은 영양소를 제공하고 폐기물을 diluting, 세포 위의 매체보다 깊이있게하면서 hypoxia을 방지, 술병의 바닥에 가스 투과 실리콘 막에 걸쳐 발생합니다. 이 플랫폼은 또한 보호 항원을 식별하는 경우 추가로 바이러스 확장될 수 있습니다.
공개
감사의 말
이 작품은 셀룰러 테라피 (계약 NIH - NHLBI (HB - 10 - 03) HHSN26820100000C) (CMR), 셀 기반의 치료를위한 전문 센터에 대한 생산 지원에 의해 지원됩니다 부여 NIH - NHLBI 1 U54 HL081007 (CMR), ASBMT 영 인베스티게이터 수상 (UG와 JV), 임상 연구 수상 (UG)에서 백혈병과 림프종 사회 특별 연구원, 그리고 에이미 Strelzer Manasevit 학술 수상 (AML).
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
|---|---|---|---|
| CellGenix | CellGenix | 2005 | |
| IL4 | R + D 시스템 | 204-IL/CF | |
| IL7 | Peprotech | 200-15 | |
| Hyclone RPMI 1640 | 써모 과학 | SH30096.01 | |
| 인간 AB 혈청 | 밸리 바이오 메디컬 주식 회사 | HP1022 | |
| Nucleofector | Amaxa / Lonza | AAF - 1001B & AAF - 1001X | |
| Nucleofection 키트 | Amaxa / Lonza | V4XP - 3012 | |
| Plasmids | NTC | N / A | |
| GM - CSF | R & D | 215-GM/CF | |
| IL1 | R & D | 201 - LB - 025 | |
| IL6 | R & D | 206 - IL - CF | |
| TNFα | R & D | 210 - TA - 010 | |
| PGE2 | 시그마 | P6532 - 1MG | |
| G - 렉스 | 윌슨 울프 제조 | AY11 - 00027 |
참고문헌
- Kaka, A. S., Foster, A. E., Weiss, H. L., Rooney, C. M., Leen, A. M. Using dendritic cell maturation and IL-12 producing capacity as markers of function: a cautionary tale. J Immunother. 31, 359-369 (2008).
- Leen, A. M., Myers, G. D., Sili, U., Huls, M. H., Weiss, H., Leung, K. S., Carrum, G., Krance, R. A., Chang, C. C., Molldrem, J. J. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1166 (2006).
- Gerdemann, U., Christin, A. S., Vera, J. F., Ramos, C. A., Fujita, Y., Liu, H., Dilloo, D., Heslop, H. E., Brenner, M. K., Rooney, C. M., Leen, A. M. Nucleofection of DCs to generate Multivirus-specific T cells for prevention or treatment of viral infections in the immunocompromised host. Mol. Ther. 17, 1616-1625 (2009).
- Leen, A. M., Christin, A., Khalil, M., Weiss, H., Gee, A. P., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Identification of hexon-specific CD4 and CD8 T-cell epitopes for vaccine and immunotherapy. J Virol. 82, 546-554 (2008).
- Leen, A. M., Christin, A., Myers, G. D., Liu, H., Cruz, C. R., Hanley, P. J., Kennedy-Nasser, A. A., Leung, K. S., Gee, A. P., Krance, R. A., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Cytotoxic T lymphocyte therapy with donor T cells prevents and treats adenovirus and Epstein-Barr virus infections after haploidentical and matched unrelated stem cell transplantation. Blood. 114, 4283-4292 (2009).
- Feuchtinger, T., Matthes-Martin, S., Richard, C., Lion, T., Fuhrer, M., Hamprecht, K., Handgretinger, R., Peters, C., Schuster, F. R., Beck, R., Schumm, M., Lotfi, R., Jahn, G., Lang, P. Safe adoptive transfer of virus-specific T-cell immunity for the treatment of systemic adenovirus infection after allogeneic stem cell transplantation. Br J Haematol. 134, 64-76 (2006).
- Bunde, T., Kirchner, A., Hoffmeister, B., Habedank, D., Hetzer, R., Cherepnev, G., Proesch, S., Reinke, P., Volk, H. D., Lehmkuhl, H., Kern, F. Protection from cytomegalovirus after transplantation is correlated with immediate early 1-specific CD8 T cells. J. Exp. Med. 201, 1031-1036 (2005).
- Leen, A., Meij, P., Redchenko, I., Middeldorp, J., Bloemena, E., Rickinson, A., Blake, N. Differential immunogenicity of Epstein-Barr virus latent-cycle proteins for human CD4(+) T-helper 1 responses. J Virol. 75, 8649-8659 (2001).
- Bickham, K., Munz, C., Tsang, M. L., Larsson, M., Fonteneau, J. F., Bhardwaj, N., Steinman, R. EBNA1-specific CD4+ T cells in healthy carriers of Epstein-Barr virus are primarily Th1 in function. J. Clin. Invest. 107, 121-130 (2001).
- Straathof, K. C., Leen, A. M., Buza, E. L., Taylor, G., Huls, M. H., Heslop, H. E., Rooney, C. M., Bollard, C. M. Characterization of latent membrane protein 2 specificity in CTL lines from patients with EBV-positive nasopharyngeal carcinoma and lymphoma. J. Immunol. 175, 4137-4147 (2005).
- Hislop, A. D., Taylor, G. S., Sauce, D., Rickinson, A. B. Cellular responses to viral infection in humans: lessons from Epstein-Barr virus. Annu. Rev. Immunol. 25, 587-617 (2007).
- Steven, N. M., Annels, N. E., Kumar, A., Leese, A. M., Kurilla, M. G., Rickinson, A. B. Immediate early and early lytic cycle proteins are frequent targets of the Epstein-Barr virus-induced cytotoxic T cell response. J. Exp. Med. 185, 1605-1617 (1997).
- Luke, J., Carnes, A. E., Hodgson, C. P., Williams, J. A. Improved antibiotic-free DNA vaccine vectors utilizing a novel RNA based plasmid selection system. Vaccine. 27, 6454-6459 (2009).
- Williams, J. A., Luke, J., Johnson, L., Hodgson, C. pDNAVACCultra vector family: high throughput intracellular targeting DNA vaccine plasmids. Vaccine. 24, 4671-4676 (2006).
- Vera, J. F., Brenner, L. J., Gerdemann, U., Ngo, M. C., Sili, U., Liu, H., Wilson, J., Dotti, G., Heslop, H. E., Leen, A. M., Rooney, C. M. Accelerated production of antigen-specific T-cells for pre-clinical and clinical applications using Gas-permeable Rapid Expansion cultureware (G-Rex. Journal of Immunotherapy. , (2009).
- Vella, A. T., Dow, S., Potter, T. A., Kappler, J., Marrack, P. Cytokine-induced survival of activated T cells in vitro and in vivo. Proc. Natl. Acad. Sci. U. S. A. 95, 3810-3815 (1998).
- Vella, A., Teague, T. K., Ihle, J., Kappler, J., Marrack, P. Interleukin 4 (IL-4) or IL-7 prevents the death of resting T cells: stat6 is probably not required for the effect of IL-4. J. Exp. Med. 186, 325-330 (1997).
- Heslop, H. E., Ng, C., Li, Y. C., Smith, C., A, C., Loftin, S. K., Krance, R. A., Brenner, M. K., Rooney, C. M. Long-term restoration of immunity against Epstein-Barr virus infection by adoptive transfer of gene-modified virus-specific T lymphocytes. Nature Medicine. 2, 551-555 (1996).
- Rooney, C. M., Smith, C. A., Ng, C., Loftin, S. K., Li, C., Krance, R. A., Brenner, M. K., Heslop, H. E. Use of gene-modified virus-specific T lymphocytes to control Epstein-Barr virus-related lymphoproliferation. Lancet. 345, 9-13 (1995).
- Einsele, H., Roosnek, E., Rufer, N., Sinzger, C., Riegler, S., Loffler, J., Grigoleit, U., Moris, A., Rammensee, H. G., Kanz, L., Kleihauer, A., Frank, F., Jahn, G., Hebart, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916-3922 (2002).
- Walter, E. A., Greenberg, P. D., Gilbert, M. J., Finch, R. J., Watanabe, K. S., Thomas, E. D., Riddell, S. R. Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N. Engl. J. Med. 333, 1038-1044 (1995).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유