Method Article
Генерация Multivirus конкретным Т-клеток по предотвращению / лечения вирусных инфекций после аллогенной трансплантации стволовых клеток
В этой статье
Резюме
Быстрый, простой и экономически эффективный протокол для поколения доноров полученных multivirus конкретных ЦТЛ (rCTL) для инфузий в аллогенных гемопоэтических стволовых клеток (ГСК) получателей риск развития ЦМВ, Adv или EBV инфекции. Этот производственный процесс GMP-совместимый и должны обеспечить более широкую реализацию Т-клеточной иммунотерапии за пределы специализированных центрах.
Аннотация
Вирусные инфекции вызывают заболеваемость и смертность в аллогенных гемопоэтических стволовых клеток (ГСК) получателей. Мы и другие успешно создан и придают T-клетки, специфические для Эпштейна Барр (ВЭБ), цитомегаловирус (ЦМВ) и аденовирус (Adv) с помощью моноцитов и EBV-преобразовано лимфобластоидных клетки (EBV-LCL) генно-модифицированных с аденовирусом вектор антиген представляющих клеток (БТР). Каких-то 2х10 5 / кг trivirus-специфических цитотоксических Т-лимфоцитов (CTL) распространились на несколько журналов после инфузии и, казалось, для профилактики и лечения даже тяжелых вирусных заболеваний, устойчивых к другим доступных методов лечения. Более полно выполнить этот обнадеживающий подход ограничен высокими издержками производства, сложности изготовления и длительного времени (4-6 недели EBV-LCL поколения, и 4-8 недель для CTL производства - всего 10-14 недели) для подготовки. Для преодоления этих ограничений мы разработали новые, GMP-совместимый протокол CTL производства. Во-первых, вместо adenovectors стимулировать Т-клеток, мы используем дендритные клетки (ДК) nucleofected с ДНК плазмиды кодирования LMP2, EBNA1 и BZLF1 (ВЭБ), Hexon и Пентон (Adv), и РР65 и IE1 (ЦМВ) в качестве антиген-представляющих клеток. Эти бронетранспортеры активировать Т-клетки, специфичные для всех стимулирующих антигенов. Во-вторых, культура активированных Т-клеток в присутствии ИЛ-4 (1,000 ед / мл) и IL-7 (10ng/ml) увеличивает и поддерживает репертуар и частота специфических Т клеток в наших линиях. В-третьих, мы использовали новые, газопроницаемых устройство культуры (G-REX), что способствует расширению и выживания большого количества клеток после однократного стимуляция, тем самым устраняя потребность в ВЭБ-LCLS и сокращения техник вмешательства. За счет внедрения этих изменений мы можем теперь производить multispecific CTL ориентации EBV, CMV, и Adv по цене на 10 6 клеток, уменьшается на> 90%, а всего за 10 дней, а не 10 недель, используя подход, который может быть распространен на дополнительные защитные вирусных антигенов. Наши FDA утвержденных подход должен иметь значение для профилактики и лечения заявок на высокий риск аллогенных ГСК получателей.
протокол
1. DC nucleofection
- Урожай моноцитарных контроллеры домена, которые были обогащены с использованием пластиковых приверженности, культивировали в течение 5 дней с помощью сотового Genix среде с IL4 (1000U/ml), GMCSF (800IU/ml) и далее созрел в течение 24 часов использования созревания DC цитокинов IL4 (1000U / мл), GMCSF (800IU/ml), IL6100ng/ml, TNF-α 10ng/ml, IL1-β 10ng/ml и PGE2 (1μg/ml) 1, нежным ресуспендирования с 3 мл пипетки передачи.
- Граф жизнеспособной контроллеры домена с использованием трипанового синий, передачи в 3-кратным 15 мл пробирки с не менее чем 0.5x10 6 и не более 2х10 6 кл / трубы.
- Центрифуга для РС 10mins @ 200г. За это время предварительно теплой сотовый Genix среде с созреванием DC цитокинов (СМИ DC созревания) - 2ml/well в трех скважинах 12-а тканевая культура рассматривается пластины в 37 ° С / 5% СО 2 инкубатора.
- Как только клетки закончили спиннинг, аспирация супернатант и добавить соответствующие плазмиды ДНК, чтобы каждый из трубы в конечной концентрации 5 мкг ДНК / трубы. В этом случае добавить плазмиды, кодирующей IE1-РР65 к трубе № 1, Hexon-Пентон к трубе № 2, и EBNA1-LMP2-BZLF1 к трубе № 3.
- Ресуспендируют ДК и ДНК с 100 мкл раствора nucloefection Amaxa, хорошо перемешать и трансфер в nucleofection кювет.
- Место в кювет 4D nucleofector, выберите программу CB150 (Amaxa / Lonza), и нажать старт.
- Сразу же после nucleofection добавить 500 мкл в 2 мл подогретого сотовый Genix DC созревания СМИ кюветы, аккуратно перемешать с помощью пипетки вверх и вниз по 2-3 раза, и передача nucleofected РС подготовлена 12-луночного планшета содержащих оставшиеся 1,5 мл предварительно нагретого СМИ DC созревания. Трансфер в 37 ° С / 5% СО 2 инкубатора для дальнейшей 12-18hrs.
2. Т-клеток, стимуляция
- Урожай и считать nucleofected контроллеры домена, и облучать на 30Gy. Вымойте раз с 10 мл среды CTL (45% RPMI, 45% кликов EHAA, 10% ЭТС, 2мм Glutamax) и ресуспендируйте @ 3 х 10 5 контроллеров домена на мл CTL СМИ.
- Бассейн минимум 7.5x10 5 (2,5 мл) и максимум 15x10 5 (5 мл) ДК содержащие каждый из плазмид и передача объединенных РС G-Rex устройства, которые затем будут помещены в инкубатор.
- Для подготовки клетки ответчик использовать либо ранее замороженных МНПК или не соблюдают мононуклеарных клеток, которые остаются после выбора постоянного тока (следование или CD14 выбор). Оттепель клетки, трансфер в нагретого культуральной среде, мыть один раз с CTL СМИ. Ресуспендируют клеток в СМИ CTL, граф клеток и довести их до концентрации 2х10 6 клеток на мл. Возьмите 15x10 6 ячеек или 7.5ml и дополнения 30000U IL4 (1000U/ml -. Окончательным концом) и 300ng IL7 (10ng/ml - финальный конц.).
- Передача 7.5ml из РВМС (15x10 6 ячеек) для G-Rex и пополнить биореактор с CTL СМИ, чтобы общий объем 30 мл.
- Культура G-Rex в течение 6-7 дней при 37 ° С / 5% CO 2 увлажненный инкубатора.
3. Т-клеток расширения
- В день 6-7, 10 мл аспирата средств массовой информации, затем смешать клетки в оставшихся 20 мл среды с 10 мл пипетки и считать жизнеспособных клеток с трипановым синий. Если Есть <50x10 6 пополнится свежим медиа + цитокинов. Если Есть> 50x10 6 ячеек удалить 10 мл клеточной суспензии, переезд в новый G-Rex, а затем кормить как G-Rexs со свежими CTL СМИ + цитокинов.
- Культура для дополнительных 4-6 дней. После достаточного клетки были расширены, выполните фенотипические и функциональные характеристики CTL и cryopreserve избыток для будущего использования.
4. Представитель Результаты:
Схема нашей FDA утвержденных multivirus конкретных CTL процесса генерации показано на рисунке 1. В отличие от конвенции multivirus CTL протоколы, которые используют adenovectors и EBV-LCL, чтобы стимулировать вирус-реактивных Т-клеток, 2 мы пришли на смену инфекционным материалом вируса с ДНК плазмиды , которые кодируют несколько антигенов производным от каждого из вирусов 3. Чтобы стимулировать trivirus CTL, нами разработаны три multicistronic плазмид кодирования Hexon и Пентон аденовируса, IE1 и РР65 ЦМВ, и EBNA1, LMP2, а BZLF1 ВЭБ. Эти антигены были выбраны на основе поощрения клинические результаты наших собственных и других групп, показывающие, что Т-клетки, направленный против Adv-hexon и Пентон 2,4-6, а также ЦМВ-1E1 и ЦМВ РР65 являются защитными в естественных условиях 7. Для EBV, EBNA1 является иммунодоминантные CD4 + T-клетки-мишени антиген экспрессируется во всех EBV-связанных злокачественных опухолей и в нормальных ВЭБ-инфицированных клеток 8,9, LMP2 является иммуногенной на несколько типов HLA и выражается в самых EBV злокачественных новообразований, в то время как 10,11 BZLF1 кодирует иммунодоминантные, немедленное рано литического цикла антиген, который стимулирует CD4 + и CD8 + Т-клеток от большинства людей и, вероятно, важна для сотрудничестваntrol клеток репликация вируса 12. Для дальнейшей оптимизации наших методов производства мы сотрудничали с природой технологий, создавшим minimalized, антибиотиков (FDA-совместимый) плазмиды для стимуляции ЦТЛ 13,14. С помощью этой стратегии мы последовательно достичь nucleofection КПД> 35% при сохранении высокой жизнеспособности клеток (данные не представлены) 3. Рисунок 2 показывает, что частота вирус-специфических Т-клеток в ответ на оптимизированных плазмиды ДНК, как измеряется IFNγ ELISpot, было больше, , чем в ответ на обычные pShuttle основе плазмиды экспрессии выражения же антигены (п = 8 аденовирус, п = 4 ЦМВ, и п = 2 EBV). Оптимальное соотношение DC: РВМС было важно для мощных стимуляция Т-клеток, как показано на рисунке 3, где отношение 1:50 производятся неоптимальной активации по сравнению с 1:20 S: R отношение (п = 2 доноров). Производство достаточного CTL номера с широкими специфичность антигена предпосылкой для клинической эффективностью против всех трех вирусов. Это достигается за счет CTL культуры в G-Rex, которая поддерживает превосходные Т расширение ячейки по сравнению с обычными 24-луночных планшетах (рис. 4а) 15, в то время как добавление IL4 и IL7 к культурам увеличивает репертуар и специфичность как показано на рисунке 4В где частота Т-клеток, реактивная против ЦМВ РР65 полученных HLA-A2 resticted NLV пептид был оценен в культурах, генерируемых в присутствии или отсутствии IL4 и / или IL7 16,17. Для оценки фенотипа и функциональных возможностей расширен клетки мы проводим проточной цитометрии анализа внутриклеточных цитокинов окрашивания / IFNγ ELISpot и Cr 51 анализов релиз на конечный продукт для криоконсервации / в инфузии. Обычно сгенерированный клетки поликлональных со смешанным населением CD4 + и CD8 + Т-клеток с антигеном-специфичность обнаруживается в обоих отсеках Т клетки. CTL способны убить вирусный антиген-клеток, экспрессирующих цели, но не вирус отрицательный частично HLA соответствие цели, указывая, что они не должны вызывать трансплантат против хозяина (GVHD) в естественных условиях (рис. 5).
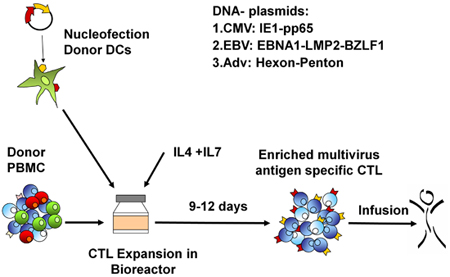
Рисунок 1. RCTL поколение протокола. Во-первых, контроллеры домена являются nucleofected с вирусного антигена кодирования плазмиды и затем смешивается с аутологичной МНПК на R: S 10 или 20:1. Клетки разлагаются в G-Rex в течение 10-14 дней в присутствии IL4 и IL7, затем собирают, считая, проверены на функции, идентичность и стерильность, а затем криоконсервированных для клинического использования.

Рисунок 2. Оптимизированная плазмид ДНК вызывают превосходной активацию Т-клеток в пробирке. Контроллеры домена были nucleofected с оптимизированной, FDA-совместимые плазмиды кодирования Hexon и Пентон (Adv), IE1 и РР65 (ЦМВ), и EBNA1, LMP2, а BZLF1 (ВЭБ) или обычные плазмиды pShuttle кодирования же антигены. Они были использованы, чтобы стимулировать Т-клетки и специфичность была проанализирована IFNγ ELISpot 10 дней после стимуляции.
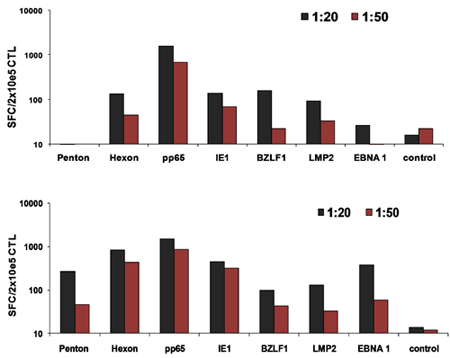
Рисунок 3 Оптимальное DC:. Соотношение T ячейки для CTL активации. Контроллеры домена от 2 доноров nucleofected со всеми тремя оптимизированы плазмид, а затем используются для стимуляции аутологичных МНПК в 1:20 или 1:50 DC: РВМС отношение. Частота реактивации Т-клеток была оценена на 10 день от IFNγ ELISpot.
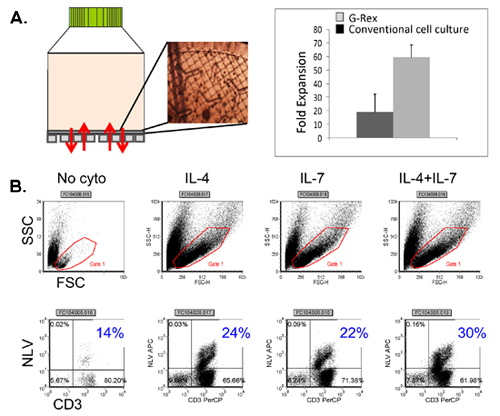
Рисунок 4. Т-клеток расширение G-Rex использованием повышения цитокинов. Группа показывает, G-Rex устройства, а также появление на CTL мембраны газопроницаемых, оценивали с помощью микроскопа. Сравнение между сотовыми выход, достигнутых в культуре ткани конвенции рассматриваются пластины против G-Rex также показано на рисунке. Группа B показывает частоту ЦМВ пентамера положительные CTL, достигнутые в культурах расширен в наличии не цитокинов, IL4 один, IL7 один и IL4 + IL7.
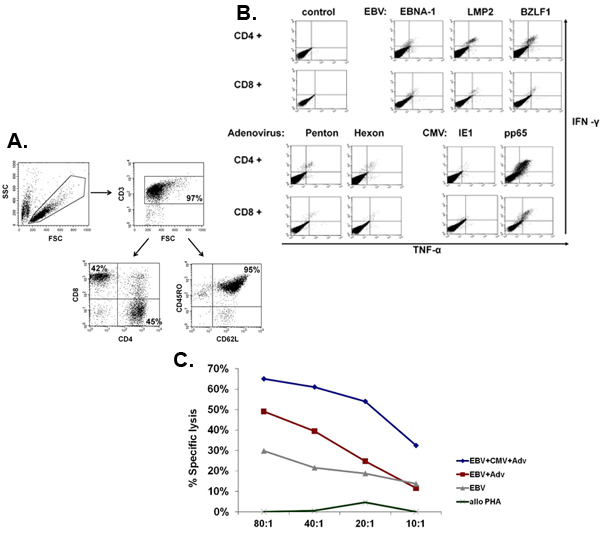
Рисунок 5. Фенотип и функции расширенного CTL. Группа показывает типичный пример фенотип расширен CTL multivirus, которые поликлональных смесью CD4 + (45% - помощник) и CD8 + (42% - цитотоксические) Т-клетки, из которых большинство (95%) выразили памяти маркер CD45RO + / CD62L +. Группа B показывает, что эти клетки являются специфическими для всех стимулирующих антигенов и полифункциональных по оценке внутриклеточного окрашивания цитокинов обнаружить производства IFNΓ и ФНО после антигена стимуляции. группы С показывает, что расширил CTL, являются действительными измеряется по 51 Cr анализа. Аутологичная LCL, либо самостоятельно, либо трансдуцированных с нулевого вектора или аденовирусного вектора выражения ЦМВ РР65 были использованы в качестве смолыполучает. Alloreactivity оценивалась с использованием аллогенных PHA взрывы в качестве мишени.
Обсуждение
Вирусные инфекции составляют существенную заболеваемости и смертности у пациентов, которые иммунитетом от своей болезни и ее лечении. После ГСК, например, инфекции, вызванные вирусом герпеса стойкие, такие как ВЭБ и ЦМВ, а также респираторные вирусы, такие как респираторно-синцитиальный вирус (RSV), хорошо известны, в то время как важность инфекций, вызванных Adv, BK вируса и человека вирус герпеса (HHV) -6 совсем недавно были оценены. Хотя фармакологические препараты являются стандартной терапией для некоторых инфекций, они имеют существенные токсичности, порождают устойчивые варианты, и часто неэффективны. Напротив, вирус-специфических Т клеток, полученных от доноров стволовых клеток оказались безопасными и эффективными для профилактики и лечения вирусной инфекции или болезни в гемопоэтических стволовых клеток (ГСК) установление 2,5,6,18-21. Тем не менее, более широкое внедрение иммунотерапии Т-клеток, в конечном счете ограничено стоимость, сложность и время, необходимое для CTL производства.
Наш новый и быстрый подход для создания multivirus CTL, описанные в текущих рукописи, должны существенно усилить возможности цитотоксических Т-клеточной терапии вирусных заболеваний, что позволяет стратегию, чтобы стать стандартом лечения ослабленным иммунитетом хозяина. Использование плазмиды nucleofected контроллеры домена, как БТР позволяет презентации антигена с обеих MHC класса I и II без конкуренции со стороны вирусных векторов или даже из нескольких вирусных антигенов выражены в одной клетке с разных популяциях постоянного тока используются для каждой плазмиды 3. Использование Ил-4 / 7 увеличивает T выживания и пролиферации клеток, что соответственно повышает частоту и репертуар реагирования антиген-специфические Т-клетки 16,17. Наконец, культура в G-Rex резко снижает T апоптоз клеток при культуры. Газообмен (O 2 и СО в 2 выхода) происходит через кремниевые мембраны газопроницаемых в основании колбы, предотвращения гипоксии, позволяя большую глубину среды выше клеток, обеспечивая больше питательных веществ и разбавления отходы. Эта платформа также может быть распространено на дополнительные вирусов, когда защитные антигены идентифицированы.
Раскрытие информации
Благодарности
Эта работа проводится при поддержке Производство помощи клеточной терапии (контракта NIH-NHLBI (HB-10-03) HHSN26820100000C) (CMR), специализированные центры для клеточной терапии грант NIH-NHLBI 1 U54 HL081007 (CMR), ASBMT Молодые премии следователя (UG и СП), лейкемии и лимфомы общества Специальные научный сотрудник в области клинической премии исследований (UG) и Эми Strelzer Manasevit ученый премии (ОМЛ).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
|---|---|---|---|
| CellGenix | CellGenix | 2005 | |
| IL4 | R + D Systems | 204-IL/CF | |
| IL7 | Peprotech | 200-15 | |
| Hyclone RPMI 1640 | Thermo Scientific | SH30096.01 | |
| Человек AB сыворотке | Долина биомедицинских Инк | HP1022 | |
| Nucleofector | Amaxa / Lonza | AAF-1001B и ААР-1001X | |
| Nucleofection Kit | Amaxa / Lonza | V4XP-3012 | |
| Плазмиды | NTC | н / | |
| GM-CSF | R & D | 215-GM/CF | |
| IL1 | R & D | 201-LB-025 | |
| IL6 | R & D | 206-Ил-CF | |
| ФНО | R & D | 210-TA-010 | |
| PGE2 | Сигма | P6532-1мг | |
| G-Rex | Уилсон Вольф Производство | AY11-00027 |
Ссылки
- Kaka, A. S., Foster, A. E., Weiss, H. L., Rooney, C. M., Leen, A. M. Using dendritic cell maturation and IL-12 producing capacity as markers of function: a cautionary tale. J Immunother. 31, 359-369 (2008).
- Leen, A. M., Myers, G. D., Sili, U., Huls, M. H., Weiss, H., Leung, K. S., Carrum, G., Krance, R. A., Chang, C. C., Molldrem, J. J. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1166 (2006).
- Gerdemann, U., Christin, A. S., Vera, J. F., Ramos, C. A., Fujita, Y., Liu, H., Dilloo, D., Heslop, H. E., Brenner, M. K., Rooney, C. M., Leen, A. M. Nucleofection of DCs to generate Multivirus-specific T cells for prevention or treatment of viral infections in the immunocompromised host. Mol. Ther. 17, 1616-1625 (2009).
- Leen, A. M., Christin, A., Khalil, M., Weiss, H., Gee, A. P., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Identification of hexon-specific CD4 and CD8 T-cell epitopes for vaccine and immunotherapy. J Virol. 82, 546-554 (2008).
- Leen, A. M., Christin, A., Myers, G. D., Liu, H., Cruz, C. R., Hanley, P. J., Kennedy-Nasser, A. A., Leung, K. S., Gee, A. P., Krance, R. A., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Cytotoxic T lymphocyte therapy with donor T cells prevents and treats adenovirus and Epstein-Barr virus infections after haploidentical and matched unrelated stem cell transplantation. Blood. 114, 4283-4292 (2009).
- Feuchtinger, T., Matthes-Martin, S., Richard, C., Lion, T., Fuhrer, M., Hamprecht, K., Handgretinger, R., Peters, C., Schuster, F. R., Beck, R., Schumm, M., Lotfi, R., Jahn, G., Lang, P. Safe adoptive transfer of virus-specific T-cell immunity for the treatment of systemic adenovirus infection after allogeneic stem cell transplantation. Br J Haematol. 134, 64-76 (2006).
- Bunde, T., Kirchner, A., Hoffmeister, B., Habedank, D., Hetzer, R., Cherepnev, G., Proesch, S., Reinke, P., Volk, H. D., Lehmkuhl, H., Kern, F. Protection from cytomegalovirus after transplantation is correlated with immediate early 1-specific CD8 T cells. J. Exp. Med. 201, 1031-1036 (2005).
- Leen, A., Meij, P., Redchenko, I., Middeldorp, J., Bloemena, E., Rickinson, A., Blake, N. Differential immunogenicity of Epstein-Barr virus latent-cycle proteins for human CD4(+) T-helper 1 responses. J Virol. 75, 8649-8659 (2001).
- Bickham, K., Munz, C., Tsang, M. L., Larsson, M., Fonteneau, J. F., Bhardwaj, N., Steinman, R. EBNA1-specific CD4+ T cells in healthy carriers of Epstein-Barr virus are primarily Th1 in function. J. Clin. Invest. 107, 121-130 (2001).
- Straathof, K. C., Leen, A. M., Buza, E. L., Taylor, G., Huls, M. H., Heslop, H. E., Rooney, C. M., Bollard, C. M. Characterization of latent membrane protein 2 specificity in CTL lines from patients with EBV-positive nasopharyngeal carcinoma and lymphoma. J. Immunol. 175, 4137-4147 (2005).
- Hislop, A. D., Taylor, G. S., Sauce, D., Rickinson, A. B. Cellular responses to viral infection in humans: lessons from Epstein-Barr virus. Annu. Rev. Immunol. 25, 587-617 (2007).
- Steven, N. M., Annels, N. E., Kumar, A., Leese, A. M., Kurilla, M. G., Rickinson, A. B. Immediate early and early lytic cycle proteins are frequent targets of the Epstein-Barr virus-induced cytotoxic T cell response. J. Exp. Med. 185, 1605-1617 (1997).
- Luke, J., Carnes, A. E., Hodgson, C. P., Williams, J. A. Improved antibiotic-free DNA vaccine vectors utilizing a novel RNA based plasmid selection system. Vaccine. 27, 6454-6459 (2009).
- Williams, J. A., Luke, J., Johnson, L., Hodgson, C. pDNAVACCultra vector family: high throughput intracellular targeting DNA vaccine plasmids. Vaccine. 24, 4671-4676 (2006).
- Vera, J. F., Brenner, L. J., Gerdemann, U., Ngo, M. C., Sili, U., Liu, H., Wilson, J., Dotti, G., Heslop, H. E., Leen, A. M., Rooney, C. M. Accelerated production of antigen-specific T-cells for pre-clinical and clinical applications using Gas-permeable Rapid Expansion cultureware (G-Rex. Journal of Immunotherapy. , (2009).
- Vella, A. T., Dow, S., Potter, T. A., Kappler, J., Marrack, P. Cytokine-induced survival of activated T cells in vitro and in vivo. Proc. Natl. Acad. Sci. U. S. A. 95, 3810-3815 (1998).
- Vella, A., Teague, T. K., Ihle, J., Kappler, J., Marrack, P. Interleukin 4 (IL-4) or IL-7 prevents the death of resting T cells: stat6 is probably not required for the effect of IL-4. J. Exp. Med. 186, 325-330 (1997).
- Heslop, H. E., Ng, C., Li, Y. C., Smith, C., A, C., Loftin, S. K., Krance, R. A., Brenner, M. K., Rooney, C. M. Long-term restoration of immunity against Epstein-Barr virus infection by adoptive transfer of gene-modified virus-specific T lymphocytes. Nature Medicine. 2, 551-555 (1996).
- Rooney, C. M., Smith, C. A., Ng, C., Loftin, S. K., Li, C., Krance, R. A., Brenner, M. K., Heslop, H. E. Use of gene-modified virus-specific T lymphocytes to control Epstein-Barr virus-related lymphoproliferation. Lancet. 345, 9-13 (1995).
- Einsele, H., Roosnek, E., Rufer, N., Sinzger, C., Riegler, S., Loffler, J., Grigoleit, U., Moris, A., Rammensee, H. G., Kanz, L., Kleihauer, A., Frank, F., Jahn, G., Hebart, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916-3922 (2002).
- Walter, E. A., Greenberg, P. D., Gilbert, M. J., Finch, R. J., Watanabe, K. S., Thomas, E. D., Riddell, S. R. Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N. Engl. J. Med. 333, 1038-1044 (1995).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены