Method Article
Generierung von Multivirus-spezifischen T-Zellen zu verhindern / zu behandeln virale Infektionen nach allogenen hämatopoetischen Stammzelltransplantation
In diesem Artikel
Zusammenfassung
Eine schnelle, einfache und kostengünstige Protokoll für die Erzeugung von Spender-derived multivirus-spezifische CTLs (RCTL) zur Infusion einer allogenen hämatopoetischen Stammzelltransplantation (HSCT) Empfänger die Gefahr der Entwicklung CMV, Adv. oder EBV-Infektionen. Dieses Herstellungsverfahren ist GMP-konform und sollte die breitere Umsetzung von T-Zell-Immuntherapie über spezialisierte Zentren zu gewährleisten.
Zusammenfassung
Virale Infektionen verursachen Morbidität und Mortalität in allogene hämatopoetische Stammzelltransplantation (HSCT) Empfänger. Wir und andere haben erfolgreich erzeugt und infundiert T-Zellen spezifisch für Epstein Barr Virus (EBV), Cytomegalovirus (CMV) und Adenovirus (Adv) mit Monozyten und EBV-transformierten lymphoblastische Zellen (EBV-LCL) mit einem Adenovirus-Vektor-Gen-modifiziert Antigen-präsentierende Zellen (APC). So wenig wie 2x10 5 / kg trivirus-spezifischen zytotoxischen T-Lymphozyten (CTL) durch mehrere Protokolle nach der Infusion vermehrt und erschien zur Vorbeugung und Behandlung sogar schwere Viruserkrankung beständig zu anderen verfügbaren Therapien. Vorbereitung - Der breiter gefasste Umsetzung dieser ermutigenden Ansatz wird durch die hohen Produktionskosten, die Komplexität der Herstellung und der längere Zeit (insgesamt 10-14 Wochen 4-6 Wochen für die EBV-LCL-Generation, und 4-8 Wochen für CTL Herstellung) begrenzt. Um diese Einschränkungen zu überwinden haben wir eine neue, GMP-konforme Produktion CTL-Protokoll entwickelt. Erstens, an Stelle des Adenovektoren auf T-Zellen verwenden wir dendritische Zellen (DCs) mit DNA Plasmiden LMP2, EBNA1 und BZLF1 (EBV), Hexon und Penton (Adv) und pp65 und IE1 (CMV) als Antigen-präsentierende nucleofected stimulieren Zellen. Diese APCs aktivieren T-Zellen spezifisch für alle stimulierenden Antigenen. Zweitens, die Kultur von aktivierten T-Zellen in Anwesenheit von IL-4 (1.000 U / ml) und IL-7 (10ng/ml) erhöht und erhält das Repertoire und die Häufigkeit von spezifischen T-Zellen in unseren Linien. Drittens haben wir eine neue, gasdurchlässige Kultur-Gerät (G-Rex), dass die Expansion und das Überleben der großen Zellzahlen fördert nach einer einzigen Stimulation, wodurch der Bedarf an EBV-LCL und die Verringerung der Techniker Intervention verwendet. Durch die Umsetzung dieser Veränderungen können wir jetzt produzieren multispezifische CTL Targeting EBV, CMV, und Adv zu einem Preis pro 10 6 Zellen, die von> 90% reduziert wird, und in nur 10 Tagen statt 10 Wochen mit einem Ansatz, um zusätzliche verlängert werden kann Schutz virale Antigene. Unsere von der FDA zugelassene Ansatz sollte der Wert für die prophylaktische Behandlung und Anwendungen für ein hohes Risiko einer allogenen HSCT Empfängern werden.
Protokoll
1. DC Nukleofektion
- Ernte Monozyten-abgeleiteten DCs, die angereichert sind mit Kunststoff-Haftung, für 5 Tage mit Zell Genix Medien mit IL4 (1000U/ml) ergänzt, GMCSF (800IU/ml) und weitere 24 Stunden lang mit dem DC-Reifung Zytokine IL4 (1000U gereift kultivierten / ml), GMCSF (800IU/ml), IL6100ng/ml, TNF-α 10ng/ml, IL1-β 10ng/ml und PGE2 (1μg/ml) 1, durch vorsichtiges Resuspendieren mit 3ml Transferpipette.
- Graf lebensfähig DCs mit Trypanblau, Transfer in 3x 15ml Röhrchen mit nicht weniger als 0.5x10 6 und nicht mehr als 2x10 6 Zellen / Röhrchen.
- Centrifuge DCs für 10 Minuten @ 200g. 2ml/well in drei Wells einer 12-well Zellkultur behandelte Platte in einem 37 ° C / 5% CO 2-Inkubator - Während dieser Zeit vorwärmen Zelle Genix Medien mit der DC-Reifung Zytokine (DC Reifung media) ergänzt.
- Sobald Zellen fertig sind Spinnen, saugen Sie den Überstand und fügen Sie die entsprechende DNA-Plasmide zu jedem der Rohre in einer finalen Konzentration von 5μg DNA / Rohr. In diesem Fall fügen Sie die Plasmid-Kodierung IE1-pp65 zu Rohr Nr. 1, Hexon-Penton zu Rohr Nr. 2 und EBNA1-LMP2-BZLF1 zu Rohr Nr. 3.
- Resuspendieren DCs und DNA mit 100 &mgr; l der Amaxa nucloefection verdünnen, gut mischen und Transfer zum Nukleofektion Küvetten.
- Legen Sie Küvetten in der 4D Nucleofector, wählen Sie Programm CB150 (Amaxa / Lonza), und drücken Sie Start.
- Unmittelbar nach Nukleofektion 500μl der 2ml vorgewärmten Zelle Genix DC Reifung Medien in die Küvette hinzu, mischen Sie vorsichtig durch Auf-und Abpipettieren 2-3 mal, und übertragen nucleofected DCs auf die vorbereitete 12-Well-Platte mit den restlichen 1,5 ml vorgewärmtem DC Reifung Medien. Transfer zum 37 ° C / 5% CO 2-Inkubator für eine weitere 12-18h.
2. T-Zell-Stimulation
- Ernte und zählen nucleofected DCs, und bestrahlen bei 30 Gy. Wash einmal mit 10 ml CTL-Medium (45% RPMI, 45% Klicks EHAA, 10% FBS, 2 mM Glutamax) und resuspendieren @ 3 x 10 5 DCs pro ml CTL Medien.
- Pool ein Minimum von 7.5x10 5 (2,5 ml) und einem Maximum von 15x10 5 (5 ml) der DCs mit jedem der Plasmide und Transfer der gepoolten DCs auf die G-Rex Gerät, das dann in den Inkubator platziert werden.
- Für die Herstellung der Responder-Zellen entweder vorher eingefroren PBMCs oder nicht haftende mononukleären Zellen, die nach dem DC-Auswahl (Einhaltung oder CD14 Auswahl) bleiben. Thaw die Zellen, um vorgewärmte Kulturmedium übertragen, einmal abwaschen mit CTL-Medien. Resuspendieren der Zellen in CTL Media, zählen die Zellen und bringt sie zu einer Konzentration von 2x10 6 Zellen pro ml. Nehmen 15x10 6 Zellen oder 7,5 ml und ergänzen mit 30000U IL4 (1000U/ml -. Endkonzentration) und 300ng IL7 (10ng/ml - Endkonzentration.).
- Transfer 7.5ml von PBMC (15x10 6 Zellen), die G-Rex und Aufstockung des Bioreaktors mit CTL Medien bis zu einem Gesamtvolumen von 30ml.
- Kultur der G-Rex für 6-7 Tage in einem 37 ° C / 5% CO 2 befeuchteten Inkubator.
3. T-Zell-Expansion
- Am Tag 6-7, absaugen 10ml von Medien, dann mischen die Zellen in den verbleibenden 20 ml Medium mit 10ml Pipette und zählen lebensfähigen Zellen unter Verwendung von Trypanblau. Wenn es <50x10 6 mit frischen Medien + Zytokine aufzufüllen. Wenn es> 50x10 6 Zellen zu entfernen 10ml Zellsuspension, um eine neue G-Rex zu übertragen, und dann füttern beide G-Rexs mit frischen CTL media + Zytokine.
- Kultur für weitere 4-6 Tage. Sobald genügend Zellen wurden erweitert, führen phänotypische und funktionelle Charakterisierung der CTL und Kryokonservierung überschüssiger für die zukünftige Verwendung.
4. Repräsentative Ergebnisse:
Eine schematische Darstellung unserer FDA-Zulassung multivirus-spezifischen CTL-Generation ist in Abbildung 1 dargestellt. Im Gegensatz zu Konventionen multivirus CTL-Protokolle, die Adenovektoren und EBV-LCL verwenden, um Virus-reaktiven T-Zellen zu stimulieren 2 haben wir infektiösen Virus-Material mit DNA-Plasmiden ersetzt dass kodieren mehrere Antigene aus jedem der Viren 3 abgeleitet. Zur Stimulierung trivirus CTL wir entwarf drei multicistronischen Plasmiden Hexon und Penton von Adenovirus, IE1 und pp65 von CMV und EBNA1, LMP2 und BZLF1 des EBV. Diese Antigene wurden auf der Grundlage ermutigenden klinischen Ergebnisse unserer eigenen und anderer Gruppen zeigen, dass T-Zellen gegen Adv-Hexon und Penton 2,4-6 gerichtet, und CMV-1E1 und CMV-pp65 sind Schutzmaßnahmen in vivo 7 gewählt. Für EBV ist EBNA1 ein immundominantes CD4 + T-Zell-Target-Antigen in allen EBV-assoziierten Tumoren und in normalen EBV-infizierten B-Zellen exprimiert 8,9, LMP2 immunogen ist über mehrere HLA-Typen und ausgedrückt in den meisten EBV Malignome, 10,11, während BZLF1 kodiert für ein immundominante, immediate early lytischen Zyklus Antigen, das sowohl CD4 + und CD8 + T-Zellen stimuliert von den meisten Menschen und ist wahrscheinlich wichtig für die Zusammenarbeitntrol von Zellen replizieren Virus 12. Zur weiteren Optimierung unserer Fertigung Methoden, die wir in Zusammenarbeit mit Nature-Technologie, die minimalized, Antibiotika-freien (FDA-konform) Plasmide für CTL Stimulation 13,14 erzeugt. Mit dieser Strategie setzen wir konsequent erreichen Nukleofektion Wirkungsgrade von> 35% unter Beibehaltung der hohen Zellvitalität (Daten nicht gezeigt) 3. Abbildung 2 zeigt, dass die Häufigkeit von Virus-spezifischen T-Zellen als Reaktion auf optimierten DNA-Plasmide wie IFNy ELIspot gemessen, größer war als Reaktion auf herkömmliche pShuttle-basierten Expressionsplasmiden Ausdruck der gleichen Antigene (n = 8 Adenovirus, n = 4 CMV, und n = 2 EBV). Das optimale Verhältnis von DC: PBMC wurde für potente T-Zell-Stimulation, wie in Abbildung 3, wo ein Verhältnis von 1:50 produziert sub-optimale Aktivierung im Vergleich zu einer 1:20 S gezeigt wichtig: R-Verhältnis (n = 2 Geber). Produktion von ausreichenden CTL Zahlen mit breiten Antigen-Spezifität ist eine Voraussetzung für die klinische Wirksamkeit gegen alle drei Viren. Dies wird durch CTL Kultur in der G-Rex, der überlegene T-Zell-Expansion unterstützt im Vergleich zu herkömmlichen 24-Well-Platten (Abbildung 4A) 15 erreicht, während die Zugabe von IL4 und IL7 die Kulturen steigt das Repertoire und Spezifität, wie in Abbildung 4B dargestellt wobei die Frequenz von T-Zellen reaktiv gegen das CMV-pp65-derived HLA-A2 resticted NLV Peptid wurde in Kulturen in der Gegenwart oder Abwesenheit von IL-4 und / oder IL7 16,17 generiert beurteilt. Zur Beurteilung der Phänotyp und funktionellen Kapazität der expandierten Zellen führen wir durchflusszytometrische Analyse intrazellulärer Zytokin-Färbung / IFNy ELIspot und Cr 51 Release Assays, die auf das Endprodukt für die Kryokonservierung / Infusion. Typischerweise werden die erzeugten Zellen sind polyklonale mit einer gemischten Bevölkerung von CD4 + und CD8 + T-Zellen mit Antigen-Spezifität nachweisbar in beiden T-Zell-Kompartimenten. Die CTL sind in der Lage, virale Antigen-exprimierenden Zielzellen töten, aber nicht negativ Virus teilweise HLA abgestimmt Zielen unter Angabe, dass sie nicht veranlassen Graft-versus-Host Erkrankung (GvHD) in vivo (Abbildung 5).
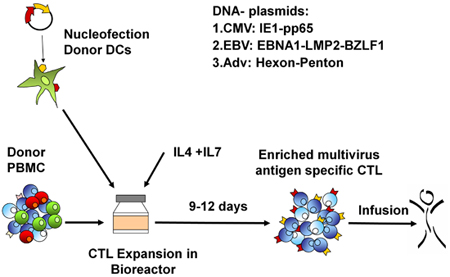
Abbildung 1. RCTL Generation-Protokoll. Erstens sind DCs mit dem viralen Antigen-kodierenden Plasmiden nucleofected und anschließend mit autologen PBMCs bei einem R: S 10 oder 20:1. Die Zellen werden in der G-Rex für 10-14 Tage in Gegenwart von IL4 und IL7, dann geerntet, gezählt, funktionsgeprüft, Identität und Sterilität, und dann für den klinischen Gebrauch kryokonserviert erweitert.

Abbildung 2. Optimized DNA-Plasmide bewirken überlegene T-Zell-Aktivierung in vitro. DCs wurden mit einer optimierten, FDA-konforme Plasmiden Hexon und Penton (Adv), IE1 und pp65 (CMV), und EBNA1, LMP2 und BZLF1 (EBV) oder konventionelle pShuttle Plasmiden die gleichen Antigene nucleofected. Diese wurden verwendet, um T-Zellen zu stimulieren und Spezifität wurde durch IFNy ELIspot 10 Tage post-Stimulation untersucht.
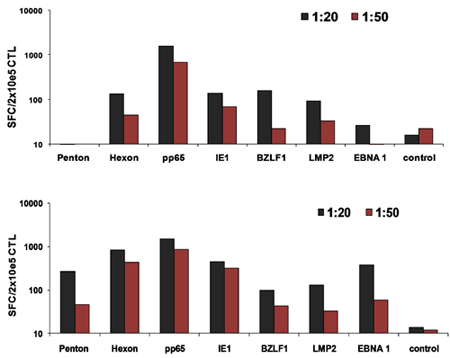
Abbildung 3 Optimale DC:. T-Zell-Verhältnisse für CTL-Aktivierung. DCs von 2 Spendern wurden mit allen drei optimierten Plasmiden nucleofected und dann zur autologen PBMCs um 1:20 oder 1:50 DC stimulieren: PBMC-Verhältnis. Die Häufigkeit der reaktivierten T-Zellen wurde am Tag 10 nach IFNy ELIspot beurteilt.
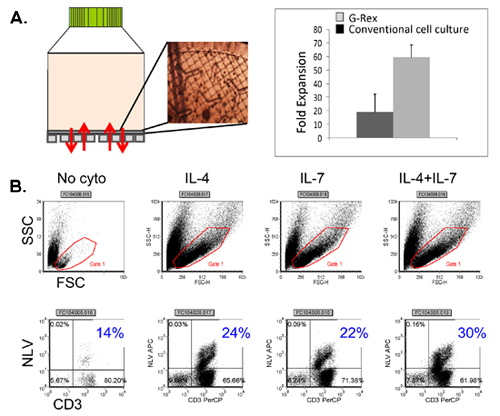
Abbildung 4. T-Zell-Expansion in den G-Rex mit Verbesserung Zytokine. Panel A zeigt die G-Rex-Gerät sowie CTL Auftritt auf dem Gas-Membran, durch Mikroskopie untersucht. Ein Vergleich zwischen Messsignaländerung in Konvention Gewebekultur behandelten Platten vs G-Rex erreicht wird ebenfalls angezeigt. Panel B zeigt die Häufigkeit von CMV-Pentamer positive CTL in Kulturen in der Gegenwart keine Zytokin, IL4 allein IL7 allein und IL4 + IL7 erweitert erreicht.
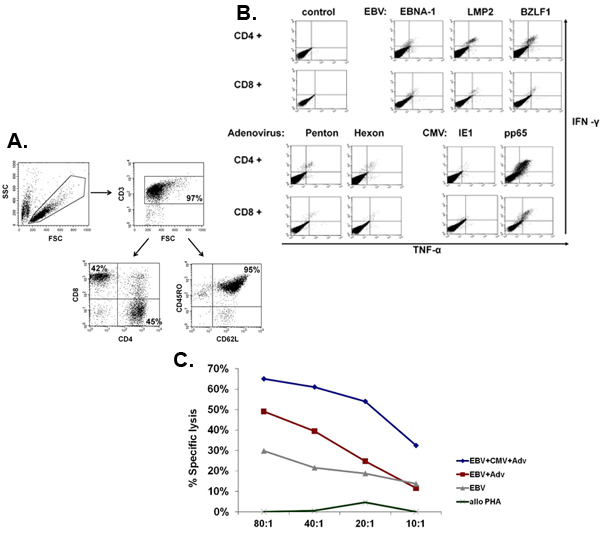
Abbildung 5. Phänotyp und Funktion erweitert CTL. Panel A zeigt ein repräsentatives Beispiel für den Phänotyp des erweiterten multivirus CTL, die polyklonale mit einer Mischung aus CD4 + (45% - Helfer) und CD8 + (42% - zytotoxische) T-Zellen, von denen die Mehrheit (95%) äußerte die Merker CD45RO + / CD62L +. Panel B zeigt, dass diese Zellen, die für alle die stimulierende Antigene sind und polyfunktionellen als durch intrazelluläre Zytokin-Färbung beurteilt, die Produktion von IFN &ggr; und TNF nach Antigen-Stimulation zu erkennen. Panel C zeigt, dass die erweiterte CTL funktional wie gemessen werden von Cr 51-Assay. Autologe LCL, entweder allein oder transduziert mit einem Null-Vektor oder einem adenoviralen Vektor, CMV-pp65 wurden als tar verwendetbekommt. Alloreaktivität wurde mittels allogener PHA Blasten als Ziel.
Diskussion
Virale Infektionen entfallen erhebliche Morbidität und Mortalität bei Patienten, die durch ihre Krankheit oder deren Behandlung immunsupprimierten. Nach HSCT, sind zum Beispiel Infektionen, die durch anhaltende Herpesviren wie EBV und CMV sowie durch respiratorische Viren wie Respiratory Syncytial Virus (RSV) hervorgerufen, bekannt, während die Bedeutung von Infektionen durch Adv, BK-Virus verursacht, und die menschliche Herpesvirus (HHV) -6 wurden in jüngerer Zeit gewürdigt worden. Während pharmakologische Wirkstoffe Standard-Therapie für einige Infektionen sind, haben sie erhebliche Nebenwirkungen erzeugen resistente Varianten, und sind häufig wirkungslos. Im Gegensatz dazu haben virus-spezifischen T-Zellen aus Stammzellen Spender stammen nachweislich sicher und wirksam für die Prävention und Behandlung von viralen Infektion oder Erkrankung in den blutbildenden Stammzellentransplantation (HSCT) Einstellung 2,5,6,18-21. Allerdings ist die breitere Umsetzung von T-Zell-Immuntherapie letztlich durch die Kosten, Komplexität und Zeit für CTL Produktion erforderliche Maß beschränkt.
Unsere neuartige und schnelle Annäherung an multivirus CTL, in der aktuellen Manuskript beschrieben, erzeugen sollte deutlich erhöhen die Machbarkeit von zytotoxischen T-Zell-Therapeutikum für Viruserkrankungen, so dass die Strategie zu einem Standard in der Versorgung der immungeschwächten Host geworden. Die Verwendung von Plasmid nucleofected DCs als APCs ermöglicht Antigen-Präsentation auf beiden MHC-Klasse I und II ohne Konkurrenz durch virale Vektoren oder auch von mehreren viralen Antigenen, die innerhalb einer einzelnen Zelle zum Ausdruck, da verschiedene DC-Populationen für jedes Plasmid 3 sind eingesetzt. Die Verwendung von IL-7.4 erhöht T-Zell-Überleben und die Proliferation, die entsprechend trägt zur Steigerung der Frequenz und des Repertoires zu reagieren Antigen-spezifischen T-Zellen 16,17. Schließlich, Kultur in der G-Rex drastisch reduziert T-Zell-Apoptose während der Kultur. Der Gasaustausch (O 2 und CO 2 in out) tritt über eine gasdurchlässige Silikonmembran am Boden der Flasche und verhindert Hypoxie und ermöglicht eine größere Tiefe des Mediums über den Zellen, die mehr Nährstoffe und Verdünnen Abfallprodukte. Diese Plattform kann auch zusätzliche Viren als wenn schützende Antigene identifiziert erweitert werden.
Offenlegungen
Danksagungen
Diese Arbeit wird von einer Produktion Assistance for Cellular Therapies (Vertrag NIH-NHLBI (HB-10 bis 03) HHSN26820100000C) (CMR), eine spezialisierte Zentren für Zell-basierten Therapie unterstützt Zuschuss NIH-NHLBI 1 U54 HL081007 (CMR), ein ASBMT Young Investigator Award (UG und JV), ein Leukemia and Lymphoma Society Special Fellow in Clinical Research Award (UG), und eine Amy Strelzer Manasevit Scholar Award (AML).
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
|---|---|---|---|
| CellGenix | CellGenix | 2005 | |
| IL4 | R + D Systems | 204-IL/CF | |
| IL7 | PeproTech | 200-15 | |
| Hyclone RPMI 1640 | Thermo Scientific | SH30096.01 | |
| Humanem AB-Serum | Tal Biomedical Inc. | HP1022 | |
| Nucleofector | Amaxa / Lonza | AAF-1001B & AAF-1001X | |
| Nucleofection Kit | Amaxa / Lonza | V4XP-3012 | |
| Plasmide | NTC | n / a | |
| GM-CSF | R & D | 215-GM/CF | |
| IL1 | R & D | 201-LB-025 | |
| IL6 | R & D | 206-IL-CF | |
| TNF | R & D | 210-TA-010 | |
| PGE2 | Sigma | P6532-1MG | |
| G-Rex | Wilson Wolf Fertigung | AY11-00027 |
Referenzen
- Kaka, A. S., Foster, A. E., Weiss, H. L., Rooney, C. M., Leen, A. M. Using dendritic cell maturation and IL-12 producing capacity as markers of function: a cautionary tale. J Immunother. 31, 359-369 (2008).
- Leen, A. M., Myers, G. D., Sili, U., Huls, M. H., Weiss, H., Leung, K. S., Carrum, G., Krance, R. A., Chang, C. C., Molldrem, J. J. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1166 (2006).
- Gerdemann, U., Christin, A. S., Vera, J. F., Ramos, C. A., Fujita, Y., Liu, H., Dilloo, D., Heslop, H. E., Brenner, M. K., Rooney, C. M., Leen, A. M. Nucleofection of DCs to generate Multivirus-specific T cells for prevention or treatment of viral infections in the immunocompromised host. Mol. Ther. 17, 1616-1625 (2009).
- Leen, A. M., Christin, A., Khalil, M., Weiss, H., Gee, A. P., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Identification of hexon-specific CD4 and CD8 T-cell epitopes for vaccine and immunotherapy. J Virol. 82, 546-554 (2008).
- Leen, A. M., Christin, A., Myers, G. D., Liu, H., Cruz, C. R., Hanley, P. J., Kennedy-Nasser, A. A., Leung, K. S., Gee, A. P., Krance, R. A., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Cytotoxic T lymphocyte therapy with donor T cells prevents and treats adenovirus and Epstein-Barr virus infections after haploidentical and matched unrelated stem cell transplantation. Blood. 114, 4283-4292 (2009).
- Feuchtinger, T., Matthes-Martin, S., Richard, C., Lion, T., Fuhrer, M., Hamprecht, K., Handgretinger, R., Peters, C., Schuster, F. R., Beck, R., Schumm, M., Lotfi, R., Jahn, G., Lang, P. Safe adoptive transfer of virus-specific T-cell immunity for the treatment of systemic adenovirus infection after allogeneic stem cell transplantation. Br J Haematol. 134, 64-76 (2006).
- Bunde, T., Kirchner, A., Hoffmeister, B., Habedank, D., Hetzer, R., Cherepnev, G., Proesch, S., Reinke, P., Volk, H. D., Lehmkuhl, H., Kern, F. Protection from cytomegalovirus after transplantation is correlated with immediate early 1-specific CD8 T cells. J. Exp. Med. 201, 1031-1036 (2005).
- Leen, A., Meij, P., Redchenko, I., Middeldorp, J., Bloemena, E., Rickinson, A., Blake, N. Differential immunogenicity of Epstein-Barr virus latent-cycle proteins for human CD4(+) T-helper 1 responses. J Virol. 75, 8649-8659 (2001).
- Bickham, K., Munz, C., Tsang, M. L., Larsson, M., Fonteneau, J. F., Bhardwaj, N., Steinman, R. EBNA1-specific CD4+ T cells in healthy carriers of Epstein-Barr virus are primarily Th1 in function. J. Clin. Invest. 107, 121-130 (2001).
- Straathof, K. C., Leen, A. M., Buza, E. L., Taylor, G., Huls, M. H., Heslop, H. E., Rooney, C. M., Bollard, C. M. Characterization of latent membrane protein 2 specificity in CTL lines from patients with EBV-positive nasopharyngeal carcinoma and lymphoma. J. Immunol. 175, 4137-4147 (2005).
- Hislop, A. D., Taylor, G. S., Sauce, D., Rickinson, A. B. Cellular responses to viral infection in humans: lessons from Epstein-Barr virus. Annu. Rev. Immunol. 25, 587-617 (2007).
- Steven, N. M., Annels, N. E., Kumar, A., Leese, A. M., Kurilla, M. G., Rickinson, A. B. Immediate early and early lytic cycle proteins are frequent targets of the Epstein-Barr virus-induced cytotoxic T cell response. J. Exp. Med. 185, 1605-1617 (1997).
- Luke, J., Carnes, A. E., Hodgson, C. P., Williams, J. A. Improved antibiotic-free DNA vaccine vectors utilizing a novel RNA based plasmid selection system. Vaccine. 27, 6454-6459 (2009).
- Williams, J. A., Luke, J., Johnson, L., Hodgson, C. pDNAVACCultra vector family: high throughput intracellular targeting DNA vaccine plasmids. Vaccine. 24, 4671-4676 (2006).
- Vera, J. F., Brenner, L. J., Gerdemann, U., Ngo, M. C., Sili, U., Liu, H., Wilson, J., Dotti, G., Heslop, H. E., Leen, A. M., Rooney, C. M. Accelerated production of antigen-specific T-cells for pre-clinical and clinical applications using Gas-permeable Rapid Expansion cultureware (G-Rex. Journal of Immunotherapy. , (2009).
- Vella, A. T., Dow, S., Potter, T. A., Kappler, J., Marrack, P. Cytokine-induced survival of activated T cells in vitro and in vivo. Proc. Natl. Acad. Sci. U. S. A. 95, 3810-3815 (1998).
- Vella, A., Teague, T. K., Ihle, J., Kappler, J., Marrack, P. Interleukin 4 (IL-4) or IL-7 prevents the death of resting T cells: stat6 is probably not required for the effect of IL-4. J. Exp. Med. 186, 325-330 (1997).
- Heslop, H. E., Ng, C., Li, Y. C., Smith, C., A, C., Loftin, S. K., Krance, R. A., Brenner, M. K., Rooney, C. M. Long-term restoration of immunity against Epstein-Barr virus infection by adoptive transfer of gene-modified virus-specific T lymphocytes. Nature Medicine. 2, 551-555 (1996).
- Rooney, C. M., Smith, C. A., Ng, C., Loftin, S. K., Li, C., Krance, R. A., Brenner, M. K., Heslop, H. E. Use of gene-modified virus-specific T lymphocytes to control Epstein-Barr virus-related lymphoproliferation. Lancet. 345, 9-13 (1995).
- Einsele, H., Roosnek, E., Rufer, N., Sinzger, C., Riegler, S., Loffler, J., Grigoleit, U., Moris, A., Rammensee, H. G., Kanz, L., Kleihauer, A., Frank, F., Jahn, G., Hebart, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916-3922 (2002).
- Walter, E. A., Greenberg, P. D., Gilbert, M. J., Finch, R. J., Watanabe, K. S., Thomas, E. D., Riddell, S. R. Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N. Engl. J. Med. 333, 1038-1044 (1995).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten