Method Article
Génération de cellules T spécifiques Multivirus pour prévenir / traiter les infections virales, après allogreffe de cellules souches hématopoïétiques
Dans cet article
Résumé
Un rapide, protocole simple et rentable pour la génération de donateurs issus multivirus des CTL spécifiques (rctl) pour perfusion à allogéniques greffe de cellules souches hématopoïétiques (HSCT) à risque de développer des infections à CMV, Adv ou EBV. Ce processus de fabrication est conforme aux BPF et devrait assurer la plus large mise en œuvre des cellules T immunothérapie delà des centres spécialisés.
Résumé
Les infections virales cause de morbidité et de mortalité dans allogreffe de cellules souches hématopoïétiques (HSCT). Nous et les autres ont réussi à produire et infusé cellules T spécifiques de virus d'Epstein Barr (EBV), le cytomégalovirus (CMV) et l'adénovirus (Adv) en utilisant les monocytes et transformés par l'EBV de cellules lymphoblastoïdes (LCL EBV) modifiées génétiquement avec un vecteur adénovirus comme cellules présentatrices d'antigènes (CPA). Aussi peu que 5 2x10 / kg trivirus-lymphocytes T cytotoxiques spécifiques (CTL) ont proliféré par plusieurs journaux après la perfusion et semblait prévenir et traiter les maladies virales graves, même résistants aux autres traitements disponibles. La plus large mise en œuvre de cette approche est encourageant limitée par les coûts de production élevés, la complexité de fabrication et le temps prolongé (4-6 semaines pour l'EBV LCL génération, et 4-8 semaines pour la fabrication de CTL - total 10-14 semaines) pour la préparation. Pour surmonter ces limitations, nous avons développé un nouveau GMP protocole de production de CTL. Tout d'abord, à la place de adénovecteurs pour stimuler les cellules T, nous utilisons des cellules dendritiques (CD) nucleofected avec l'ADN des plasmides codant LMP2, EBNA1 et BZLF1 (EBV), Hexon et Penton (ADV), et de pp65 et IE1 (CMV) en tant que présentatrice d'antigène cellules. Ces APC de réactiver les cellules T spécifiques pour tous les antigènes stimulant. Deuxièmement, la culture des lymphocytes T activés en présence d'IL-4 (1000 U / ml) et de l'IL-7 (10ng/ml) augmente et soutient le répertoire et la fréquence des cellules T spécifiques dans nos lignes. Troisièmement, nous avons utilisé un nouveau dispositif de gaz à la culture perméable (G-Rex) qui favorise l'expansion et la survie d'un nombre à grandes cellules après une stimulation unique, éliminant ainsi l'exigence de l'EBV et LCL en réduisant l'intervention de technicien. En mettant en œuvre ces changements, nous pouvons maintenant produire CTL multispécifiques ciblant EBV, CMV, et Adv à un coût par 10 6 cellules qui est réduit par> 90%, et en seulement 10 jours plutôt que 10 semaines en utilisant une approche qui peut être étendue à d'autres protection des antigènes viraux. Notre approuvé par la FDA approche doit être de valeur pour les applications prophylactiques et le traitement pour les bénéficiaires de risque élevé GCSH allogénique.
Protocole
1. Nucléofection DC
- Récolte dérivées de monocytes PED, qui ont été enrichies avec l'adhésion de plastique, cultivées pendant 5 jours à l'aide de cellules-Genix-sur des milieux supplémentés avec IL4 (1000U/ml), GMCSF (800IU/ml) et encore mûri pendant 24h en utilisant les cytokines IL4 maturation des DC (1000U / ml), GMCSF (800IU/ml), IL6100ng/ml, le TNF-α 10ng/ml, IL1-β 10ng/ml et la PGE2 (1μg/ml) 1, par resuspension doux avec une pipette 3 ml.
- Comptez PED viables en utilisant le bleu trypan, le transfert dans des tubes 15ml 3x avec pas moins de 6 0.5x10 et pas plus de 2x10 6 cellules / tube.
- Centrifuger les PED pour les 10mins @ 200g. Pendant ce temps préchauffer cellulaire Genix des milieux supplémentés avec les cytokines maturation des DC (médias maturation des DC) - 2ml/well dans trois puits d'une culture de tissus de 12 puits dans une plaque de traiter 37 ° C / 5% de CO 2 incubateur.
- Une fois que les cellules ont fini de filage, aspirer le surnageant et ajouter des plasmides d'ADN correspondant à chacun des tubes dans une concentration finale de 5 pg d'ADN / tube. Dans ce cas, ajoutez le plasmide codant pour IE1-pp65 au tube n ° 1, Hexon-Penton au tube n ° 2, et EBNA1-LMP2-BZLF1 au tube n ° 3.
- Resuspendre PED et l'ADN avec 100 pi de solution de nucloefection Amaxa, bien mélanger et transférer les cuvettes nucléofection.
- Cuvettes place dans le Nucleofector 4D, choisissez le programme CB150 (Amaxa / Lonza), et appuyez sur Start.
- Immédiatement après nucléofection ajouter 500μl de 2ml préchauffé médias Genix cellulaire maturation des DC dans la cuvette, mélanger doucement par aspiration et refoulement 2-3 fois, et le transfert PED nucleofected le prêt de 12 puits plaque contenant le reste de 1,5 ml de préchauffée les médias maturation des DC. Transfert à la 37 ° C / 5% de CO 2 incubateur pour un autre 12-18hrs.
2. Stimulation des cellules T
- Récolte et de compter les PED nucleofected, et irradier au 30 Gy. Laver une fois avec 10ml de milieu CTL (45% du RPMI, 45% Clics EHAA, 10% de FBS, 2mM Glutamax) et resuspendre @ 3 x 10 5 PED par ml de médias CTL.
- Piscine un minimum de 5 7.5x10 (2.5ml) et un maximum de 15x10 5 (5 ml) contenant des PED chacun des plasmides et de transférer les PED en commun à l'appareil G-Rex qui seront ensuite placés dans l'incubateur.
- Pour la préparation des cellules répondeuses utiliser soit CMSP préalablement congelé ou non adhérente des cellules mononucléées qui restent après la sélection DC (adhésion ou CD14 sélection). Décongeler les cellules, le transfert d'un milieu de culture préchauffée, se laver une fois avec les médias CTL. Resuspendre les cellules dans les médias CTL, compter les cellules et les amener à une concentration de 2x10 6 cellules par ml. Prenez 15x10 6 cellules ou 7,5 ml et compléter avec 30000U IL4 (1000U/ml -. Concentration finale) et 300ng IL7 (10ng/ml - conc finale.).
- Transfert 7,5 ml de PBMC (15x10 6 cellules) pour le G-Rex et compléter le bioréacteur avec les médias de CTL à un volume total de 30ml.
- Culture du G-Rex pendant 6-7 jours dans un 37 ° C / 5% de CO 2 incubateur humidifié.
3. L'expansion des cellules T
- Le jour de 6-7, 10ml aspiration des médias, puis mélanger les cellules dans le reste de 20ml médias avec une pipette de 10ml et de compter les cellules viables en utilisant du bleu trypan. S'il ya <50x10 6 reconstituer avec les médias frais + cytokines. S'il ya> 50x10 6 cellules retirer 10ml de suspension cellulaire, le transfert à un nouveau G-Rex, puis nourrir les deux G-Rexs avec Fresh Media CTRL + cytokines.
- Culture pour une 4-6 jours supplémentaires. Une fois que suffisamment de cellules ont été élargis, effectuer la caractérisation phénotypique et fonctionnelle de l'excès de CTL et cryoconserver pour une utilisation future.
4. Les résultats représentatifs:
Un schéma de notre approuvé par la FDA multivirus spécifique processus de génération de CTL est montré dans la figure 1. Contrairement à la convention multivirus protocoles CTL qui utilisent adénovecteurs et EBV-LCL pour stimuler le virus réactive les cellules T 2, nous avons remplacé matériel viral infectieux avec des plasmides d'ADN qui codent des antigènes multiples issus de chacun des trois virus. Pour stimuler CTL trivirus nous avons conçu trois multicistroniques plasmides codant Hexon et Penton de l'adénovirus, IE1 et pp65 du CMV, et EBNA1, LMP2, et BZLF1 de l'EBV. Ces antigènes ont été choisis sur la base des résultats cliniques encourageants de notre propre et d'autres groupes qui montrent que les cellules T dirigées contre ADV-hexon et penton 2,4-6, et à CMV-1E1 et à CMV pp65 sont protecteurs in vivo 7. Pour l'EBV, EBNA1 est un CD4 + antigène T immunodominant cellule cible exprimée dans toutes les tumeurs malignes associées à l'EBV et dans les cellules normales B EBV-infectés 8,9, LMP2 est immunogène pour tous les types HLA multiples et exprimée dans la plupart des tumeurs malignes EBV, 10,11 tandis BZLF1 encode une immunodominants, immédiate antigène précoce du cycle lytique qui stimule à la fois CD4 + et CD8 + T de la plupart des individus et est probablement important pour la coopérationntrol de cellules répliquant le virus 12. Pour optimiser encore davantage nos méthodes de fabrication, nous avons collaboré avec la technologie de la nature qui a généré minimisée, sans antibiotique (conforme FDA) pour la stimulation de CTL plasmides 13,14. En utilisant cette stratégie nous avons constamment réaliser des économies d'nucléofection> 35% tout en maintenant la viabilité cellulaire élevée (données non présentées) 3. La figure 2 montre que la fréquence des cellules T spécifiques du virus en réponse à des plasmides d'ADN optimisée telle que mesurée par IFN ELISPOT, était supérieure qu'en réponse à des plasmides d'expression conventionnels pShuttle basé exprimant les mêmes antigènes (n = 8 adénovirus, CMV n = 4 et n = 2 EBV). Le ratio optimal de DC: PBMC était important pour la stimulation des cellules T puissants comme le montre la figure 3, où un ratio de 01:50 produite sous-optimale par rapport à une activation 01:20 S: ratio R (n = 2 donneurs). Production de nombres suffisants CTL avec une spécificité d'antigène large est un pré-requis pour l'efficacité clinique contre les trois virus. Ce résultat est obtenu par la culture CTL dans le G-Rex, qui soutient l'expansion des cellules T supérieure par rapport aux traditionnels des plaques 24 puits (figure 4A) 15, alors que l'addition d'IL4 et IL7 à des augmentations des cultures et la spécificité du répertoire comme le montre la figure 4B où la fréquence des cellules T réactives contre le CMV pp65-dérivés de HLA-A2 resticted NLV peptide a été évaluée dans des cultures produites dans la présence ou l'absence d'IL4 et / ou IL7 16,17. Pour évaluer la capacité phénotype et fonctionnelle des cellules élargi que nous effectuons une analyse de cytométrie en flux, cytokines intracellulaires coloration / IFN ELISPOT, et des essais Cr communiqué 51 sur le produit final pour la cryoconservation / perfusion. Généralement, les cellules générées sont polyclonaux avec une population mixte de cellules CD4 + et CD8 + T avec l'antigène de spécificité détectable dans les deux compartiments cellulaires T. Les CTL sont capables de tuer exprimant l'antigène viral des cellules cibles du virus, mais pas négative partiellement HLA cibles appariés, ce qui indique qu'ils ne doivent pas induire une réaction du greffon contre l'hôte (GvHD) in vivo (figure 5).
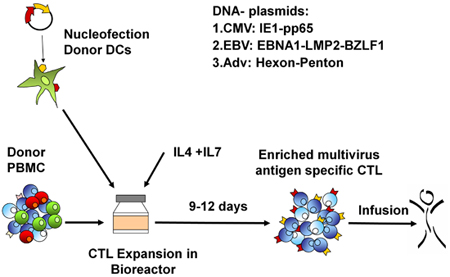
Figure 1. Protocole de génération de rctl. Tout d'abord, les PED sont nucleofected avec les antigènes viraux plasmides codant et ensuite mélangés avec des PBMC autologues à un R: S de 10 ou 20h01. Les cellules sont développées dans le G-Rex pendant 10-14 jours, en présence d'IL4 et IL7, puis récoltées, comptées, testé pour la fonction, l'identité et la stérilité, et ensuite cryoconservés pour une utilisation clinique.

Figure 2. Plasmides d'ADN optimisée induisent supérieure activation des cellules T in vitro. PED ont été optimisés avec nucleofected, conformes à la FDA Hexon plasmides codant et Penton (ADV), IE1 et pp65 (CMV), et EBNA1, LMP2, et BZLF1 (EBV) ou les plasmides pShuttle conventionnels codant pour les antigènes mêmes. Ils ont été utilisés pour stimuler les cellules T et la spécificité a été analysée par ELISPOT IFN 10 jours post-stimulation.
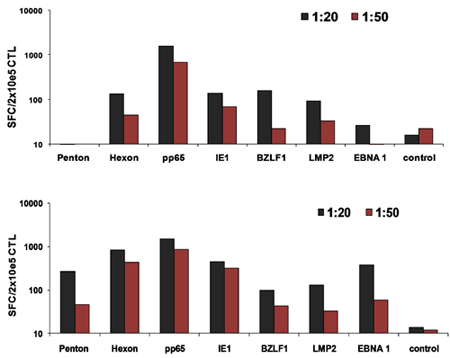
Figure 3 DC optimale:. Ratios des lymphocytes T pour l'activation de CTL. PED à partir de 2 donneurs ont été nucleofected avec les trois plasmides optimisée et ensuite utilisé pour stimuler les PBMC autologues à 1:20 ou 1:50 DC: ratio de PBMC. La fréquence des cellules T réactivé a été évaluée sur 10 jours par IFN ELISPOT.
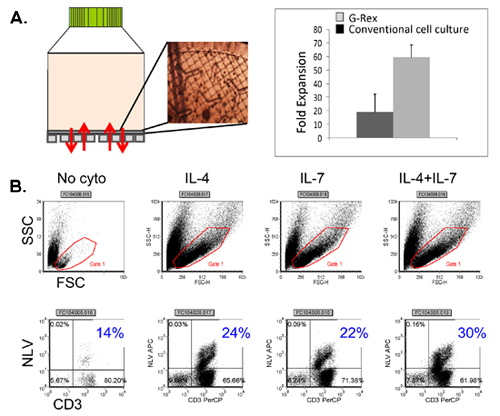
Figure 4. Expansion des cellules T dans le G-Rex en utilisant des cytokines amélioration. Le panneau A montre l'appareil G-Rex ainsi que l'apparence de CTL sur la membrane perméable au gaz, évaluée par microscopie. Une comparaison entre la production de cellules obtenus en culture tissulaire Convention traitées plaques vs G-Rex est également représentée. Groupe B montre la fréquence du CMV pentamère CTL positifs obtenus dans les cultures élargi, en présence de cytokines pas, IL4 seul, seul et IL7 IL4 + IL7.
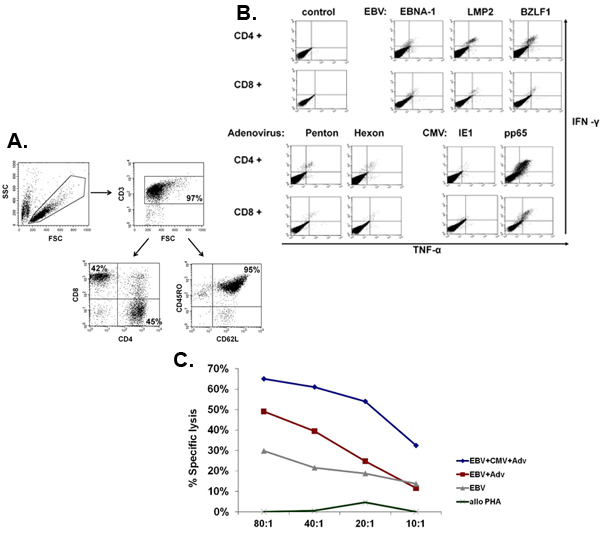
Figure 5. Phénotype et la fonction des CTL élargi. Le panneau A montre un exemple représentatif du phénotype de l'CTL élargi multivirus, qui sont polyclonaux avec un mélange de cellules CD4 + (45% - helper) et CD8 + (42% - cytotoxiques) des cellules T, dont la majorité (95%) ont exprimé le la mémoire de marqueur CD45RO + / CD62L +. panneau B montre que ces cellules sont spécifiques pour tous les antigènes stimulant et sont polyfonctionnels évaluée par coloration des cytokines intracellulaires pour détecter la production d'IFNy et TNF après stimulation antigénique. panneau C montre que les CTL élargi sont fonctionnels tels que mesurés par Cr 51 dosage. LCL autologues, soit seule ou transduites avec un vecteur nul ou un vecteur adénoviral exprimant CMV pp65 ont été utilisés comme du goudronobtient. Alloréactivité été évaluée en utilisant allogéniques explosions PHA comme une cible.
Discussion
Les infections virales représentent une morbidité et une mortalité importantes chez les patients qui sont immunodéprimés par leur maladie ou son traitement. Après HSCT, par exemple, les infections causées par les herpèsvirus persistants tels que l'EBV et le CMV, ainsi que par des virus respiratoires comme le virus respiratoire syncytial (VRS), sont bien connus, tandis que l'importance des infections causées par Adv, virus BK, et humain herpesvirus (HHV) -6 ont plus récemment été appréciée. Alors que les agents pharmacologiques sont le traitement standard pour certaines infections, ils ont des toxicités importantes, de générer des variants résistants, et sont souvent inefficaces. En revanche, les cellules T spécifiques du virus provenant de donneurs de cellules souches se sont avérés sûrs et efficaces pour la prévention et le traitement de l'infection virale ou une maladie de la greffe de cellules souches hématopoïétiques (HSCT) la mise en 2,5,6,18-21. Cependant, la mise en œuvre plus large de l'immunothérapie cellulaire T est finalement limitée par le coût, la complexité et le temps requis pour la production de CTL.
Notre approche nouvelle et rapide de générer des CTL multivirus, décrite dans le manuscrit en cours, devrait accroître considérablement la faisabilité de la thérapie cellulaire T cytotoxique pour les maladies virales, permettant à la stratégie visant à devenir une norme de soins pour l'hôte immunodéprimé. L'utilisation de plasmide PED nucleofected comme APC permet la présentation des antigènes sur les deux CMH de classe I et II, sans la concurrence des vecteurs viraux ou bien à partir de multiples antigènes viraux exprimés dans une cellule unique, depuis les différentes populations DC sont utilisés pour chacune des 3 plasmide. L'utilisation de l'IL-4 / 7 augmente la survie des cellules T et la prolifération, qui permet une augmentation correspondante de la fréquence et le répertoire de réponse spécifique de l'antigène des cellules T 16,17. Enfin, la culture des pays du G-Rex réduit considérablement l'apoptose des cellules T au cours de la culture. Les échanges gazeux (O 2 et de CO 2 dans la sortie) se produit à travers une membrane de silicium perméables au gaz, à la base du flacon, ce qui empêche l'hypoxie, tout en permettant une plus grande profondeur de milieu au-dessus des cellules, fournissant plus de nutriments et de diluer les déchets. Cette plate-forme peut aussi être étendu à d'autres virus comme lorsque des antigènes protecteurs ont été identifiés.
Déclarations de divulgation
Remerciements
Ce travail est soutenu par une aide à la production pour les thérapies cellulaires (contrat NIH-NHLBI (HB-10-03) HHSN26820100000C) (CMR), un des centres spécialisés pour thérapie cellulaire subvention du NIH-NHLBI 1 U54 HL081007 (CMR), une ASBMT Young Investigator Award (UG et JV), Fellow Société de leucémie et de lymphome spécial de bourses de recherche clinique (UG), et un prix Amy Strelzer Scholar Manasevit (LAM).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
|---|---|---|---|
| CellGenix | CellGenix | 2005 | |
| IL4 | R + D Systems | 204-IL/CF | |
| IL7 | Peprotech | 200-15 | |
| Hyclone RPMI 1640 | Thermo Scientific | SH30096.01 | |
| Sérum humain AB | Vallée Biomedical Inc | HP1022 | |
| Nucleofector | Amaxa / Lonza | AAF-1001B & AAF-1001X | |
| Kit nucléofection | Amaxa / Lonza | V4XP-3012 | |
| Les plasmides | NTC | n / a | |
| GM-CSF | R & D | 215-GM/CF | |
| IL1 | R & D | 201-LB-025 | |
| IL6 | R & D | 206-IL-FC | |
| TNF | R & D | 210-TA-010 | |
| PGE2 | Sigma | P6532-1MG | |
| G-Rex | Wilson Loup fabrication | AY11-00027 |
Références
- Kaka, A. S., Foster, A. E., Weiss, H. L., Rooney, C. M., Leen, A. M. Using dendritic cell maturation and IL-12 producing capacity as markers of function: a cautionary tale. J Immunother. 31, 359-369 (2008).
- Leen, A. M., Myers, G. D., Sili, U., Huls, M. H., Weiss, H., Leung, K. S., Carrum, G., Krance, R. A., Chang, C. C., Molldrem, J. J. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1166 (2006).
- Gerdemann, U., Christin, A. S., Vera, J. F., Ramos, C. A., Fujita, Y., Liu, H., Dilloo, D., Heslop, H. E., Brenner, M. K., Rooney, C. M., Leen, A. M. Nucleofection of DCs to generate Multivirus-specific T cells for prevention or treatment of viral infections in the immunocompromised host. Mol. Ther. 17, 1616-1625 (2009).
- Leen, A. M., Christin, A., Khalil, M., Weiss, H., Gee, A. P., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Identification of hexon-specific CD4 and CD8 T-cell epitopes for vaccine and immunotherapy. J Virol. 82, 546-554 (2008).
- Leen, A. M., Christin, A., Myers, G. D., Liu, H., Cruz, C. R., Hanley, P. J., Kennedy-Nasser, A. A., Leung, K. S., Gee, A. P., Krance, R. A., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Cytotoxic T lymphocyte therapy with donor T cells prevents and treats adenovirus and Epstein-Barr virus infections after haploidentical and matched unrelated stem cell transplantation. Blood. 114, 4283-4292 (2009).
- Feuchtinger, T., Matthes-Martin, S., Richard, C., Lion, T., Fuhrer, M., Hamprecht, K., Handgretinger, R., Peters, C., Schuster, F. R., Beck, R., Schumm, M., Lotfi, R., Jahn, G., Lang, P. Safe adoptive transfer of virus-specific T-cell immunity for the treatment of systemic adenovirus infection after allogeneic stem cell transplantation. Br J Haematol. 134, 64-76 (2006).
- Bunde, T., Kirchner, A., Hoffmeister, B., Habedank, D., Hetzer, R., Cherepnev, G., Proesch, S., Reinke, P., Volk, H. D., Lehmkuhl, H., Kern, F. Protection from cytomegalovirus after transplantation is correlated with immediate early 1-specific CD8 T cells. J. Exp. Med. 201, 1031-1036 (2005).
- Leen, A., Meij, P., Redchenko, I., Middeldorp, J., Bloemena, E., Rickinson, A., Blake, N. Differential immunogenicity of Epstein-Barr virus latent-cycle proteins for human CD4(+) T-helper 1 responses. J Virol. 75, 8649-8659 (2001).
- Bickham, K., Munz, C., Tsang, M. L., Larsson, M., Fonteneau, J. F., Bhardwaj, N., Steinman, R. EBNA1-specific CD4+ T cells in healthy carriers of Epstein-Barr virus are primarily Th1 in function. J. Clin. Invest. 107, 121-130 (2001).
- Straathof, K. C., Leen, A. M., Buza, E. L., Taylor, G., Huls, M. H., Heslop, H. E., Rooney, C. M., Bollard, C. M. Characterization of latent membrane protein 2 specificity in CTL lines from patients with EBV-positive nasopharyngeal carcinoma and lymphoma. J. Immunol. 175, 4137-4147 (2005).
- Hislop, A. D., Taylor, G. S., Sauce, D., Rickinson, A. B. Cellular responses to viral infection in humans: lessons from Epstein-Barr virus. Annu. Rev. Immunol. 25, 587-617 (2007).
- Steven, N. M., Annels, N. E., Kumar, A., Leese, A. M., Kurilla, M. G., Rickinson, A. B. Immediate early and early lytic cycle proteins are frequent targets of the Epstein-Barr virus-induced cytotoxic T cell response. J. Exp. Med. 185, 1605-1617 (1997).
- Luke, J., Carnes, A. E., Hodgson, C. P., Williams, J. A. Improved antibiotic-free DNA vaccine vectors utilizing a novel RNA based plasmid selection system. Vaccine. 27, 6454-6459 (2009).
- Williams, J. A., Luke, J., Johnson, L., Hodgson, C. pDNAVACCultra vector family: high throughput intracellular targeting DNA vaccine plasmids. Vaccine. 24, 4671-4676 (2006).
- Vera, J. F., Brenner, L. J., Gerdemann, U., Ngo, M. C., Sili, U., Liu, H., Wilson, J., Dotti, G., Heslop, H. E., Leen, A. M., Rooney, C. M. Accelerated production of antigen-specific T-cells for pre-clinical and clinical applications using Gas-permeable Rapid Expansion cultureware (G-Rex. Journal of Immunotherapy. , (2009).
- Vella, A. T., Dow, S., Potter, T. A., Kappler, J., Marrack, P. Cytokine-induced survival of activated T cells in vitro and in vivo. Proc. Natl. Acad. Sci. U. S. A. 95, 3810-3815 (1998).
- Vella, A., Teague, T. K., Ihle, J., Kappler, J., Marrack, P. Interleukin 4 (IL-4) or IL-7 prevents the death of resting T cells: stat6 is probably not required for the effect of IL-4. J. Exp. Med. 186, 325-330 (1997).
- Heslop, H. E., Ng, C., Li, Y. C., Smith, C., A, C., Loftin, S. K., Krance, R. A., Brenner, M. K., Rooney, C. M. Long-term restoration of immunity against Epstein-Barr virus infection by adoptive transfer of gene-modified virus-specific T lymphocytes. Nature Medicine. 2, 551-555 (1996).
- Rooney, C. M., Smith, C. A., Ng, C., Loftin, S. K., Li, C., Krance, R. A., Brenner, M. K., Heslop, H. E. Use of gene-modified virus-specific T lymphocytes to control Epstein-Barr virus-related lymphoproliferation. Lancet. 345, 9-13 (1995).
- Einsele, H., Roosnek, E., Rufer, N., Sinzger, C., Riegler, S., Loffler, J., Grigoleit, U., Moris, A., Rammensee, H. G., Kanz, L., Kleihauer, A., Frank, F., Jahn, G., Hebart, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916-3922 (2002).
- Walter, E. A., Greenberg, P. D., Gilbert, M. J., Finch, R. J., Watanabe, K. S., Thomas, E. D., Riddell, S. R. Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N. Engl. J. Med. 333, 1038-1044 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon