Method Article
דור Multivirus ספציפיים תאים T כדי למנוע / לטפל זיהומים נגיפיים לאחר השתלת allogeneic תא גזע hematopoietic
In This Article
Summary
פרוטוקול מהיר, פשוט וחסכוני עבור הדור של התורם הנגזרות multivirus ספציפי ההרג (rCTL) עבור עירוי כדי allogeneic hematopoietic בתאי גזע להשתלה (HSCT) מקבלי בסיכון לפתח זיהומים CMV, עו"ד או EBV. תהליך הייצור GMP תואמי וצריך להבטיח את יישום רחב יותר של חיסוני T-cell מעבר במרכזים מיוחדים.
Abstract
זיהומים נגיפיים גורם התחלואה והתמותה ב allogeneic השתלת תא גזע hematopoietic (HSCT) לנמענים. אנו ואחרים יצרו בהצלחה חדורים T-תאים ספציפיים עבור אפשטיין בר וירוס (EBV), ציטומגלווירוס (CMV) ו adenovirus (עו"ד) באמצעות ומונוציטים ו-EBV הפך לתא lymphoblastoid (EBV-LCL) גנים שונה עם וקטור adenovirus כמו הצגת אנטיגן תאים (נגמ"שים). כמה כמו 2x10 5 / ק"ג trivirus ספציפי לימפוציטים מסוג T ציטוטוקסיים (CTL) התרבו ידי יומני ספורים לאחר עירוי ונראה למנוע ולטפל במחלה ויראלית קשה אפילו עמידים לטיפולים זמינים אחרים. יישום רחב יותר של גישה זו מעודדת מוגבל על ידי עלויות ייצור גבוהות, המורכבות של ייצור זמן ממושך (4-6 שבועות לדור EBV-LCL, ו 4-8 שבועות לייצור CTL - סך הכל 10-14 שבועות) להכנה. כדי להתגבר על המגבלות האלה פיתחנו חדש, GMP תואם פרוטוקול ייצור CTL. ראשית, במקום adenovectors לעורר מתאי T אנו משתמשים תאים דנדריטים (DCS) nucleofected עם DNA פלסמידים קידוד LMP2, EBNA1 ו BZLF1 (EBV), Hexon ו פנטון (עו"ד), ו pp65 ו IE1 (CMV) כמו הצגת אנטיגן תאים. נגמ"שים אלה מחדש בתאי T ספציפיים עבור כל גירוי אנטיגנים. תרבות שנית, של הפעלת מתאי T בנוכחות של IL-4 (1000 U / ml) ו-IL-7 (10ng/ml) מגדילה ומקיים את הרפרטואר ותדירות שתאי T ספציפיים הקווים שלנו. שלישית, השתמשנו במכשיר חדש, גז תרבות חדיר (G-Rex) שמקדם את הרחבת והישרדות של מספרים גדולים לאחר גירוי תא יחיד, ובכך להסיר את הדרישה EBV-LCLS וצמצום התערבות טכנאי. על ידי יישום השינויים האלה אנחנו יכולים עכשיו לייצר CTL multispecific מיקוד EBV, CMV, ועו"ד במחיר 10 דולר 6 תאים הוא מופחת על ידי 90%>, וב רק 10 ימים ולא 10 שבועות באמצעות גישה זו ניתן להרחיב נוספים אנטיגנים נגיפיים מגן. גישת ה-FDA שלנו צריך להיות בעל ערך עבור יישומים מניעתי וטיפול בסיכון גבוה מקבלי allogeneic HSCT.
Protocol
1. DC nucleofection
- מונוציטים הנגזרות קציר DCs, אשר היו מועשר באמצעות דבקות פלסטיק, בתרבית במשך 5 ימים באמצעות Cell Genix מדיה בתוספת IL4 (1000U/ml), GMCSF (800IU/ml) ו התבגר נוספת 24hrs באמצעות ציטוקינים התבגרות DC IL4 (1000U / ml), GMCSF (800IU/ml), IL6100ng/ml, TNF-α 10ng/ml, IL1-β 10ng/ml ו PGE2 (1μg/ml) 1, על ידי resuspension עדין עם טפטפת העברת 3ml.
- הרוזן DCs קיימא באמצעות trypan כחול, העברה לתוך צינורות 15ml 3x עם לא פחות מ 0.5x10 6 ולא יותר מ 2x10 6 תאים / צינור.
- צנטריפוגה DCs עבור 10mins @ 200 גרם. במהלך הזמן הזה מראש חם Cell Genix התקשורת השלים עם ציטוקינים התבגרות DC (DC התקשורת התבגרות) - 2ml/well בשלוש בארות התרבות 12-באר רקמות שטופלו צלחת 37 ° C / 5% CO 2 באינקובטור.
- ברגע שסיימת תאים ספינינג, לשאוב supernatant ולהוסיף את פלסמידים DNA רלוונטי לכל אחד הצינורות בריכוז סופי של ה-DNA צינור 5μg /. במקרה זה להוסיף את הקידוד פלסמיד IE1-pp65 לצינור מס '1, Hexon-פנטון על צינור מס' 2, ו-EBNA1 LMP2-BZLF1 אל צינור # 3.
- Resuspend DCs ו-DNA עם 100μl של פתרון nucloefection Amaxa, מערבבים היטב ומעבירים את cuvettes nucleofection.
- Cuvettes מקום nucleofector 4D, לבחור תוכנית CB150 (Amaxa / Lonza), ולחץ להתחיל.
- מיד לאחר nucleofection להוסיף 500μl של 2ml מראש חימם Cell Genix DC התקשורת התבגרות כדי קובט, מערבבים בעדינות על ידי pipetting למעלה ולמטה 2-3 פעמים, DCs nucleofected להעביר לצלחת 12 גם מוכן המכיל את הנותרים 1.5 מ"ל של prewarmed DC התקשורת התבגרות. העברה של 37 ° C / 5% CO 2 חממה נוספת 12-18hrs.
2. גירוי תא T
- קציר ולספור DCs nucleofected ו מקרינים על 30Gy. לשטוף פעם אחת עם 10 מ"ל של מדיום CTL (45% RPMI, קליקים EHAA 45%, 10% FBS, 2mm Glutamax) ו resuspend @ 3 x 10 5 DCs לכל מ"ל של התקשורת CTL.
- בריכת מינימום של 7.5x10 5 (2.5ml) ועד למקסימום של 15x10 5 (5 מ"ל) של DCs המכילות כל אחת פלסמידים ולהעביר את DCs נקווה למכשיר ה-G-Rex, אשר לאחר מכן ניתן יהיה להציב בחממה.
- להכנת תאים המגיב להשתמש גם PBMCs קפוא בעבר או לא חסיד mononuclear התאים שנותרו לאחר הבחירה DC (או דבקות CD14 מבחר). להפשיר את התאים, להעביר בינוני תרבות prewarmed, לשטוף פעם עם התקשורת CTL. Resuspend התאים מדיה CTL, לספור את התאים ולהביא אותם בריכוז של 2x10 6 תאים לכל מיליליטר. קח 15x10 6 תאים או 7.5ml ולהשלים עם 30000U IL4 (1000U/ml -. קונצרט כלשהו סופי) ו 300ng IL7 (10ng/ml - קונצרט כלשהו הסופי.).
- העברת 7.5ml של PBMC (15x10 6 תאים) ל-G-רקס למעלה למעלה bioreactor עם התקשורת CTL כדי בהיקף כולל של 30 מ"ל.
- תרבות ה-G-Rex במשך 6-7 ימים 37 ° C / 5% CO 2 באינקובטור humidified.
3. T הרחבת התא
- ביום 6-7, 10 מ"ל לשאוב התקשורת, ואז לערבב את התאים הנותרים 20ml של התקשורת עם פיפטה 10 מ"ל ו לספור תאים קיימא באמצעות trypan כחול. אם יש <50x10 6 לחדש עם התקשורת + ציטוקינים טריים. אם יש> 50x10 6 תאים להסיר 10ml ההשעיה התא, העברה חדשה G-Rex, ולאחר מכן להאכיל גם G-Rexs עם התקשורת CTL + ציטוקינים טריים.
- התרבות 4-6 ימים נוספים. לאחר מספיק תאים הורחבו, לבצע אפיון פנוטיפי ופונקציונלי של עודף CTL ו cryopreserve לשימוש עתידי.
4. נציג תוצאות:
סכמטי של תהליך ה-FDA multivirus הספציפי שלנו דור CTL מוצג באיור 1. בניגוד לאמנה פרוטוקולים multivirus CTL אשר השימוש adenovectors EBV ו-LCL לעורר וירוס-reactive בתאי T 2 יש לנו להחליף חומר וירוס מדבק עם פלסמידים DNA המקודדים אנטיגנים רבים שמקורם בכל אחת וירוסים 3. כדי לעורר CTL trivirus עיצבנו three multicistronic פלסמידים קידוד Hexon ו פנטון של adenovirus, IE1 ו pp65 של CMV, ו EBNA1, LMP2 ו BZLF1 של EBV. אנטיגנים אלה נבחרו בהתבסס על תוצאות מעודדות הקליניים של שלנו ושל קבוצות אחרות מראים כי תאי T המכוונים נגד עו"ד hexon ו-פנטון 2,4-6, וכדי CMV-1E1 ו CMV-pp65 הם המגן in vivo 7. עבור EBV, EBNA1 היא מסוג CD4 + immunodominant היעד תא T אנטיגן לידי ביטוי בכל EBV הקשורים ממאירות וכן EBV נגועים בתאים נורמליים B 8,9, LMP2 הוא immunogenic בין סוגי HLA מרובים לידי ביטוי ממאירות EBV ביותר, בעוד 10,11 BZLF1 מקודד immunodominant, אנטיגן מיידית מוקדם במחזור ממס מגרה הן מסוג CD4 + ו - CD8 + T תאים מרוב יחידים חשוב סביר לדוntrol של תאים שכפול הנגיף 12. כדי להמשיך לייעל את שיטות הייצור שלנו אנו פעולה עם טכנולוגיה הטבע שיצר minimalized, ללא אנטיביוטיקה (FDA תואמי) פלסמידים לגירוי CTL 13,14. באמצעות אסטרטגיה זו אנו בעקביות להשיג יעילות של 35% nucleofection> תוך שמירה על כדאיות התא גבוה (מידע לא מוצג) 3. איור 2 מראה כי שכיחותה של וירוס ספציפי בתאי T בתגובה פלסמידים DNA אופטימיזציה כפי שנמדד על ידי IFNγ ELIspot, היה גדול יותר מ בתגובה pShuttle מבוססי פלסמידים קונבנציונאלי ביטוי המבטא את אנטיגנים זהה (n = 8 adenovirus, n = 4 CMV, ו n = 2 EBV). יחס אופטימלי של DC: PBMC היה חשוב גירוי חזק תא T כפי שמוצג באיור 3 שם יחס של 1:50 המיוצר תת אופטימלית ההפעלה לעומת 1:20 S: יחס R (n = 2 תורמים). הפקה של מספרים CTL מספיק עם סגוליות אנטיגן רחב הוא תנאי מוקדם עבור יעילות קלינית כנגד כל שלושת וירוסים. זו מושגת על ידי תרבות CTL ב-G-Rex, התומך תא מעולה הרחבה T לעומת 24 גם צלחות קונבנציונאלי (איור 4 א) 15, תוך תוספת של IL4 ו IL7 לעליות תרבויות הרפרטואר וספציפיות כפי שמוצג באיור 4B איפה את תדירות בתאי T תגובתי נגד CMV-pp65-derived HLA-A2 resticted NLV פפטיד הוערך בתרבויות שנוצר נוכחות או היעדר של IL4 ו / או IL7 16,17. כדי להעריך את היכולת פנוטיפ תפקודית של תאים מורחבת אנו מבצעים ניתוח תזרים cytometric, תאיים מכתים / IFNγ ציטוקינים ELIspot, Cr ו - 51 מבחני שחרור על המוצר הסופי עבור cryopreservation / חליטה. בדרך כלל התאים שנוצרו הם polyclonal עם אוכלוסייה מעורבת של CD4 + ו - CD8 + T תאים עם סגוליות-אנטיגן להבחין בשני תאים תא T. CTL מסוגלים להרוג אנטיגן נגיפי לבטא בתאי המטרה, אך לא וירוס שלילית חלקית HLA יעדים מתאימים, המציין כי הם לא צריכים לגרום השתל נגד מארח מחלה (GVHD) in vivo (איור 5).
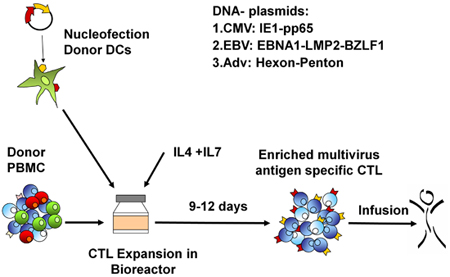
באיור 1. בפרוטוקול rCTL דור. ראשית, הם DCs nucleofected עם אנטיגן קידוד פלסמידים ויראלי ולאחר מכן מעורבב עם PBMCs עצמיים ב-R: S של 10 או 20:01. תאים הם התרחבו ב-G-Rex במשך 10-14 ימים בנוכחות IL4 ו IL7, שנקטפו אז, נספר, נבדק על זהות פונקציה, עקרות, וגם אז cryopreserved לשימוש קליני.

איור 2. פלסמידים DNA אופטימליים לגרום לתא מעולה הפעלה T במבחנה. DCs היו nucleofected עם אופטימיזציה, ה-FDA תואמי פלסמידים קידוד Hexon ו פנטון (עו"ד), ו IE1 pp65 (CMV), ו EBNA1, LMP2 ו BZLF1 (EBV) או פלסמידים pShuttle קונבנציונאלי קידוד אנטיגנים אותו. אלה שימשו כדי לעורר בתאי T וספציפיות נותח על ידי ELIspot IFNγ 10 ימים לאחר גירוי.
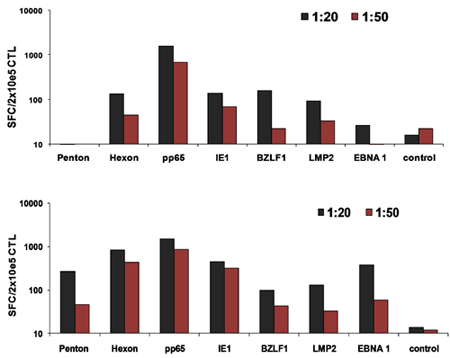
איור 3 DC אופטימלית:. יחס תא T להפעלת CTL. DCs מ 2 התורמים היו nucleofected עם כל שלושת פלסמידים מותאם ולאחר מכן השתמשו כדי לעורר PBMCs עצמיים בשעה 1:20 או 1:50 DC: יחס PBMC. תדירות של תאים T מחדש הוערכה על 10 יום על ידי IFNγ ELIspot.
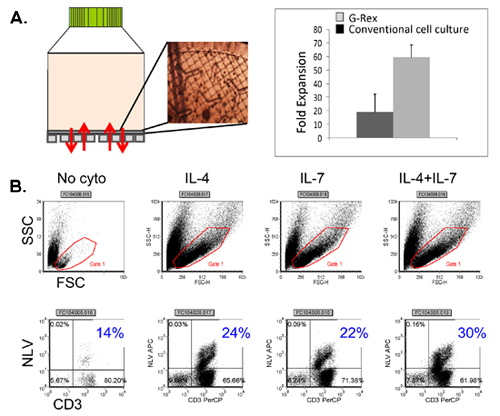
איור 4. התרחבות T תא ה-G-Rex באמצעות ציטוקינים שיפור. לוח מראה את מכשיר ה-G-רקס, כמו גם המראה CTL על קרום חדיר גז, מוערך על ידי מיקרוסקופית. השוואה בין התפוקה תא להשיג בתרבית רקמה כנס מטופלים צלחות vs G-Rex מוצג גם. לוח ב 'מראה את התדר של CTL pentamer CMV חיובית מושגת בתרבויות מורחב בנוכחות ציטוקינים לא, IL4 לבד, לבד IL7 IL4 + IL7.
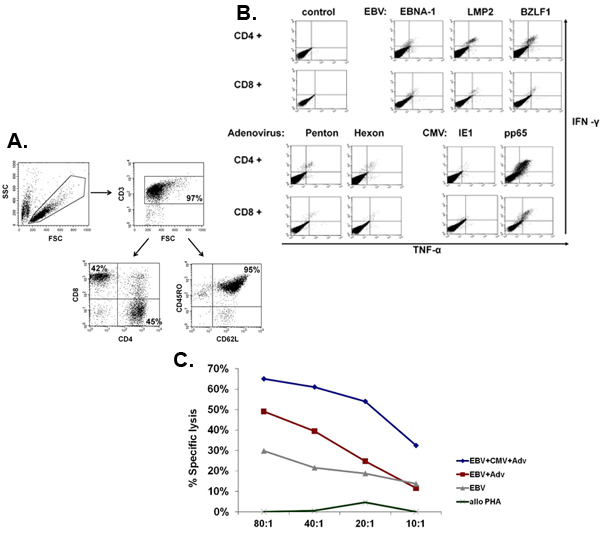
איור 5. הפנוטיפ והתפקוד של CTL מורחבת. לוח מראה דוגמה מייצגת של הפנוטיפ של CTL multivirus מורחבת, אשר polyclonal בתערובת של CD4 + (45% - עוזר) ו - CD8 + (42% - ציטוטוקסיות) ותאי T, אשר רובם (95%) הביעו את זיכרון סמן CD45RO + / CD62L +. לוח ב 'מראה כי תאים אלה הם ספציפיים לכל האנטיגנים מגרה והם polyfunctional כפי שהוערכו על ידי מכתים ציטוקינים תאיים לאתר הייצור של IFNΓ ו TNFα לאחר גירוי אנטיגן. לוח C מראה כי CTL מורחבת הם פונקציונליים, כפי שהיא נמדדת על ידי assay 51 Cr. LCL עצמיים, לבד או עם transduced וקטור ריק או וקטור adenoviral להביע CMV-pp65 שימשו זפתמקבל. Alloreactivity הוערכה באמצעות allogeneic תקיעות PHA כמטרה.
Discussion
זיהומים נגיפיים להסביר תחלואה ותמותה משמעותי בחולים immunocompromised על ידי המחלה או הטיפול בה. לאחר HSCT, למשל, זיהומים הנגרמים על ידי herpesviruses מתמשך כגון EBV ו CMV, כמו גם על ידי וירוסים בדרכי הנשימה כגון וירוס סינסיציאלי הנשימה (RSV), ידועים היטב, בעוד את החשיבות של זיהומים הנגרמים על ידי עו"ד, וירוס BK, אדם ההרפס (HHV) -6 יש יותר לאחרונה מוערך. בעוד הם סוכני תרופתי הטיפול הסטנדרטי לזיהומים מסוימים, יש להם רעילות משמעותית, ליצור גרסאות עמידים, אינם יעילים לעיתים קרובות. לעומת זאת, וירוס ספציפי T בתאים שמקורם בתאי גזע התורמים הוכיחו בטוח ויעיל למניעה וטיפול של זיהום או מחלה ויראלית של השתלת תא גזע hemopoietic (HSCT) הגדרת 2,5,6,18-21. עם זאת, יישום רחב יותר של חיסוני תא T הוא מוגבל בסופו של דבר את העלות והמורכבות, ואת הזמן הנדרש לייצור CTL.
הרומן שלנו גישה מהירה ליצור multivirus CTL, המתואר בכתב היד הנוכחית, יש להגדיל באופן משמעותי את הכדאיות של טיפול ציטוטוקסיים לתא T עבור מחלות ויראליות, מה שמאפשר את האסטרטגיה להיות רמת הטיפול לארח את החיסון. השימוש DCs nucleofected פלסמיד כמו נגמ"שים מאפשר הצגת אנטיגן על שניהם אני בכיתה ו-II MHC ללא תחרות מצד וקטורים ויראליים או למעשה מן אנטיגנים נגיפיים מרובים לידי ביטוי בתוך תא בודד מאז אוכלוסיות שונות DC מנוצלים עבור כל 3 פלסמיד. השימוש הישרדות IL-T 07/04 עליות שגשוג תאים, אשר בהתאם עוזר להגדיל את התדירות ואת הרפרטואר להגיב אנטיגן ספציפי בתאי T 16,17. לבסוף, תרבות ה-G-Rex מפחיתה באופן דרמטי את תא T אפופטוזיס במהלך התרבות. חילופי גז (O 2 ב ו - CO 2 מתוך) מתרחשת על פני קרום חדיר גז סיליקון בבסיס הבקבוק, מניעת היפוקסיה תוך מתן אפשרות יותר עומק של המדיום מעל התאים, לספק חומרים מזינים יותר דילול חומרי פסולת. פלטפורמה זו ניתן גם להרחיב וירוסים נוספים כאשר אנטיגנים מגן מזוהים.
Disclosures
Acknowledgements
עבודה זו נתמכת על ידי סיוע ייצור עבור טיפולים נייד (חוזה NIH-NHLBI (HB-10-03) HHSN26820100000C) (CMR), במרכזים מיוחדים לטיפול סלולריים מבוססי גרנט NIH-NHLBI 1 U54 HL081007 (CMR), ASBMT פרס החוקר הצעיר (UG ו JV), עמית לוקמיה ולימפומה החברה מיוחדים פרס המחקר הקליני (UG), ו Strelzer איימי פרס Manasevit Scholar (AML).
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
|---|---|---|---|
| CellGenix | CellGenix | 2005 | |
| IL4 | R + D מערכות | 204-IL/CF | |
| IL7 | Peprotech | 200-15 | |
| Hyclone RPMI 1640 | Thermo Scientific | SH30096.01 | |
| האדם א.ב. בסרום | עמק ביו בע"מ | HP1022 | |
| Nucleofector | Amaxa / Lonza | משרת בחיל האוויר-1001B & משרת בחיל האוויר-1001X | |
| Nucleofection Kit | Amaxa / Lonza | V4XP-3012 | |
| פלסמידים | NTC | n / a | |
| GM-CSF | R & D | 215-GM/CF | |
| IL1 | R & D | LB-201-025 | |
| IL6 | R & D | 206-IL-CF | |
| TNFα | R & D | 210-TA-010 | |
| PGE2 | סיגמא | P6532-1mg | |
| G-Rex | וילסון וולף ייצור | AY11-00027 |
References
- Kaka, A. S., Foster, A. E., Weiss, H. L., Rooney, C. M., Leen, A. M. Using dendritic cell maturation and IL-12 producing capacity as markers of function: a cautionary tale. J Immunother. 31, 359-369 (2008).
- Leen, A. M., Myers, G. D., Sili, U., Huls, M. H., Weiss, H., Leung, K. S., Carrum, G., Krance, R. A., Chang, C. C., Molldrem, J. J. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1166 (2006).
- Gerdemann, U., Christin, A. S., Vera, J. F., Ramos, C. A., Fujita, Y., Liu, H., Dilloo, D., Heslop, H. E., Brenner, M. K., Rooney, C. M., Leen, A. M. Nucleofection of DCs to generate Multivirus-specific T cells for prevention or treatment of viral infections in the immunocompromised host. Mol. Ther. 17, 1616-1625 (2009).
- Leen, A. M., Christin, A., Khalil, M., Weiss, H., Gee, A. P., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Identification of hexon-specific CD4 and CD8 T-cell epitopes for vaccine and immunotherapy. J Virol. 82, 546-554 (2008).
- Leen, A. M., Christin, A., Myers, G. D., Liu, H., Cruz, C. R., Hanley, P. J., Kennedy-Nasser, A. A., Leung, K. S., Gee, A. P., Krance, R. A., Brenner, M. K., Heslop, H. E., Rooney, C. M., Bollard, C. M. Cytotoxic T lymphocyte therapy with donor T cells prevents and treats adenovirus and Epstein-Barr virus infections after haploidentical and matched unrelated stem cell transplantation. Blood. 114, 4283-4292 (2009).
- Feuchtinger, T., Matthes-Martin, S., Richard, C., Lion, T., Fuhrer, M., Hamprecht, K., Handgretinger, R., Peters, C., Schuster, F. R., Beck, R., Schumm, M., Lotfi, R., Jahn, G., Lang, P. Safe adoptive transfer of virus-specific T-cell immunity for the treatment of systemic adenovirus infection after allogeneic stem cell transplantation. Br J Haematol. 134, 64-76 (2006).
- Bunde, T., Kirchner, A., Hoffmeister, B., Habedank, D., Hetzer, R., Cherepnev, G., Proesch, S., Reinke, P., Volk, H. D., Lehmkuhl, H., Kern, F. Protection from cytomegalovirus after transplantation is correlated with immediate early 1-specific CD8 T cells. J. Exp. Med. 201, 1031-1036 (2005).
- Leen, A., Meij, P., Redchenko, I., Middeldorp, J., Bloemena, E., Rickinson, A., Blake, N. Differential immunogenicity of Epstein-Barr virus latent-cycle proteins for human CD4(+) T-helper 1 responses. J Virol. 75, 8649-8659 (2001).
- Bickham, K., Munz, C., Tsang, M. L., Larsson, M., Fonteneau, J. F., Bhardwaj, N., Steinman, R. EBNA1-specific CD4+ T cells in healthy carriers of Epstein-Barr virus are primarily Th1 in function. J. Clin. Invest. 107, 121-130 (2001).
- Straathof, K. C., Leen, A. M., Buza, E. L., Taylor, G., Huls, M. H., Heslop, H. E., Rooney, C. M., Bollard, C. M. Characterization of latent membrane protein 2 specificity in CTL lines from patients with EBV-positive nasopharyngeal carcinoma and lymphoma. J. Immunol. 175, 4137-4147 (2005).
- Hislop, A. D., Taylor, G. S., Sauce, D., Rickinson, A. B. Cellular responses to viral infection in humans: lessons from Epstein-Barr virus. Annu. Rev. Immunol. 25, 587-617 (2007).
- Steven, N. M., Annels, N. E., Kumar, A., Leese, A. M., Kurilla, M. G., Rickinson, A. B. Immediate early and early lytic cycle proteins are frequent targets of the Epstein-Barr virus-induced cytotoxic T cell response. J. Exp. Med. 185, 1605-1617 (1997).
- Luke, J., Carnes, A. E., Hodgson, C. P., Williams, J. A. Improved antibiotic-free DNA vaccine vectors utilizing a novel RNA based plasmid selection system. Vaccine. 27, 6454-6459 (2009).
- Williams, J. A., Luke, J., Johnson, L., Hodgson, C. pDNAVACCultra vector family: high throughput intracellular targeting DNA vaccine plasmids. Vaccine. 24, 4671-4676 (2006).
- Vera, J. F., Brenner, L. J., Gerdemann, U., Ngo, M. C., Sili, U., Liu, H., Wilson, J., Dotti, G., Heslop, H. E., Leen, A. M., Rooney, C. M. Accelerated production of antigen-specific T-cells for pre-clinical and clinical applications using Gas-permeable Rapid Expansion cultureware (G-Rex. Journal of Immunotherapy. , (2009).
- Vella, A. T., Dow, S., Potter, T. A., Kappler, J., Marrack, P. Cytokine-induced survival of activated T cells in vitro and in vivo. Proc. Natl. Acad. Sci. U. S. A. 95, 3810-3815 (1998).
- Vella, A., Teague, T. K., Ihle, J., Kappler, J., Marrack, P. Interleukin 4 (IL-4) or IL-7 prevents the death of resting T cells: stat6 is probably not required for the effect of IL-4. J. Exp. Med. 186, 325-330 (1997).
- Heslop, H. E., Ng, C., Li, Y. C., Smith, C., A, C., Loftin, S. K., Krance, R. A., Brenner, M. K., Rooney, C. M. Long-term restoration of immunity against Epstein-Barr virus infection by adoptive transfer of gene-modified virus-specific T lymphocytes. Nature Medicine. 2, 551-555 (1996).
- Rooney, C. M., Smith, C. A., Ng, C., Loftin, S. K., Li, C., Krance, R. A., Brenner, M. K., Heslop, H. E. Use of gene-modified virus-specific T lymphocytes to control Epstein-Barr virus-related lymphoproliferation. Lancet. 345, 9-13 (1995).
- Einsele, H., Roosnek, E., Rufer, N., Sinzger, C., Riegler, S., Loffler, J., Grigoleit, U., Moris, A., Rammensee, H. G., Kanz, L., Kleihauer, A., Frank, F., Jahn, G., Hebart, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916-3922 (2002).
- Walter, E. A., Greenberg, P. D., Gilbert, M. J., Finch, R. J., Watanabe, K. S., Thomas, E. D., Riddell, S. R. Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N. Engl. J. Med. 333, 1038-1044 (1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved