Method Article
Microiontophoresis y micromanipulación de imagen intravital de fluorescencia de la microcirculación
En este artículo
Resumen
Microiontophoresis implica movimiento de los iones a partir de una micropipeta en respuesta a una diferencia de potencial eléctrico entre el interior y el exterior de la micropipeta. Moléculas biológicamente activas así son liberados en proporción a la corriente eléctrica. Nos ilustran microiontophoresis acetilcolina en conjunto con micromanipulación para estudiar vasodilatación dependiente del endotelio en la microcirculación.
Resumen
Microiontophoresis implica el paso de corriente a través de una punta de la micropipeta para ofrecer un soluto en un lugar designado dentro de una preparación experimental. Microiontophoresis puede simular una transmisión sináptica mediante la entrega de los neurotransmisores y los neuropéptidos en las neuronas de forma reproducible 2. Volumen insignificante (líquido) de desplazamiento evita la perturbación mecánica en la preparación experimental. La adaptación de estas técnicas en la microcirculación 3 ha permitido a los mecanismos de la vasodilatación y la vasoconstricción a estudiar a nivel microscópico in vivo 4,5. Una ventaja clave de distribución localizada como está permitiendo a las respuestas vasomotoras a estudiar en los lugares definidos dentro de una red microvascular sin evocar los cambios sistémicos o reflexiva de la presión arterial y el flujo sanguíneo del tejido, lo que revela las propiedades intrínsecas de los microvasos.
Una limitación de microiontophoresis es que la concentración del agente entregado en el lugar de interés es difícil de determinar 6. Sin embargo, su liberación de la punta de la micropipeta es proporcional a la intensidad y duración de la expulsión actual 2,7, de modo que reproducir las relaciones de estímulo-respuesta se puede determinar fácilmente en condiciones experimentales definidas (descrito más adelante). Los factores adicionales que afectan la entrega microiontophoretic incluyen la concentración de solutos y la ionización en la solución. El diámetro interior de la punta de la micropipeta debe ser aproximadamente 1 mo menos para minimizar difusional 'fuga', que puede ser contrarrestada con una corriente de retención. Así, una externa (positivo) actual se utiliza para expulsar una educación y una corriente negativa utilizado para mantener dentro de la micropipeta.
Fabricación de micropipetas se facilita con sofisticados extractores electrónicos 8. Micropipetas se tiran de los tubos capilares de vidrio que contiene un filamento que la solución de "mechas" en la punta de la micropipeta cuando se llena de la parte de atrás ("rellenadas"). Esto se realiza mediante la inserción de un tubo capilar conectado a una jeringa que contiene la solución de los intereses y la solución de la expulsión en el lumen de la micropipeta. Micromanipuladores permiten la colocación deseada de micropipetas en la preparación experimental. Micromanipulador montados sobre una base móvil se puede colocar alrededor de la preparación de acuerdo a la topografía de las redes microvasculares (desarrollado más adelante).
El presente protocolo demuestra microiontophoresis de la acetilcolina (ACh + Cl -) en una arteriola de la preparación del músculo cremáster de ratón (ver protocolo asociado: ID JoVe # 2874) para producir vasodilatación dependiente del endotelio. Entrega de estímulos se sincroniza con la adquisición de imágenes digitalizadas mediante un disparador electrónico. El uso de Cx40 BAC-GCaMP2 9 ratones transgénicos permite la visualización de las respuestas de calcio intracelular subyacente vasodilatación arteriolar en las células endoteliales de la microcirculación de vida.
Protocolo
1. Cuidado de los Animales y el empleo
Después de la revisión y aprobación del Cuidado de Animales institucional y el empleo, los ratones machos de al menos 12 semanas de edad se utilizan. Un ratón es anestesiados con pentobarbital sódico (60 mg / kg) vía intraperitoneal (ip). A lo largo de los procedimientos quirúrgicos y protocolos experimentales, la anestesia se mantiene con los suplementos (10-20% de la inyección inicial, ip), según sea necesario (cada 30-60 minutos, se indica por la respuesta de la retirada a los pies o pellizcar la cola). Después de la terminación del procedimiento experimental el ratón es una sobredosis con pentobarbital (ip) y sacrificados por dislocación cervical.
2. Micropipetas y Microiontophoresis
- Micropipetas Microiontophoresis (diámetro de la punta interna ~ 1 m) se preparan a partir de tubos de vidrio borosilicato capilar mediante un extractor de pipeta horizontal. La nuestra tiene un ~ 5 mm para una rigidez cónica; ya se estrecha son más flexibles.
- Micropipetas se rellena con 1M ACh (Figure1A-C) disueltos en 18,2 mW agua. Para el relleno, un tubo capilar se conecta a 0,2 micras filtro acoplado a una jeringa que contiene el agonista de interés (Figura 1). Estas pueden ser fácilmente fabricados (abajo) o comprados a proveedores comerciales. El tubo capilar se introduce en la parte final de la solución micropipeta y ACh se entrega en la luz mientras se retira el tubo capilar se llena como la micropipeta. La celebración de la micropipeta con punta hacia abajo, las burbujas de aire agitando suavemente la micropipeta.
- La micropipeta se fija en un soporte montado en un micromanipulador (Figura 2). El titular tiene un alambre de plata de conectar la solución de ACh en la micropipeta a un pin externo, que a su vez está conectado al terminal positivo de un programador microiontophoresis. Un hilo de plata segundo asegurado en el borde de la preparación del tejido está conectado a la terminal negativa para completar el circuito como la punta de la micropipeta se avanza en la solución salina fisiológica sobre la preparación.
- Una corriente de retención se aplica para evitar la vasodilatación (o la respuesta fluorescente) cuando la punta de la micropipeta se coloca junto a la pared de las arteriolas. Retención actual variará con el tamaño de la punta de la micropipeta (diámetro interno = 1 m) y la concentración de agonista, pero es altamente reproducible para los parámetros definidos (se utiliza ~ 200 nA para 1M ACh, una punta de micras). La corriente de retención deja coincidiendo con la entrega de eyección actual a través del disparador electrónico (Figura 1) sincronizado con el inicio de la adquisición de la imagen.
3. Micromanipulación
- Una plataforma personalizada para un platina del microscopio XY fue fabricado en acero inoxidable ferromagnético. Dimensiones de la plataforma (1 / 8 "X 12" X 13 ") permitirá el espacio suficiente para micromanipuladores posición en torno a la preparación experimental Micromanipuladores deseada (Figura 2A). Asegurado a las bases magnética (Figura 2B) permiten una colocación según lo dictado por la preparación. Estos son coloca directamente sobre la plataforma fabricada en torno a la preparación para micropipetas posicionamiento en los sitios de interés (Figura 2C).
4. Resultados representante
- Con la punta de la micropipeta posición adyacente a una arteriola, no hay respuesta de fluorescencia de ACh (retención actual de ajustadas para evitar fugas de ACh). Por debajo de un umbral de estímulo no hubo ningún efecto. Sin embargo, como aumento de la intensidad del estímulo, la fluorescencia de células endoteliales de calcio mayor a través de distancias cada vez mayores a lo largo de la arteriola, al igual que la intensidad de fluorescencia en el sitio de estimulación (Figura 3).
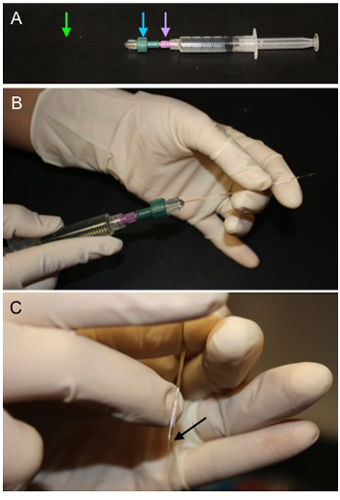
Figura 1. Método de Relleno pipetas Microiontophoresis. A) Un tubo capilar (flecha verde) se fija en un conector de compresión (flecha azul) unido a un filtro de 0,2 micras (flecha morada), que luego se fija a una jeringa llena de 1M ACh. B) El tubo capilar se introduce en la pipeta microiontophoresis a través de la parte de atrás y la solución se desplaza a llenar la luz de la micropipeta. C) Una vez que la pipeta se llena, mantenga la punta hacia abajo y dé golpecitos encima de la vela para eliminar las burbujas (flecha negro).

Figura 2. Plataforma personalizada para la colocación de micromanipulador. .. A) una plataforma de acero inoxidable ferromagnético se coloca sobre una base del microscopio contiene una costumbre MVX10 XY traslación B) Circular bases magnética colocada en la parte inferior del compacto de 3 ejes micromanipuladores C) Micromanipuladores colocados alrededor de la preparación experimental (ver protocolo asociado: ID JoVe # 2874) para estudiar los sitios específicos de interés. Latamaño compacto y la versatilidad ir micropipetas permiten múltiples para ser utilizados simultáneamente.

Figura 3. Fluorescencia de calcio en arteriolas. Fluorescencia de calcio de las células endoteliales que recubren la pared arteriolar aumenta con la intensidad del estímulo. Los primeros tres paneles que se muestran imágenes de fluorescencia de las respuestas a A) 250 nA, B) 500 nA y C) 1000 eyección nA de corriente (los 500 ms duración del pulso). La distancia a la que la fluorescencia de células endoteliales de calcio aumento se indica con corchetes en el AC (~ 130, 270 y 400 micras, respectivamente). La línea de referencia a través de la arteriola en cada panel indica que las respuestas de fluorescencia (F / Fo) a ACh se registraron en el sitio de estimulación. D) Las grabaciones de F / Fo tiempo frente a los estímulos para aumentar la ACh. Como eyección corriente aumentó, F / Fo aumento en la amplitud y la duración. Tenga en cuenta que 100 nA estímulo estaba por debajo del umbral y no tuvo ningún efecto.
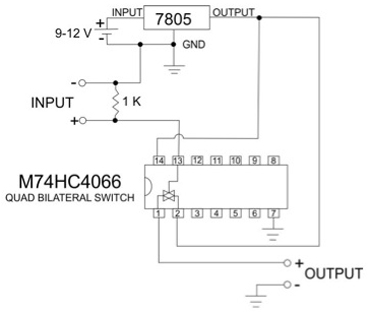
Complementaria la figura 1. Diagrama del circuito de disparador electrónico. Este circuito está conectado con un puerto paralelo de un ordenador personal. Cuando se activa proporciona un constante pulso TTL de 5V. El chip 7805 es un regulador de voltaje 5V conectada a una fuente de alimentación de 9-12V DC (una batería de voltaje adecuado está bien). La salida de la 7805 proporciona energía al interruptor bilateral Quad y la salida del circuito. De entrada a través de la resistencia de 1K es desde el ordenador.
Discusión
El protocolo aquí descrito muestra los métodos de preparación y ejecución de micropipetas para microiontophoresis. La entrega de la acetilcolina se usa para ilustrar la señalización del calcio subyacente vasodilatación dependiente del endotelio en las arteriolas del ratón anestesiado. Nuestros resultados muestran que la distancia a la que la ACh aumenta la fluorescencia de las células endoteliales aumenta el calcio con la intensidad de la corriente de expulsión de la micropipeta microiontophoresis (Figura 3). La falta de incremento de fluorescencia en condiciones de reposo indica una fuga insignificante de ACh de la micropipeta. La falta de respuesta a la intensidad del estímulo 100 nA (Figura 3, la leyenda) pone de manifiesto que un umbral de intensidad de la estimulación es necesaria para el calcio de las células endoteliales a aumentar. Estas técnicas se pueden adaptar fácilmente a otros agentes vasoactivos y la preparación del tejido.
Consideraciones prácticas: En el trabajo con microiontophoresis para estudiar la reactividad arteriolar, varias cosas deben ser reconocidos. Aunque ha sido difícil determinar la concentración real del agonista entrega, estímulo-respuesta curvas son reproducibles dentro y entre los preparativos. Estas se pueden realizar mediante la celebración de la duración del pulso constante (por ejemplo, 500 ms) y la variación de la expulsión de corriente (por ejemplo, 250, 500 y 1000 nA; Figura 3). Por otra parte, la expulsión de corriente puede mantenerse constante (por ejemplo, 500 nA) y la duración de pulso variable (por ejemplo, 250, 500 y 1000 ms). Para una referencia a las acciones de una concentración de agonista definido, la preparación puede ser superfused con la solución apropiada 5. Debido a que la fuerza impulsora para la eyección de soluto es el movimiento de carga eléctrica, el agente a entregar debe llevar a un cargo neto a ser desplazados de la micropipeta. Para asegurarse de que el agente de interés es el portador de la carga principal, se disuelve en alta concentración (por ejemplo, 1 M de ACh) para minimizar el electro-osmosis. Cuando se requiere la manipulación del pH de la solución de llenado micropipeta, los controles del vehículo necesarios para determinar los efectos no específicos. Los controles adecuados también se debe realizar para el paso de la corriente solo (por ejemplo, utilizando pipetas llenas de solución salina isotónica). La distancia efectiva de difusión del agente de su lugar de liberación debe ser comprobado y es más fácil determinar empíricamente por la desaparición de una respuesta fisiológica (por ejemplo, la vasodilatación o un aumento del calcio intracelular en la expulsión de ACh) como la micropipeta se coloca en define las distancias desde el sitio de destino. En la práctica, la distancia de difusión efectiva está muy influenciada por la forma en la punta de la micropipeta se coloca en el tejido, por ejemplo, si presiona la punta en el tejido y su punta se halla cerrado, que la eyección está alterada. Excesivo del tejido conectivo es particularmente problemático y debe ser removido de la superficie del tejido durante la preparación quirúrgica. También debe prestarse atención a la posibilidad de agotar la punta del agente designado. Esto se reduce al mínimo por medio de pulsos relativamente cortos (por ejemplo, ≤ 1 s). Con las corrientes sostenida (por ejemplo, varios segundos), el agonista puede ser expulsado de la punta más rápido de lo que puede ser sustituida por la difusión de la solución de llenado a granel en la micropipeta.
Porque el volumen insignificante se desplaza con microiontophoresis, si uno está tratando de cambiar el medio iónico local (por ejemplo, para ofrecer una K despolarizante estímulo +), esto no puede ser efectivamente logrado con microiontophoresis pero se logra fácilmente con presión de eyección de líquido a granel de la deseada composición. Para la estimulación local de una arteriola, puntas de micropipeta con un diámetro interno de 3.2 micras trabajar bien con la presión de eyección 4-5 psi (28 a 35 kPa) y la duración del pulso (por ejemplo, 1 segundo), controlada con una válvula de solenoide 10. Cuando la entrega sostenida de un agente de una micropipeta en un microvasos es necesario, la expulsión de la presión se prefiere utilizar pipetas de diámetro apropiado punta internos (por ejemplo, ~ 10 mm) 11,12. Una columna hidrostática de altura conocida con una válvula de llave de paso ofrece un barato y bien definido en / de la cabeza de presión constante. Los caudales están determinados por el diámetro interior de la punta de la pipeta y la presión de la conducción. Como siempre, los controles del vehículo son esenciales para excluir las acciones no específicas de expulsión a presión.
Divulgaciones
Todos los procedimientos y protocolos con animales fueron aprobados por el Cuidado de Animales y el empleo de la Universidad de Missouri y realizado de acuerdo con la Guía de los Institutos Nacionales de Salud para el Cuidado y Uso de Animales de Laboratorio. La producción de este artículo fue patrocinado por Stanford Fotónica.
Agradecimientos
Investigación en el laboratorio de los autores con el apoyo de los Institutos Nacionales de Salud subvenciones R37-HL041026, R01 y R01-HL086483 HL056786 (SSS) y F32-HL097463 y T32 AR048523 (PB) del Servicio de Salud Pública de Estados Unidos.
Materiales
| Name | Company | Catalog Number | Comments |
| Material utilizado | Empresa | Número de catálogo | Comentarios |
| Borosilicato tubos capilares | Warner Instrumentos | GC120F-10 | |
| Extractor horizontal con una pipeta | Sutter Instrumentos | modelo P-97 | |
| Acetilcolina cloruro | Sigma-Aldrich | A6625 | |
| adaptador para Luer centro | Martech | AC1343 | Para asegurar la tubería microcapilar |
| 0,2 m de nylon Titan filtro | Dom Sri | 42204-NN | Bajo volumen de retención para minimizar la pérdida |
| 5 ml jeringa | Becton-Dickinson Co. | 309603 | |
| Pipeta titular | Warner Instrumentos | E45W-M12VH | |
| Alambre de plata | Warner Instrumentos | AG10W | Diámetro de 0,25 mm |
| 3-ejes micromanipulador | Siskiyou diseñar instrumentos | DT3-100, MXB, MXC, MGB / 8 | Componentes de manipulador, como se muestra |
| microiontophoresis actual programador | Mundial de Instrumentos de Precisión | Modelo 260 | |
| dispositivo de disparo | Costumbre | costumbre | circuito dispuesto en el Supl. Figura 1 |
| placas de acero inoxidable | McMaster-Carr | 1 / 8 "X 12" X 12 " | De acuerdo con el diseño |
| La intensificación de la cámara digital | Stanford Fotónica Inc | XR/Mega-10 | Integrado con el software de control de Piper |
Referencias
- Majno, G., Palade, G. E. Studies on inflammation. 1. The effect of histamine and serotonin on vascular permeability: an electron microscopic study. J. Biophys. Biochem. Cytol. 11, 571-605 (1961).
- Majno, G., Palade, G. E., Schoefl, G. I. Studies on inflammation. II. The site of action of histamine and serotonin along the vascular tree: a topographic study. J. Biophys. Biochem. Cytol. 11, 607-626 (1961).
- Grant, R. T. Direct Observation of Skeletal Muscle Blood Vessels (Rat Cremaster). J. Physiol. 172, 123-137 (1964).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc. Res. 5, 384-394 (1973).
- Bohlen, H. G., Gore, R. W., Hutchins, P. M. Comparison of microvascular pressures in normal and spontaneously hypertensive rats. Microvasc. Res. 13, 125-130 (1977).
- Klitzman, B., Duling, B. R. Microvascular hematocrit and red cell flow in resting and contracting striated muscle. Am. J. Physiol. 237, 481-490 (1979).
- Hungerford, J. E., Sessa, W. C., &, S. e. g. a. l., S, S. Vasomotor control in arterioles of the mouse cremaster muscle. FASEB J. 14, 197-207 (2000).
- Figueroa, X. F., Paul, D. L., Simon, A. M., Goodenough, D. A., Day, K. H., Damon, D. N., Duling, B. R. Central role of connexin40 in the propagation of electrically activated vasodilation in mouse cremasteric arterioles in vivo. Circ. Res. 92, 793-800 (2003).
- Wolfle, S. E., Schmidt, V. J., Hoepfl, B., Gebert, A., Alcolea, S., Gros, D., de Wit, C. Connexin45 cannot replace the function of connexin40 in conducting endothelium-dependent dilations along arterioles. Circ. Res. 101, 292-1299 (2007).
- Milkau, M., Kohler, R., de Wit, C. Crucial importance of the endothelial K+ channel SK3 and connexin40 in arteriolar dilations during skeletal muscle contraction. FASEB J. 24, 3572-3579 (2010).
- Bagher, P., Duan, D., Segal, S. S. Evidence for impaired neurovascular transmission in a murine model of Duchenne Muscular Dystrophy. J. Appl. Physiol. 110, 601-610 (2011).
- Tallini, Y. N., Brekke, J. F., Shui, B., Doran, R., Hwang, S. M., Nakai, J., Salama, G., Segal, S. S., Kotlikoff, M. I. Propagated endothelial Ca2+ waves and arteriolar dilation in vivo: measurements in Cx40BAC-GCaMP2 transgenic mice. Circ. Res. 101, 1300-1309 (2007).
- Grant, R. T. The effects of denervation on skeletal muscle blood vessels (rat cremaster). J. Anat. 100, 305-316 (1966).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, H34-H41 (1985).
- Bagher, P., Segal, S. S. Regulation of blood flow in the microcirculation: Role of conducted vasodilation. Acta Physiol. , (2011).
- Hill, M. A., Simpson, B. E., Meininger, G. A. Altered cremaster muscle hemodynamics due to disruption of the deferential feed vessels. Microvasc. Res. 39, 349-363 (1990).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados