Method Article
Los ensayos farmacológicos y genéticos funcionales para manipular la regeneración de la planaria Japonica Dugesia
En este artículo
Resumen
Un modelo atractivo para el estudio de la diferenciación de células madre en un animal vivo es el gusano planaria. La regeneración se estudia por medio de experimentos sencillos que la amputación se realiza fácilmente en un laboratorio básico y son susceptibles de (farmacológicos y genéticos In vivo RNAi) la manipulación que se detallan los protocolos en este artículo.
Resumen
Platelmintos de vida libre planarias tienen una larga historia de uso experimental, debido a su notable capacidad regenerativa 1. Pequeños fragmentos extirpados de estos animales, la reforma del plan original del cuerpo después de la regeneración de las estructuras del cuerpo que faltan. Por ejemplo, si un fragmento de 'tronco' se corta de un gusano intacto, 'cabeza', una nueva regeneración de la parte anterior y una "cola" se regeneran posteriormente la restauración de la original de polaridad "de cabeza a la cola" de las estructuras del cuerpo antes de la amputación (Figura 1A).
La regeneración es conducido por las células madre de las planarias, conocido como "neoblastos", que se diferencian en aproximadamente 30 diferentes tipos de células durante la homeostasis normal del cuerpo y la regeneración del tejido cumplir. Este proceso de regeneración es robusto y fácil de demostrar. Debido a la dedicación de varios laboratorios de vanguardia, muchas herramientas y métodos de genética funcional han sido optimizados para este modelo de sistema. En consecuencia, los recientes avances se han realizado considerables en la comprensión y la manipulación de los eventos moleculares que sustentan la plasticidad del desarrollo planaria 2-9.
El modelo de sistema planaria será de interés para una amplia gama de científicos. Para los neurocientíficos, el modelo ofrece la oportunidad de estudiar la regeneración de un sistema nervioso, en lugar de la regeneración / reparación del mismo proceso de las células nerviosas que normalmente son objeto de estudio en muchos modelos establecidos. Planarias expresar una gran cantidad de neurotransmisores 10, representan un importante sistema para estudiar la evolución del sistema nervioso central 11, 12 y tienen un potencial de detección de comportamiento 13, 14.
Resultados regenerativos son susceptibles de manipulación por parte de apparoaches farmacológicos y genéticos. Por ejemplo, las drogas pueden ser examinados por los efectos sobre la regeneración con sólo colocar fragmentos de los cuerpos de las drogas que contienen soluciones en diferentes momentos después de la amputación. El papel de los genes individuales pueden ser estudiados usando los métodos de caída (en vivo ARNi), que se puede lograr ya sea a través de ciclos de microinyección o por la alimentación por bacterias expresado construye dsRNA 8, 9, 15. Ambos enfoques pueden producir fenotipos visualmente impactantes en alta penetrancia, por ejemplo, la regeneración de los animales bipolar 16-21. Para facilitar la adopción de este modelo y la aplicación de tales métodos, mostramos en este artículo los protocolos de vídeo para los ensayos farmacológicos y genéticos (in vivo ARNi por la alimentación) con el Dugesia planaria japonica.
Protocolo
1. Fragmento de tronco de la regeneración de ensayo
- Dejar de alimentar a un grupo de gusanos por lo menos 5 días antes del ensayo de regeneración de asegurar que los animales están libres de residuos y de los alimentos ingeridos (~ 30 gusanos intactos, cada gusano ~ 10.8 mm de largo después de la hambruna).
- En el día de la prueba, un enjuague pre-congelados plato nivelado de hielo con agua y cubrir la superficie plana de helado con una envoltura de plástico. Con unas pinzas, un lugar de papel de filtro en la envoltura de plástico.
- Humedezca el papel de filtro con unas gotas de agua de manantial. Transferencia de planarias en filtro (<20 gusanos por filtro) con una pipeta de transferencia. Los gusanos pueden volver a colocarse en el filtro, si es necesario, por repipetting con agua de manantial más. Retire el exceso de líquido.
- El uso de un bisturí, amputar la cabeza de un solo corte realizado aproximadamente a medio camino entre el vértice anterior del animal y el extremo anterior de la faringe (Figura 1).
- El uso de un bisturí, amputar la región de la cola de un solo corte realizado aproximadamente a medio camino entre el extremo de la cola del animal y el extremo posterior de la faringe (Figura 1). Retire el exceso de mucosidad en el bisturí con una toalla de papel humedecida con alcohol al 70% después del corte. Limpie el exceso de etanol a partir de bisturí.
- Transferencia del filtro a través de unas pinzas en una placa de Petri (100 x 25 mm de profundidad), que contiene agua de manantial. Espere ~ 3 minutos (para el cierre de la herida, observable por un pellizco y oscurecimiento de la herida).
- Enjuague fragmentos del tronco de papel de filtro en una placa de Petri que contienen medio deseado para el ensayo de regeneración y traslado al termostatizado incubadora (24 ° C).
- Puntuación fenotipo de regeneración después de aproximadamente una semana, cuando las estructuras regeneradas son identificables (Figura 1).
2. La manipulación farmacológica de la regeneración: la bipolaridad inducida por praziquantel
- Prepare praziquantel (PZQ) de stock de medicamentos de solubilización en DMSO (62.4mg PZQ en 1 ml de imágenes de stock 200 mM). Utilice el mismo día.
- Hacer 50 ml de solución que contiene el fármaco (90 M PZQ) en sales Montjuch búfer. Vortex de ~ 1 minuto para asegurar la dispersión.
- Realizar análisis tronco fragmento regenerativa como se detalla anteriormente [protocolo n º 1], la exposición de una cohorte de fragmentos del tronco para PZQ en la etapa final [1,7].
- Después de 24-48 horas, cambio de PZQ que contienen los medios de comunicación para el agua de manantial, el lavado de varios gusanos (> 3) veces.
- Volver gusanos a la incubadora. Bipolaridad puntuación (de dos cabezas, Figura 1B) una semana después del corte.
3. La manipulación genética de la regeneración: en el protocolo de alimentación vivo ARNi
- Antes del ensayo, preparar homogeneizado de hígado de pollo. Deseche las secciones grasos, de color amarillo de foodstock, y el hígado puré restante. Filtro de puré a través de colador de malla y la suspensión alícuota para el almacenamiento (1,5 ml tubos, -20 ° C).
- Antes del ensayo, preparar bovina glóbulos rojos (GR) en alícuotas de suministro en las muestras de 1 ml, almacenados a -20 ° C.
- Seleccione los gusanos de RNAi. Tres cohortes se utilizan: el gen de interés, el control positivo (gen conocido con el fenotipo RNAi; Figura 1 C, D y E) de control y negativo (gen sin fenotipo RNAi, también es útil para la evaluación de los niveles de caída en comparación con cohortes experimental). Para cada cohorte, el uso ~ 250 gusanos (~ 10.8 mm de largo después de que mueren de hambre por lo menos 5 días). Tienda en agua de manantial en la bañera de plástico.
- Para cada población de cohortes RNAi deshielo, de E. coli que expresan genes dsRNA objetivo de interés [8], junto con un tubo de homogeneizado de hígado de pollo [3,1] y un tubo de glóbulos rojos [3,2].
- Pellet bacterias (13.000 g, 1 minuto). Aspirar el sobrenadante y el pellet se resuspende en 2xYT los medios de comunicación (~ 700μl). Centrifugar, desechar el sobrenadante, el lugar de pellets en hielo.
- Crear un gran agujero P200 punta de la pipeta por cortar el extremo de la punta. Bien volver a suspender el sedimento bacteriano en una mezcla de homogeneizado de hígado de pollo (150 l) y los glóbulos rojos (50 l) para crear la mezcla de alimentación RNAi. Eliminar las burbujas de aire por centrifugación.
- Para la alimentación, retire la mayor parte del agua de la tina de plástico que contenía gusanos (dejar en profundidad ~ 1 pulgada). Tina remolino de concentrar los gusanos en el centro de este contenedor, y una pipeta de mezcla de alimentación RNAi en un círculo acorralando a los gusanos. Use una pipeta de transferencia de convencer cuidadosamente fugitivos de vuelta a la mezcla de alimentación RNAi sin perturbar otros comensales!
- Después de la alimentación (aproximadamente 1 hora), identificar las planarias que bien alimentados. Estos gusanos muestran una coloración roja intensa de eritrocitos ingeridos. Descartar otros.
- Reemplace con cuidado la alimentación de solución con agua de manantial, lo que minimiza la perturbación para evitar excreción de los alimentos. Para ello, suavemente localizar a los gusanos a un lado del tubo con una pipeta de transferencia, derrama el agua turbia, y sustituya cuidadosamente con agua dulce vertida por la pared de enfrente de la bañera. Planarias Resubmerge rápidamente como la exposición prolongada al aire también se traduce en excreción de alimentos.
- Libremente en síal tapón del depósito y retorno a la incubadora (24 ° C)
- Repita el protocolo de RNAi de alimentación en varios ciclos (~ 2-3 días de diferencia), intercalados con ciclos de regeneración [protocolo # 1] para la detección de fenotipos RNAi. Un protocolo estándar para la alimentación y la regeneración efectiva de muchos genes se muestra en la Figura 2, que lleva alrededor de un mes de duración total.
Modificar este esquema de genes diferentes, como el protocolo óptimo dependerá de factores tales como la estabilidad del ARNm, la localización del tejido, pervivencia de proteínas, o el desarrollo de un fenotipo que se opone a varios ciclos de alimentación después de la regeneración. Evaluar los niveles de caída, simplemente la detección de la penetrancia del fenotipo (si es evidente), o por métodos qPCR para comparar los niveles de ARNm específicos con la cohorte de control negativo.
4. Los resultados representativos:
El fragmento de ensayo de la regeneración del tronco es robusto de tal manera que todos los gusanos deben regenerarse con normalidad anterior-posterior ("cabeza a la cola") polaridad. Esto se puede marcar tan pronto como cinco días después del corte, facilitado por la aparición de las manchas oculares anterior (asterixed, Figura 1). Sin embargo, la completa restauración morfológica de estructuras perdidas se produce después de una semana. La manipulación farmacológica de la regeneración del tronco fragmento PZQ para producir dos cabezas gusanos (fig. 1B) también es robusto (CE 50 = 87 (+ -) 11% fragmentos bipolar, 70μM PZQ durante 48 horas 20). La bipolaridad se produce en un ciclo regenerativo único. Menor eficacia en estos ensayos es probable se relaciona con problemas con la solubilidad del fármaco y / o almacenamiento, o el uso de una especie de gusano plano diferente, donde PZQ es ineficaz. Para los medicamentos con menor penetrancia, un índice anteriorización se utiliza a menudo para marcar fenotipos intermedios, aparte de 22 bipolaridad completa. Fenotipos resultantes de RNAi de las construcciones de control positivo se muestra en la Figura 1: RNAi de Dugesia japonica seis-1 (D j-seis-1) resulta en un fenotipo sin ojos 23 (fig. 1C), RNAi de Dugesia japonica PC2 (Dj-PC2) resulta en una pérdida de la respuesta de aversión luz 24 (Figura 1D) y de RNAi Dugesia japonica βcatenin-1 (Dj-βcatenin-1) resulta en un fenotipo de dos cabezas 16-19, 21 a partir de fragmentos del tronco (Figura 1). Estos fenotipos se puede lograr utilizando los siguientes protocolos de RNAi sencilla: Dj-seis-1 (FFxFx), Dj-PC2 (FFFx), Dj-βcatenin-1 (FFxFx), donde F = ciclo de alimentación y x = ciclo regenerativo, respectivamente.
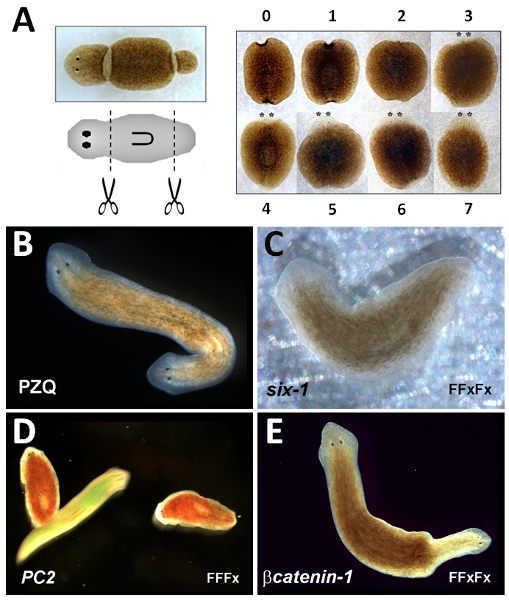
Figura 1:... Fragmento del tronco ensayo de regeneración de la izquierda, imagen de la planaria (arriba) y esquema (centro) para mostrar la ubicación de un fragmento de tronco derecho extirpado, timecourse de la regeneración del tronco fragmento que muestra la apariencia de un fragmento de la regeneración en el momento indicado (días) B Imagen de dos cabezas planaria producida por la exposición PZQ. "Ciega" C gusano producido por Dj-seis-1 RNAi. Pérdida D de la respuesta de aversión luz inmóvil gusanos Dj-PC2 RNAi (manchas rojas), en comparación con el gusano de control móvil (manchado verde). E bipolar planaria producido por Dj-βcatenin-1 RNAi. En Bélgica, el final original anterior de los gusanos de RNAi se orienta hacia la izquierda.
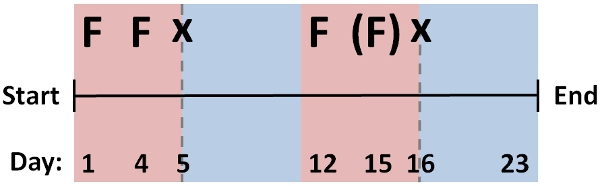
Figura 2: Secuencia de la alimentación y ciclos de corta de protocolo típico de RNAi que comprende alimentación múltiple (F), y los ciclos de regeneración (x) que es eficaz para la caída de muchos genes en D. japonica. La modificación de este protocolo para los distintos genes pueden ser necesarios para obtener resultados óptimos, por ejemplo mediante un archivo. Menos (entre paréntesis) o un número mayor de alimentación y los ciclos de regeneración
Discusión
Los protocolos de los ensayos aquí descritos detalladamente para el estudio y la manipulación de la regeneración de la planaria Dugesia japonica. Son simples y no requieren equipo especializado de tal manera que se pueden realizar fácilmente en el laboratorio o en clase. Los ensayos se pueden realizar individualmente o combinados (para la detección química genética de eficacias de drogas en vivo) y se puede realizar a nivel del gen candidato, o se adaptan a la selección imparcial, rendimiento superior al 8. Ya sea para el estudio de la biología fascinante de planarias por derecho propio, o para evaluar la función in vivo de los homólogos de mamíferos en un modelo alternativo para el estudio de la regeneración de tejidos, estos enfoques deben catalizar el interés de una amplia gama de investigadores.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Trabajar en el laboratorio con el apoyo de la NSF (MCB0919933) y el NIH (GM088790).
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo | Vendedor | Número de catálogo | Comentarios |
|---|---|---|---|
| Agua de manantial | Kandiyohi. Premium Aguas Inc. Minneapolis, MN | n / a | Otras formas de agua de manantial funcionan bien también. Primer juicio en los ensayos de viabilidad. |
| 1 x tampón sales de Montjuïch: NaCl (1,6 mm), CaCl2 (1 mm), MgSO4 (1 mM), MgCl2 (0,1 mM), KCl (0,1 mm), NaHCO3 (1,2 mm), HEPES (1,5 mm). pH 7,4 a 24 ° C. | Múltiples proveedores | n / a | Artificial de agua para los tratamientos de drogas durante los ensayos de regeneración para asegurar tampón de pH. Solución 08/05 Holtfreter es una alternativa. |
| 2xYT caldo | Fisher Scientific | BP2467-500 | Los medios de comunicación = 31 g / L. Autoclave. |
| Petri (100x25mm) | Fisher Scientific | 08-757-11 | Gusanos de vivienda durante los ciclos de regeneración |
| Plaza del plato (100x100x15mm) | Fisher Scientific | 08 a 757-11A | Se llenan de agua, la congelación de la bandeja de hielo utilizado como superficie de gusano de corte |
| Tina de plástico: Twist Ziploc 'n Loc (16 oz). | Varios minoristas | n / a | Contenedores estancos conveniente para las cohortes RNAi |
| Hígado de pollo | Comestibles comerciales | n / a | Sesgo hacia los suministros orgánicos, debido a la evasión de los antibióticos. |
| Batidora | Todo proveedor de cocina | n / a | Utilizar para hacer puré de hígado de pollo |
| Alambre de 1 mm de malla colador | Todo proveedor de cocina | n / a | Se utiliza para forzar el puré de hígado de pollo |
| Los glóbulos rojos de bovino | Lampire Laboratorios Biológicos | 7240807 | 100% de lavado y se agruparon suspensión de glóbulos rojos |
| Circular papeles de filtro | Whatman # 3 | 1003 055 | |
| Pipeta de transferencia | Fisher Scientific | 13-711-41 | |
| Hojas estériles, quirúrgica | Los vendedores múltiples | n / a | |
| ± Praziquantel | Sigma Aldrich | P4668 | Tienda de alícuotas de polvo en la oscuridad a 4 ° C. Se secan. |
| Dj-seis-1 | GenBank AJ557022.1 | RNAi positivo de control de "ojo-less" fenotipo 23 | |
| Dj-βcatenin-1 | GenBank AB181913.1 | RNAi control positivo de dos cabezas fenotipo 17 | |
| Dj-PC2 | RNAi control positivo de la pérdida del fenotipo de la aversión de luz 24 |
Referencias
- Morgan, T. H. Experimental studies of the regeneration of Planaria maculata. Arch Entwm Org. 7, 364-397 .
- Robb, S. M., Ross, E., Sánchez Alvarado, A. SmedGD: the Schmidtea mediterranea genome database. Nucleic Acids Res. 36, 599-606 (2008).
- Forsthoefel, D. J., Newmark, P. A. Emerging patterns in planarian regeneration. Curr Opin Genet Dev. 19, 412-4120 (2009).
- Adell, T., Cebrià, F., Saló, E. Gradients in Planarian Regeneration and Homeostasis. Cold Spring Harb Perspect Biol. 2, (2010).
- Agata, K., Watanabe, K. Molecular and cellular aspects of planarian regeneration. Semin Cell Dev Biol. 10, 377-383 (1999).
- Newmark, P. A. &. a. m. p. ;. a. m. p., Sánchez-Alvarado, A. Not your father's planarian: a classic model enters the era of functional genomics. Nat Rev Genet. 3, 210-219 (2002).
- Reddien, P. W., Sánchez-Alvarado, A. Fundamentals of planarian regeneration. Ann Rev Cell Dev Biol. 20, 725-757 (2004).
- Reddien, P. W., Bermange, A. L., Murfitt, K. J., Jennings, J. R., Sánchez-Alvarado, A. Identification of genes needed for regeneration, stem cell function, and tissue homeostasis by systematic gene perturbation in planaria. Dev Cell. 8, 635-649 (2005).
- Newmark, P. A., Reddien, P. W., Cebria, F. &. a. m. p. ;. a. m. p., Sánchez-Alvarado, A. Ingestion of bacterially expressed double-stranded RNA inhibits gene expression in planarians. Proc Natl Acad Sci USA. 100, 11861-11865 (2003).
- Collins, J. J. Genome-Wide Analyses Reveal a Role for Peptide Hormones in Planarian Germline Development. PLoS Biology. 8, e10000509-e10000509 (2010).
- Cebrià, F. Regenerating the central nervous system: how easy for planarians!. Dev Genes Evol. , 733-748 (2007).
- Mineta, K. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proc Natl Acad Sci USA. 100, 7666-7671 (2003).
- Oviedo, N. J., Nicolas, C. L., Adams, D. S., Levin, M. Emerging Model Organisms. A Laboratory Manual Chapter. 8, (2009).
- Buttarelli, F. R., Pellicano, C., Pontieri, F. E. Neuropharmacology and behavior in planarians: translations to mammals. Comp Biochem Physiol. 147, 399-408 (2008).
- Sánchez-Alvarado, A., Newmark, P. A. Double-stranded RNA specifically disrupts gene expression during planarian regeneration. Proc Natl Acad Sci U S A. 96, 5049-5054 (1999).
- Gurley, K. A., Rink, J. C., Sánchez-Alvarado, A. Beta-catenin defines head versus tail identity during planarian regeneration and homeostasis. Science. 319, 323-327 (2008).
- Yazawa, S., Umesono, Y., Hayashi, T., Tarui, H., Agata, K. Planarian Hedgehog/Patched establishes anterior-posterior polarity by regulating Wnt signaling. Proc Natl Acad Sci U S A. 106, 22329-22334 (2009).
- Petersen, C. P., Reddien, P. W. Smed-betacatenin-1 is required for anteroposterior blastema polarity in planarian regeneration. Science. 319, 327-330 (2008).
- Iglesias, M., Gomez-Skarmeta, J. L., Saló, E., Adell, T. Silencing of Smed-betacatenin1 generates radial-like hypercephalized planarians. Development. 135, 1215-1221 (2008).
- Nogi, T., Zhang, D., Chan, J. D., Marchant, J. S., S, J. A novel biological activity of praziquantel requiring voltage-operated Ca2+ channel beta subunits: subversion of flatworm regenerative polarity. PLoS Negl Trop Dis. 3, e464-e464 (2009).
- Oviedo, N. J. Long-range neural and gap junction protein-mediated cues control polarity during planarian regeneration. Dev Biol. 339, 188-199 (2010).
- Nogi, T., Levin, M. Characterization of innexin gene expression and functional roles of gap-junctional communication in planarian regeneration. Dev Biol. 287, 314-335 (2005).
- Mannini, L. Djeyes absent (Djeya) controls prototypic planarian eye regeneration by cooperating with the transcription factor Djsix-1. Dev Biol. 269, 346-359 (2004).
- Agata, K. Structure of the planarian central nervous system (CNS) revealed by neuronal cell markers. Zoolog Sci. 15, 433-440 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados