Method Article
Pharmakologische und Functional genetischen Tests zu manipulieren Regeneration der Planarien Dugesia japonica
In diesem Artikel
Zusammenfassung
Ein attraktives Modell zur Untersuchung Stammzell-Differenzierung innerhalb eines lebenden Tieres ist der Planarie flatworm. Die Regeneration wird durch einfache Amputation Experimente, die leicht in einem der Grundlagenforschung im Labor durchgeführt werden untersucht und sind zugänglich für pharmakologische und genetische ( In vivo RNAi) Manipulation durch Protokolle in diesem Artikel beschrieben.
Zusammenfassung
Frei lebende Plattwürmer Planarien haben eine lange Geschichte der experimentellen Nutzung aufgrund ihrer bemerkenswerten Regenerationsfähigkeit 1. Kleine Fragmente von diesen Tieren herausgeschnitten Reform der ursprüngliche Bauplan folgende Regeneration der fehlenden Strukturen des Körpers. Zum Beispiel, wenn ein "Stamm"-Fragment aus einer intakten Wurm geschnitten wird, einen neuen "Kopf" wird nach vorne zu regenerieren und einen "Schwanz" wird hinten regenerieren Wiederherstellung des ursprünglichen "Kopf-an-Schwanz" Polarität von Körperstrukturen vor der Amputation (Abbildung 1A).
Die Regeneration wird durch Planarien Stammzellen als "Neoblasten", die in ~ 30 verschiedene Zelltypen differenzieren während der normalen Homöostase des Körpers und durchgesetzt Geweberegeneration bekannt angetrieben. Diese regenerative Prozess ist robust und leicht zu demonstrieren. Durch das Engagement mehrerer bahnbrechender Labs, viele Werkzeuge und funktionellen genetischen Methoden haben nun für dieses Modell-System optimiert. Folglich hat erhebliche jüngsten Fortschritte im Verständnis und die Manipulation der molekularen Ereignisse zugrunde Planarie Entwicklungsstörungen Plastizität 2-9 worden.
Die Planarie Modellsystem von Interesse, eine breite Palette von Wissenschaftlern werden. Für Neurowissenschaftler, bietet das Modell die Möglichkeit, die Regeneration einer ganzen Nervensystems Studie, anstatt einfach nur das Nachwachsen / Reparatur von einzelnen Nervenzelle Prozess, der in der Regel stehen im Mittelpunkt der Studie in vielen etablierten Modellen. Planarien Ausdruck einer Vielzahl von Neurotransmittern 10, sind ein wichtiger für die Erforschung von Evolution des zentralen Nervensystems 11, 12 und Verhaltensstörungen Screening potenzieller 13, 14.
Regenerative Ergebnisse sind zugänglich für Manipulation durch pharmakologische und genetische apparoaches. Zum Beispiel können Medikamente auf ihre Wirkung auf die Regeneration einfach, indem man Körper-Fragmenten in Drogen-haltige Lösungen zu verschiedenen Zeitpunkten nach der Amputation zu sehen sein. Die Rolle einzelner Gene kann studierte mit Knockdown-Methoden (in vivo RNAi), die entweder durch Zyklen von Mikroinjektion oder durch Fütterung dsRNA-Konstrukte 8, 9, 15 bakteriell exprimiert erreicht werden kann. Beide Ansätze können optisch ansprechende Phänotypen mit hoher Penetranz, zum Beispiel die Regeneration von bipolaren Tiere 16-21 zu produzieren. Zur Erleichterung der Einführung dieses Modells und Umsetzung solcher Methoden, präsentieren wir in diesem Video Artikel Protokolle für pharmakologische und genetische Tests (in vivo RNAi durch Füttern) mit der Planarie Dugesia japonica.
Protokoll
1. Trunk-Fragment Regeneration Test
- Stop-Fütterung einer Kohorte von Würmern für mindestens 5 Tage vor der regenerativen Test, um sicherzustellen, Tiere sind frei von Abfall und aufgenommene Nahrung (~ 30 intakt Würmer, jeder Wurm ~ 8-10 mm langen post-Hunger).
- Am Tag des Tests, spülen Sie eine pre-frozen eingeebnet Eis Schüssel mit Wasser und deckt den flachen vereisten Oberfläche mit Klarsichtfolie auslegen. Mit einer Pinzette, stellen Sie einen Filterpapier auf der Plastikfolie.
- Feuchten Sie das Filterpapier mit ein paar Tropfen Quellwasser. Transfer Planarien auf Filterpapier (<20 Würmern pro Filter) mit einem Transferpipette. Worms finden Sie auf Filter neu positioniert werden, falls notwendig, durch repipetting mit mehr Quellwasser. Entfernen Sie überschüssige Flüssigkeit.
- Mit einem Skalpell amputieren den Kopf durch einen einzigen Schnitt etwa auf halbem Weg zwischen der vorderen Spitze des Tieres und dem vorderen Ende des Pharynx (Abbildung 1A) hergestellt.
- Mit einem Skalpell amputieren Heckbereich durch einen einzigen Schnitt gemacht etwa auf halbem Weg zwischen dem hinteren Ende des Tier-und hinteren Ende des Pharynx (Abb. 1A). Entfernen Sie überschüssigen Schleim auf das Skalpell mit einem Papiertuch, befeuchtet mit 70% Ethanol nach dem Schneiden. Überschüssiges Ethanol aus Skalpell.
- Transfer-Filter über Pinzette in eine Petrischale (100 x 25mm Tiefe) mit Quellwasser. Warten Sie ca. 3 Minuten (für den Wundverschluss, beobachtbaren durch einen Quetsch-und Verdunkelung der Wunde).
- Spülen Stamm-Fragmente aus Filterpapier in Petrischale mit gewünschte Medium für regenerative Assay und Transfer zum thermostatisierten Inkubator (24 ° C).
- Ergebnis regenerative Phänotyp nach ~ 1 Woche, wenn regeneriert Strukturen erkennbar (Abb. 1A).
2. Pharmakologische Manipulation der Regeneration: Bipolarität von Praziquantel induzierten
- Bereiten Sie Praziquantel (PZQ) Lager durch Lösen Medikament in DMSO (62.4mg PZQ in 1ml für 200mm Lager). Verwenden Sie am selben Tag.
- Machen Sie 50 mL der Drogen-haltige Lösung (90 uM PZQ) in gepufferter Montjuch Salze. Vortex für ~ 1 Minute, um die Dispersion zu gewährleisten.
- Führen Stamm-Fragment regenerative Assay wie oben beschrieben [Protokoll Nr. 1], Aussetzen einer Kohorte von Stamm-Fragmente PZQ im letzten Schritt [1,7].
- Nach 24-48 Stunden, Austausch PZQ-haltigen Medien für Quellwasser, Wasch-Würmer mehrere (> 3) mal.
- Zurück Würmer Inkubator. Ergebnis Bipolarität (zwei Köpfe, Abbildung 1B) 1 Woche nach dem Schneiden.
3. Genetische Manipulation der Regeneration: in vivo RNAi Fütterung Protokoll
- Vor dem Test vorbereiten Hühnerleber Homogenat. Discard Fettsäuren, gelb gefärbte Abschnitte aus Lebensmittelvorräten und Püree verbleibenden Leber. Filter Püree durch Mesh-Sieb und aliquoten Aufhängung für die Lagerung (1.5 mL Röhrchen, -20 ° C).
- Vor dem Test vorbereiten Rinder roten Blutkörperchen (Erythrozyten) durch Aliquotierung Versorgung in 1ml Proben bei -20 ° C.
- Wählen Würmer für RNAi. Drei Kohorten werden: Gen von Interesse, positive Kontrolle (Gen mit bekannten RNAi-Phänotyp; Abbildung 1C, D & E) und eine negative Kontrolle (Gen ohne RNAi-Phänotyp, auch nützlich für die Beurteilung der Knockdown Ebenen im Vergleich zu experimentellen Kohorte). Für jede Kohorte, verwenden Sie ~ 250 Würmer (~ 8-10 mm lange, nachdem hungern für mindestens 5 Tage). Shop in Quellwasser in Plastikwanne.
- Für jede RNAi Kohorte Tauwetter Lager von E. coli exprimieren dsRNA Targeting Gen von Interesse [8], zusammen mit einem Rohr aus Hühnerleber Homogenat [3.1] und einem Rohr von RBC [3,2].
- Pellet Bakterien (13.000 g, 1 Minute). Überstand entfernen und Pellet in 2xYT Medien (~ 700μl). Zentrifugieren, Überstand verwerfen, Pellet-Platz auf dem Eis.
- Erstellen Sie eine große Bohrung P200 Pipettenspitze durch das Abschneiden der Ende der Spitze. Gründlich resuspendieren Bakterienpellet in einer Mischung aus Geflügelleber Homogenat (150 mL) und Erythrozyten (50 ul), um RNAi Fütterung Remix erstellt werden. Luftblasen durch Zentrifugation.
- Für die Fütterung, entfernen Sie den größten Teil des Wassers aus der Kunststoffwanne mit Würmern (leave ~ 1 Zoll Tiefe). Swirl Wanne Würmer in der Mitte der Verpackung konzentrieren und Pipette RNAi Fütterung Mischung in einen Kreis einzupferchen Würmer. Verwenden Sie einen Transferpipette sorgfältig Koax-Flüchtlinge zurück auf die RNAi Fütterung Mix ohne störende anderen Gäste!
- Nach der Fütterung (~ 1 Stunde), zu identifizieren Planarien, die gut genährt. Diese Würmer zeigen eine tiefrote Färbung von eingenommenen RBC. Discard andere.
- Vorsichtig wieder Nährlösung mit frischem Quellwasser und minimiert Störungen Egestion von Lebensmitteln zu verhindern. Um dies zu tun, sanft lokalisieren die Würmer auf der einen Seite der Röhre mit einem Transferpipette, gieße trübem Wasser und sorgfältig mit frischem Wasser zu ersetzen ergossen sich die gegenüberliegende Wand der Wanne. Resubmerge Planarien schnell wie bei längerer Exposition an der Luft führt auch in Lebensmitteln Egestion.
- Locker seal Behälterdeckel und Rückkehr zum Inkubator (24 ° C)
- Wiederholen Sie die RNAi Fütterung Protokoll über mehrere Zyklen (~ 2-3 Tage auseinander), mit regenerativen Zyklen [Protokoll Nr. 1], um Bildschirm für RNAi-Phänotypen durchsetzt. Ein Standardprotokoll für die Fütterung und die Regeneration effektiv für viele Gene ist in Abbildung 2, die ca. 1 Monat dauert in Gesamtdauer angezeigt.
Ändern Sie diese Regelung für verschiedene Gene, wie eine optimale Protokoll auf Faktoren wie die Stabilität der mRNA-, Gewebe-Lokalisierungs-, Protein-perdurance oder die Entwicklung von einem Phänotyp, der mehrere Werkstücksumspannzyklen schließt nach der Regeneration abhängen wird. Beurteilen knockdown Ebenen durch einfaches Screening nach Penetranz des Phänotyps (wenn erkennbar), oder durch qPCR Ansätze zur gezielten mRNA-Spiegel mit negativen Kontrolle Kohorte zu vergleichen.
4. Repräsentative Ergebnisse:
Der Stamm-Fragment Regeneration Test ist robust, so dass alle Würmer sollten mit normaler anterior-posterior ("Kopf-Schwanz") Polarität zu regenerieren. Dies kann, sobald 5 Tage nach dem Schneiden, durch das Aufkommen des vorderen Augenflecken (asterixed, Abbildung 1A) erleichtert gewertet. Allerdings tritt vollständige morphologische Wiederherstellung der verlorenen Strukturen nach einer Woche. Pharmakologische Manipulation von Stamm-Fragment Regeneration durch PZQ zu zweiköpfigen Würmer Ausbeute (Abbildung 1B) ist auch robust (EC 50 = 87 (+ -) 11% bipolare Fragmente, 70μM PZQ für 48 Stunden 20). Bipolarität erfolgt über eine einzige regenerative Zyklus. Geringere Wirksamkeit bei diesen Tests wahrscheinlich bezieht sich auf Probleme mit Drogen Löslichkeit und / oder Lagerung oder Verwendung eines anderen flatworm Arten, bei denen PZQ ist unwirksam. Bei Medikamenten mit geringer Penetranz, ist eine Vorverlegung Index häufig verwendet, um Zwischen-Phänotypen beiseite Ergebnis aus kompletten Bipolarität 22. Phänotypen, die sich aus RNAi der positiven Kontrolle Konstrukte sind in Abbildung 1 dargestellt: RNAi von Dugesia japonica sechs 1 (D j-six-1) führt zu einer eyeless Phänotyp 23 (1C), RNAi von Dugesia japonica PC2 (Dj-PC2) führt zu einem Verlust des Lichtes Abneigung Antwort 24 (1D) und RNAi von Dugesia japonica βcatenin-1 (Dj-βcatenin-1) führt zu einer zweiköpfigen Phänotyp 16-19, 21 aus Stamm-Fragmente (Abb. 1E). Diese Phänotypen lassen sich mit den folgenden einfachen RNAi Protokolle werden: Dj-six-1 (FFxFx), Dj-PC2 (FFFx), Dj-βcatenin-1 (FFxFx), wo F = Fütterung Zyklus und x = regenerative Zyklus jeweils.
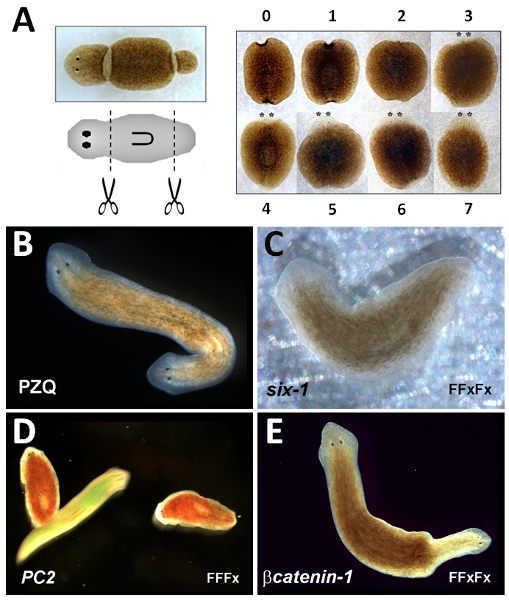
Abbildung 1:... Trunk Fragment Regeneration Assay A Left, Image der Planarie (oben) und schematische (Mitte) auf Position herausgeschnitten Stamm-Fragment zeigen Right, zeigt Zeitverlauf der Stamm-Fragment Regeneration Aussehen zu regenerieren Fragment bei angegebenen Zeiten (Tage) B Image of zweiköpfigen Planarie durch PZQ Belichtung hergestellt. C 'Eyeless "Wurm von Dj-six-1 RNAi. D Lichtverlust Abneigung Reaktion in immobile Dj-PC2 RNAi Würmer (rot gefärbt), im Vergleich zu mobilen Kontrolle Wurm (gebeizt hergestellt grün). E Bipolar Planarie von Dj-βcatenin-1 RNAi produziert. In BE, ist die ursprüngliche vordere Ende des RNAi Würmer orientiert sich an der linken Seite.
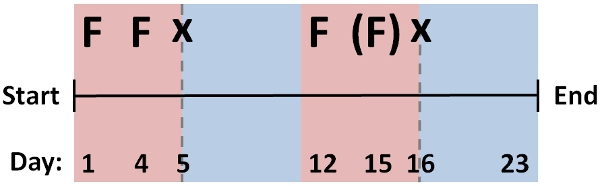
Abbildung 2: Ablauf der Fütterung und Schneiden Zyklen für typische RNAi-Protokoll aus mehreren Fütterungen (F), und der regenerativen Zyklen (x), die effektiv für Knockdown von vielen Genen in D. ist japonica. Änderung dieses Protokolls für einzelne Gene erforderlich sein, um optimale Ergebnisse zu erzielen, zum Beispiel mit einem weniger (Klammern) oder eine größere Anzahl von Fütterung und regenerative Zyklen.
Diskussion
Die Protokolle hier beschriebenen Details Assays zur Untersuchung und Manipulation Regeneration der Planarien Dugesia japonica. Sie sind einfach und erfordern keine spezielle Ausrüstung, so dass sie leicht im Labor oder im Klassenzimmer durchgeführt werden. Assays können einzeln ausgeführt werden, oder kombiniert (für chemisch-genetischen Screening von Drogen Wirkungsgraden in vivo) und kann bei der Kandidaten-Gen-Ebene durchgeführt werden, oder sind anpassungsfähig, unvoreingenommene, höheren Durchsatz-Screening 8. Ob für das Studium der faszinierenden Biologie der Planarien in ihrem eigenen Recht oder die Bewertung der in vivo-Funktion von Säuger-Homologen in einem alternativen Modell zum Studium der Regeneration der Gewebe, sollten diese Ansätze Interesse aus einem vielfältigen Angebot von Forschern zu katalysieren.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Arbeit im Labor ist von der NSF (MCB0919933) und NIH (GM088790) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagens | Verkäufer | Katalog-Nummer | Kommentare |
|---|---|---|---|
| Quellwasser | Kandiyohi. Premium-Waters Inc. Minneapolis, MN | n / a | Andere Formen von Quellwasser gut funktionieren auch. Studie erstmals Lebensfähigkeit Assays. |
| 1 x gepufferte Montjuïch Salze: NaCl (1,6 mm), CaCl2 (1mm), MgSO4 (1mm), MgCl2 (0,1 mm), KCl (0,1 mm), NaHCO3 (1,2 mm), HEPES (1,5 mm). pH 7,4 bei 24 ° C. | Mehrere Anbieter | n / a | Künstliche Wasser für medikamentöse Behandlungen während regenerative Assays zur pH-Pufferung zu gewährleisten. 5 / 8 Holtfreter-Lösung ist eine Alternative. |
| 2xYT Broth | Fisher Scientific | BP2467-500 | Media = 31 g / L. Autoklaviert. |
| Petrischale (100x25mm) | Fisher Scientific | 08-757-11 | Housing Würmer während Regenerationszyklen |
| Platz Dish (100x100x15mm) | Fisher Scientific | 08 bis 757-11A | Füllen Sie mit Wasser, einfrieren für Eiswürfelschale als Wurm Schnittfläche verwendet |
| Kunststoffwanne: Ziploc Twist 'n Loc (16oz). | Verschiedene Einzelhändler | n / a | Komfortable wasserdichte Behälter für RNAi Kohorten |
| Geflügelleber | Handelsregister Lebensmittelgeschäfte | n / a | Bias in Richtung Bio-Lieferungen wegen Vermeidung von Antibiotika. |
| Stabmixer | Jede Küche Lieferanten | n / a | Verwenden Sie für die Herstellung Hühnerleber Püree |
| Draht 1mm Mesh-Sieb | Jede Küche Lieferanten | n / a | Verwenden Sie zum Spannen Hühnerleber Püree |
| Bovine roten Blutkörperchen | Lampire Biological Laboratories | 7240807 | 100% gewaschene und RBC-Suspension gebündelt |
| Circular Filterpapiere | Whatman Nr. 3 | 1003 055 | |
| Transferpipette | Fisher Scientific | 13-711-41 | |
| Sterile, chirurgische Messer | Multiple Vendors | n / a | |
| ± Praziquantel | Sigma Aldrich | P4668 | Shop Pulver Aliquots im Dunkeln bei 4 ° C. Austrocknen. |
| Dj-six-1 | GenBank AJ557022.1 | RNAi positive Kontrolle für "eye-less"-Phänotyp 23 | |
| Dj-βcatenin-1 | GenBank AB181913.1 | RNAi positive Kontrolle für zweiköpfige Phänotyp 17 | |
| Dj-PC2 | RNAi positive Kontrolle für den Verlust von Licht Abneigung Phänotyp 24 |
Referenzen
- Morgan, T. H. Experimental studies of the regeneration of Planaria maculata. Arch Entwm Org. 7, 364-397 .
- Robb, S. M., Ross, E., Sánchez Alvarado, A. SmedGD: the Schmidtea mediterranea genome database. Nucleic Acids Res. 36, 599-606 (2008).
- Forsthoefel, D. J., Newmark, P. A. Emerging patterns in planarian regeneration. Curr Opin Genet Dev. 19, 412-4120 (2009).
- Adell, T., Cebrià, F., Saló, E. Gradients in Planarian Regeneration and Homeostasis. Cold Spring Harb Perspect Biol. 2, (2010).
- Agata, K., Watanabe, K. Molecular and cellular aspects of planarian regeneration. Semin Cell Dev Biol. 10, 377-383 (1999).
- Newmark, P. A. &. a. m. p. ;. a. m. p., Sánchez-Alvarado, A. Not your father's planarian: a classic model enters the era of functional genomics. Nat Rev Genet. 3, 210-219 (2002).
- Reddien, P. W., Sánchez-Alvarado, A. Fundamentals of planarian regeneration. Ann Rev Cell Dev Biol. 20, 725-757 (2004).
- Reddien, P. W., Bermange, A. L., Murfitt, K. J., Jennings, J. R., Sánchez-Alvarado, A. Identification of genes needed for regeneration, stem cell function, and tissue homeostasis by systematic gene perturbation in planaria. Dev Cell. 8, 635-649 (2005).
- Newmark, P. A., Reddien, P. W., Cebria, F. &. a. m. p. ;. a. m. p., Sánchez-Alvarado, A. Ingestion of bacterially expressed double-stranded RNA inhibits gene expression in planarians. Proc Natl Acad Sci USA. 100, 11861-11865 (2003).
- Collins, J. J. Genome-Wide Analyses Reveal a Role for Peptide Hormones in Planarian Germline Development. PLoS Biology. 8, e10000509-e10000509 (2010).
- Cebrià, F. Regenerating the central nervous system: how easy for planarians!. Dev Genes Evol. , 733-748 (2007).
- Mineta, K. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proc Natl Acad Sci USA. 100, 7666-7671 (2003).
- Oviedo, N. J., Nicolas, C. L., Adams, D. S., Levin, M. Emerging Model Organisms. A Laboratory Manual Chapter. 8, (2009).
- Buttarelli, F. R., Pellicano, C., Pontieri, F. E. Neuropharmacology and behavior in planarians: translations to mammals. Comp Biochem Physiol. 147, 399-408 (2008).
- Sánchez-Alvarado, A., Newmark, P. A. Double-stranded RNA specifically disrupts gene expression during planarian regeneration. Proc Natl Acad Sci U S A. 96, 5049-5054 (1999).
- Gurley, K. A., Rink, J. C., Sánchez-Alvarado, A. Beta-catenin defines head versus tail identity during planarian regeneration and homeostasis. Science. 319, 323-327 (2008).
- Yazawa, S., Umesono, Y., Hayashi, T., Tarui, H., Agata, K. Planarian Hedgehog/Patched establishes anterior-posterior polarity by regulating Wnt signaling. Proc Natl Acad Sci U S A. 106, 22329-22334 (2009).
- Petersen, C. P., Reddien, P. W. Smed-betacatenin-1 is required for anteroposterior blastema polarity in planarian regeneration. Science. 319, 327-330 (2008).
- Iglesias, M., Gomez-Skarmeta, J. L., Saló, E., Adell, T. Silencing of Smed-betacatenin1 generates radial-like hypercephalized planarians. Development. 135, 1215-1221 (2008).
- Nogi, T., Zhang, D., Chan, J. D., Marchant, J. S., S, J. A novel biological activity of praziquantel requiring voltage-operated Ca2+ channel beta subunits: subversion of flatworm regenerative polarity. PLoS Negl Trop Dis. 3, e464-e464 (2009).
- Oviedo, N. J. Long-range neural and gap junction protein-mediated cues control polarity during planarian regeneration. Dev Biol. 339, 188-199 (2010).
- Nogi, T., Levin, M. Characterization of innexin gene expression and functional roles of gap-junctional communication in planarian regeneration. Dev Biol. 287, 314-335 (2005).
- Mannini, L. Djeyes absent (Djeya) controls prototypic planarian eye regeneration by cooperating with the transcription factor Djsix-1. Dev Biol. 269, 346-359 (2004).
- Agata, K. Structure of the planarian central nervous system (CNS) revealed by neuronal cell markers. Zoolog Sci. 15, 433-440 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten