Method Article
Farmakolojik ve Fonksiyonel Genetik Tahliller Planarian Rejenerasyon işleyin Dugesia
Bu Makalede
Özet
, Canlı hayvan içinde kök hücre farklılaşması çalışmak için cazip bir model planarian flatworm. Yenileme, temel laboratuvar kolayca yapılır basit amputasyon deneyleri ile çalışılmış ve farmakolojik ve genetik (uygun In vivo RNAi) Bu makalede protokolleri tarafından ayrıntılı olarak manipülasyon.
Özet
Serbest yaşayan planarian flatworms olağanüstü rejeneratif kabiliyetleri 1 deneysel kullanım nedeniyle uzun bir geçmişi var. Bu hayvanların eksize Küçük parçaları eksik vücut yapıları yenilenme orijinal vücut planı reformu. Örneğin, eğer sağlam bir solucan bir 'gövde' parçası kesilir, yeni bir 'kafa' anteriora yeniden ve 'kuyruk' (Şekil amputasyon öncesindeki özgün vücut yapılarının 'baş-kuyruk' kutupluluk geri posteriora yeniden 1A).
Yenileme, 'normal vücut homeostazı ve uygulanan doku rejenerasyonu sırasında ~ 30 farklı hücre tipleri haline ayırt neoblasts' olarak bilinen planarian kök hücreleri tarafından tahrik edilmektedir. Bu rejeneratif sürecinin sağlam ve göstermek için kolay. Şimdi birkaç öncü laboratuarları, birçok araç ve fonksiyonel genetik yöntemler bağlılığı sayesinde bu model sistemi için optimize edilmiştir. Sonuç olarak, önemli son gelişmeler planarian gelişimsel plastisite 2-9 temelini oluşturan moleküler olayları anlama ve manipüle yapılmıştır.
Planarian model sistem bilim adamlarından oluşan geniş bir ilgi olacaktır. Sinirbilimciler için, model, bütün bir sinir sisteminin rejenerasyon çalışması yerine, sadece tek bir sinir hücresi süreci genellikle birçok kurulan modellerde çalışmanın odak regrowth / tamir için fırsat tanıyor. Planaryalar bir bolluk ifade nörotransmitterlerin (10), merkezi sinir sistemi 11, 12, evrim eğitimi için önemli bir sistem temsil ve davranış tarama potansiyeli 13, 14 .
Rejeneratif sonuçlarını, farmakolojik ve genetik apparoaches tarafından manipülasyon için uygun. Örneğin, uyuşturucu, sadece gövde parçaları yerleştirerek amputasyon sonra uyuşturucu içeren farklı zaman noktalarında çözümler rejenerasyon üzerindeki etkileri için taranmalıdır. Mikroenjeksiyon, devir veya dsRNA yapıları 8, 9, 15, bakteriyel ifade beslenme yoluyla da elde edilebilir demonte yöntemleri (in vivo RNAi), bireysel genlerin rolü incelenebilir . Her iki yaklaşım, bipolar hayvanlar 16-21 yüksek penetrans-örneğin, rejenerasyon görsel olarak çarpıcı fenotipleri üretebilir . Bu model ve bu yöntemlerin uygulanması benimsenmesini kolaylaştırmak için, biz, planarian Dugesia japonica kullanarak, farmakolojik ve genetik testlerin (in vivo RNAi ile besleyerek) Bu video makale protokollerde vitrin.
Protokol
1. Trunk parçası rejenerasyon tahlil
- Hayvanların atık ve yutulur gıda (~ 30 bozulmamış solucanlar, her solucan ~ açlık sonrası 8-10 mm uzunluğunda) emin olmak için en az 5 gün önce rejeneratif tahlil için solucanlar bir kohort beslenme durdurun.
- Testinin gününde, su ile önceden dondurulmuş tesviye buz bulaşık durulama ve plastik wrap ile düz buzlu bir yüzey kapağı. Forseps kullanarak, plastik ambalaj malzemesi ile bir filtre kağıdı yerleştirin.
- Filtre kağıdı, kaynak suyu birkaç damla ile ıslatın. Planaryalar bir transfer pipet kullanarak filtre (filtre ortalama <20 solucanlar) üzerine aktarın. Worms, gerekirse daha fazla kaynak suyu ile repipetting, filtre yeniden konumlandırılmış olabilir. Aşırı sıvı çıkarın.
- Bir neşter kullanılarak, tek bir kesim hayvan ön apeks ve yutak (Şekil 1A) ön ucu arasında yaklaşık yarım baş organını.
- Bir neşter kullanılarak, yaklaşık yarım kuyruk hayvan sonu ve yutak (Şekil 1A) arka ucu arasında yapılan tek bir kesim tarafından kuyruk bölgesi organını. Neşter kestikten sonra% 70 etanol ile ıslatılmış kağıt havlu ile aşırı mukus çıkarın. Neşter fazla etanol silin.
- Kaynak suyu içeren bir Petri kabı (100 x 25mm derinlik) içine forseps aracılığıyla filtre aktarın. (Yaranın kapanması için, yara pinching ve koyulaşması tarafından gözlemlenebilir) ~ 3 dakika bekleyin.
- Petri kabı içeren termostatlı inkübatör rejeneratif tahlil ve transfer (24 ° C) için istenen orta gövde parçalarının içine filtre kağıdı durulayın.
- ~ 1 hafta sonra yeniden yapılar tanımlanabilir (Şekil 1A) Puan rejeneratif fenotipi.
2. Farmakolojik manipulasyon praziquantel tarafından uyarılan iki kutupluluk: rejenerasyon
- DMSO çözülebilmesinde ilaç (62.4mg PZQ 200mm hisse senedi için 1 ml) praziquantel (PZQ) stok hazırlayın. Aynı gün kullanın.
- Tamponlu Montjuch tuzları ilaç içeren solüsyon (90 mcM PZQ) 50ml olun. ~ Dağılım sağlamak için 1 dakika karıştırın.
- [Protokol # 1], son adım [1.7] PZQ gövde parçalarının bir kohort açığa, yukarıda ayrıntılı olarak gövde parçası rejeneratif tahlil gerçekleştirin.
- 24-48 saat sonra, döviz PZQ içeren, kaynak suyu için medya solucanlar birkaç kez çamaşır (> 3).
- Inkübatör için solucanlar dönün. Puan iki kutupluluk (iki başkanları, Şekil 1B) bir hafta sonra kesme.
3. Rejenerasyon Genetik manipülasyon: in vivo RNAi besleme protokolü
- Önce tahlil, tavuk karaciğeri Homojenat hazırlar. Gıda stoklarının gelen yağ, sarı renkli bölümler, ve püresi kalan karaciğer atın. Depolama için örgü süzgeç ve alikotu süspansiyon (1.5mL tüpler, -20 ° C) süzülür püresi.
- Tahlil için, önce 1mL örnekleri -20 ° C'de saklanan, arz aliquoting sığır kırmızı kan hücreleri (eritrositler) hazırlamak
- RNAi için solucanlar seçin. Üç kohortlarında kullanılır: ilgi gen, pozitif kontrol (bilinen RNAi fenotip gen Şekil 1C, D & E) ve negatif kontrol (hiçbir RNAi fenotip gen, aynı zamanda deneysel kohort göre demonte seviyelerinin değerlendirilmesi için yararlı). Her kohort için, ~ 250 solucanlar (en az 5 gün açlıktan sonra uzun ~ 8-10 mm) kullanın. Plastik küvet kaynak suyu saklayın.
- Ilgi dsRNA hedef gen ifade E. coli her RNAi kohort, çözülme stok için [8], tavuk karaciğeri Homojenat bir tüp ile birlikte [3,1] ve eritrositlerde bir tüp [3,2].
- Pelet bakteriler (13.000 g, 1 dakika). Süpernatant ve tekrar süspansiyon pelet 2xYT medya (~ 700μl) çıkarın. Recentrifuge buz üzerinde supernatant, yer pelet atmak.
- Büyük bir delik P200 pipet ucu sonu keserek oluşturun. RNAi beslenme karışımı oluşturmak için tavuk karaciğeri Homojenat (150 mcL) ve eritrosit (50 mcL) oluşan bir karışım iyice bakteriyel pelet tekrar süspansiyon haline getirin. Santrifüj hava kabarcıklarını çıkarın.
- Besleme için (~ 1 inç derinlikte terk) solucanları içeren plastik küvet suyun çoğunluğu çıkarın. Swirl küvet, solucanlar, bu kabın merkezinde konsantre ve solucanlar corralling bir daire içinde pipet RNAi beslenme karışımı. Diğer Diners rahatsızlık vermesini dikkatlice RNAi beslenme karışımı üzerine geri kaçakla koaksiyel bir transfer pipet kullanın!
- Beslemeden sonra (~ 1 saat), iyi beslenen Planaryalar belirlemek. Bu solucanlar yutulur eritrositlerde koyu kırmızı bir renklenme gösterir. Diğerleri atın.
- Dikkatle, taze bahar su ile çözüm beslenme, gıda egestion önlemek için rahatsızlığı en aza indirmek değiştirin. Bunu yapmak için, hafifçe bir tarafa transfer pipet kullanarak tüp, bulanık su dökmek ve dikkatli bir şekilde küvetin Karşı duvarda dökülen tatlı su ile değiştirin solucanlar yerelleştirmek. Resubmerge Planaryalar hızla havaya uzun süre maruz kalma olarak da gıda egestion sonuçları.
- Gevşek seal konteyner kapağı ve kuvöz dönüş (24 ° C)
- Rejeneratif döngüleri [protokol # 1] RNAi fenotipleri için ekran ile serpiştirilmiş çok sayıda döngüleri üzerinden RNAi besleme protokolü (~ 2-3 gün arayla), tekrarlayın. Şekil 2, toplam süresi yaklaşık 1 ay sürüyor, birçok genin etkili beslenme ve yenilenme için standart bir protokol gösterilmiştir .
Optimum protokol mRNA stabilitesini, doku yerelleştirme, protein perdurance, ya da birden fazla besleme döngüleri rejenerasyon sonra önleyen bir fenotip gelişimi gibi faktörlere bağlı olarak, farklı genler için bu şemaya değiştirin. Sadece negatif kontrol kohort ile hedef mRNA düzeylerini karşılaştırmak için fenotipi (görünen eğer) penetrans tarama, veya qPCR yaklaşımlarla tarafından demonte seviyeleri değerlendirin.
4. Temsilcisi sonuçları:
Gövde parçası rejenerasyon tahlil tüm solucanlar normal ön-arka ('baş-kuyruk) polarite ile yeniden gerektiği gibi sağlam. Bu kısa sürede, ön eyespots (asterixed Şekil 1A) ortaya çıkması kolaylaştırılmış kesme beş gün sonra, atılır . Ancak, kayıp yapıların morfolojik restorasyon tam bir hafta sonra ortaya çıkar. Iki başlı solucanlar verim PZQ gövde parçası yenilenme Farmakolojik manipulasyon (Şekil 1B) aynı zamanda güçlü (EC 50 = 87 (+ -)% 11 bipolar parçaları, 48 saat 20 70μM PZQ). Iki kutupluluğun tek bir rejeneratif döngüsü boyunca ortaya çıkar. Bu testleri daha düşük etkinlik, büyük olasılıkla uyuşturucu çözünürlük ve / veya depolama, veya PZQ etkisiz bir farklı flatworm türlerin kullanımı ile ilgili sorunlar ile ilgilidir. Penetrasyonun daha düşük olan ilaçlar için, bir anteriorization indeksi genellikle tam iki kutupluluk 22 kenara ara fenotipleri puan için kullanılır. Pozitif kontrol yapıları RNAi fenotipleri Şekil 1'de gösterilmiştir: japonica Dugesia RNAi altı-1 (D j-six-1), gözsüz bir fenotip 23 (Şekil 1C), Dugesia japonica PC2 RNAi (Dj-PC2) sonuçları ışık kaçınma tepkisi 24 (Şekil 1D) ve RNAi kaybı sonuçları Dugesia japonica βcatenin-1 (Dj-βcatenin-1), iki başlı bir gövde parçaları (Şekil 1E) fenotip 16-19, 21 sonuç . Bu fenotipleri aşağıdaki basit RNAi protokolleri kullanarak elde edilebilir: Dj-altı-1 (FFxFx), Dj-PC2 (FFFx), Dj-βcatenin-1 (FFxFx), F = besleme döngüsü ve x = rejeneratif döngüsü sırasıyla.
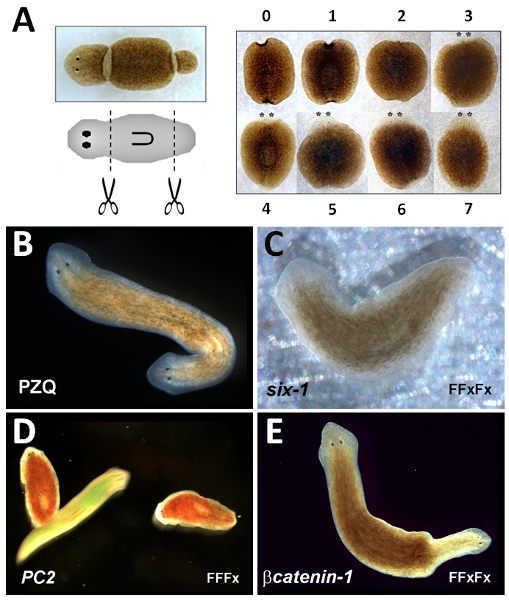
Şekil 1:... Trunk parçası rejenerasyon tahlil Sol, planarian (üstte) ve şematik (orta) Image eksize gövde parçası yerini göstermek için sağ, gövde parçası yenilenme timecourse belirtilen zamanlarda yenileyici parçası görünümünü gösteren (gün) B PZQ maruz tarafından üretilen iki başlı planarian Image Dj-altı-1 RNAi. mobil kontrol solucan göre hareketsiz Dj-PC2 RNAi solucanlar (lekeli kırmızı) ışık kaçınma tepkisi D kaybı, (lekeli tarafından üretilen C 'gözsüz' solucan Dj-βcatenin-1 RNAi tarafından üretilen yeşil) E Bipolar planarian. BE, RNAi solucanlar orijinal anterior ucu sola yönelik.
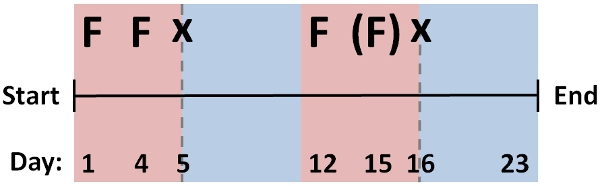
Şekil 2: D. birçok genin etkili olduğu demonte için birden fazla beslenmeleri oluşan tipik RNAi protokolü (F) ve rejeneratif döngüleri (x) için devir besleme ve kesim sırası japonica. Bireysel genler için bu protokol Modifikasyonu kullanarak, örneğin, en iyi sonuçlar için gerekli olabilecek daha az (parantez) veya besleme ve rejeneratif döngüleri daha büyük bir sayı.
Tartışmalar
Protokolleri japonica planarian Dugesia yenilenme eğitim ve işlenmesi için burada ayrıntılı testlerin nitelendirdi. Bunlar basit ve kolayca laboratuar veya sınıf yapılabilir gibi özel ekipman gerektirmez. Tahliller ayrı ayrı ya da kombine (kimyasal ilaç etkinliklerinin in vivo genetik tarama için) ve aday gen düzeyinde yapılabilir, ya da tarafsız, daha yüksek verim tarama 8 adapte olabilir. Kendi sağ Planaryalar ilginç biyoloji eğitim için olsun, ya da doku rejenerasyonu çalışmak için alternatif bir model memeli homologları in vivo fonksiyonu değerlendirmek için, araştırmacılar bu yaklaşımların çeşitli faiz katalize edilmelidir .
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Laboratuarda İş NSF (MCB0919933) ve NIH (GM088790) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif | Satıcı | Katalog Numarası | Yorumlar |
|---|---|---|---|
| Kaynak suyu | Kandiyohi. Premium Waters A.Ş. Minneapolis, MN | n / a | Kaynak suyu diğer formları da iyi çalışır. Canlılığı testlerin ilk deneme. |
| (1,6) NaCl, CaCl2 (1mm), MgSO4 (1mm), MgCl2 (0.1mm), KCl (0.1mm), NaHCO3 (1.2mm), Hepes (1.5mm): 1 x Montjuich tuzları tamponlu. 24 pH 7.4 ° C. | Birden çok tedarikçiden | n / a | PH tampon sağlamak için rejeneratif deneyleri sırasında ilaç tedavileri için yapay su. 5 / 8 Holtfreter çözümü bir alternatiftir. |
| 2xYT Broth | Fisher Scientific | BP2467-500 | Medya = 31 g / L. Otoklavlı. |
| Petri Dish (100x25mm) | Fisher Scientific | 08-757-11 | Yenilenme döngüleri sırasında Konut solucanlar |
| Kare Bulaşık (100x100x15mm) | Fisher Scientific | 08-757-11A | Solucan kesim yüzeyi buz tepsisi olarak kullanılan su, dondurma ile doldurun |
| Plastik küvet: Ziploc Büküm 'n Loc (16oz). | Çeşitli perakendeciler | n / a | RNAi kohortlarında için uygun su geçirmez kaplarda |
| Tavuk Karaciğer | Ticari bakkal | n / a | Antibiyotik kaçınma nedeniyle organik kaynakları önyargılı. |
| Blender | Herhangi bir mutfak tedarikçisi | n / a | Tavuk karaciğeri püresi yapmak için kullanın. |
| Tel 1mm Mesh süzgeç | Herhangi bir mutfak tedarikçisi | n / a | Tavuk karaciğeri püresi süzme için kullanın |
| Sığır kırmızı kan hücreleri | Lampire Biyolojik Laboratuvarları | 7240807 | % 100 eritrosit süspansiyonu Yıkanmış ve havuzlu |
| Dairesel filtre kağıtları | Whatman # 3 | 1003 055 | |
| Transferi Pipet | Fisher Scientific | 13-711-41 | |
| Steril, cerrahi bıçaklar | Birden çok tedarikçiden | n / a | |
| ± Praziquantel | Sigma Aldrich | P4668 | 4 karanlıkta saklayın toz alikotları ° C Birbirinden ayrılacak. |
| Dj-altı-1 | GenBank AJ557022.1 | RNAi "göz" fenotip 23 için pozitif kontrol | |
| Dj-βcatenin-1 | GenBank AB181913.1 | Iki başlı fenotip 17 RNAi pozitif kontrol | |
| Dj-PC2 | RNAi, ışık kaçınma fenotip 24 kaybı için pozitif kontrol |
Referanslar
- Morgan, T. H. Experimental studies of the regeneration of Planaria maculata. Arch Entwm Org. 7, 364-397 .
- Robb, S. M., Ross, E., Sánchez Alvarado, A. SmedGD: the Schmidtea mediterranea genome database. Nucleic Acids Res. 36, 599-606 (2008).
- Forsthoefel, D. J., Newmark, P. A. Emerging patterns in planarian regeneration. Curr Opin Genet Dev. 19, 412-4120 (2009).
- Adell, T., Cebrià, F., Saló, E. Gradients in Planarian Regeneration and Homeostasis. Cold Spring Harb Perspect Biol. 2, (2010).
- Agata, K., Watanabe, K. Molecular and cellular aspects of planarian regeneration. Semin Cell Dev Biol. 10, 377-383 (1999).
- Newmark, P. A. &. a. m. p. ;. a. m. p., Sánchez-Alvarado, A. Not your father's planarian: a classic model enters the era of functional genomics. Nat Rev Genet. 3, 210-219 (2002).
- Reddien, P. W., Sánchez-Alvarado, A. Fundamentals of planarian regeneration. Ann Rev Cell Dev Biol. 20, 725-757 (2004).
- Reddien, P. W., Bermange, A. L., Murfitt, K. J., Jennings, J. R., Sánchez-Alvarado, A. Identification of genes needed for regeneration, stem cell function, and tissue homeostasis by systematic gene perturbation in planaria. Dev Cell. 8, 635-649 (2005).
- Newmark, P. A., Reddien, P. W., Cebria, F. &. a. m. p. ;. a. m. p., Sánchez-Alvarado, A. Ingestion of bacterially expressed double-stranded RNA inhibits gene expression in planarians. Proc Natl Acad Sci USA. 100, 11861-11865 (2003).
- Collins, J. J. Genome-Wide Analyses Reveal a Role for Peptide Hormones in Planarian Germline Development. PLoS Biology. 8, e10000509-e10000509 (2010).
- Cebrià, F. Regenerating the central nervous system: how easy for planarians!. Dev Genes Evol. , 733-748 (2007).
- Mineta, K. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proc Natl Acad Sci USA. 100, 7666-7671 (2003).
- Oviedo, N. J., Nicolas, C. L., Adams, D. S., Levin, M. Emerging Model Organisms. A Laboratory Manual Chapter. 8, (2009).
- Buttarelli, F. R., Pellicano, C., Pontieri, F. E. Neuropharmacology and behavior in planarians: translations to mammals. Comp Biochem Physiol. 147, 399-408 (2008).
- Sánchez-Alvarado, A., Newmark, P. A. Double-stranded RNA specifically disrupts gene expression during planarian regeneration. Proc Natl Acad Sci U S A. 96, 5049-5054 (1999).
- Gurley, K. A., Rink, J. C., Sánchez-Alvarado, A. Beta-catenin defines head versus tail identity during planarian regeneration and homeostasis. Science. 319, 323-327 (2008).
- Yazawa, S., Umesono, Y., Hayashi, T., Tarui, H., Agata, K. Planarian Hedgehog/Patched establishes anterior-posterior polarity by regulating Wnt signaling. Proc Natl Acad Sci U S A. 106, 22329-22334 (2009).
- Petersen, C. P., Reddien, P. W. Smed-betacatenin-1 is required for anteroposterior blastema polarity in planarian regeneration. Science. 319, 327-330 (2008).
- Iglesias, M., Gomez-Skarmeta, J. L., Saló, E., Adell, T. Silencing of Smed-betacatenin1 generates radial-like hypercephalized planarians. Development. 135, 1215-1221 (2008).
- Nogi, T., Zhang, D., Chan, J. D., Marchant, J. S., S, J. A novel biological activity of praziquantel requiring voltage-operated Ca2+ channel beta subunits: subversion of flatworm regenerative polarity. PLoS Negl Trop Dis. 3, e464-e464 (2009).
- Oviedo, N. J. Long-range neural and gap junction protein-mediated cues control polarity during planarian regeneration. Dev Biol. 339, 188-199 (2010).
- Nogi, T., Levin, M. Characterization of innexin gene expression and functional roles of gap-junctional communication in planarian regeneration. Dev Biol. 287, 314-335 (2005).
- Mannini, L. Djeyes absent (Djeya) controls prototypic planarian eye regeneration by cooperating with the transcription factor Djsix-1. Dev Biol. 269, 346-359 (2004).
- Agata, K. Structure of the planarian central nervous system (CNS) revealed by neuronal cell markers. Zoolog Sci. 15, 433-440 (1998).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır