Method Article
La interacción hidrofóbica automatizada cromatografía en columna de selección para uso en la purificación de proteínas
En este artículo
Resumen
Un método automático para la identificación adecuados cromatografía de interacción hidrófoba (HIC) medios para ser utilizados en el proceso de purificación de proteínas se presenta. El método utiliza un sistema de líquido de presión media, incluyendo cromatografía de buffer blending automatizado, la inyección de la muestra dinámica de bucle, la selección secuencial de columna, el análisis de múltiples longitudes de onda, y la recolección dividida fracción del eluato.
Resumen
En contraste con otros métodos cromatográficos para las proteínas purificadores (por ejemplo, filtración en gel, afinidad y de intercambio iónico), cromatografía de interacción hidrofóbica (HIC) comúnmente requiere la determinación experimental (referido como cribado o "exploración") con el fin de seleccionar el medio cromatográfico más adecuado para purificar una proteína dada 1. El método aquí presentado describe un enfoque automatizado a la exploración de un medio óptimo de HIC para ser utilizados en la purificación de proteínas.
HIC separa las proteínas y otras biomoléculas de un lisado crudo basado en las diferencias de hidrofobicidad. Similar a la cromatografía de afinidad (AC) y cromatografía de intercambio iónico (IEX), HIC es capaz de concentrar la proteína de interés a medida que avanza a través del proceso cromatográfico. Las proteínas más adecuados para la purificación por HIC son aquellos con las regiones de la superficie hidrofóbica y capaces de soportar la exposición a la sal concentraciones superiores a 2 M municiónsulfato de Milenio ((NH 4) 2 SO 4). HIC se elige a menudo como un método de purificación de proteínas que carecen de una etiqueta de afinidad, y por lo tanto inadecuados para CA, y cuando IEX no proporciona purificación adecuada. Restos hidrófobos en la superficie de la proteína temporalmente unirse a un ligando no polar acoplado a una matriz inerte, inmóvil. La interacción entre la proteína y el ligando son altamente dependientes de la concentración de sal del tampón que fluye a través de la columna de cromatografía, con altas concentraciones iónicas fortalecimiento de la interacción proteína-ligando y haciendo que la proteína inmóvil (es decir, unido dentro de la columna) 2. Como sal disminución concentraciones, la interacción proteína-ligando se disipa, la proteína vuelve a ser móvil y se eluye de la columna. Varios medios de HIC están disponibles comercialmente en preenvasados columnas, cada una contiene de varios ligandos hidrófobos (por ejemplo, S-butilo, butilo, octilo, y fenil) reticulado a diferentes densidades de perlas de agarosa de una especificaciónde diámetro IFIC 3. La columna de exploración automática permite un enfoque eficaz para la determinación de que los medios de HIC se debe emplear para futuros experimentos, optimización más exhaustivos y purificación de proteínas se ve un 4.
La proteína específica que se purificó aquí es la proteína recombinante fluorescente verde (GFP), sin embargo, el enfoque puede ser adaptado para la purificación de otras proteínas con una o más regiones superficiales hidrofóbicas. GFP actúa como una proteína modelo de utilidad, debido a su estabilidad, máximo única absorción de luz de 397 nm, y la fluorescencia cuando se expone a la luz UV 5. Lisado bacteriano que contiene GFP tipo salvaje se preparó en un tampón de alto contenido en sal, se carga en un sistema de Bio-Rad medio DuoFlow cromatografía presión del líquido, y se adsorbe en columnas HiTrap HIC que contienen diferentes medios de HIC. La proteína se eluyó de las columnas y se analizó mediante en-línea y de ejecución posterior a métodos de detección. Mezcla de búfer, la inyección de dinamismo loop, col secuencialUMN selección, el análisis de múltiples longitudes de onda, y la recogida de división fracción eluato aumentado la funcionalidad del sistema y la reproducibilidad del método experimental.
Protocolo
1. Buffer y preparación de muestras
- Nota técnica: Todos los tampones se deben refrigerar y cada paso de este protocolo se debe realizar en hielo oa 4 ° C, a menos que se indique lo contrario. La baja temperatura es esencial para prevenir la degradación de la proteína a purificar y para garantizar las condiciones de funcionamiento óptimas. Los medios de comunicación de HIC puede producir resultados diferentes de separación si se opera a temperatura ambiente, y el sistema de cromatografía debe ser operado en una caja de 4 ° C ambiente frío o frío.
- Preparar 500 ml de los siguientes topes: 200 mM NaH 2 PO 4 (Buffer A1), 200 mM Na 2 HPO 4, (tampón A2), y 4,8 M (NH 4) 2 SO 4 (B2 del buffer). El agua desionizada (B1 Tampón) también se utilizará. Degas la memoria intermedia para garantizar óptimas condiciones de funcionamiento cromatográficas. El maximizador sistema se mezclan Buffers A1 y A2 para generar un tampón fosfato bajo contenido de sal de elución, y se mezcla B1 y B2 Bufferspara generar el alto contenido en sal sulfato de amonio tampón inicial (2,4 M (NH 4) 2 SO 4).
- Preparar 20 ml de muestra a ser cargado mediante la mezcla de 10 ml de lisado de células que contiene la proteína a ser purificado con 10 ml de tampón de B2. La concentración de sulfato de amonio final de la solución celular lisado muestra debe ser de aproximadamente 2,4 M (NH 4) 2 SO 4, por lo que es aproximadamente equivalente a la memoria intermedia de inicio. Lisado celular se pueden preparar por resuspender el sedimento celular bacteriana en tampón TE (10 mM Tris 1 mM EDTA, pH 8,0) seguido por ultrasonidos o la adición de 1 mg / ml de lisozima y centrifugación a 3.700 xg durante 10 minutos.
- Se filtra la mezcla lisado-tampón a través de una baja unión a proteínas 0,45 micras jeringa filtro para eliminar las partículas de la solución. Mantener la muestra en hielo hasta que esté listo para ser cargado en el sistema.
2. Configuración física y Plomería de DuoFlow sistema de cromatografía
- Asegúrese de que toda la energía del dispositivo y las conexiones de comunicación se hacen. Los dispositivos deben ser visibles en la ventana de DuoFlow biológica cromatografía de software de control manual. Un resumen de los dispositivos se muestran en la Tabla 1. Una ilustración del sistema y el diagrama de fontanería es en la Figura 2.
- Conecte las conexiones eléctricas de las válvulas a los puertos maximizador de la bomba de estación de trabajo y el sistema de tal manera que la numeración del puerto sigue una secuencia lógica. Marque cada válvula con su número de puerto correspondiente para futuras consultas. La estación de trabajo de la bomba y maximizador de servir como sistema de las conexiones principales de comunicación entre el ordenador / controlador y el sistema de cromatografía. Las válvulas se reconocen automáticamente y se muestra en el software cuando se conecta a cualquiera de los dispositivos.
- Nota técnica: Si bien el funcionamiento del sistema de cromatografía en modo manual, las válvulas se controlan de forma independiente. Tenga cuidado para comprobar que la trayectoria de flujo deseado se configura, en particular cuando las válvulas de conmutación, antes de iniciar aficionadoER flujo.
- Sumerja el tubo de teflón en los buffers A1, A2, B1 y B2. Asegúrese de volúmenes adecuados de búfer están disponibles para todo el protocolo y que la tubería seguirá siendo sumergido. Preparación de 500 ml de buffers A1, A2 y B2 y 1 l de tampón B1 será adecuada.
- Plumb muestra la carga de la válvula y el bucle de muestra dinámica como se ilustra en la Figura 2 y según las instrucciones del fabricante. Conectar el bucle de muestra a la entrada de la válvula de muestra (Posición 3) utilizando la menor longitud de la tubería sea posible. Esto minimizará la dilución de la muestra durante el proceso de carga de la muestra.
- Reducir al mínimo la longitud del tubo entre la muestra, la bomba de carga de la muestra, y la carga de la muestra de entrada de la válvula (posición 2). Esto disminuirá la cantidad de muestra necesaria para cargar el bucle de muestra.
- Preparar 8 pares de idéntico tamaño de 1/16 "tubo PEEK OD, con cada par unidos por una unión hembra 1/4-28 female-to-1/4-28. Conecte los pares de las posiciones 1-8 de la segunda columna Las válvulas de selección. La Unión 7s conectados en línea a las posiciones de las columnas de la válvula de selección de 2-8 luego serán sustituidas por las columnas de cromatografía para ser probadas. La unión en línea conectada con la posición 1 se mantiene como una columna de cromatografía de derivación.
- Nota técnica: Asegurarse de que cada par de tubos está conectado a la misma posición en ambas válvulas de columna de selección.
- Encienda el UV de longitud de onda de 4 / Detector Vis (QuadTec) de la lámpara y la longitud de onda fija de la lámpara 280 nm Detector UV. Las longitudes de onda para ser medidos por el QuadTec de este protocolo son, entre 214 nm, 280 nm y 397 nm. Medición de 280 nm tanto con el detector de UV de longitud de onda fija y QuadTec proporciona redundancia del sistema y asegura la validez de los datos.
- Confirme todos los detectores están calibrados según las instrucciones del fabricante. El regulador de contrapresión es necesario para reducir la acumulación de burbujas de aire en los detectores y debe ser instalada aguas abajo de los detectores, pero aguas arriba del monitor de pH.
- El sistema que aquí se presenta incluye dos fraccionamienton los colectores, lo que proporciona mayor comodidad importante para el análisis posterior a la ejecución de eluido. Una los colectores de fracciones, válvula de flujo divisor, y el controlador divisor como se ilustra en la Figura 2. El colector de fracciones conectado a la posición 1 de la válvula divisor recogerá 900 fracciones de eluato l en 12 ml tubos de cultivo, mientras que el colector de fracciones conectado a la posición 2 se recogen fracciones de 100 l de eluato en 96 placas de microtitulación así.
- La posición 2 colector de fracciones, divisor de la válvula, y el controlador divisor funcionan sin conexión de la estación de trabajo de la cromatografía. El controlador divisor está contenida dentro de una bomba de Bio-Rad Econo degradado, sin embargo, el componente de la bomba del dispositivo no se utiliza. Un "Split%" valor de la opción se mostrará en la bomba de gradiente Econo cuando la válvula divisora está conectada a ella.
- % Split Set a 10. La posición 1 colector de fracciones se recogen 90% del eluato (900 l / fracción), y la posición 2 colector de fracciones se recogen10% (100 l / fracción). Los colectores de fracciones avanzará en sincronía permitiendo números fracción de ambos colectores para corresponder a la otra.
- Vuelva a colocar el colector estándar de fracción de la cabeza caída sobre el colector Posición fracción 2 con la cabeza caída de microplacas. La cabeza gota microplaca tiene una abertura más pequeña, que permite el conjunto de tamaños de gota 50% más pequeñas (es decir, 25 l en lugar de la l estándar 50) y es particularmente beneficioso cuando la recogida inferior o igual a 500 fracciones l.
- Utilizando el panel de control en la pantalla, ajustar la posición 2 colector de fracciones para recoger las fracciones en placas de 96 pocillos y avanzar a un ritmo de 1 muestra / minuto. El controlador divisor y la posición 2 colector de fracciones se inicia manualmente inmediatamente después del comienzo de la carrera de cromatografía primero.
- Enjuague la posición 2 colector de fracciones y la cabeza caída microplaca con tampón B1.
3. Líneas de cebado del sistema, método de programación de ejecución, y EquilibratIng. HIC Columnas
- Con sistema de líneas de entrada maximizador sumergido en Buffers desgasificado A1, A2, B1, B2, y las bombas principales del puesto de trabajo, enjuague bucle de muestra, y limpiar el sistema de cromatografía de acuerdo con las instrucciones del fabricante. Paso de cebado completo con las 4 entradas del sistema Maximizer (A1, A2, B1 y B2) con el fin de eliminar las burbujas de aire que quedan.
- Preparación del sistema requiere la operación manual del controlador del sistema a través del software BioLogic. Confirme la correcta posición de la válvula de carga de la muestra y las válvulas de la columna de selección antes de iniciar el flujo de búfer.
- Preparar para iniciar un manual de 1 ml / minuto de flujo de tampón de elución (0% de B) a través del sistema, como se describe en los pasos 3.4-3.5.
- En la ventana Configuración del software del programa BioLogic, seleccione "Usar buffer blending" y "tampón fosfato con Sulfato de Amonio". Confirme Buffers A1, A2, B1 y B2 muestran en la ventana de instalación corresponden a aquellos que estén preparados.
- Configuración manual de la velocidad de flujo de 1 ml / minuto de tampón de elución(0% de B). Observar la contrapresión, la conductividad, los trazados de rayos UV, y el pH sea coherente y dentro de los límites normales de operación. Las anomalías indican el aire o el bloqueo de la columna que debe ser abordado antes de proceder.
- Lave todas las 8 líneas de selección de columna con 5 ml de tampón de elución. Para ello, primero detener el flujo, el establecimiento de las dos válvulas de selección de columna a la posición 2, y la reanudación de la 1 ml / minuto de flujo, 0% B. Repita el procedimiento para las líneas de selección de las columnas en las posiciones 3-8.
- Conectar las columnas de 1 ml de HIC HiTrap para cargos de 2-8 válvulas de selección de columna. Completar pasos 3.8-3.13 con una columna a la vez. Tomar nota de que se coloca en la columna de HIC en el que la posición de selección de la válvula. Un resumen de los medios de comunicación de las columnas de HIC características se muestran en la Tabla 2.
- La conexión física de las columnas de GE Healthcare HiTrap al sistema de Bio-Rad DuoFlow requiere una serie de accesorios que utilizan 1/4-28, M6 y accesorios de montaje. Retire la unión de conectar la posición 2 válvulas de selección de columna. ALign el Bio-Rad y accesorios de GE Healthcare, como se ilustra en la Figura 3.
- Conecte los accesorios aguas arriba de las columnas a la DuoFlow. Evitar que queden atrapadas burbujas de aire en la columna o tubo con firmeza fijación de los herrajes de las columnas ascendentes a la conexión de la selección de válvulas de aguas arriba. Ejecutar tampón de elución a través de las conexiones hasta que todo el aire es expulsado y una gran caída de tampón está presente. Detener temporalmente el flujo de búfer.
- Quitar el tapón conectado a la entrada de la columna y colocar una gota grande de bajo contenido de sal tampón (0% de B) en la parte superior de la columna. Fije la columna a los accesorios de aguas arriba. Tener tanto la entrada de la columna y la conexión de entrada llena de gotas de tampón asegura una conexión libre de burbujas de aire.
- Si la columna se utiliza por primera vez, rompa el extremo de salida de la columna. Conecte la salida de los herrajes de las columnas posteriores y la tubería de la válvula de selección. Verifique todas las conexiones están bien apretados.
- Establecer el límite de contrapresión a 40 psi. Lavar la columna wIth 5 volúmenes de columna (5 volúmenes de columna = 5 ml) de tampón de elución (0% de B), con un caudal de 1 ml / minuto. Continuar lavado de la columna, si es necesario, hasta que el pH, los trazados de UV y de contrapresión se han estabilizado.
- Lavar la columna con 10 volúmenes de columna (10 ml) de tampón de inicio (100% B) a un caudal de 1 ml / minuto. Continuar lavado columna, si es necesario, hasta que los parámetros del sistema que figuran en la etapa precedente, así como la conductividad se han estabilizado.
- La columna de HIC preparado anteriormente está ahora listo para la carga de la muestra. Una vez que todas las columnas que se analizarán están preparados, cambie manualmente las válvulas de selección de columna a la posición 1 (la unión) y detener el flujo de búfer.
4. Carga de las muestras
- Sumergir muestra tubería de entrada en la muestra de 20 ml para comenzar el proceso de carga de la muestra en el bucle de muestra dinámica. Desde la ventana de configuración manual del software de BioLogic, cambiar la carga de la muestra de bucle / lavado de la válvula a la posición 1 (de muestra) y la válvula de carga de muestra para purgar.
- Iniciar acciones deel bucle de muestra de la bomba de carga, la elaboración de la muestra en el tubo de la bomba a un caudal de 1 ml / minuto hasta inmediatamente después de la muestra alcanza la válvula de carga de la muestra. Esto elimina tampón y / o el aire de la línea de carga de la muestra.
- Detener el flujo de la bomba de carga y cambie la válvula de carga de la muestra de la purga a la carga. Reinicie el bucle de muestra de la bomba de carga con un caudal de 1 ml / minuto hasta 10 ml de la muestra se ha dibujado en el bucle de muestra dinámica.
- Suficiente muestra está ahora cargado en el bucle de muestra dinámica de hasta 10 carreras secuenciales columna de HIC de exploración.
5. Programación del método de software y ejecución del Protocolo de columna Escultismo
- Desde la ventana de configuración del software BioLogic, seleccione los dispositivos del sistema marcados con un asterisco en la Tabla 1.
- Seleccione 6 columnas de HIC a ensayo. Programa de un gradiente lineal de sal descendiendo y 6-columna método de exploración, como se ilustra en la Tabla 3. El programa es un método modificatión de la instalación del software BioLogic columna de HIC y se ha optimizado para la aplicación actual.
- Un método de exploración de la columna 6 se recomienda debido a las limitaciones colector de fracciones. Todas las columnas 7 puede ser explorado si el método de programa se ajusta para recoger grandes volúmenes de las fracciones. No agregue el paso de exploración hasta que el programa es otra forma completa, como la selección de la función de exploración impide su posterior edición.
- Comienza la carrera de exploración. Manualmente comenzará tampón inicial (100% B) de flujo, 1 ml / minuto. Pulsa start en el controlador de divisor para comenzar eluato 90% -10% stream-splitting entre el colector de 12 ml de la cultura fracción de tubo (posición 1) y el colector de placa de 96 pocillos fracción (posición 2), respectivamente. Nota técnica: Recupera el colector de placa de 96 pocillos fracción se opera en línea del software de BioLogic.
- Ejecutar el método del programa. Inmediatamente después de comenzar la carrera método de programa, pulse Inicio en el panel de control en pantalla de la línea fraccionamiento placas de 96 pocillosn del colector. Si los dos colectores de fracciones no son 100% sincronizado, de forma manual avanzar en la línea 96 y colector de fracciones a medida que avanza la placa de colector otras fracciones en el tubo de la fracción segunda colección.
- Observe la pantalla en tiempo real para confirmar los parámetros previstos de ejecución. B contrapresión, la conductividad, y% (Figura 4) se ejecutan los parámetros que pueden ser monitoreados para asegurarse de columna a columna de la reproducibilidad de las condiciones de ejecución. Posicionamiento de la válvula, el pH y la carga de la muestra también debe ser monitoreada. Trazados UV pueden ser comparados para verificar similares flujo a través de los picos de elución.
- Utilizar en línea y de ejecución posterior a las técnicas de análisis de eluato para identificar el perfil de elución y la purificación de la proteína de interés (es decir, "proteína diana").
- Para las muestras que contienen las buenas prácticas agrarias, observar la elución en línea usando la proteína de absorción UV a 397 nm única. Comparar la GFP-397 nm de absorbancia específica de seguimiento a la absorbancia nm de proteínas en general el seguimiento 280 para estimar la separación relativay la purificación utilizando los diferentes medios de HIC de ser explorado (Figura 5).
- Después de la ejecución del análisis de las buenas prácticas agrarias y otras proteínas objetivo se puede lograr a través de varios métodos. Las alícuotas de 5-50 l de las fracciones de la placa 96-y se puede transferir a una placa fresca y se ensayó el contenido de proteína específica por ELISA o Western Blot, y contenido de proteína total de cada fracción se pueden analizar mediante el uso convencional de SDS-PAGE o un Experion microfluidos sistema de electroforesis. GFP fluorescencia puede ser detectada en 12 ml de cultivo que utilizan tubos de luz UV (Figura 6).
- Identificación de la mayoría de los medios de HIC prometedores se puede determinar por comparación de elución GFP relativa a otras proteínas contenidas en la muestra. Purificación con los medios de HIC más prometedores entonces puede ser optimizado de acuerdo con otros parámetros, incluyendo el tipo y la concentración de tampón de inicio y el pH.
- Nota técnica: Al final del experimento, coloque todas las líneas de entrada en el búfer B1 (desgasificadoH 2 O) y enjuagar las bombas, válvulas, tubos y todo con agua. Siga las instrucciones del fabricante para la limpieza y el almacenamiento a largo plazo del sistema de cromatografía y las columnas de HIC.
6. Resultados representativos:
Representativa gradiente salino de HIC, la conductividad, y la presión en la columna de las carreras de exploración se presentan en la Figura 4. El cambio en la concentración de sal (línea azul), medido por el porcentaje de tampón elaborado a partir de líneas de amortiguamiento alto contenido de sal es típico de la metodología de HIC. A medida que la concentración de sal disminuye, proteínas unidas a la columna se eluyen. Conductividad (línea roja), que corresponde a la concentración de sales que tiene, se mide en línea inmediatamente después de los detectores de QuadTec y UV. El off-set entre gradiente de sal y los trazados de conductividad indica el tiempo requerido para el tampón para viajar desde la entrada de tampón, a través del sistema, y para el monitor de conductividad. A lo largo de la muestra de ejecución, tque la presión del sistema (líneas grises) y el pH se mantienen relativamente constantes.
La Figura 5 muestra cromatogramas de secuencia de carreras columna de HIC de exploración. La detección en línea de la proteína total (A 280, línea azul) y las buenas prácticas agrarias (A 397, línea verde) se lleva a cabo mediante la medición de la absorbancia de la luz a 280 nm y 397, respectivamente. Es posible aproximar la abundancia relativa GFP y separación para cada carrera de exploración mediante la comparación de las dos líneas. GFP unido a las columnas de HIC probados con diferentes grados de afinidad y su perfil de elución variados. Selección de una columna de HIC preferido para purificaciones futuros se basa en la identificación de la columna que produce el pico más agudo GFP elución y la mayor separación de otras proteínas.
En la Figura 6, tubos de cultivo para las fracciones 10, 12, 14, 16 y 18 de la FF Fenil (alta sub) de exploración de ejecución se visualizaron bajo ambiente (fluorescente) ligero y ultravioleta (UV). Los tubos fueron vistas tanto hacia adelante como cara (paneles de la izquierda) y de arriba hacia abajo (paneles de la derecha) con el fin de observar el espectro de las buenas prácticas agrarias emisión característica. GFP (verde) se detecta claramente en la fracción 14 en las dos imágenes UV. Estos datos de la carrera post-corresponden muy bien con la detección en línea de las buenas prácticas agrarias mediante la medición de absorbancia a 397 nm eluido (A 397, línea verde), que también se identifica como fracción 14 que contiene el pico principal de las buenas prácticas agrarias eluido. El azul difusa en el panel UV izquierdo está la luz emitida por la lámpara UV.
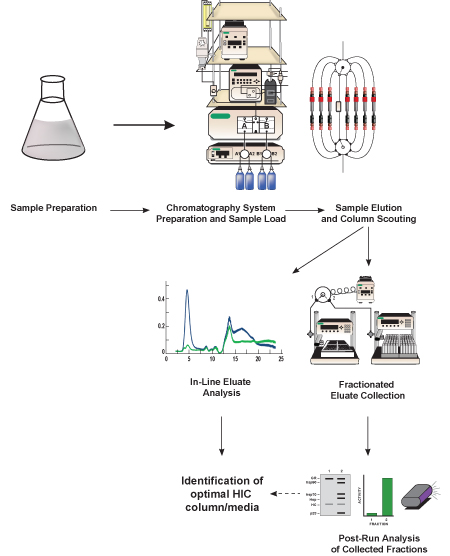
Figura 1. Representación esquemática de este protocolo. Lisado bacteriano que contiene proteína de interés (GFP, proteína diana) se prepara, se diluyó en un equivalente tampón de alta salinidad a la memoria intermedia de inicio cromatografía, y se filtró. Una vez que el sistema de cromatografía líquida se prepara, se carga y se muestra la proteína diana se separa de otras proteínas i presenten el lisado utilizando un medio de cromatografía hidrófoba contenida en una columna de HIC preenvasado. El método de separación se repite varias veces utilizando diferentes medios cromatografía (referido como columna de exploración) con el fin de determinar qué medios proporciona la separación mejor GFP. Las proteínas eluidas (eluido) se analizaron en línea utilizando detectores incluidos en el sistema de cromatografía y se recogió en fracciones más pequeñas para su posterior (post-pista) análisis. Basado en el análisis en línea y posterior ejecución de la actividad GFP y separación, una columna de HIC óptima y medio cromatográfico se identifican.
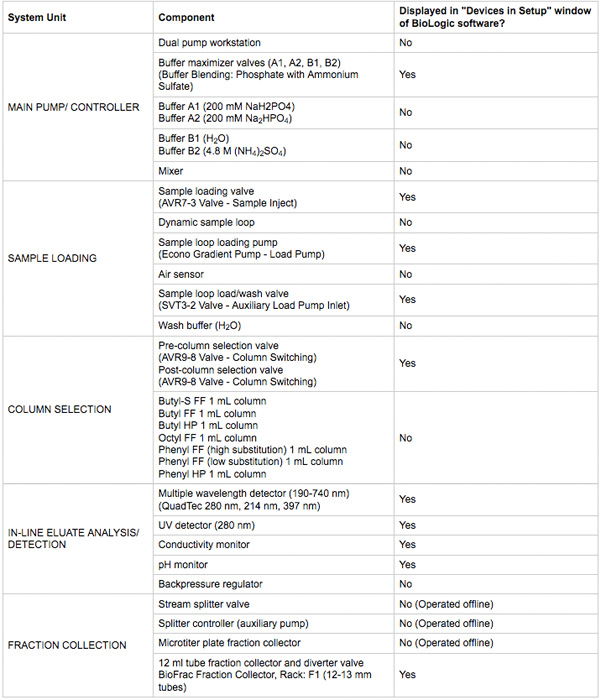
Tabla 1. Principales componentes del sistema de cromatografía se utilizan en este protocolo.
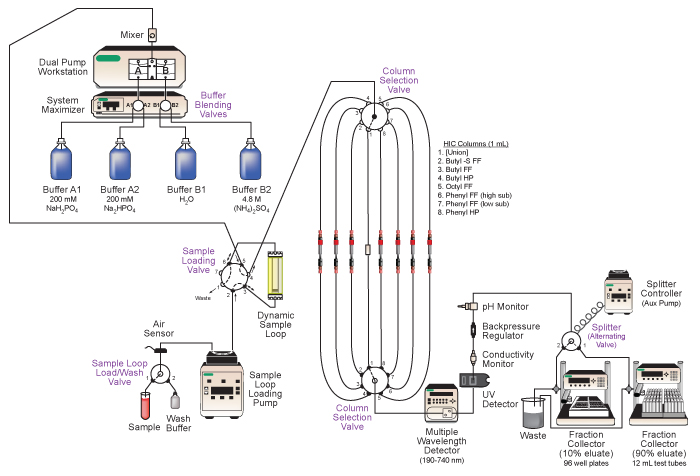
Figura 2. Diagrama de Bio-Rad DuoFlow media presión sistema de cromatografía de líquido empleado. Las principales características de la SYderivan incluyen la mezcla tampón automatizado, la carga de la muestra para los funcionamientos de las columnas secuenciales, la selección automática de columnas de cromatografía diferentes, en línea análisis del eluato, y recogida en tándem del eluato se fraccionó. Véase el texto y en la Tabla 1 para más detalles.
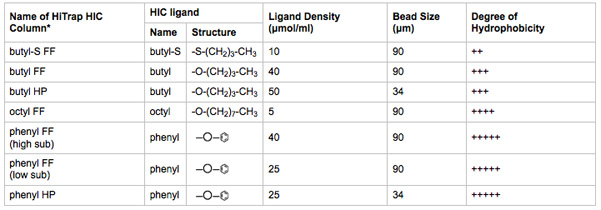
Características de las tablas 2. Biofísicos de los medios de prueba de HIC. El nombre de la columna de HIC HiTrap es indicativo del ligando, la densidad de ligando, y tamaño de las perlas.
* FF = flujo rápido, HP = alto rendimiento. Mayor tamaño de grano aumenta la capacidad de unión del ligando y del caudal. Menor tamaño de grano aumenta la resolución cromatográfica. La información derivada de la literatura proporcionada por el fabricante.

Figura 3. La conexión de la columna de GE Healthcare HiTrap HIC de Bio-Rad DuoFlow system.To la tuerca de arriba Delrin 1/4-28 unaª virola (A1), un Luer macho-hembra montaje 1/4-28 (B1) y macho 1/16 "a mujer adaptador Luer (C) están conectados. Los accesorios se unen a la columna HiTrap después de haber sido lavado con tampón y que tiene todas las burbujas de quitar. La salida de la columna está conectada a una hembra de 1/16 "a macho de M6 (D), Luer macho a hembra M6 montaje (E), y 1 hembra Luer-mujer / 4.28 montaje (B 2). Este conjunto está conectado a la tuerca de Delrin aguas abajo 1/4-28 y férula (A 2). El panel superior muestra los accesorios separados y el panel inferior muestra los accesorios de montaje.
| Paso # | Volumen (ml) | Descripción | Parámetros | |
| 1 | 0,00 | Recoger fracciones de 1,0 ml durante la ejecución de toda | ||
| 2 | 0,00 | Switch Columnas | Columna 1 HIC (Posición 2) | |
| 3 | 0,00 | Flujo isocrática | pH: 6,80 100% de B | Volumen: 2,00 ml Caudal: 1,00 ml / min |
| 4 | 2,00 | Línea de base cero | QuadTec | |
| 5 | 2,00 | Línea de base cero | Detector de UV | |
| 6 | 2,00 | Inyectar la muestra | Ejemplo de carga Loop dinámico | Auto Inyectar la válvula Volumen: 0,50 ml Caudal: 1,00 ml / min |
| 7 | 3,00 | Flujo isocrática | pH: 6,80 100% de B | Volumen: 5,00 ml Caudal: 1,00 ml / min |
| 8 | 8,00 | Degradado lineal | pH: 6,80 100% de B -> B 0% | Volumen: 10,00 ml Caudal: 1,00 ml/ Min |
| 9 | 18,00 | Flujo isocrática | pH: 6,80 0% de B | Volumen: 3,00 ml Caudal: 1,00 ml / min |
| 10 | 21,00 | Flujo isocrática | pH: 6,80 100% de B | Volumen: 5,00 ml Caudal: 1,00 ml / min |
| 11 | 26,00 | Columnas de conmutación | Unión (Posición 1) | |
| Final | 26,00 | Fin del Protocolo | Repite automáticamente con 5 columnas de HIC adicionales (Posiciones 3-7) | |
| Scouts de tipo | Número de Pistas: 6 | Número de Pasos explorado: 1 | ||
Tabla 3. BioLogic protocolo de software para el método de HIC de exploración empleado.

Figura 4. Gradiente Representativa sal de HIC, la conductividad, y la presión de la columna. A medida que la concentración de sal (línea azul) disminuye, la conductividad (línea roja) también lo hace. El off-set entre gradiente de sal y los trazados de conductividad indica el tiempo requerido para el tampón para viajar desde la entrada de tampón para el monitor de conductividad. La presión del sistema (líneas grises) permanece relativamente constante durante la duración de la carrera de exploración.
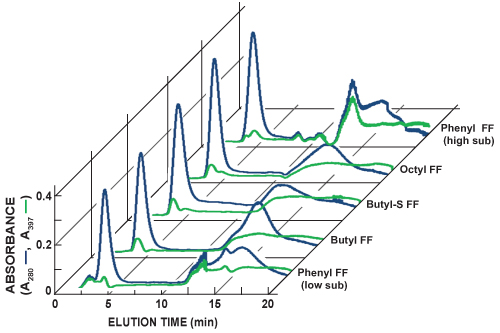
Figura 5. Cromatogramas compilados de la columna de exploración secuencial de HIC HiTrap carreras. La detección en línea de la proteína total (A 280, línea azul) y las buenas prácticas agrarias (A 397, línea verde) se lleva a cabo mediante la medición de la absorbancia de la luz a 280 nm y 397, respectivamente. En esta serie de experimentos, el pico más agudo GFP elución se observó con el FF Fenil (alta sub) cLA COLUMNA. La Fenil FF (alta sub) también apareció en la columna para proporcionar la mayor separación entre las buenas prácticas agrarias y otras proteínas. Columnas adicionales 1 ml HiTrap HIC prueba incluye la sustitución de Fenil bajo flujo rápido (Fenil FF (bajo sub)), el flujo rápido de butilo (butilo FF), butil-S de flujo rápido (butil-S FF), y el flujo de octilo rápido (FF octil) .
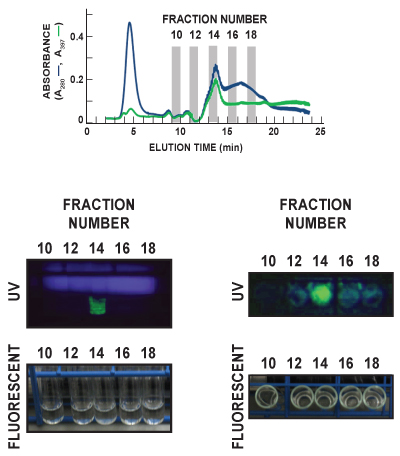
Figura 6. Representante posterior a la ejecución de la visualización de las buenas prácticas agrarias en el efluente de la muestra. Fracciones de eluato se recogió a una velocidad de 1/minuto, y cada uno se analizó el contenido de GFP. En esta figura representativa, tubos de cultivo para las fracciones 10, 12, 14, 16 y 18 de la FF Fenil (alta sub) de exploración de ejecución se visualizaron bajo ambiente (fluorescente) la luz y la radiación ultravioleta (UV). Los tubos fueron vistas tanto hacia adelante como cara (paneles de la izquierda) y de arriba hacia abajo (paneles de la derecha). El azul difusa en el panel UV izquierdo está la luz emitida por la lámpara UV. GFP (verde) se detecta claramente en el Fracción 14 en ambas imágenes UV. El panel superior muestra el total de proteínas (A280, línea azul) y las buenas prácticas agrarias (A 397, línea verde) trazados cromatograma de las 5 fracciones que son visualizados.
Discusión
Técnicas de cromatografía líquida no han resultado útiles para la preparación de proteínas altamente purificadas necesarios para llevar a cabo inmunológico 6, 7 bioquímicos y estructurales de los estudios 8. Métodos de purificación de HIC más a menudo requieren determinación empírica de un medio preferido, y la estructura ligando, ligando densidad, y propiedades de la matriz de talón todo han demostrado su impacto en los resultados cromatográficos 2, 3. La columna de exploración automática es un enfoque eficaz para la selección de un medio de HIC para la optimización posterior y purificación de proteínas 4. El método de columna automatizado de exploración presentada puede ser fácilmente adaptado a diferentes estrategias de HIC de purificación de proteínas. Las alteraciones en la concentración de sal, la elección de la sal, el gradiente de sal, y el pH puede además mejorar las condiciones de purificación, y los efectos de variar estos parámetros esenciales se han examinado anteriormente 13,14. Eluato HIC que contiene un objetivo prote parcialmente purificadaen puede purificarse adicionalmente mediante una técnica cromatográfica complementarios, tales como cromatografía de intercambio iónico (IEX) o de filtración en gel / exclusión de tamaño cromatografía 9,10.
Debido a su absorción de la luz única y características de emisión, el perfil de elución de las buenas prácticas agrarias que permiten detectar en línea y los enfoques de ejecución posterior. A tal fin, este protocolo adicional se puede adaptar para la purificación de fusión recombinantes GFP-proteínas, en el que una proteína diana no relacionado es "etiquetado" con GFP. GFP-etiquetados proteínas diana pueden ser detectados con luz UV 11 y se purificó utilizando diversos enfoques cromatográficos, incluyendo la estrategia de purificación de HIC se ha descrito anteriormente. Purificación de las buenas prácticas agrarias también se ha convertido en un elemento básico en los laboratorios de bioquímica pedagógica para la enseñanza de las técnicas modernas de la ciencia de proteínas 12.
Mientras que la purificación de la proteína básica de HIC se puede realizar utilizando una cromatografía sustancialmente menos robusta Sytallo, la instrumentación que aquí se presenta tiene una serie de ventajas para ayudar en la obtención de resultados favorables. Notables beneficios de la utilización de un sistema altamente automatizado incluyen la mejora de run-to-run condición reproducibilidad, ahorro de tiempo, y la disminución de oportunidades para que el aire se introduzcan en el sistema 10. Sistema controlado mezcla tampón, que es facilitado por el sistema maximizador, permite una mayor coherencia en la preparación de tampón y reproducibilidad experimental. Dibujo de carga de muestra suficiente en el bucle de muestra dinámica para todos exploración se ejecuta además asegura la uniformidad de la muestra se añade a cada columna y permite la producción secuenciales sin interrupción o manual de recarga. Inyección de la muestra controlada desde el bucle muestra en la columna disminuye la variabilidad que se puede producir con la carga manual de las muestras. Un par de válvulas de selección de columna para permitir carreras muestras consecutivas, cada una utilizando una columna de HIC diferente, sin tener que replumb el sistema. Realización de Mul TI-longitud de onda análisis es particularmente beneficioso cuando ensayando una proteína con un perfil espectrofotométrico único. Además de las buenas prácticas agrarias, citocromos, flavoproteínas y otras proteínas que contienen hemo-pueden beneficiarse de esta técnica. Dispositivos de control de conductividad y el pH de permitir la verificación en tiempo real de las condiciones experimentales. Fracción de la colección de Split eluido permite un manejo fracción de mejora y permite una fácil transferencia de métodos de análisis de ejecución después de que requieren un volumen de muestra mínimo (por ejemplo, ELISA, SDS-PAGE, Western Blot, y la electroforesis de microfluidos Experion). Mientras utiliza la línea fracción de segundo colector requiere de la sincronización manual, que permite la máxima flexibilidad en la selección de colector de fracciones. Los inconvenientes más importantes a utilizar como un sistema de cromatografía de columna de HIC robusta para exploración y purificación de proteínas incluyen el tiempo inicial y los gastos presupuestarios relacionados con la adquisición de instrumentos y la formación del operador.
t "> El protocolo presentado aquí utiliza un Bio-Rad DuoFlow sistema de cromatografía;. sin embargo, la instrumentación igualmente robusto de otros fabricantes, tales como el Avant ÄKTA de GE Healthcare, también pueden utilizarse ser y son capaces de producir resultados equivalentes cromatografía Incluso comparables sistema tienen características únicas (por ejemplo, el método de programación, las limitaciones de nomenclatura de componentes, las preferencias del operador, y la escalabilidad) que deben ser considerados antes de iniciar un procedimiento de purificación o la adquisición de instrumentos.Divulgaciones
Seleccione reactivos de cromatografía y la instrumentación suplementario fueron proporcionados por Bio-Rad.
Agradecimientos
Este trabajo fue financiado por los Institutos Nacionales de Salud de subvención GM086822 y la Fundación Nacional de Ciencias de investigación importante la instrumentación de subvención DBI-0960313. Los autores desean agradecer a los Dres. Jon Miyake & Donna Hardy (Bio-Rad) y Jennifer Loertscher (Universidad de Seattle), por su experiencia técnica. Seleccione los reactivos y la instrumentación de cromatografía suplementario fueron generosamente proporcionadas por Bio-Rad.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| DuoFlow BioLogic Pathfinder 20 del Sistema | Bio-Rad | 7602257 | Incluye sistema maximizador, batidora, estación de trabajo F10, la válvula AVR7-3, UV QuadTec / Vis con detector de celda de flujo, colector de fracciones BIOFRAC, el software de productos biológicos y kit de inicio |
| AVR9-8 flujo de la selección de la válvula | Bio-Rad | 7600408 | De alta presión de la válvula, 9-puerto, 8-posición, 3,500 psi (233 bar) de límite, para uso con el sistema BioLogic DuoFlow |
| La válvula de desvío SV3T-2 | Bio-Rad | 7600410 | La válvula de solenoide, 3-puerto, 2-posición, 30 psi (2 bar) límite, para uso con el sistema BioLogic DuoFlow |
| Corriente del divisor de la válvula | Bio-Rad | ||
| tico = LSR y parentCategoryGUID = 22c495f1-36ff-44a3-9140-ee7e54d0b1ba "target =" _blank "> DynaLoop 25 Kit | Bio-Rad | 7500451 | Deslizante del pistón kit de muestreo del lazo, incluye 25 ml DynaLoop deslizamiento del pistón de bucle, DynaLoop juego de piezas (# 750-0450) |
| Colector de fracciones BIOFRAC | Bio-Rad | 7410002 | Dos fracción de col lectores utilizan |
| BIOFRAC caída de la cabeza del adaptador de microplacas | Bio-Rad | 7410088 | |
| BIOFRAC adaptador de la placa de microtitulación | Bio-Rad | Y en el país = EE.UU. & lang = es & ProductID = 741-0017 "target =" _blank "> 7410017 | |
| UV Óptica Módulo | Bio-Rad | 7500202 | |
| Lámpara halógena | Bio-Rad | < un target = "_blank"> 7601331 | |
| Econo degradado de la bomba | Bio-Rad | 7319001 | bomba de gradiente para la purificación de proteínas de baja presión, incluye tubos y kit de accesorios |
| Experion Sistema | Bio-Rad | bio-rad.com/prd/en/US/adirect/biorad? cmd = BRCatgProductDetail y ProductID = 224301 "target =" _blank "> 7007001 | |
| Experion Pro260 Kit de Análisis | Bio-Rad | 7007102 | |
| HiTrap columna de HIC kit de selección | GE Healthcare | 28-4110-07 | Incluye 7 x 1 ml preenvasados columnas de los medios de comunicación de HIC para el Movimiento Scout |
| GE Healthcare-a-Bio-Rad herrajes de las columnas | GE Healthcare | 18111251 y 18111257 |
Referencias
- Cummins, P. M., O'Connor, B. F. Hydrophobic interaction chromatography. Methods Mol. Biol. 681, 431-437 (2011).
- Nagrath, D., Xia, F., Cramer, S. M. Characterization and modeling of nonlinear hydrophobic interaction chromatographic systems. J. Chromatogr. A. 1218, 1219-1226 (2011).
- To, B. C., Lenhoff, A. M. Hydrophobic interaction chromatography of proteins. IV. Protein adsorption capacity and transport in preparative mode. J. Chromatogr. A. 1218, 427-440 (2011).
- Huddleston, J. G., Wang, R., Lyddiatt, A. On the use of mild hydrophobic interaction chromatography for "method scouting" protein purification strategies in aqueous two-phase systems: a study using model proteins. Biotechnol Bioeng. 44, 626-635 (1994).
- Arun, K. H., Kaul, C. L., Ramarao, P. Green fluorescent proteins in receptor research: an emerging tool for drug discovery. J. Pharmacol. Toxicol. Methods. 51, 1-23 (2005).
- Terrizzi, S. C., Banh, C., Brossay, L.A Protocol for the Production of KLRG1 Tetramer. J. Vis. Exp. (35), e1701-e1701 (2010).
- Murphy, P. J. M., Morishima, Y., Kovacs, J. J., Yao, T. P., Pratt, W. B. Regulation of the dynamics of hsp90 action on the glucocorticoid receptor by acetylation/deacetylation of the chaperone. J. Biol. Chem. 280, 33792-33799 (2005).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 Magnetosome Associated Protein MamAΔ41. J. Vis. Exp. (37), 10-3791 (2010).
- Kong, Y., Li, X., Bai, G., Ma, G., Su, Z. An automatic system for multidimensional integrated protein chromatography. J. Chromatogr. A. 1217, 6898-6904 (2010).
- Camper, D. V., Viola, R. E. Fully automated protein purification. Anal. Biochem. 393, 176-181 (2009).
- Hammon, J., Palanivelu, D. V., Chen, J., Patel, C., Minor, D. L. A green fluorescent protein screen for identification of well-expressed membrane proteins from a cohort of extremophilic organisms. Protein Sci. 18, 121-133 (2009).
- Wu, Y. Using green and red fluorescent proteins to teach protein expression, purification, and crystallization. Biochem. Mol. Biol. Educ. 36, 43-54 (2008).
- Queiroz, J. A., Tomaz, C. T., Cabral, J. M. Hydrophobic interaction chromatography of proteins. J. Biotechnol. 87, 143-159 (2001).
- McCue, J. T. Theory and use of hydrophobic interaction chromatography in protein purification applications. Methods Enzymol. 463, 405-414 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados