Method Article
タンパク質の精製で使用するための自動化された疎水性相互作用クロマトグラフィーカラムの選択
要約
タンパク質精製のプロセスで使用される適切な疎水性相互作用クロマトグラフィー(HIC)メディアを識別するための自動化された方法が示されています。メソッドは、自動化されたバッファ·ブレンディング、動的なサンプルループ注入、順次列の選択、マルチ波長分析、分割割合溶出コレクションなどの中圧液体クロマトグラフィーシステムを利用しています。
要約
精製タンパク質(例えば、ゲル濾過、アフィニティー、イオン交換)用の他のクロマトグラフィー法とは対照的に、疎水性相互作用クロマトグラフィー(HIC)は、一般に最も適したクロマトグラフ媒体を選択するために実験的な決定を(スクリーニングまたは "スカウト"と呼ばれる)が必要です与えられたタンパク質1を精製する 。ここで紹介する方法は、タンパク質精製に使用する最適なHICメディアのスカウトへの自動アプローチを説明します。
HICは、疎水性の差に基づいて粗ライセートからタンパク質などの生体分子を分離しています。アフィニティークロマトグラフィー(AC)とイオン交換クロマトグラフィー(IEX)と同様に、HICは、クロマトグラフィープロセスの進行に応じて、目的のタンパク質を濃縮することができます。最高のHICによる精製に適したタンパク質は、疎水性表面領域を有するものが含まれており、2 Mの弾薬を超える濃度の塩への暴露に耐えることができるnium硫酸塩((NH 4)2 SO 4)。 HICは、多くの場合、アフィニティタグを欠いているタンパク質の精製法として選択し、ACのため、適さない、とIEXは、十分な精製を提供するために失敗したときにされています。タンパク質表面の疎水性部分は、一時的に不活性、不動のマトリックスに結合された非極性リガンドに結合する。タンパク質とリガンドとの相互作用は、タンパク質-リガンド相互作用を強化し、不動のタンパク質(すなわち、列の内側に結合した2)を作る高イオン濃度で、クロマトグラフィーカラムを通過する緩衝液の塩濃度に大きく依存します。塩濃度が低下すると、タンパク質 - リガンド相互作用は消費電力、タンパク質は再び携帯電話になり、カラムから溶出する。 HIC複数の媒体がプリパックドカラムで市販されている、複数の疎水リガンド(例えばオクチルs-ブチル、ブチルおよびフェニル)のそれぞれ含むものには規格のアガロースビーズに濃度を変化させて架橋タイプIFIC直径3。 HICメディアが将来、より徹底的な最適化の実験やタンパク質精製の ために採用すべきかを決定するための効率的なアプローチは、4を実行するためにスカウト自動化された列ができます。
ここで精製されている特定のタンパク質は、組換え緑色蛍光タンパク質(GFP)であるが、アプローチは、1つまたは複数の疎水性表面領域と他のタンパク質を精製するために適合させることができる。 GFPは紫外線を5にさらされたとき、その安定性、397 nmでのユニークな吸光度のピークと蛍光による有用なモデルタンパク質として機能します。野生型GFPを含む細菌ライセートは、高塩緩衝液中に調製Bio-Rad社DuoFlow媒体圧力液体クロマトグラフィーシステムにロードされ、異なるHICメディアを含むハイトラップHICカラムに吸着させた。タンパク質はカラムから溶出し、内の行と、実行後の検出法によって分析した。バッファ·ブレンディング、動的なサンプルループ注入、シーケンシャルCOLUMN選択、マルチ波長分析、分割割合溶出コレクションは、実験的アプローチのシステムおよび再現性の機能を増加した。
プロトコル
1。バッファおよびサンプルの準備
- テクニカルノート:すべてのバッファは冷蔵であるべきであり、特に断りのない限り、このプロトコルの各ステップは、氷上もしくは4℃で実行する必要があります。低温精製されるタンパク質の分解を防ぐために、最適な運転条件を確保するために不可欠です。 HICメディアは、室温で動作する場合は、別の分離結果を生む可能性があり、クロマトグラフィーシステムは、4℃のコールドルームやコールドボックスで動作する必要があります。
- 200mMののNaH 2 PO 4(バッファA1)、200mMののNa 2 HPO 4、(バッファA2)、4.8 M(NH 4)2 SO 4(バッファB2):次のバッファの500ミリリットルを用意します。脱イオン水(バッファB1)も使用されます。ドガ最適なクロマトグラフの操作条件を確保するためのバッファ。システムマキシマイザーは、低塩、リン酸の溶出バッファーを生成するためにバッファA1とA2を一緒にブレンドされ、それがバッファB1とB2をブレンドします。高塩硫酸アンモニウムの開始バッファー(2.4 M(NH 4)2 SO 4)を生成します。
- バッファB2の10mlで精製されるタンパク質を含む細胞溶解物10mlを混合することによってロードされるサンプル20mlを準備します。細胞ライセート試料溶液の最終硫酸アンモニウム濃度は開始バッファーへのそれはほぼ同じながら、約2.4 M(NH 4)2 SO 4でなければなりません。細胞溶解液をTE緩衝液中の細菌細胞ペレット(10mMトリス、1mMのEDTA、pH 8.0)を再懸濁することにより調製することができる超音波処理または10分間3700×gで1 mg / mlのリゾチームと遠心分離を加えた。
- 溶液からの粒子状物質を除去するフィルタ低タンパク質結合0.45μmのシリンジを介して溶解液を緩衝液混合物をフィルタリングします。それがシステムにロードする準備ができるまでサンプルを氷上に保持します。
2。 DuoFlowクロマトグラフィーシステムの物理的なセットアップと配管
- すべてのデバイスの電源を確保し、通信接続が行われます。デバイスは、生物学的DuoFlowクロマトグラフィソフトウェアのマニュアルコントロールウィンドウに表示されます。デバイスの概要を表1に記載されています。システムや配管図の図は、図2である。
- ポート番号は、論理的順序に従うようなポンプステーション、およびシステムマキシマイザーポートへのバルブのための電気的接続を添付してください。将来の参考のために、それぞれのポート番号を各バルブにラベルを付けます。ポンプステーション、およびシステムマキシマイザーは、コンピュータ/コントローラおよびクロマトグラフィーシステムの間の主な通信接続として機能します。いずれかのデバイスに接続したときにバルブが自動的に認識され、ソフトウェアに表示されます。
- テクニカルノート:マニュアルモードでのクロマトグラフィーシステムを操作している場合、バルブを独立に制御されています。バフを開始する前に、バルブを切り替えたときに、特に、所望の流路が構成されていることを確認するために世話をするERのフロー。
- バッファA1、A2、B1、およびB2に沈めるテフロンチューブ。バッファの適切なボリュームを確保するプロトコル全体のために利用可能であり、そのチューブは水没したまま継続します。バッファA1、A2、B2の1のバッファB1のLが十分である500mlを調製した。
- 図2に、製造元の指示ごとに示すように、下げ振りのサンプルはバルブと動的なサンプルループをロードする。可能なチューブの最小の長さを使用してサンプル弁入口(ポジション3)サンプルループに接続します。これは、サンプルのロード·プロセス中にサンプルの希釈を最小限に抑えることができます。
- サンプル、サンプルのローディングポンプ、サンプルのローディングバルブの入口(ポジション2)との間のチューブの長さを最小限に抑えることができます。これは、サンプルループをロードするために必要なサンプル量が減少します。
- 各ペアが1/4-28 female-to-1/4-28女性組合によって結合して、1/16 "OD PEEKチューブの8つの同じサイズのペアを準備します。2列の位置1-8のペアを接続します。選択弁7組合sは、後でテストするクロマトグラフィーカラムに置換されますカラム選択バルブのポジション2-8ラインに接続されています。組合ポジション1と接続されたインラインは、クロマトグラフィーカラムのバイパスとして維持されます。
- テクニカルノート:チューブの各ペアは、カラム選択バルブの両方で同じ位置に接続されていることを確認してください。
- 4波長のUV / VIS検出器(QuadTec)ランプと固定波長280nmのUV検出器のランプの両方をオンにします。このプロトコルのためのQuadTecによって測定される波長は214nmで、280 nm、および397 nmの含まれています。固定波長UV検出器の両方を持つ280 nmでの測定とQuadTecは、システムの冗長性を提供し、データの妥当性を保証します。
- すべての検出器を確認し、製造元の指示に従って校正されています。背圧レギュレータは、検出器に気泡の蓄積を低減する必要があると検出器のダウンストリームが、pHモニターのアップストリームをインストールする必要があります。
- ここで紹介するシステムは、2つのfractioが含まれています実行後の溶出液の分析のための実質的な利便性を提供するn個のコレクター、。フラクションコレクターは、ストリームスプリッタバルブ、図2に示すように、スプリッタコントローラを取り付けます。フラクションコレクターは、96ウェルマイクロタイタープレート内で100μlの溶出画分を収集しますポジション2に接続している間にスプリッタバルブの位置1に接続されたフラクションコレクターは、12 mlの培養チューブに900μlの溶出画分を収集します。
- ポジション2フラクションコレクター、スプリッタバルブ、スプリッタコントローラは、クロマトグラフィーワークステーションのオフラインで運営されています。スプリッタコントローラは、Bio-Radエコノグラジエントポンプ内に含まれているが、装置のポンプコンポーネントが使用されていません。スプリッタバルブがそれに接続されている場合、 "%分割"の設定オプションは、エコノグラジエントポンプに表示されます。
- 〜10%の分割を設定します。ポジション1フラクションコレクタは、溶出液(900μL/分)の90%を収集し、ポジション2フラクションコレクタは、収集されます10%(100μL/分)。フラクションコレクターは、お互いに対応するには、両方のコレクターのフラクション番号を可能に同期して進みます。
- マイクロドロップヘッドの位置2フラクションコレクターの標準的なフラクションコレクタのドロップヘッドを交換してください。マイクロドロップヘッドは50%小さく、ドロップサイズ(すなわち、25μlの代わりに標準の50μl)の収集を可能にし、≤500μlの画分を収集する際に特に有益であるより小さい開口部を持っています。
- 画面上のコントロールパネルを使用して、1サンプル/分の速度で96ウェルプレート、事前に分画を収集するためにポジション2フラクションコレクタを設定します。スプリッタコントローラとポジション2フラクションコレクターは、最初のクロマトグラフィーの実行開始直後に手動で開始されます。
- ポジション2フラクションコレクターとバッファB1とマイクロドロップヘッドをフラッシュします。
3。プライミング系ライン、プログラミングの実行方法、およびEquilibratるHICカラム
- 脱気したバッファーA1、A2、B1、およびワークステーションポンプB2、首相に沈めシステムマキシマイザー入口ラインと、サンプルループをすすぎ、メーカーの指示に従ってクロマトグラフィーシステムをフラッシュします。残りの気泡を除去するための4マキシマイザーシステムの入口とプライミングステップ(A1、A2、B1、およびB2)が完了しました。
- システムの準備には、生物学的ソフトウェアを介してシステムコントローラの手動操作を必要とします。前のバッファフローを開始するサンプルのロードバルブとカラム選択バルブの正しい位置を確認してください。
- ステップ3.4から3.5で説明したように、システムを介して溶出バッファー(0%B)の取扱説明書1ミリリットル/分フローを開始する準備をします。
- 生物学プログラムのソフトウェアのセットアップウィンドウで、 "硫酸アンモニウムリン酸緩衝液"と "バッファ·ブレンディングを使用"を選択してください。バッファA1、A2、B1、およびセットアップウィンドウに表示されているB2は、これらの準備に対応することを確認します。
- 手動での溶出バッファー1ml /分の流量を設定(0%B)。背圧を観察し、導電性、UVトレーシング、およびpHは、一貫性の通常の動作範囲内で残っています。異常は前に進むに対処する必要があり、空気やカラムの閉塞を示しています。
- 5 mlの溶出バッファーで、すべての8カラム選択線をフラッシュします。 B.、0%をポジション2に両方のカラム選択バルブを設定し、1ml /分のフローを再開、最初のフローを停止することによってこれを行うポジション3-8のカラム選択線について、この手順を繰り返します。
- カラム選択バルブの位置2-8 1 mlのハイトラップHICカラムを接続します。一度に1つの列でステップ3.8から3.13までを完了します。 HICカラムがどの選択バルブの位置に配置されているから注意してください。 HICカラムのメディアの特性の概要は表2に記載されています。
- Bio-Rad社DuoFlowシステムへのGEヘルスケア·ハイトラップ列の物理的な接続は、1/4-28を利用して継手、M6、とルアーフィッティングのシリーズを必要とします。ポジション2カラム選択バルブを接続して組合を削除します。 A図3に示すように、Bio-Rad社およびGEヘルスケア継手lign。
- DuoFlowに上流のカラムフィッティングを取り付けます。しっかりと上流の選択弁の継手に上流のカラムフィッティングを取り付けることによって、列またはチューブ内に気泡が入らないようにします。すべての空気が追放され、バッファの大規模な降下が存在されるまで、継手を介して溶出バッファーを実行します。一時的にバッファフローを停止します。
- カラム入口に接続されているストッパーを外し、カラムの上に低塩濃度バッファー(0%B)の大きな落ち込みを配置します。上流のフィッティングにカラムを取り付けます。カラム入口とバッファーの液滴であふれインレットフィッティングの両方を持つことは、気泡の自由な接続を保証します。
- 列が最初に使用されている場合は、カラムの出口側の端を折ります。下流のカラムフィッティングおよび選択バルブチューブにコンセントを取り付けます。すべての付属品がしっかり固定されていることを確認します。
- 40 psiに背圧の上限を設定します。列wを洗う1ml /分の流速で溶出緩衝液(0%B)のi番目の5カラム容量(5カラム体積= 5)を添加した。必要に応じて、カラムの洗浄を続け、pH値になるまで、UVトレーシングと背圧は安定している。
- 10カラム容量(10ml)を1ml /分の流量で開始バッファー(100%B)でカラムを洗浄します。前述の手順と同様に導電性に記載されているシステムパラメータが安定するまで、必要に応じて、カラムの洗浄を続けます。
- 上記で調製したHICカラムは現在、サンプルをロードするための準備ができています。テストされるすべての列が用意されたら、手動で位置1(組合)にカラム選択バルブを切り替えて、バッファフローを停止します。
4。サンプルのロード
- ダイナミックサンプルループにサンプルをロードするプロセスを開始し、20 mlのサンプルに沈めるのサンプルインレットチューブ。生物学的ソフトウェアの手動設定ウィンドウから、スイッチのサンプル·ループ·ロード/ポジション1(サンプル)およびパージするためのサンプル·ローディングバルブにバルブを洗浄する。
- のアクションを開始サンプルループは、直前までサンプルはサンプルのローディングバルブに到達した後、1ml /分の流量でポンプチューブに試料を策定、ポンプをロードする。これは、バッファおよび/または試料負荷ラインから空気を除去します。
- ローディングポンプの流量を停止し、ロードするためのパージからサンプルのローディングバルブを切り替えます。サンプル10mlをダイナミックサンプルループに引き込まされるまで、1ml /分の流量で試料ループのロードポンプを再起動します。
- 最大10個の連続したHICカラムスカウティング実行するための十分なサンプルは、動的サンプルループにロードされます。
5。ソフトウェア方式のプログラミングとカラムスカウティングプロトコルを実行する
- 生物学的ソフトウェアのセットアップ]ウィンドウから、 表1にアスタリスクが付いているシステムデバイス]を選択します。
- アッセイに6 HIC列を選択します。プログラム線形降順塩勾配と6列のスカウト方法は、表3に示す。メソッドは、プログラムがmodificatです。生物学的ソフトウェアHICカラムのセットアップのイオンとは、現在のアプリケーションに最適化されています。
- 6カラムスカウティング方法はフラクションコレクターの制限により、推奨されます。プログラムのメソッドは大きなフラクションを収集するために調整されている場合は、すべての7つの列は、スカウトすることができます。スカウト機能を選択すると、その後の編集を防止するため、プログラムが、それ以外の場合は完了するまで、スカウトのステップを追加しないでください。
- スカウトの実行を開始します。手動で開始バッファを開始する(100%B)流量、1ml /分。それぞれ、12mlの培養チューブのフラクションコレクター(ポジション1)、96ウェルプレートのフラクションコレクター(ポジション2)の間に90%-10%溶出液ストリーム分割を開始するスプリッタコントローラ上で開始を押します。テクニカルノート:96ウェルプレートフラクションコレクターは、生物学的ソフトウェアからのオフラインで動作させることを思い出してください。
- プログラムのメソッドを実行します。すぐにプログラムのメソッドの実行を開始した後、オフラインで96ウェルプレートfractioの画面上のコントロールパネルの[スタート]を押すn個のコレクタ。 2フラクションコレクターが100%同期していない場合は、手動で第二のフラクションコレクションチューブに他のフラクションコレクターの進歩として、オフラインで96ウェルプレートのフラクションコレクターを進めています。
- 予想されるランタイム·パラメータを確認するためにリアルタイム表示を観察します。背圧、導電率、%B(図4)は、実行条件のカラム間の再現性を確保するために監視することができます実行パラメータです。バルブの位置は、pH、サンプルのロードも監視する必要があります。 UVトレーシングは、同様のフロースルー溶出ピークを確認するために比較することができます。
- 目的のタンパク質(すなわち、 "標的タンパク質")の溶出プロファイルおよび精製を識別するためのラインと、実行後の溶出液の分析技術を利用しています。
- GFPを含むサンプルについては、397 nmでのタンパク質の独自のUV吸光度を使用してインラインで溶出を観察します。相対的な分離を推定するためのトレースを一般的なタンパク質の280 nmの吸光度にトレースGFP固有の397 nmの吸光度を比較(図5)スカウトされている別のHICメディアを使用して精製。
- GFPと他の標的タンパク質の実行後の分析は、複数のメソッドを介して行うことができます。 96ウェルプレート分画5から50までの液のアリコートを新鮮プレートに移し、ELISAまたはウェスタンブロットにより、特定のタンパク質含有量について検定し、各画分の総タンパク質含有量は、従来のSDS-PAGEなどを用いて分析することができますすることができますExperionマイクロ流体電気泳動システム。 GFP蛍光は紫外光( 図6)を使用して、12mlの培養管で検出することができる。
- 最も有望なHICメディアの同定は、試料中に含まれる他のタンパク質への相対的なGFPの溶出との比較によって決定することができる。最も有望なHICメディアと精製は、[スタート]バッファーとpHの種類や濃度など、他のパラメータに応じて最適化することができます。
- テクニカルノート:実験の結論では、(脱気したバッファーB1にすべてのインレットラインを配置H 2 O)と徹底的に水でポンプ、バルブ、およびすべてのチューブをリンス。クロマトグラフィーシステムとHICカラムの洗浄と長期保存のためにメーカーの指示に従ってください。
6。代表的な結果:
代表的なHIC塩勾配、導電率、スカウトランのカラム圧力は、 図4に示されています。のような高塩緩衝線から引き出されたバッファの割合で測定した塩分濃度の変化(青線)は、HIC方法論の典型である。塩濃度が減少すると、タンパク質がカラムの溶出にバインドされます。観測された塩濃度に対応する導電性(赤線)は、QuadTecとUV検出器の直後に行単位で測定されます。塩勾配と導電率のトレーシングとの間のオフセットは、バッファの入口から、システムを介して、導電性モニターに移動するためのバッファに必要な時間を示しています。サンプルの実行、Tを通して彼のシステム圧力(灰色線)とpHは比較的一定に保たれます。
図5は、連続したHICカラムスカウティングランのクロマトグラムを示しています。総蛋白(280、青線)とGFP(397、緑のライン)のインライン検出は、それぞれ、280 nmと397 nmの光の吸光度を測定することによって行われます。これは、2つの行を比較することによって近似する各スカウト実行の相対的なGFP発現量との分離が可能です。 GFPは、親和性の程度が異なるとテストされたHICカラムにバインドし、その溶出プロファイルが変化した。将来の精製のための好ましいHICカラムの選択は、シャープなGFPの溶出ピークと他のタンパク質から最大の分離を生成する列を識別するに基づいています。
図6では、分画10、12、14、16、および実行をスカウトフェニルFF(高いサブ)の18の培養管は、周囲の部屋(蛍光灯)の下で、光と超視覚化した紫外(UV)光。チューブが特徴的なGFPの発光スペクトルを観察するために、両方の顔フォワード(左パネル)とトップダウン(右パネル)を観察した。 GFP(緑色)がはっきりとUV両方のイメージのフラクション14に検出されます。これらの実行後のデータは、溶出したGFPの主要ピークを含む画分として14を識別する397 nmの(397、緑の線)で溶出液の吸光度を測定することにより、GFPのインライン検出とうまく対応しています。左側のUVパネルの拡散青色光、UVランプから放出される。
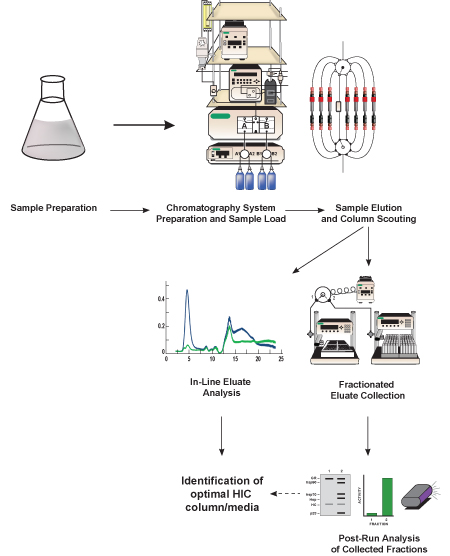
図1。このプロトコルの概略図。目的のタンパク質を含む細菌ライセート(GFP、標的タンパク質)は、準備クロマトグラフィー開始バッファーへの高塩緩衝液と同等に希釈し、ろ過されています。液体クロマトグラフィーシステムが準備されると、サンプルがロードされ、標的タンパク質は、他のタンパク質から分離されたiを含まれているプレパックHICカラムに含まれている疎水性クロマトグラフィー媒体を用いてライセートをnである。分離法は、最高のGFPの分離を提供するメディアを決定するために、異なるクロマトグラフィーメディア(列がスカウトと呼ばれる)を使用して複数回繰り返されます。溶出したタンパク質(溶出液)はインラインクロマトグラフィーシステムに含まれている検出器を使用して、それがその後の(実行後)解析用の小さな画分に収集され分析されます。内の行と、実行後のGFP活性の分析と分離、最適なHICカラムとクロマトグラフ媒体に基づいて識別されます。
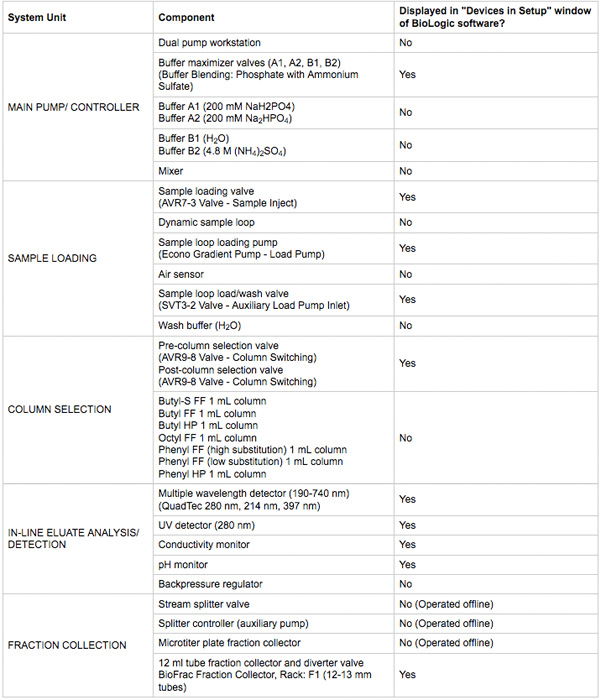
表1は、このプロトコルで使用される主要なクロマトグラフィーシステムのコンポーネント。
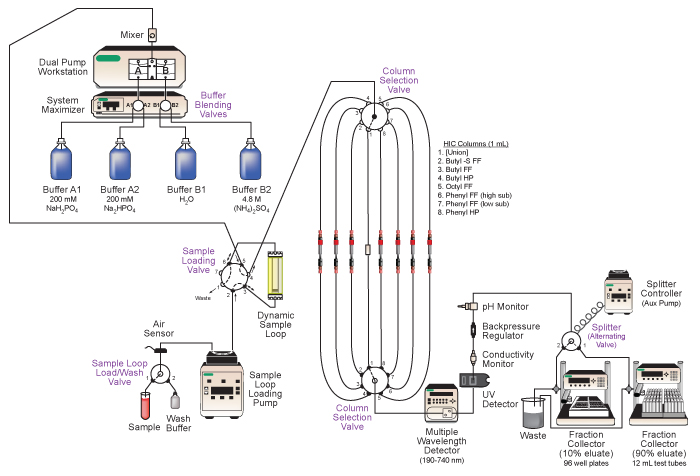
図2。採用Bio-Rad社DuoFlow中圧液体クロマトグラフィーシステムの図。 SYの主な特徴分画した溶出液の連続列の実行のためのサンプルのロード自動化されたバッファ·ブレンディング、異なるクロマトグラフィーカラムの自動選択、溶出液のインライン分析、タンデムコレクションを含む幹。詳細については、テキストと表1を参照してください。
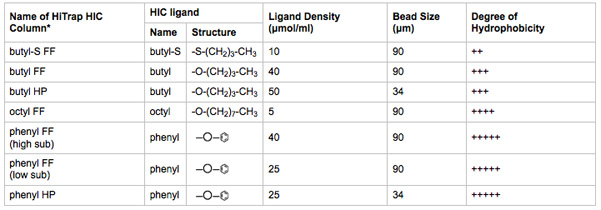
表2。HICメディアの生物物理特性がテストされています。ハイトラップのHICカラムの名前は、リガンド、リガンド密度、ビーズの大きさの指標である。
* FFは=速い流れ、HP =ハイパフォーマンス。大きいビーズサイズはリガンド結合容量と流量を増加させます。小さいビーズのサイズは、クロマトグラフィー分解能を向上させます。製造元から提供されている文献から得られた情報。

図3。 Bio-Rad社DuoFlow system.To上流1/4-28デルリンナットにGEヘルスケア·ハイトラップHICカラムの接続NDフェルール(A1)、オスルアーメス1/4-28フィッティング(B1)と男性の1/16 " - メスルアーフィッティング(C)接続されています。フィッティングがされた後、ハイトラップカラムに添付されているバッファを使用してフラッシュし、すべての気泡を除去した。カラムの出口では、女性の1/16 " - オスM6金具(D)に接続されているオスルアーメスM6フィッティング(E)、および女性のルアー·ツー·メス·1 / 4月28日フィッティング(B 2)。この全体のアセンブリは、下流1/4-28デルリンナットとフェルール(2)に接続されています。上部のパネルには、継手が分離示しており、 下部のパネルには、組み立てられた継手を示しています。
| #ステップ | 量(mL) | 説明 | パラメータ | |
| 1 | 0.00 | 全体の実行中に1.0mLの画分を集め | ||
| 2 | 0.00 | SWITchのコラム | HICカラム1 (ポジション2) | |
| 3 | 0.00 | アイソクラティックフロー | pH値:6.80 100%B | ボリューム:2.00 mLの 流量:1.00 mL / minの |
| 4 | 2.00 | ゼロベース | QuadTec | |
| 5 | 2.00 | ゼロベース | UV検出器 | |
| 6 | 2.00 | サンプルを注入する | サンプルのロード 動的ループ | 自動バルブを注入 ボリューム:0.50 mLの 流量:1.00 mL / minの |
| 7 | 3.00 | アイソクラティックフロー | pH値:6.80 100%B | ボリューム:5.00 mLの 流量:1.00 mL / minの |
| 8 | 8.00 | 線形グラデーション | pH値:6.80 100パーセントB - > 0%B | ボリューム:10.00 mLの 流量:1.00 mLの/分 |
| 9 | 18.00 | アイソクラティックフロー | pH値:6.80 0%B | ボリューム:3.00 mLの 流量:1.00 mL / minの |
| 10 | 21.00 | アイソクラティックフロー | pH値:6.80 100%B | ボリューム:5.00 mLの 流量:1.00 mL / minの |
| 11 | 26.00 | スイッチの列 | 組合 (ポジション1) | |
| 終わり | 26.00 | 議定書の末尾 | 5つの追加HICカラムで自動的に繰り返し (位置3-7) | |
| タイプをスカウト | 実行の数:6 | スカウトステップ数:1 | ||
採用HICスカウト方法については、 表3。生物·ソフトウェア·プロトコル。

図4代表的なHIC塩勾配、導電率、カラム圧力。塩濃度(青線)が減少すると、導電率(赤線)は、同様に行います。塩勾配と導電率のトレーシングとの間のオフセットはバッファ入口から導電率のモニタに移動するためのバッファに必要な時間を示しています。システム圧力(灰色の線)がスカウトを実行の期間が比較的一定に保たれます。
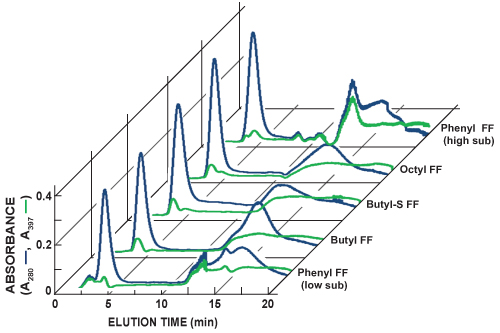
図5連続したハイトラップHICカラムスカウティングランのクロマトグラムをコンパイルします。総蛋白(280、青線)とGFP(397、緑のライン)のインライン検出は、それぞれ、280 nmと397 nmの光の吸光度を測定することによって行われます。この一連の実験では、シャープなGFPの溶出ピークは、フェニルFF(高いサブ)Cで観察されたolumn。フェニルFF(高いサブ)列には、GFPと他のタンパク質との間の最大の分離を提供するために登場しました。さらに1 mlのハイトラップHICカラム(フェニルFF(低サブ))、ブチル速い流れ(ブチルFF)、ブチル-S速い流れ(ブチル-S FF)、およびオクチル速い流れ(オクチルFF)が含まフェニル高速フロー低置換をテスト。
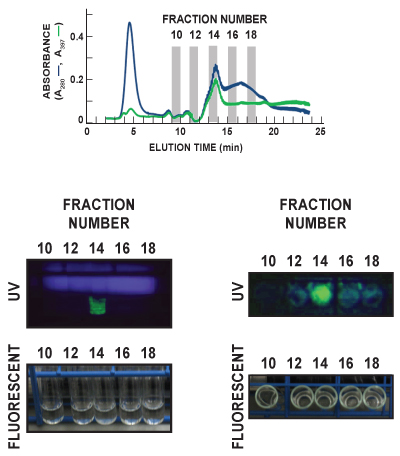
図6サンプルの溶出液中のGFPの代表、実行後の可視化。溶出画分を1/minuteの割合で回収し、各々はGFPのコンテンツを分析した。この代表的な図では、実行をスカウト分数10、12、14、16、フェニルFF(高いサブ)の18の培養管は、周囲の部屋(蛍光灯)の光と紫外線(UV)光の下で可視化した。チューブは、両方の顔フォワード(左パネル)とトップダウン見られていた(右パネル)。左側のUVパネルの拡散青色光、UVランプから放出される。 GFP(緑色)が明らかにフラクショナルに検出されUVイメージの両方でる14。上部のパネルには、総蛋白(A280、青線)とGFP(397、緑の線)を可視化されて5画分のクロマトグラムのトレーシングを示しています。
ディスカッション
液体クロマトグラフィー技術は、7生化学的免疫学6を行うために必要な高度に精製したタンパク質、および構造的な8つの研究を準備するために貴重な実証されています。 HICの精製方法は、ほとんどの場合、好ましい培地の経験的判断を必要とし、配位子の構造、リガンド密度、マトリックスビーズのプロパティはすべてのクロマトグラフの結果は2、3に影響を与えることが示されている。スカウト自動化された列は、その後の最適化とタンパク質精製4 HIC培地を選択するための効率的なアプローチである。提示自動化されたカラムスカウティング手法は、容易に様々なHICタンパク質の精製戦略に適合させることができます。塩濃度、塩の選択は、塩勾配、およびpHの変化は、さらに精製条件を向上させることができ、これらの必須のパラメータを変えることの効果は以前に13,14日されています。部分的に精製されたターゲットproteを含むHIC溶出液には、さらに、イオン交換クロマトグラフィー(IEX)またはゲル濾過/サイズ排除クロマトグラフィー9,10などの補完的なクロマトグラフィー技術を用いて精製することができます。
そのユニークな光の吸光度および発光特性の、GFPの溶出プロファイル内の行と、実行後のアプローチを使用して識別することができます。そのために、このプロトコルは、さらに関係のない目的タンパク質がGFPで "タグ付け"されている、組換えGFP融合タンパク質の精製に適応することができます。 GFPタグ付きの標的タンパク質は、UV光11と、上記HIC精製戦略を含む様々なクロマトグラフィー手法を用いて精製して検出することができます。 GFPの精製はまた、近代的な蛋白質科学技術の12の教育のための生化学ラボで教育主食となっています。
基本的なHICタンパク質の精製は、実質的に少ない堅牢なクロマトグラフィーSYを用いて行うことができますが、ステムは、ここで紹介するインストルメンテーションは、良好な結果を得ることを支援するために、異なる多くの利点があります。高度に自動化システムを利用しての顕著な利点は、改善·実行·実行するために条件の再現性、時間を節約し、システム10に導入される空気の機会を減少させたが含まれています。システム·マキシマイザーにより促進されるシステム制御バッファブレンディングは、バッファの準備と実験の再現性に増加した一貫性を可能にします。スカウトは、さらに実行するすべての動的なサンプルループに十分なサンプルの負荷を描画すると、サンプルの均一性は、各列に追加され確保され、中断、または手動でリロードすることなく、順次実行を可能にします。カラムにサンプルループから制御された試料注入は、手動でサンプルロードで発生する可能性がありばらつきが減少します。カラム選択バルブのペアは、それぞれのシステムをreplumbすることなく、異なるHICカラムを使用して、連続したサンプルの実行が可能になります。 MULを実行するユニークな分光プロファイルを使用して蛋白質を測定する時TI-波長分析では、特に有益です。 GFPに加えて、シトクロム、flavoproteins、および他のヘム含有タンパク質は、この技術の恩恵を受ける可能性があります。伝導度とpHモニタリングデバイスは、リアルタイムの実験条件の検証を可能にします。分割分数溶出コレクションは改善された分画処理を行うことができ、最小限のサンプル量(例えば、ELISA、SDS-PAGE、ウェスタンブロット、とExperionマイクロ流体電気泳動)を必要と実行後の分析手法について簡単に転送できます。第二のフラクションコレクタをオフラインで操作すると手動で同期を必要とするが、それはフラクションコレクタの選択に最大の柔軟性を可能にします。 HICスカウトカラムとタンパク質の精製のためにそのような堅牢なクロマトグラフィーシステムを活用した最も重要な欠点は、楽器の収集とオペレータのトレーニングに関連付けられている最初の時間と予算の支出が含まれています。
T ">ここで紹介するプロトコルは、Bio-Rad社DuoFlowクロマトグラフィーシステムを利用します。。しかし、このようなGEヘルスケアからÄKTAの前衛のような他のメーカーからも同様に堅牢なインストルメンテーションを利用することもできると同等の結果を生成することが可能であっても同等のクロマトグラフィーシステム精製法や楽器の取得を開始する前に考慮すべき固有の特性(例えば、メソッドのプログラミング、コンポーネントの命名法、演算子の優先順位、およびスケーラビリティの制限)があります。開示事項
クロマトグラフィー用試薬を選択し、補足的な計装は、Bio-Radから提供されました。
謝辞
この作品は、健康補助金GM086822と国立科学財団の主要な研究助成金計装DBI-0960313の国立研究所によって資金を供給された。著者は、博士に感謝します。ジョン·三宅&ドナハーディ(Bio-Rad社)とその技術的専門知識のためにジェニファーLoertscher(シアトル大学)。クロマトグラフィー用試薬を選択し、補足的な計装は、寛大にBio-Rad社によって提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(オプション) |
| 生物学的DuoFlowパスファインダー20システム | バイオ·ラッド | 7602257 | システムマキシマイザー、ミキサー、F10のワークステーション、AVR7-3バルブ、フローセル、BioFracフラクションコレクター、生物学的ソフトウェア、スターターキットを使用QuadTecのUV / VIS検出器を含む |
| AVR9-8ストリーム選択バルブ | バイオ·ラッド | 7600408 | 生物学的DuoFlowシステムで使用する高圧バルブ、9ポート、8ポジション、3,500 PSI(233バー)の制限、 |
| 分流弁SV3T-2 | バイオ·ラッド | 7600410 | 生物学的DuoFlowシステムで使用する電磁弁、3ポート、2ポジション、30 PSI(2バー)の制限、 |
| ストリームスプリッタバルブ | バイオ·ラッド | ||
| tical = LSR&parentCategoryGUID = 22c495f1-36ff-44a3-9140-ee7e54d0b1ba "ターゲット=" _blank "> DynaLoop 25キット | バイオ·ラッド | 7500451 | スライディングピストンサンプルループ·キット、25ミリリットルのDynaLoopスライディングピストンループ、DynaLoop部品キット(#750から0450まで)が含まれています |
| BioFracフラクションコレクタ | バイオ·ラッド | 7410002 | 二つの分数COL使用lectors |
| BioFracマイクロドロップヘッドアダプタ | バイオ·ラッド | 7410088 | |
| BioFracマイクロタイタープレートアダプタ | バイオ·ラッド | &国=米国&LANG = EN&ProductID =に741-0017 "ターゲット=" _blank "> 7410017 | |
| UV光モジュール | バイオ·ラッド | 7500202 | |
| ハロゲンランプ | バイオ·ラッド | < 1ターゲット= "_blank"> 7601331 | |
| エコノグラジエントポンプ | バイオ·ラッド | 7319001 | 低圧タンパク質精製のための勾配ポンプは、チューブと継手キットが含まれています |
| Experionシステム | バイオ·ラッド | bio-rad.com/prd/en/US/adirect/biorad?CMD = BRCatgProductDetail&ProductID =に224301 "ターゲット=" _blank "> 7007001 | |
| Experion Pro260分析キット | バイオ·ラッド | 7007102 | |
| ハイトラップHICカラム選択キット | GEヘルスケア | 28-4110-07 | スカウトのためにHICのメディアの7×1ミリリットルプレパックドカラムが含まれています |
| GEヘルスケア·ツー·Bio-Rad社のカラムフィッティング | GEヘルスケア | 18111251と18111257 |
参考文献
- Cummins, P. M., O'Connor, B. F. Hydrophobic interaction chromatography. Methods Mol. Biol. 681, 431-437 (2011).
- Nagrath, D., Xia, F., Cramer, S. M. Characterization and modeling of nonlinear hydrophobic interaction chromatographic systems. J. Chromatogr. A. 1218, 1219-1226 (2011).
- To, B. C., Lenhoff, A. M. Hydrophobic interaction chromatography of proteins. IV. Protein adsorption capacity and transport in preparative mode. J. Chromatogr. A. 1218, 427-440 (2011).
- Huddleston, J. G., Wang, R., Lyddiatt, A. On the use of mild hydrophobic interaction chromatography for "method scouting" protein purification strategies in aqueous two-phase systems: a study using model proteins. Biotechnol Bioeng. 44, 626-635 (1994).
- Arun, K. H., Kaul, C. L., Ramarao, P. Green fluorescent proteins in receptor research: an emerging tool for drug discovery. J. Pharmacol. Toxicol. Methods. 51, 1-23 (2005).
- Terrizzi, S. C., Banh, C., Brossay, L.A Protocol for the Production of KLRG1 Tetramer. J. Vis. Exp. (35), e1701-e1701 (2010).
- Murphy, P. J. M., Morishima, Y., Kovacs, J. J., Yao, T. P., Pratt, W. B. Regulation of the dynamics of hsp90 action on the glucocorticoid receptor by acetylation/deacetylation of the chaperone. J. Biol. Chem. 280, 33792-33799 (2005).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 Magnetosome Associated Protein MamAΔ41. J. Vis. Exp. (37), 10-3791 (2010).
- Kong, Y., Li, X., Bai, G., Ma, G., Su, Z. An automatic system for multidimensional integrated protein chromatography. J. Chromatogr. A. 1217, 6898-6904 (2010).
- Camper, D. V., Viola, R. E. Fully automated protein purification. Anal. Biochem. 393, 176-181 (2009).
- Hammon, J., Palanivelu, D. V., Chen, J., Patel, C., Minor, D. L. A green fluorescent protein screen for identification of well-expressed membrane proteins from a cohort of extremophilic organisms. Protein Sci. 18, 121-133 (2009).
- Wu, Y. Using green and red fluorescent proteins to teach protein expression, purification, and crystallization. Biochem. Mol. Biol. Educ. 36, 43-54 (2008).
- Queiroz, J. A., Tomaz, C. T., Cabral, J. M. Hydrophobic interaction chromatography of proteins. J. Biotechnol. 87, 143-159 (2001).
- McCue, J. T. Theory and use of hydrophobic interaction chromatography in protein purification applications. Methods Enzymol. 463, 405-414 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved