Method Article
Automated interação hidrofóbica Seleção coluna de cromatografia para uso na purificação de proteínas
Neste Artigo
Resumo
Um método automático para a identificação de interacção hidrofóbica adequados cromatografia (HIC) meios de comunicação para ser utilizados no processo de purificação de proteínas é apresentada. O método utiliza um meio de pressão-sistema de cromatografia líquida incluindo mistura de tampão automatizado, injecção lacete dinâmica amostra, a selecção de coluna sequencial, multi-comprimento de onda de análise, e recolha de divisão eluato fracção.
Resumo
Em contraste com outros métodos cromatográficos para proteínas de purificação (por exemplo, filtração em gel, afinidade e de troca iónica), cromatografia de interacção hidrofóbica (HIC) comumente requer determinação experimental (referido como triagem ou "scouting"), a fim de seleccionar o meio mais adequado para cromatografia para a purificação de uma dada proteína 1. O método aqui apresentado descreve uma abordagem automatizada para aferição para um meio óptimas HIC a serem utilizados na purificação de proteínas.
HIC separa proteínas e outras biomoléculas a partir de um lisado bruto com base nas diferenças de hidrofobicidade. Semelhante a cromatografia de afinidade (AC) e cromatografia de permuta iónica (IEX), HIC é capaz de se concentrar a proteína de interesse à medida que progride através do processo cromatográfico. Proteínas mais adequados para a purificação por HIC incluem aqueles com regiões superfície hidrofóbica e capaz de suportar a exposição a concentrações de sal em excesso de 2 ammo Mtitânio sulfato de ((NH4) 2 SO 4). HIC é muitas vezes escolhido como um método de purificação para proteínas que faltam um marcador de afinidade e, portanto, inadequado para AC, e quando IEX não fornecer purificação adequada. Porções hidrofóbicas na superfície da proteína temporariamente se ligar a um ligando não polar acoplado a uma matriz inerte, imóvel. A interacção entre a proteína e do ligando são altamente dependente da concentração de sal do tampão que flui através da coluna de cromatografia, com altas concentrações iónicas reforçar a interacção proteína-ligando e tornando a proteína imóvel (isto é, ligado no interior da coluna) 2. Como diminuir as concentrações de sal, a interacção proteína-ligando dissipa, a proteína torna-se novamente móvel e elui da coluna. Vários meios HIC estão disponíveis comercialmente em pré-embalados colunas, cada uma contendo de vários ligandos hidrofóbicos (por exemplo, S-butilo, butilo, octilo, e fenil) reticulado em diferentes densidades de esferas de agarose de uma especificaçãodiâmetro ific 3. Coluna Automated aferição permite uma abordagem eficiente para determinar que a mídia HIC deve ser empregada para o futuro, experimentos de otimização mais exaustivos e purificação de proteínas é executado 4.
A proteína específica a ser purificado é aqui recombinante da proteína verde fluorescente (GFP), no entanto, a abordagem pode ser adaptado para a purificação de outras proteínas com uma ou mais regiões superfície hidrofóbica. GFP serve como um modelo útil proteína, devido à sua estabilidade, único pico de absorvância de luz a 397 nm, e de fluorescência quando exposta à luz UV 5. Lisado bacteriano contendo GFP do tipo selvagem foi preparado de um tampão de elevado teor de sal, carregado num meio DuoFlow Bio-Rad a pressão do sistema de cromatografia líquida, e adsorvido a colunas HiTrap HIC contendo diferentes meios HIC. A proteína foi eluída das colunas e analisadas por in-line e métodos de pós-run de detecção. Mistura de buffer, a injeção de ciclo dinâmico amostra, col seqüencialUMN selecção, multi-comprimento de onda, análise e de divisão de recolha eluato fracção aumentou a funcionalidade do sistema ea reprodutibilidade da abordagem experimental.
Protocolo
1. Buffer e Preparação da Amostra
- Nota técnica: Todos os tampões devem ser refrigerado e cada passo deste protocolo deve ser realizado em gelo ou a 4 ° C, salvo indicação em contrário. A baixa temperatura é essencial para evitar a degradação da proteína a ser purificado, e para assegurar as condições de operação óptimas. Meios HIC pode produzir resultados diferentes de separação se operado à temperatura ambiente, eo sistema de cromatografia deve ser operado em uma caixa de 4 C câmara fria ou fria °.
- Preparar 500 ml de os seguintes tampões: 200 mM de NaH 2 PO 4 (Tampão A1), 200 mM de Na 2 HPO 4, (Tampão A2), e 4,8 M (NH4) 2 SO 4 (B2 tampão). Água desionizada (B1 Buffer) também vai ser usado. Desgaseificar a buffer para assegurar condições óptimas de operação cromatográficos. O maximizer sistema misturam Buffers A1 e A2 para gerar um baixo teor de sal tampão de eluição de fosfato, e vai misturar Buffers B1 e B2para gerar a alta sal de amónio sulfato de tampão inicial (2,4 M (NH4) 2 SO 4).
- Preparar 20 ml de amostra a ser carregado por mistura de 10 ml de lisado celular contendo a proteína a ser purificado, com 10 ml de Tampão B2. A concentração final de sulfato de amónio da solução da amostra de células lisado deve ser de aproximadamente 2,4 M (NH4) 2 SO 4, tornando-a mais ou menos equivalente para o buffer de início. Lisado celular podem ser preparados por ressuspensão do sedimento celular bacteriana em tampão TE (10 mM Tris 1 mM de EDTA, pH 8,0) seguido por sonicação ou a adição de 1 mg / ml de lisozima e centrifugação a 3700 × g durante 10 minutos.
- Filtrar a mistura lisado-buffer através de uma proteína de ligação baixa 0,45 seringa iM filtro para remover as partículas a partir da solução. Manter a amostra em gelo até que está pronta para ser carregada no sistema.
2. Instalação Física e encanamento de DuoFlow sistema de cromatografia
- Certifique-se de todo o poder, e conexões de comunicação são feitas. Os dispositivos devem ser visíveis na DuoFlow cromatografia janela Biologic software de controle manual. Um resumo dos dispositivos estão listados na Tabela 1. Uma ilustração do sistema de encanamento e diagrama é na Figura 2.
- Fixe as conexões elétricas para que as válvulas da bomba portas da estação de trabalho e sistema maximizer tais que a numeração da porta segue uma seqüência lógica. Rotule cada válvula com seu respectivo número de porta para referência futura. A estação de trabalho da bomba e maximizador sistema servir como as conexões principais de comunicação entre o computador / controlador e sistema de cromatografia. Válvulas será reconhecido e visualizado automaticamente no software quando conectado a qualquer dispositivo.
- Nota técnica: Ao operar o sistema de cromatografia em modo manual, as válvulas são controladas independentemente. Ter o cuidado de verificar que o caminho de fluxo desejada é configurado, particularmente quando se muda de válvulas, antes de iniciar lustrefluxo er.
- Tubo de Teflon submergir em Buffers A1, A2, B1 e B2. Assegurar volumes adequados de tampão estão disponíveis para o protocolo de inteira e que os tubos continuará a ser submerso. Preparação 500 ml de Buffers A1, A2 e B2 e 1 L de tampão B1 será adequada.
- Prumo amostra carregamento da válvula e laço de amostra dinâmica, como ilustrado na Figura 2 e por instruções do fabricante. Ligue o circuito de amostra para a entrada da válvula de amostra (posição 3) usando o menor comprimento de tubagem possível. Isto irá minimizar a diluição da amostra durante o processo de carga da amostra.
- Minimizar o comprimento da tubagem entre a amostra, a bomba de carregamento da amostra, ea amostra de entrada da válvula de carregamento (posição 2). Isto irá diminuir a quantidade de amostra necessário para carregar o laço de amostra.
- Preparar 8 pares de tamanho idêntico de 1/16 tubagem PEEK "OD, com cada par unidas entre si por uma união female-to-1/4-28 1/4-28 fêmea. Ligar os pares de Posições 1-8 da coluna dois válvulas de seleção. A União 7s ligados em-linha para posições de coluna de selecção de válvula 2-8, mais tarde, ser substituídas pelas colunas de cromatografia a serem testadas. A união em linha ligada com Posição 1 será mantido como uma coluna de cromatografia de bypass.
- Nota técnica: Assegurar que cada par de tubos está ligado a mesma posição em ambas as válvulas de selecção de coluna.
- Ligue o UV o 4-comprimento de onda / Detector Vis (QuadTec) lâmpada e fixo-comprimento de onda 280 nm lâmpada Detector UV. Os comprimentos de onda a ser medidos pelo QuadTec para este protocolo incluem 214 nm, 280 nm e 397 nm. Medindo 280 nm com tanto Detector UV fixo-comprimento de onda e QuadTec fornece redundância do sistema e garante a validade dos dados.
- Confirme todos os detectores são calibrados conforme as instruções do fabricante. O regulador de contrapressão é necessária para reduzir a acumulação de bolhas de ar em detectores e deve ser instalado a jusante dos detectores mas a montante do monitor de pH.
- O sistema aqui apresentado inclui duas fractiocoletores de n, que oferece conveniência substancial para o pós-run análise eluato. Anexar os coletores de fração, fluxo de válvula divisor e divisor de controlador, como ilustrado na Figura 2. O colector de fracções ligado para a posição 1 da válvula de separador irá recolher 900 uL fracções eluídas em tubos de cultura de 12 ml, enquanto que o colector de fracções ligadas à posição 2 irá recolher 100 uL fracções eluídas em 96 placas de microtitulação.
- A posição coletor de fração 2, divisor de válvula, e divisor de controlador são operados off-line da estação de trabalho de cromatografia. O controlador divisor está contido dentro de um Bio-Rad bomba de gradiente Econo, no entanto, o componente de bomba do dispositivo não é utilizado. A "% Split" opção de configuração será exibido na bomba Gradiente Econo quando a válvula divisor é conectado a ele.
- % Set Dividir a 10. A posição colector de fracções 1 irá recolher 90% do eluato (900 ul / fracção), ea posição colector de fracções 2 irá recolher10% (100 uL / fracção). Os colectores fracção irá avançar em sincronia permitindo números fraccionários, de ambos os colectores para corresponder ao outro.
- Substitua o padrão fração cabeça queda coletor sobre o coletor de fração posição 2 com uma cabeça de queda de microplacas. A cabeça de gota de microplacas tem uma abertura menor, o que permite recolha de tamanhos de gota 50% menores (isto é uL 25 em vez do uL 50 padrão) e é particularmente benéfico quando recolha ≤ 500 fracções uL.
- Usando o painel de controle na tela, defina a posição do coletor fração 2 para coletar frações em placas de 96 poços e avançar a uma taxa de 1 amostra / minuto. O controlador de divisor e Posição colector de fracções 2 será iniciado manualmente imediatamente a seguir ao início da corrida de cromatografia em primeiro lugar.
- Lave a posição 2 e coletor de fração cabeça queda de microplacas com B1 Buffer.
3. Injeção Linhas do Sistema, Método Run Programação e EquilibratColunas ing HIC
- Com linhas do sistema de entrada maximizer submerso em Buffers desgaseificados A1, A2, B1 e B2, a estação de trabalho principais bombas, lavagem de amostragem, e lave o sistema de cromatografia por instruções do fabricante. Passo escorva completo com todos os 4 entradas do sistema maximizer (A1, A2, B1 e B2), a fim de remover as bolhas de ar restantes.
- Preparando o sistema exige a operação manual do controlador de sistema através do software BioLogic. Confirme o correto posicionamento da válvula de amostra de carga e válvulas de seleção de coluna antes de iniciar o fluxo de buffer.
- Preparar para iniciar uma ml 1 manual / minuto fluxo de tampão de eluição (0% B) através do sistema, tal como descrito nos Passos 3.4-3.5.
- Na janela de configuração do software BioLogic programa, selecione "Usar Blending Buffer" e "tampão fosfato com sulfato de amônio". Confirme Buffers A1, A2, B1, B2 e listado na janela de configuração correspondem aos preparado.
- Manualmente definir a taxa de fluxo de 1 ml / minuto de tampão de eluição(0% de B). Observe contrapressão, condutividade, traçados UV e pH permaneçam consistentes e dentro dos limites normais de operação. Anormalidades indicar ar ou bloqueio coluna que devem ser abordados antes de prosseguir.
- Lave todas as 8 linhas de seleção de coluna com 5 ml tampão de eluição. Faça isso antes parar o fluxo, estabelecendo ambas as válvulas de seleção de coluna para a posição 2, e retomar o fluxo de 1 ml / minuto, B. 0% Repita o procedimento para as linhas da coluna de seleção nas posições 3-8.
- Ligue 1 ml colunas HIC HiTrap para Posições 2-8 de válvulas de selecção de coluna. Completar os passos 3.8-3.13 com uma coluna de cada vez. Tome nota de qual coluna HIC é colocado em que posição da válvula de seleção. Um resumo dos meios de comunicação características coluna HIC está listado na Tabela 2.
- A conexão física de colunas HiTrap da GE Healthcare para o sistema DuoFlow Bio-Rad requer uma série de acessórios que utilizam 1/4-28, M6 e acessórios Luer. Retire a união conectando a posição 2 válvulas de seleção de coluna. Align o Bio-Rad e acessórios GE Healthcare como ilustrado na Figura 3.
- Anexe acessórios coluna montante para o DuoFlow. Evite bolhas de interceptação na coluna ou tubo com firmeza anexando os acessórios coluna montante para a instalação a montante da válvula de seleção. Executar tampão de eluição através dos acessórios até que todo o ar é expelido e uma grande queda de tampão está presente. Temporariamente parar o fluxo de buffer.
- Retirar a rolha ligada à entrada da coluna e colocar uma grande queda de baixo teor de sal de tampão (0% de B) sobre a parte superior da coluna. Fixe a coluna para os ajustes a montante. Tendo tanto de entrada da coluna e ajuste de entrada cheia de gotas de tampão garante uma conexão livre de bolhas de ar.
- Se a coluna está a ser usado pela primeira vez, se romper a extremidade de saída da coluna. Fixe a saída para as conexões e tubos de coluna a jusante da válvula de seleção. Verifique todas as conexões estão firmemente apertadas.
- Definir o limite de contrapressão a 40 psi. Lavar a coluna with 5 volumes de coluna (5 volumes de coluna = 5 ml) de tampão de eluição (0% de B) com uma taxa de fluxo de 1 ml / minuto. Continuar lavagem da coluna, se necessário, até que o pH, os traçados de UV e de contrapressão ter estabilizado.
- Lavar a coluna com 10 volumes de coluna (10 ml) tampão inicial (100% de B) com uma taxa de fluxo de 1 ml / minuto. Continuar lavagem da coluna, se necessário, até que os parâmetros do sistema listados na etapa anterior, bem como a condutividade ter estabilizado.
- A coluna HIC preparado acima está agora pronto para o carregamento da amostra. Uma vez que todas as colunas a serem testadas são preparados, mudar manualmente as válvulas de seleção de coluna para a posição 1 (união) e parar o fluxo de buffer.
4. Carregando Amostra
- Submerge tubagem de entrada da amostra em 20 ml de amostra para iniciar o processo de carregamento da amostra na ansa de amostragem dinâmica. A partir da janela de configuração manual do software BioLogic, mude carga loop de amostra / lavar válvula para a posição 1 (Amostra) e da válvula de carregamento de amostras para Limpar.
- Iniciar a ação dea amostra de bomba de carga loop, a elaboração de amostra para o tubo da bomba com um caudal de 1 ml / minuto até imediatamente após amostra atinge a válvula de carregamento de amostra. Isto remove tampão e / ou ar a partir da linha de carga de amostra.
- Parar o fluxo da bomba de carregamento e comutar a válvula de carregamento da amostra a partir de purga para carregar. Reiniciar o ciclo de carregamento de amostra bomba com um caudal de 1 ml / minuto, até 10 ml de amostra tenha sido puxado para o circuito de amostra dinâmico.
- Amostra suficiente é agora carregada no loop de amostra dinâmico para até 10 sequenciais funcionamentos coluna HIC de aferição.
5. Programação do Método Software e executando o protocolo Coluna Escotismo
- Na janela de configuração do software BioLogic, selecione os dispositivos do sistema marcados com um asterisco na Tabela 1.
- Seleccionar 6 colunas HIC do ensaio. Programa de um gradiente de sal linear descendente e 6-coluna método de aferição, como ilustrado na Tabela 3. O programa é um método modificatíon do BioLogic configuração coluna software HIC e foi otimizada para a aplicação atual.
- Um método 6-coluna aferição é recomendado devido a limitações de colector de fracções. Todos os 7 colunas podem ser sondado se o método de programa é ajustado para recolher volumes maiores fracção. Não adicione a etapa de aferição até que o programa é de outra maneira completa, como a seleção do recurso aferição impede a edição subseqüente.
- Comece a corrida de aferição. Manualmente iniciar tampão inicial (100% de B), fluxo de 1 ml / minuto. Pressione iniciar no controlador de divisor de iniciar 90% -10% eluato fluxo separação entre o colector ml de cultura 12 fracção tubo (posição 1) e do 96-poços colector de fracções placa (posição 2), respectivamente. Nota Técnica: Lembre-se do 96-bem coletor de fração placa é operado offline a partir do software BioLogic.
- Executar o método de programa. Imediatamente após o início do método run programa, pressione iniciar no painel de controle na tela do desligada placa de 96 poços fractiocolector n. Se os dois coletores de fração não são 100% síncrona, avançar manualmente o offline 96-bem coletor de fração placa com o avanço da fração de outros coletores para o segundo tubo fração coleção.
- Observe a visualização em tempo real para confirmar os parâmetros de execução previstos. B contrapressão, condutividade e% (Figura 4) são executados parâmetros que podem ser monitorados para garantir a coluna a coluna de reprodutibilidade das condições de execução. Posicionamento da válvula, pH, e carregamento da amostra também devem ser monitorados. Traçados UV podem ser comparados para verificar flow-through semelhante picos de eluição.
- Utilizar em linha e pós-run técnicas de análise de eluato para identificar o perfil de eluição e purificação da proteína de interesse (isto é, "proteína alvo").
- Para as amostras contendo GFP, observar-se a eluição em linha usando absorvância da proteína UV único em 397 nm. Compare o GFP-397 nm de absorbância específica de rastreamento para o geral nm de absorvância proteína 280 de rastreamento para estimar separação relativae purificação, utilizando os meios diferentes HIC sendo scouted (Figura 5).
- Pós-run análise da GFP e outras proteínas alvo pode ser conseguida através de vários métodos. Alíquotas de uL das fracções 5-50 96-poços de placas podem ser transferidas para uma placa de fresco e ensaiadas quanto à proteína específica por ELISA ou Western blot, e teor de proteína total de cada fracção pode ser analisada por meio convencional de SDS-PAGE ou um Experion sistema de eletroforese microfluídica. GFP fluorescência pode ser detectada em 12 ml de cultura, utilizando tubos de luz UV (Figura 6).
- Identificação dos mais promissores meios HIC pode ser determinada por comparação da GFP de eluição em relação a outras proteínas contidas na amostra. A purificação com os meios mais promissores HIC pode então ser optimizada de acordo com outros parâmetros, incluindo o tipo e concentração de tampão de início e de pH.
- Nota técnica: Na conclusão do experimento, coloque todas as linhas de entrada em B1 Buffer (desgaseificadosH2O) e lave as bombas, válvulas, e toda a tubagem com água. Seguir as instruções dos fabricantes para limpeza e armazenamento a longo prazo do sistema de cromatografia e colunas HIC.
6. Resultados representativos:
Representante gradiente de sal de HIC, a condutividade, ea pressão da coluna das pistas de aferição são apresentados na Figura 4. A alteração na concentração de sal (linha azul), tal como medida pela percentagem de tampão de desenhada a partir de linhas de alta sal tampão é típico da metodologia de HIC. À medida que a concentração de sal diminui, as proteínas ligado ao eluir da coluna. Condutividade (linha vermelha), que corresponde à concentração de sal observado, é medida em linha imediatamente após os detectores QuadTec e UV. O off-set entre gradiente de sal e os traçados de condutividade indica o tempo necessário para o tampão para viajar a partir da entrada de tampão, através do sistema, e para o monitor de condutividade. Ao longo do exemplo de execução, tele pressão do sistema (linhas cinzentas) e pH permaneça relativamente constante.
A Figura 5 mostra cromatogramas de corridas seqüenciais de coluna HIC escotismo. A detecção in-line de proteína total (A 280, linha azul) e GFP (A 397, a linha verde) é realizada através da medição da absorvância de luz a 280 nm e 397 nm, respectivamente. É possível aproximar abundância relativa a GFP e separação para cada execução de aferição, comparando as duas linhas. GFP ligado às colunas testadas HIC com diferentes graus de afinidade e do seu perfil de eluição variaram. Selecção de uma coluna de HIC preferido para purificações futuras baseia-se na identificação da coluna que produz o pico de eluição mais nítida GFP e maior separação de outras proteínas.
Na Figura 6, os tubos de cultura para as fracções 10, 12, 14, 16, e 18 do FF Fenil (sub elevada) de aferição de execução foram visualizadas sob luz ambiente da sala (fluorescente) e ultravioleta (UV). Os tubos foram vistas tanto cara-forward (painéis da esquerda) e top-down (painéis da direita), a fim de observar o espectro de emissão característico GFP. GFP (verde) é claramente detectado na fracção 14 em ambas as imagens de UV. Esses dados depois da corrida corresponde muito bem com a detecção in-line de GFP medindo a absorvância a 397 nm eluato (A 397, linha verde), que também identifica Fração 14 como contendo o pico principal de GFP eluído. O azul difusa no painel de UV esquerdo é a luz emitida a partir da lâmpada UV.
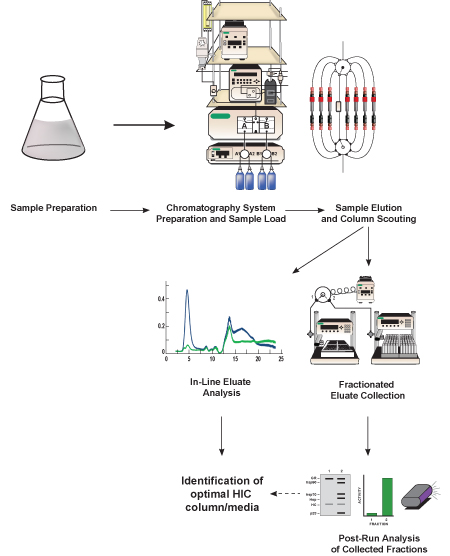
Figura 1. Representação esquemática do presente protocolo. Lisado bacteriano contendo proteína de interesse (GFP, a proteína alvo) é preparado, diluiu-se em um equivalente de tampão de alto sal para o buffer de início cromatografia, e filtrada. Uma vez que o sistema de cromatografia líquida é preparada, a amostra é carregada ea proteína alvo é separada a partir de outras proteínas continha iN o lisado usando um meio de cromatografia hidrófoba contidos numa coluna de pré-embalado de HIC. O método de separação é repetido várias vezes, utilizando meios de cromatografia diferentes (referido como coluna de aferição), a fim de determinar qual dos meios fornece a melhor separação GFP. As proteínas eluídas (eluído) é analisado em linha utilizando detectores incluídos no sistema de cromatografia e é recolhido em fracções menores para análise (pós-run) subsequente. Com base na análise de linha e de pós-execução da actividade da GFP e separação, uma coluna HIC óptima e meio cromatográfico são identificados.
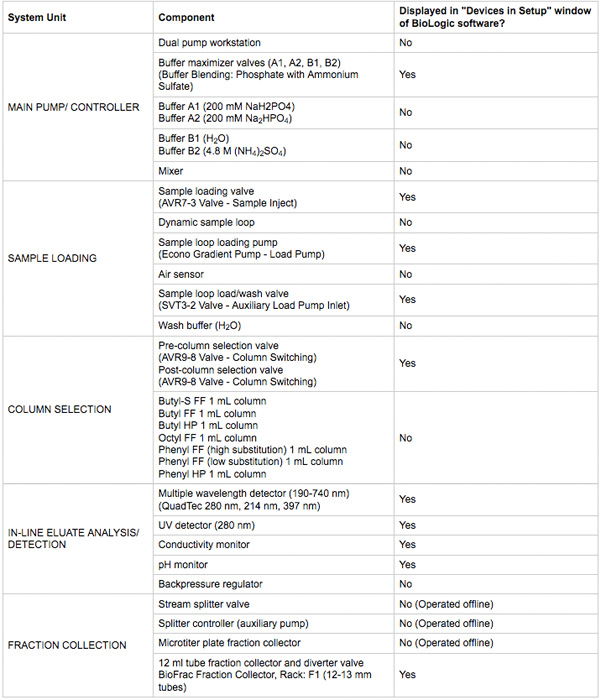
Tabela 1. Componentes principais do sistema de cromatografia utilizadas neste protocolo.
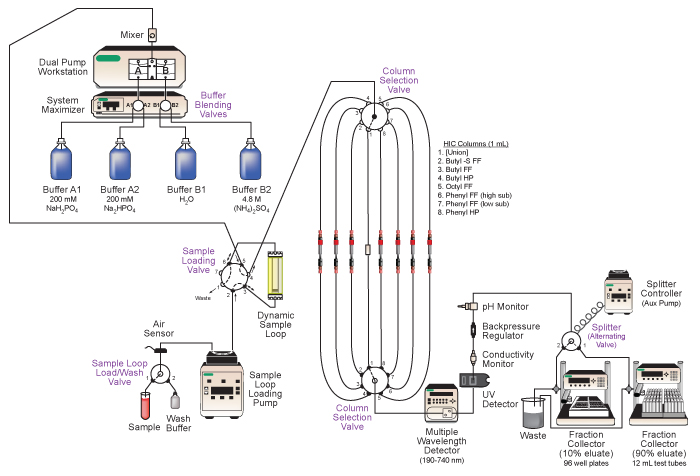
Figura 2. Esquema do sistema de DuoFlow Bio-Rad cromatografia líquida de média pressão empregue. Principais características do syestaminais incluir mistura tampão automatizado, o carregamento da amostra para execuções de coluna sequenciais, a selecção automática de colunas de cromatografia diferentes, em linha de análise do eluato, e recolha em tandem do eluato fraccionado. Veja o texto e Tabela 1 para detalhes.
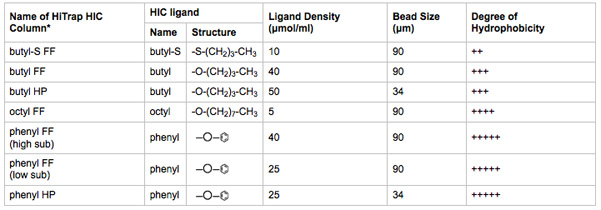
Tabela 2. Características biofísicas da mídia HIC testado. O nome da coluna HIC HiTrap é indicativo do ligando, a densidade de ligando, eo tamanho do grânulo.
* FF = fluxo rápido; HP = desempenho elevado. Maior tamanho das partículas aumenta a capacidade de ligação do ligando e da vazão. Menor tamanho das partículas aumenta resolução cromatográfica. Informação derivada da literatura fornecida pelo fabricante.

Figura 3. Ligação da GE Healthcare HiTrap coluna HIC para system.To DuoFlow Bio-Rad a porca Delrin montante 1/4-28 umª manga (A1), um encaixe Luer-mulher macho 1/4-28 (B1) e masculino 1/16 "para a mulher encaixe Luer (C) estão conectados. Os acessórios são anexar à coluna HiTrap depois de ter sido lavada com tampão e tendo todas as bolhas de removida. A saída da coluna está ligado a uma fêmea 1/16 "-macho encaixe M6 (D), Luer macho-fêmea para encaixe M6 (E), e Luer fêmea-fêmea 1 / 4-28 encaixe (B 2). Esta montagem inteira está ligado à porca Delrin jusante 1/4-28 e virola (A 2). O painel superior mostra os encaixes separadas ea painel inferior mostra os acessórios montados.
| Etapa # | Volume (mL) | Descrição | Parâmetros | |
| 1 | 0,00 | Coletar 1,0 mL frações durante a corrida inteira | ||
| 2 | 0,00 | SwitColunas ch | Coluna HIC 1 (Posição 2) | |
| 3 | 0,00 | Fluxo isocrática | pH: 6,80 100% de B | Volume: 2,00 mL Fluxo: 1,00 mL / min |
| 4 | 2,00 | Zero Base | QuadTec | |
| 5 | 2,00 | Zero Base | Detector UV | |
| 6 | 2,00 | Injectar Amostra | Load Sample Circuito dinâmico | Auto Injectar Válvula Volume: 0,50 mL Fluxo: 1,00 mL / min |
| 7 | 3,00 | Fluxo isocrática | pH: 6,80 100% de B | Volume: 5,00 mL Fluxo: 1,00 mL / min |
| 8 | 8,00 | Gradiente Linear | pH: 6,80 100% B - B> 0% | Volume: 10,00 mL Fluxo: 1,00 mL/ Min |
| 9 | 18,00 | Fluxo isocrática | pH: 6,80 B 0% | Volume: 3,00 mL Fluxo: 1,00 mL / min |
| 10 | 21,00 | Fluxo isocrática | pH: 6,80 100% de B | Volume: 5,00 mL Fluxo: 1,00 mL / min |
| 11 | 26,00 | Colunas de comutação | União (Posição 1) | |
| Final | 26,00 | Fim do Protocolo | Repete automaticamente com 5 colunas adicionais HIC (Posições 3-7) | |
| Olheiro tipo | Número de execuções: 6 | Número de Passos scouted: 1 | ||
Tabela 3. Protocolo de software para o método de aferição BioLogic HIC empregue.

Figura 4. Gradiente de sal representativas HIC, a condutividade, ea pressão da coluna. Como a concentração de sal (linha azul) diminui, condutividade (linha vermelha) faz tão bem. O off-set entre gradiente de sal e os traçados de condutividade indica tempo necessário para o tampão para viajar a partir da entrada de tampão para o monitor de condutividade. A pressão do sistema (linhas cinzentas) permanece relativamente constante durante a duração da execução de aferição.
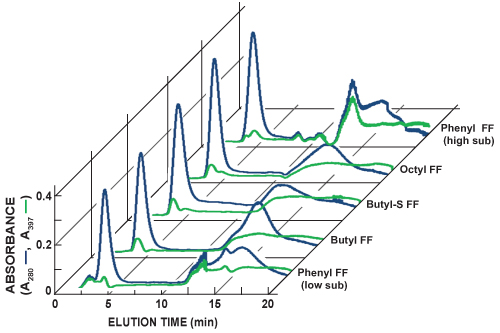
Figura 5. Cromatogramas Compilado de coluna sequencial HiTrap HIC aferição corridas. A detecção in-line de proteína total (A 280, linha azul) e GFP (A 397, a linha verde) é realizada através da medição da absorvância de luz a 280 nm e 397 nm, respectivamente. Nesta série de experiências, o pico de eluição mais nítida GFP foi observada com o FF Fenil (sub alta) column. O FF Fenil coluna (sub alta) também apareceu para fornecer a maior separação entre GFP e outras proteínas. Adicional de 1 ml HiTrap colunas HIC testado incluiu substituição de fluxo rápido Phenyl baixa (Phenyl FF (sub baixo)), butil fluxo rápido (butil FF), butil-S de fluxo rápido (butil-S FF), e fluxo rápido octil (octil FF) .
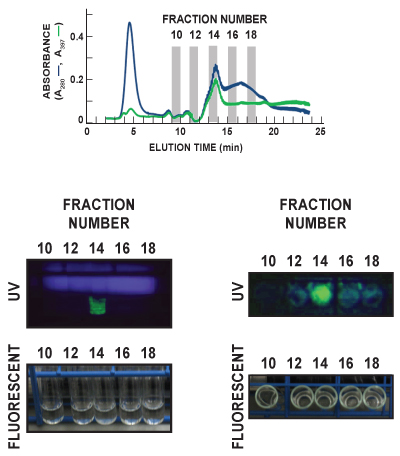
Figura 6. Visualização representativas pós-run da GFP em eluato da amostra. Fracções eluídas foram recolhidos a uma taxa de 1/minute, e cada um foi analisada quanto ao teor GFP. Nesta figura representativa, para tubos de cultura de fracções 10, 12, 14, 16, e 18 do FF Fenil (sub elevada) de aferição de execução foram visualizadas sob ambiente (fluorescente) e luz ultravioleta (UV). Os tubos foram vistas tanto cara-forward (painéis da esquerda) e top-down (painéis da direita). O azul difusa no painel de UV esquerdo é a luz emitida a partir da lâmpada UV. GFP (verde) é claramente detectado em Fracção 14 em ambas as imagens de UV. O painel superior indica a proteína total (A280, linha azul) e GFP (A linha 397, verde) traçados cromatograma dos 5 fracções sendo visualizado.
Discussão
Técnicas de cromatografia líquida provaram inestimável para a preparação de proteínas altamente purificadas necessárias para a realização de 6 imunológica, bioquímica 7, e 8 estudos estruturais. Métodos de purificação HIC mais frequentemente requer a determinação empírica de um meio preferido, e estrutura de ligando, a densidade de ligando, e as propriedades da matriz do grânulo todos têm sido mostrados para impacto nos resultados cromatográficas 2, 3. Coluna automatizado de aferição é uma abordagem eficiente para a seleção de um meio de HIC para otimização subseqüente e purificação de proteínas 4. O método automatizado coluna de aferição apresentados podem ser prontamente adaptado para várias estratégias de purificação de proteínas HIC. Alterações na concentração de sal, a escolha do sal, gradiente de sal, e pH pode melhorar ainda mais as condições de purificação, e os efeitos da variação destes parâmetros essenciais foram previamente analisado 13,14. Eluato de HIC contendo uma prote alvo parcialmente purificadain pode ser adicionalmente purificado utilizando uma técnica cromatográfica complementar, tal como cromatografia de permuta iónica (IEX) ou de exclusão em gel de filtração / tamanho cromatografia 9,10.
Devido à sua absorvância de luz original e características de emissão, o perfil de eluição de GFP podem ser identificados utilizando, em linha e pós-run abordagens. Para esse efeito, este protocolo pode ainda ser adaptada para a purificação de recombinantes GFP de fusão de proteínas, em que uma proteína-alvo não relacionado é "marcado" com GFP. Proteínas alvo GFP pode ser detectada com luz UV 11 e purificado utilizando várias abordagens cromatográficas, incluindo a estratégia de purificação HIC descrito acima. Purificação GFP também se tornou um marco pedagógico nos laboratórios de bioquímica para o ensino de técnicas de proteína ciência moderna 12.
Enquanto a purificação da proteína básica de HIC pode ser conduzida usando uma substancialmente menos robusto cromatografia syhaste, a instrumentação aqui apresentado tem um número de vantagens distintas para auxiliar na obtenção de resultados favoráveis. Benefícios notáveis de se utilizar um sistema altamente automatizado incluem a melhoria executar-a-correr condição de reprodutibilidade, tempo de poupança, e diminuiu oportunidades para o ar a ser introduzidos no sistema 10. Sistema controlado mistura de tampão, o que é facilitado pela maximizer sistema, permite a consistência aumentou na preparação de tampão e reprodutibilidade experimental. Desenho carga de amostra suficiente para a ansa de amostragem dinâmico para todos aferição é executado assegura ainda mais a uniformidade da amostra a ser adicionado a cada coluna e permite que para execuções sequenciais sem interrupção ou manual de recarga. Injecção da amostra controlado a partir do circuito de amostra na coluna diminui variabilidade que pode ocorrer com carregamento manual da amostra. Um par de válvulas de selecção de coluna permitir para execuções de amostra consecutivos, cada um utilizando uma coluna HIC diferente, sem ter de replumb o sistema. Executando mul ti-comprimento de onda de análise é particularmente benéfico quando se examina uma proteína com um perfil único espectrofotométrico. Além disso a GFP, citocromos, flavoproteínas, e outros heme contendo proteínas podem beneficiar deste técnica. Dispositivos de monitorização de condutividade e pH permitir a verificação de tempo real condições experimentais. Dividir recolha eluato fracção permite a manipulação fracção melhorada e permite a transferência fácil para os métodos de pós-executar a análise que requerem um mínimo volume de amostra (por exemplo, ELISA, SDS-PAGE, Western blot, e Experion electroforese microfluídico). Ao operar off-line segundo coletor fração requer sincronização manual, que permite a máxima flexibilidade na seleção de coletores de fração. As desvantagens mais significativas para a utilização como um sistema de cromatografia robusto para a coluna HIC aferição e purificação de proteínas incluem o tempo inicial e as despesas orçamentais associados à aquisição de instrumentos e treinamento do operador.
t "> O protocolo apresentado aqui utiliza um Bio-Rad DuoFlow sistema de cromatografia;. no entanto, a instrumentação igualmente robusta de outros fabricantes, tais como o Avant Akta da GE Healthcare, podem também ser utilizados e são capazes de produzir resultados equivalentes sistema de cromatografia Mesmo comparável têm características únicas de programação (por exemplo, limitações, método de nomenclatura de componentes, a preferência do operador, e escalabilidade) que devem ser considerados antes de iniciar um processo de purificação ou aquisição de instrumentos.Divulgações
Seleccionar reagentes de cromatografia e instrumentação suplementar foram fornecidos pela Bio-Rad.
Agradecimentos
Este trabalho foi financiado pelo National Institutes of Health concessão GM086822 e National Science Foundation grande pesquisa instrumentação concessão DBI-0960313. Os autores gostariam de agradecer as Dras. Jon Miyake & Donna Hardy (Bio-Rad) e Jennifer Loertscher (Seattle University), pela sua competência técnica. Seleccionar reagentes de cromatografia e instrumentação suplementar foram generosamente fornecidas pelo Bio-Rad.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
| BioLogic DuoFlow Pathfinder 20 Sistema | Bio-Rad | 7602257 | Inclui sistema maximizador, mixer, estação de trabalho F10, AVR7-3 da válvula, QuadTec UV / Vis detector com célula de fluxo, coletor de fração BioFrac, software BioLogic, e kit de iniciação |
| AVR9-8-stream selecionar válvula | Bio-Rad | 7600408 | De alta pressão da válvula, 9-porta, posição 8, 3.500 psi (233 bar) limite, para uso com o sistema DuoFlow BioLogic |
| Desviador válvula SV3T-2 | Bio-Rad | 7600410 | Válvula de solenóide, 3-porta, posição 2, 30 psi (2 bar) limite, para uso com o sistema DuoFlow BioLogic |
| Stream Splitter válvula | Bio-Rad | ||
| tical = LSR & parentCategoryGUID = 22c495f1-36ff-44a3-9140-ee7e54d0b1ba "target =" _blank "> DynaLoop 25 Kit | Bio-Rad | 7500451 | Sliding pistão kit de amostragem, inclui 25 ml de deslizamento DynaLoop laço pistão, DynaLoop partes kit (# 750-0450) |
| Coletor de Frações BioFrac | Bio-Rad | 7410002 | Dois col fração leitores utilizado |
| BioFrac microplaca adaptador cabeça queda | Bio-Rad | 7410088 | |
| BioFrac adaptador placa de microtitulação | Bio-Rad | & Country = EUA & lang = pt & ProductID = 741-0017 "target =" _blank "> 7410017 | |
| Optics UV Módulo | Bio-Rad | 7500202 | |
| Lâmpada halógena | Bio-Rad | < um target = "_blank"> 7601331 | |
| Econo Bomba Gradiente | Bio-Rad | 7319001 | bomba de gradiente de baixa pressão purificação de proteínas, inclui tubagem e kit de acessórios |
| Experion Sistema | Bio-Rad | bio-rad.com/prd/en/US/adirect/biorad? cmd = BRCatgProductDetail & ProductID = 224301 "target =" _blank "> 7007001 | |
| Experion Kit Análise Pro260 | Bio-Rad | 7007102 | |
| HiTrap kit seleção HIC coluna | GE Healthcare | 28-4110-07 | Inclui 7 x 1 ml pré-embalados colunas de mídia HIC para aferição |
| GE Healthcare para a Bio-Rad acessórios coluna | GE Healthcare | 18111251 e 18111257 |
Referências
- Cummins, P. M., O'Connor, B. F. Hydrophobic interaction chromatography. Methods Mol. Biol. 681, 431-437 (2011).
- Nagrath, D., Xia, F., Cramer, S. M. Characterization and modeling of nonlinear hydrophobic interaction chromatographic systems. J. Chromatogr. A. 1218, 1219-1226 (2011).
- To, B. C., Lenhoff, A. M. Hydrophobic interaction chromatography of proteins. IV. Protein adsorption capacity and transport in preparative mode. J. Chromatogr. A. 1218, 427-440 (2011).
- Huddleston, J. G., Wang, R., Lyddiatt, A. On the use of mild hydrophobic interaction chromatography for "method scouting" protein purification strategies in aqueous two-phase systems: a study using model proteins. Biotechnol Bioeng. 44, 626-635 (1994).
- Arun, K. H., Kaul, C. L., Ramarao, P. Green fluorescent proteins in receptor research: an emerging tool for drug discovery. J. Pharmacol. Toxicol. Methods. 51, 1-23 (2005).
- Terrizzi, S. C., Banh, C., Brossay, L.A Protocol for the Production of KLRG1 Tetramer. J. Vis. Exp. (35), e1701-e1701 (2010).
- Murphy, P. J. M., Morishima, Y., Kovacs, J. J., Yao, T. P., Pratt, W. B. Regulation of the dynamics of hsp90 action on the glucocorticoid receptor by acetylation/deacetylation of the chaperone. J. Biol. Chem. 280, 33792-33799 (2005).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 Magnetosome Associated Protein MamAΔ41. J. Vis. Exp. (37), 10-3791 (2010).
- Kong, Y., Li, X., Bai, G., Ma, G., Su, Z. An automatic system for multidimensional integrated protein chromatography. J. Chromatogr. A. 1217, 6898-6904 (2010).
- Camper, D. V., Viola, R. E. Fully automated protein purification. Anal. Biochem. 393, 176-181 (2009).
- Hammon, J., Palanivelu, D. V., Chen, J., Patel, C., Minor, D. L. A green fluorescent protein screen for identification of well-expressed membrane proteins from a cohort of extremophilic organisms. Protein Sci. 18, 121-133 (2009).
- Wu, Y. Using green and red fluorescent proteins to teach protein expression, purification, and crystallization. Biochem. Mol. Biol. Educ. 36, 43-54 (2008).
- Queiroz, J. A., Tomaz, C. T., Cabral, J. M. Hydrophobic interaction chromatography of proteins. J. Biotechnol. 87, 143-159 (2001).
- McCue, J. T. Theory and use of hydrophobic interaction chromatography in protein purification applications. Methods Enzymol. 463, 405-414 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados