Method Article
Automatisé d'interaction hydrophobe Chromatographie sur colonne de sélection pour l'utilisation dans la purification des protéines
Dans cet article
Résumé
Procédé automatisé pour identifier appropriés chromatographie d'interaction hydrophobe (HIC) médias à être utilisés dans le procédé de purification de protéine est présenté. La méthode utilise un système de moyenne pression chromatographie en phase liquide, y compris buffer blending automatisé, dynamique boucle d'injection de l'échantillon, sélection de la colonne séquentielle, multi-longueur d'onde d'analyse et de collecte de l'éluat scission fraction.
Résumé
Contrairement à d'autres méthodes chromatographiques pour les protéines purification (filtration sur gel, par exemple, l'affinité et l'échange d'ions), chromatographie d'interaction hydrophobe (HIC) nécessite souvent la détermination expérimentale (dénommé dépistage ou "scouting") afin de sélectionner le support le plus approprié par chromatographie en phase pour purifier une protéine donnée 1. La méthode présentée ici décrit une approche automatisée pour le scoutisme pour un média optimales HIC à être utilisés dans la purification des protéines.
HIC sépare les protéines et autres biomolécules à partir d'un lysat brut basée sur les différences de caractère hydrophobe. Semblable à la chromatographie d'affinité (AC) et chromatographie échangeuse d'ions (IEX), CIH est capable de concentrer la protéine d'intérêt à mesure qu'elle progresse dans le processus chromatographique. Protéines qui conviennent le mieux pour la purification par HIC comprennent ceux qui sont avec les régions de surface hydrophobes et capables de résister à l'exposition au sel concentrations supérieures à 2 M munitionssulfate de titane ((NH 4) 2 SO 4). HIC est souvent choisi comme un procédé de purification des protéines qui n'ont pas un marqueur d'affinité, et donc impropres à AC, et quand IEX ne parvient pas à fournir de purification adéquate. Fractions hydrophobes sur la surface de la protéine temporairement se lier à un ligand non polaire couplé à une inerte, matrice immobile. L'interaction entre la protéine et le ligand sont fortement tributaires de la concentration en sel de la mémoire tampon qui coule à travers la colonne de chromatographie, avec de fortes concentrations ioniques renforcement de l'interaction protéine-ligand et de faire la protéine immobile (c.-à-lié à l'intérieur de la colonne) 2. Sous forme de sel concentrations diminution, l'interaction protéine-ligand se dissipe, la protéine est de nouveau mobile et est éluée de la colonne. Plusieurs médias HIC sont disponibles dans le commerce pré-emballés colonnes, chacune contenant plusieurs ligands hydrophobes (par exemple S-butyle, butyle, octyle, et phényl) réticulé à différentes densités de billes d'agarose d'un specdiamètre ific 3. Colonne automatisé dépistage permet une approche efficace pour déterminer quels médias HIC devrait être utilisée pour de futures expériences d'optimisation, les plus exhaustives et purification des protéines fonctionne 4.
La protéine spécifique se purifier ici est une protéine recombinante fluorescente verte (GFP), mais l'approche peut être adaptée pour la purification d'autres protéines avec une ou plusieurs régions de surface hydrophobes. GFP sert une protéine modèle utile, en raison de sa stabilité, unique pic d'absorbance de lumière à 397 nm et la fluorescence lorsqu'ils sont exposés à la lumière UV 5. Lysat bactérien contenant la GFP de type sauvage a été préparé dans un tampon riche en sel, chargé dans un Bio-Rad moyennes DuoFlow système de pression chromatographie en phase liquide, et adsorbés sur des colonnes HiTrap HIC contenant différents médias HIC. La protéine a été élue des colonnes et analysées par en ligne et les méthodes de détection post-terme. Mélange tampon, dynamique boucle d'injection de l'échantillon, col séquentiellelonne de sélection, multi-longueur d'onde d'analyse et de collecte de l'éluat scission fraction augmenté la fonctionnalité du système et la reproductibilité de la démarche expérimentale.
Protocole
1. Tampon et préparation des échantillons
- Note technique: Tous les tampons doivent être réfrigérés et chaque étape de ce protocole doit être effectué sur la glace ou à 4 ° C, sauf indication contraire. Le basse température est essentiel pour empêcher la dégradation de la protéine à purifier et d'assurer des conditions de fonctionnement optimales. Médias HIC peut produire des résultats différents de séparation si elle est exploitée à la température ambiante, et le système de chromatographie doit être utilisé dans un coffret de 4 ° C d'ambiance froide ou froide.
- Préparer 500 ml de les tampons suivants: 200 mM NaH 2 PO 4 (Tampon A1), 200 mM de Na 2 HPO 4, (tampon A2), et 4,8 M (NH 4) 2 SO 4 (B2 tampon). L'eau déminéralisée (B1 Buffer) seront également utilisés. Dégazer la mémoire tampon afin d'assurer des conditions de fonctionnement optimales chromatographiques. Le système de maximisation se mélangent Tampons A1 et A2 pour générer un tampon faible teneur en sel de phosphate d'élution, et il se mélangera B1 et B2 Tamponspour générer le tampon en sel d'ammonium de sulfate de début (2,4 M (NH 4) 2 SO 4).
- Préparer 20 ml d'échantillon à être chargé en mélangeant 10 ml de lysat cellulaire contenant la protéine à purifier avec 10 ml de tampon B2. La concentration d'ammonium de sulfate finale de la solution d'échantillon de lysat cellulaire doit être d'environ 2,4 M (NH 4) 2 SO 4, rendant peu près équivalente à la mémoire tampon de début. Lysat cellulaire peut être préparé par remise en suspension du culot cellulaire bactérienne dans un tampon TE (Tris 10 mM EDTA 1 mM, pH 8,0) suivi par sonication ou par addition de 1 mg / ml de lysozyme et centrifugation à 3700 xg pendant 10 minutes.
- Filtrer le mélange lysat-tampon à travers une faible teneur en protéines se liant 0,45 um seringue filtre pour éliminer les particules de la solution. Maintenir l'échantillon sur la glace jusqu'à ce qu'il soit prêt à être chargé dans le système.
2. Installation physique et de la plomberie de DuoFlow Système de chromatographie
- Assurez-vous tout pouvoir appareil et les raccordements de communication sont faits. Les dispositifs devraient être visibles dans le DuoFlow biologique chromatographie fenêtre du logiciel de commande manuelle. Un résumé des périphériques sont répertoriés dans le tableau 1. Une illustration du système et le schéma de plomberie est à la figure 2.
- Fixez les connexions électriques pour les vannes à des orifices de la pompe et le système Maximizer postes de travail tels que la numérotation du port suit une séquence logique. Étiquetez chaque vanne avec son numéro de port respectif pour référence future. Le poste de travail de la pompe et le système Maximizer servir les liaisons de communication principales entre l'ordinateur / contrôleur et le système de chromatographie. Vannes sera automatiquement reconnu et affiché dans le logiciel lorsqu'il est connecté à chaque périphérique.
- Note technique: Pendant le fonctionnement du système de chromatographie en mode manuel, les soupapes sont commandées indépendamment. Prendre soin pour vérifier que le trajet d'écoulement souhaité est configuré, en particulier lorsque les vannes de commutation, avant d'initier chamoisdébit er.
- Plonger le tube dans Téflon Tampons A1, A2, B1 et B2. Assurez-vous de volumes adéquats de tampon sont disponibles pour le protocole entier et que le tube va continuer de rester en plongée. Préparation de 500 ml de tampons A1, A2 et B2 et 1 L de tampon B1 sera suffisant.
- Plumb échantillon de chargement de soupape et boucle d'échantillonnage dynamique comme l'illustre la figure 2 et selon les instructions du fabricant. Connectez la boucle d'échantillonnage à l'entrée de la vanne de l'échantillon (position 3) en utilisant la plus petite longueur de tube possible. Cela permettrait de minimiser la dilution des échantillons au cours du processus de charge de l'échantillon.
- Réduire la longueur du tube entre l'échantillon, la pompe de chargement des échantillons, et entrée de la vanne échantillon de chargement (Position 2). Cela réduira la quantité d'échantillon nécessaire pour charger la boucle d'échantillonnage.
- Préparez 8 paires de taille identique de 1/16 "tube PEEK OD, avec chaque paire reliés entre eux par un syndicat 1/4-28 femelle female-to-1/4-28. Branchez les paires de positions 1-8 de la deuxième colonne vannes de sélection. l'Union 7est connecté en ligne à des postes de la colonne de sélection de vannes 2-8 sera plus tard remplacé par des colonnes de chromatographie à tester. Le syndicat en ligne liée à la position 1 sera maintenue comme une voie de contournement colonne de chromatographie.
- Note technique: Veiller chaque paire de tube est relié à la même position sur les deux vannes de sélection de colonne.
- Tournez à la fois sur l'UV 4-longueur d'onde / Détecteur de Vis (Quadtec) de la lampe et longueur d'onde fixe 280 nm lampe UV détecteur. Les longueurs d'onde à mesurer par le Quadtec pour ce protocole comprennent 214 nm, 280 nm, et 397 nm. Mesure 280 nm à la fois avec le détecteur UV longueur d'onde fixe et Quadtec fournit une redondance du système et assure la validité des données.
- Confirmez tous les détecteurs sont calibrés conformément aux instructions du fabricant. Le régulateur de contre-pression qui est nécessaire pour réduire l'accumulation de bulles d'air dans les détecteurs et doit être installé en aval des détecteurs mais en amont de l'écran du pH.
- Le système présenté ici comprend deux fractiocollectionneurs n, qui offre une commodité importante pour l'analyse éluat après la course. Fixer les collecteurs de fractions, les flux de séparateur de soupapes, et le contrôleur de séparation, comme illustré dans la figure 2. Le collecteur de fraction relié à la position 1 de la vanne de séparation permettra de recueillir 900 fractions d'éluat ul dans 12 tubes de culture ml, tandis que le collecteur de fraction relié à la position 2 permettra de recueillir 100 fractions d'éluat ul dans 96 plaques de microtitration ainsi.
- Le collecteur de fraction la position 2, clapet de répartition, et le répartiteur de commande sont exploités hors du poste de travail chromatographie. Le contrôleur diviseur est contenu dans une pompe à Bio-Rad Econo dégradé, mais la composante de la pompe de l'appareil n'est pas utilisé. Un "Split%" réglage de l'option sera affichée sur la pompe à gradient Econo lorsque la soupape de diviseur est connecté.
- % Split Set à 10. Le collecteur de fraction Position 1 permettra de recueillir 90% de l'éluat (900 pl / fraction), et le collecteur de fraction Position 2 permettra de recueillir10% (100 pi / fraction). Les collecteurs de fractions avancera en synchronisme permettant numéros fraction de deux collecteurs de correspondre à l'autre.
- Remplacer la tête fraction norme collecteur goutte sur le collecteur de fractions Position 2 avec une tête goutte de microplaques. La tête goutte microplaque a une ouverture plus petite, ce qui permet la collecte des tailles baisse de 50% plus petites (soit 25 pi au lieu de la norme 50 pi) et est particulièrement bénéfique lors de la collecte ≤ 500 fractions ul.
- Utilisation du panneau de commande à l'écran, réglez le collecteur de fraction Position 2 à recueillir des fractions en plaques à 96 puits et avance à une vitesse de 1 échantillon / minute. Le contrôleur de diviseur et collecteur de fractions position 2 est lancée manuellement immédiatement après le début de la course première chromatographie.
- Rincer le collecteur de fractions position 2 et la tête goutte de microplaques avec B1 tampon.
3. Lignes système d'amorçage, méthode Run Programmation et EquilibratIng colonnes HIC
- Avec des lignes d'entrée du système Maximizer immergé dans Tampons dégazés A1, A2, B1, B2, et les premiers du poste de travail pompes, rincer boucle d'échantillonnage, et rincer le système de chromatographie par les instructions du fabricant. Étape d'amorçage complet avec tous les 4 entrées Maximizer System (A1, A2, B1, et B2) afin d'éliminer les bulles d'air restantes.
- Préparer le système nécessite manoeuvre manuelle de la commande de système via le logiciel BioLogic. Confirmer le bon positionnement de la vanne de charge de l'échantillon et vannes de sélection de colonne avant de commencer flux de tampon.
- Préparez-vous à lancer un manuel de 1 ml / minute de débit de tampon d'élution (0% B) à travers le système, tel que décrit dans les étapes 3,4-3,5.
- Dans la fenêtre Installation du logiciel du programme BioLogic, sélectionnez "Utiliser buffer blending» et «un tampon phosphate avec du sulfate d'ammonium". Confirmez Tampons A1, A2, B1, B2 et répertorié dans la fenêtre de configuration correspondent à ceux qui sont prêts.
- Manuellement régler le débit à 1 ml / minute de tampon d'élution(B 0%). Observez la contre-pression, la conductivité, tracés UV, et le pH restent cohérents et dans les limites normales de fonctionnement. Anomalies indiquent l'air ou de blocage colonne qui doit être adressée avant de procéder.
- Rincer toutes les 8 lignes de sélection de colonne avec 5 ml de tampon d'élution. Pour ce faire, d'abord en arrêtant l'écoulement, la mise en deux vannes de sélection de colonne à la position 2, et la reprise du 1 ml / minute de débit, 0% B. Répétez l'opération pour les lignes de sélection de colonnes en positions 3-8.
- Connectez-1 colonnes ml HiTrap HIC à des postes de 2-8 des vannes de sélection de colonne. Effectuer les étapes 3.8-3.13 avec une colonne à la fois. Prenez note de la colonne qui HIC est placé dans laquelle position de la vanne de sélection. Un résumé des médias colonne HIC caractéristiques énumérées dans le Tableau 2.
- La connexion physique des colonnes de GE Healthcare HiTrap au système de Bio-Rad DuoFlow exige une série de raccords en utilisant 1/4-28, M6, et les raccords Luer. Retirer l'union qui relie les 2 postes vannes de sélection de colonne. Unelign le Bio-Rad et GE Healthcare raccords comme illustré à la figure 3.
- Ferrures de fixation de colonne en amont de la DuoFlow. Eviter la formation de bulles d'air dans la colonne de tubage ou par solidarisation des raccords de colonne en amont de la vanne à boisseau de sélection en amont. Exécuter un tampon d'élution à travers les raccords jusqu'à ce que tout l'air est expulsé et une grosse goutte de tampon est présent. Temporairement arrêter l'écoulement du tampon.
- Retirer le bouchon relié à l'entrée de la colonne et placer une goutte de faible teneur en sel tampon (0% de B) sur le sommet de la colonne. Fixer la colonne sur les raccords en amont. Ayant à la fois l'entrée de la colonne et le raccord d'entrée débordant avec des gouttes de tampon assure une connexion sans bulles d'air.
- Si la colonne est utilisée pour la première fois, casser l'extrémité de sortie de la colonne. Fixer la prise sur les raccords et les tubes de colonne en aval vanne de sélection. Vérifiez tous les raccords sont bien fixés.
- Régler la limite de la contre-pression de 40 psi. Laver la colonne wvec 5 volumes de colonne (5 volumes de colonne = 5 ml) de tampon d'élution (0% de B) à un débit de 1 ml / minute. Continuer de lavage colonne, si nécessaire, jusqu'à ce que le pH, les tracés et de contre-pression UV se sont stabilisés.
- Laver la colonne avec 10 volumes de colonne (10 ml) de tampon de départ (100% B) à un débit de 1 ml / minute. Continuer de lavage colonne, si nécessaire, jusqu'à ce que les paramètres du système énumérés à l'étape précédente ainsi que la conductivité se sont stabilisés.
- La colonne HIC préparé ci-dessus est maintenant prêt pour le chargement de l'échantillon. Une fois toutes les colonnes à tester sont préparés, basculer manuellement les vannes de sélection de colonne à la position 1 (l'union) et arrêter l'écoulement du tampon.
4. Le chargement des échantillons
- Tubulure d'entrée Submerge échantillon dans 20 ml d'échantillon pour commencer le processus de chargement de l'échantillon dans la boucle d'échantillonnage dynamique. De la fenêtre de réglage manuel du logiciel BioLogic, passer charge boucle d'échantillonnage / laver la vanne en position 1 (échantillon) et l'échantillon de soupape de chargement à purger.
- Initier des actions dela pompe de chargement d'échantillon boucle, pour déterminer l'échantillon dans le tube de pompe à un débit de 1 ml / minute jusqu'à ce que immédiatement après l'échantillon atteint la soupape de chargement de l'échantillon. Cela supprime un tampon et / ou de l'air à partir de la ligne de charge de l'échantillon.
- Arrêter le débit de la pompe de chargement et placez la vanne de chargement de l'échantillon à partir de purge à charger. Redémarrer la pompe de chargement d'échantillon de boucle à un débit de 1 ml / minute jusqu'à ce que 10 ml de l'échantillon a été aspiré dans la boucle d'échantillonnage dynamique.
- Échantillon suffisant est maintenant chargé dans la boucle d'échantillonnage dynamique pour un maximum de 10 pistes séquentielles colonne HIC scoutisme.
5. Programmation de la méthode logicielle et exécution du Protocole de la colonne Scoutisme
- De la fenêtre de configuration du logiciel BioLogic, sélectionnez les périphériques du système marqués d'un astérisque dans le tableau 1.
- Sélectionnez 6 colonnes HIC pour le dosage. Programme d'un gradient linéaire de sel descendant et 6 colonnes méthode scoute, comme illustré dans le Tableau 3. Le programme est un procédé modification de la configuration du logiciel BioLogic colonne de CIH et a été optimisé pour l'application en cours.
- Une méthode 6-colonne dépistage est recommandé en raison des limitations collecteur de fractions. Tous les 7 colonnes peut être repéré si la méthode du programme est ajusté à collecter des volumes fraction supérieure. Ne pas ajouter de l'étape jusqu'à ce que le scoutisme programme est par ailleurs complète, que la sélection de la fonction reconnaissance empêche édition ultérieure.
- Commencez le long du scoutisme. Manuellement commencer tampon début (100% B) de débit, 1 ml / minute. Appuyez sur start sur le contrôleur de séparateur de commencer éluat 90% -10% flux de fractionnement entre le collecteur 12 ml de la culture fraction tube (position 1) et le collecteur plaque de 96 puits fraction (Position 2), respectivement. Note technique: Rappeler le collecteur plaque de 96 puits fraction est exploité hors ligne à partir du logiciel BioLogic.
- Exécuter la méthode du programme. Immédiatement après le démarrage du programme de la méthode run, appuyez sur Start sur le panneau de contrôle à l'écran de l'déconnecté fractionnement plaque de 96 puitsn collecteur. Si les deux collecteurs de fractions ne sont pas 100% synchrone, avancer manuellement la ligne de 96 puits collecteur de fraction la plaque que les progrès d'autres collecteurs de fractions pour le tube de collecte seconde fraction.
- Observez l'affichage en temps réel pour confirmer les paramètres d'exécution prévus. B contre-pression, la conductivité, et% (figure 4) sont gérés les paramètres qui peuvent être surveillés pour s'assurer de colonne à la colonne reproductibilité des conditions de fonctionnement. Positionnement de la vanne, le pH et le chargement des échantillons doivent également être surveillées. Tracés UV peuvent être comparés pour vérifier le débit-même grâce à des pics d'élution.
- Utiliser en ligne et de post-terme des techniques d'analyse d'éluat pour identifier le profil d'élution et la purification de la protéine d'intérêt («protéine cible" par exemple).
- Pour les échantillons contenant la GFP, d'observer l'élution en ligne à l'aide d'absorbance UV de la protéine unique à 397 nm. Comparer la GFP spécifique 397 nm l'absorbance de traçage à l'absorbance nm générale des protéines 280 traçage pour estimer la séparation par rapportet la purification en utilisant des supports différents HIC étant repéré (figure 5).
- Post-run analyse de la GFP et autres protéines cibles peut être accompli grâce à des méthodes multiples. Des aliquotes de pl 5-50 à partir des fractions de la plaque de 96 puits peuvent être transférés à une nouvelle plaque et analysés pour leur teneur en protéine spécifique par ELISA ou Western Blot, et teneur totale en protéines de chaque fraction peut être analysé en utilisant classique SDS-PAGE ou un système Experion électrophorèse microfluidique. Fluorescence de la GFP peut être détecté dans 12 des tubes de culture ml en utilisant la lumière UV (figure 6).
- Identification de la plupart des porteurs multimédia HIC peut être déterminée par comparaison de la GFP élution par rapport à d'autres protéines contenues dans l'échantillon. Purification avec les médias les plus prometteurs de HIC peut alors être optimisée en fonction d'autres paramètres, y compris le type et la concentration du tampon de début et de pH.
- Note technique: À l'issue de l'expérience, placer toutes les lignes d'entrée dans B1 Buffer (dégazéH 2 O) et rincer à fond les pompes, vannes, tubes et tous avec de l'eau. Suivez les instructions du fabricant pour le nettoyage et stockage à long terme du système de chromatographie et de colonnes de HIC.
6. Résultats représentatifs:
Gradient représentant le sel HIC, la conductivité, et la pression de la colonne des pistes scoutisme sont présentés dans la figure 4. Le changement de la concentration en sel (ligne bleue), telle que mesurée par le pourcentage de tampon établie à partir de lignes tampons haute teneur en sel est typique de la méthodologie HIC. Que la concentration en sel diminue, protéines liés à l'éluer la colonne. De conductivité (ligne rouge), qui correspond à la concentration observée du sel, est mesurée en ligne immédiatement après les détecteurs Quadtec et UV. Le décalage entre gradient de sel et les tracés de conductivité indique le temps nécessaire pour le tampon se déplacer à partir de la mémoire tampon d'entrée, par l'intermédiaire du système, et au moniteur de conductivité. Tout au long de la série d'analyses, tla pression du système, il (lignes grises) et le pH restent relativement constants.
La figure 5 montre les chromatogrammes de pistes séquentielles colonne HIC scoutisme. La détection en ligne des protéines totales (A 280, ligne bleue) et la GFP (A 397, ligne verte) est accompli en mesurant l'absorbance de la lumière à 280 nm et 397 nm, respectivement. Il est possible d'approcher l'abondance relative de la GFP et de la séparation pour chaque course le scoutisme en comparant les deux lignes. GFP liée aux colonnes testées HIC avec différents degrés d'affinité et de son profil d'élution varie. Sélection d'une colonne préféré HIC pour les purifications futurs repose sur l'identification de la colonne qui produit le pic d'élution plus forte GFP et le plus grand séparation d'avec d'autres protéines.
Dans la figure 6, des tubes de culture pour les fractions 10, 12, 14, 16 et 18 de la FF Phenyl (haute sub) scoutisme terme ont été visualisés sous ambiante (fluorescente) léger et ultraviolet (UV). Les tubes ont été consultés deux face-avant (à gauche) et top-down (panneaux de droite) afin d'observer le spectre caractéristique d'émission GFP. GFP (green) est clairement détecté dans la fraction 14 dans les deux images UV. Ces données post-terme correspondent bien avec la détection en ligne de la GFP en mesurant l'absorbance éluat à 397 nm (A 397, ligne verte), qui identifie également Fraction 14 comme contenant le pic principal de la GFP élue. Le bleu diffuse dans le panneau UV gauche est la lumière émise par la lampe UV.
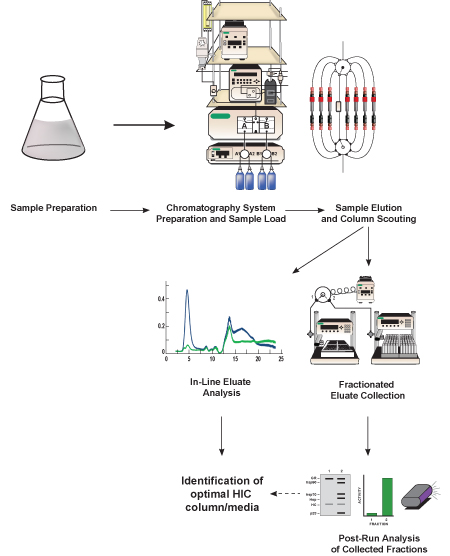
Figure 1. Représentation schématique de ce protocole. Lysat bactérien contenant des protéines d'intérêt (GFP, protéine cible) est préparé, on le dilue dans un tampon équivalent en sel dans le tampon de départ chromatographie, et filtré. Une fois que le système de chromatographie liquide est préparé, l'échantillon est chargé et la protéine cible est séparée des autres protéines contenues in le lysat avec un milieu de chromatographie hydrophobe contenue dans une colonne de pré-emballé HIC. La méthode de séparation est répété plusieurs fois en utilisant les médias de chromatographie différents (dénommée colonne dépistage) afin de déterminer quels médias prévoit la séparation meilleure GFP. Les protéines éluées (éluat) est analysé en ligne en utilisant des détecteurs inclus dans le système de chromatographie et l'on recueille en plus petites fractions pour subséquente (après la course) analyse. Basé sur l'analyse en ligne et après la course de l'activité GFP et de la séparation, une colonne optimale HIC et moyennes chromatographique sont identifiés.
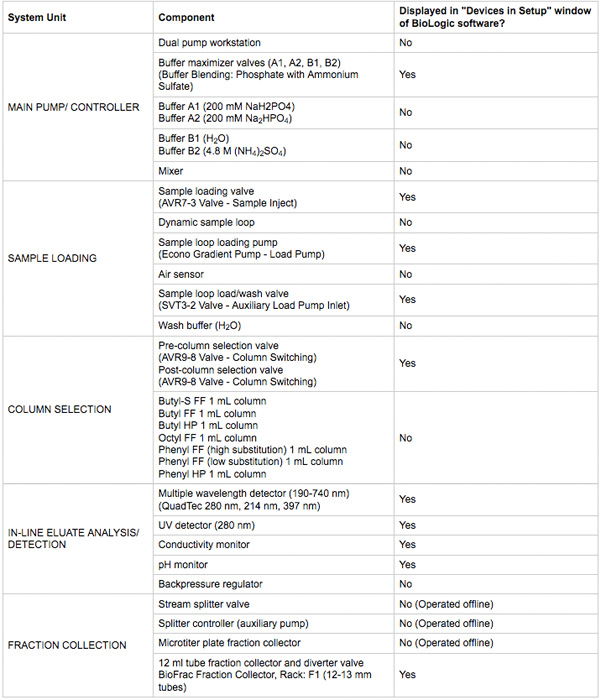
Tableau 1. Les éléments clés du système de chromatographie utilisées dans le présent protocole.
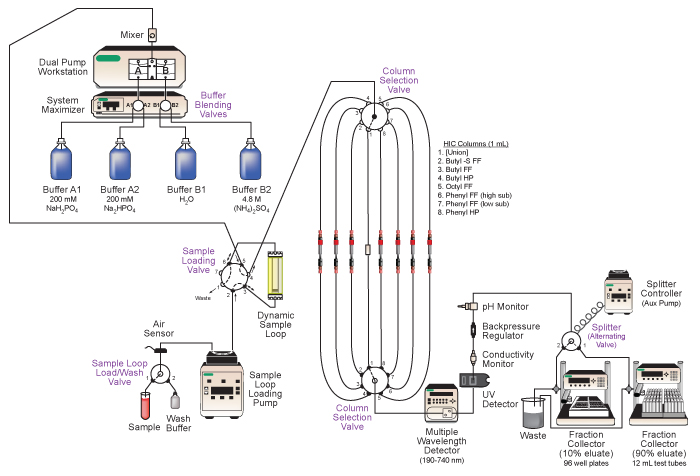
Figure 2. Schéma de Bio-Rad DuoFlow moyenne pression système de chromatographie liquide employé. Principales caractéristiques de la sydécoulent comprennent buffer blending automatisé, le chargement de l'échantillon pour les courses de colonnes séquentielles, la sélection automatique des colonnes de chromatographie différentes, une analyse en ligne de l'éluat, et la collecte en tandem de l'éluat fractionnée. Voir le texte et le tableau 1 pour plus de détails.
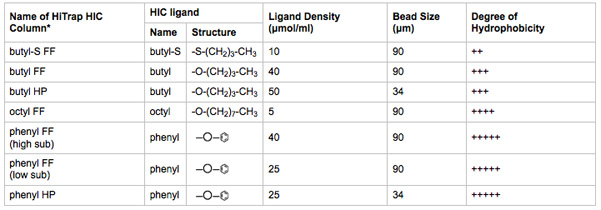
Tableau 2 Caractéristiques. Biophysiques des médias HIC testé. Le nom de la colonne de CIH HiTrap est indicatif du ligand, la densité de ligand, et la taille du cordon.
* FF = débit rapide; HP = haute performance. Agrandir la taille du cordon augmente la capacité de liaison du ligand et le débit. Diminuer la taille du talon augmente la résolution chromatographique. L'information tirée de documents fournis par le fabricant.

Figure 3. Connexion de la colonne de GE Healthcare HiTrap HIC à Bio-Rad DuoFlow system.To l'écrou 1/4-28 Delrin amont unee virole (A1), un mâle Luer-à-raccord femelle 1/4-28 (B1) et mâle 1/16 "à raccord Luer femelle (C) sont connectés. Les raccords sont attacher à la colonne HiTrap après avoir été rincée avec un tampon et ayant toutes les bulles retiré. La sortie de la colonne est reliée à une femme 1/16 "à l'homme M6 de montage (D), Luer mâle-femelle pour raccord M6 (E), et Luer femelle-femelle 1 à / 4-28 raccord (B 2). Cette ensemble est relié à l'écrou Delrin 1/4-28 aval et virole (A 2). Le panneau supérieur montre les raccords séparés et le panneau inférieur montre les raccords assemblés.
| Étape # | Volume (ml) | Description | Paramètres | |
| 1 | 0,00 | Recueillir 1.0 mL fractions lors de l'exécution entière | ||
| 2 | 0,00 | La SuisseColonnes ch | Colonne HIC une (Position 2) | |
| 3 | 0,00 | Débit isocratique | pH: 6,80 100% de B | Volume: 2,00 mL Débit: 1,00 ml / min |
| 4 | 2,00 | Zéro de référence | Quadtec | |
| 5 | 2,00 | Zéro de référence | Détecteur de rayons UV | |
| 6 | 2,00 | Injecter l'échantillon | Chargement d'échantillon Boucle dynamique | Auto Injecter Valve Volume: 0,50 ml Débit: 1,00 ml / min |
| 7 | 3,00 | Débit isocratique | pH: 6,80 100% de B | Volume: 5,00 ml Débit: 1,00 ml / min |
| 8 | 8,00 | Dégradé linéaire | pH: 6,80 100% de B -> B 0% | Volume: 10,00 mL Débit: 1,00 ml/ Min |
| 9 | 18,00 | Débit isocratique | pH: 6,80 B 0% | Volume: 3,00 ml Débit: 1,00 ml / min |
| 10 | 21,00 | Débit isocratique | pH: 6,80 100% de B | Volume: 5,00 ml Débit: 1,00 ml / min |
| 11 | 26,00 | Colonnes de commutation | Union (Position 1) | |
| Fin | 26,00 | Fin du Protocole | Répète automatiquement avec 5 colonnes supplémentaires HIC (Positions 3-7) | |
| Scout de type | Nombre de pistes: 6 | Nombre d'étapes Repéré: 1 | ||
Tableau 3. Le logiciel de protocole pour BioLogic méthode scoute HIC employés.

Figure 4. Représentant gradient de sel HIC, la conductivité, et la pression de la colonne. Comme la concentration en sel (ligne bleue) diminue, la conductivité (ligne rouge) fait aussi bien. Le hors-jeu entre le gradient de sel et de tracés de conductivité indique le temps nécessaire pour le tampon de voyager de l'entrée du tampon à l'écran de conductivité. La pression du système (lignes grises) reste relativement constant pendant toute la durée de la course du scoutisme.
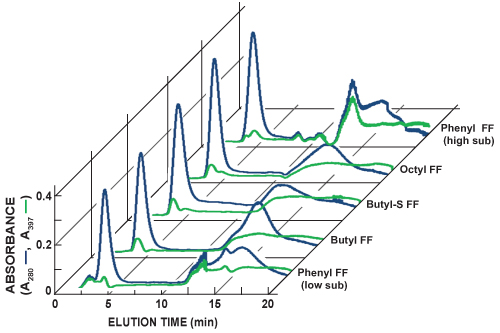
Figure 5. Chromatogrammes compilés de colonne HiTrap HIC séquentielle dépistage pistes. La détection en ligne des protéines totales (A 280, ligne bleue) et la GFP (A 397, ligne verte) est accompli en mesurant l'absorbance de la lumière à 280 nm et 397 nm, respectivement. Dans cette série d'expériences, le pic de plus forte GFP a été observée avec élution de la FF Phenyl (haute sub) column. Le Phenyl FF (haute sous) la colonne est également apparu à fournir la plus grande séparation entre la GFP et d'autres protéines. Additionnelles 1 colonnes HiTrap ml HIC testé inclus substitution phényle écoulement rapide à faible (Phényl FF (faible sous)), butyle écoulement rapide (FF butyle),-S butyle écoulement rapide (S-butyle FF), et octyle écoulement rapide (FF octyle) .
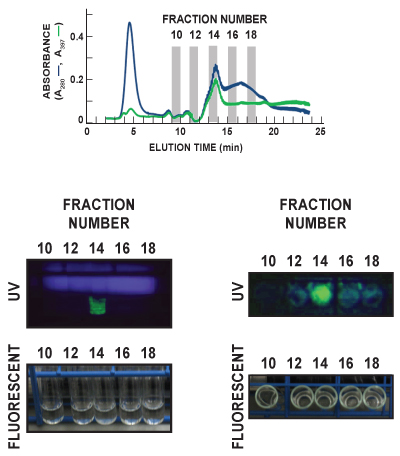
Figure 6. Représentant après la course de visualisation de la GFP dans l'éluat de l'échantillon. Fractions d'éluat ont été prélevés à un taux de 1/minute, et chacun a été analysé pour sa teneur GFP. Dans ce chiffre représentatif, tubes de culture pour les fractions 10, 12, 14, 16 et 18 de la FF Phenyl (haute sub) scoutisme terme ont été visualisés sous ambiante (fluorescente) et la lumière ultraviolette (UV). Les tubes ont été consultés deux face-avant (à gauche) et top-down (panneaux de droite). Le bleu diffuse dans le panneau UV gauche est la lumière émise par la lampe UV. GFP (green) est clairement détecté dans Fraction 14 dans les deux images UV. Le panneau supérieur indique la protéine totale (A280, ligne bleue) et la GFP (A 397, ligne verte) tracés chromatogramme des fractions de 5 étant visualisés.
Discussion
Les techniques de chromatographie liquide se sont avérés inestimables pour la préparation de protéines hautement purifiées nécessaires à la conduite 6 immunologiques, biochimiques 7, 8 et structurelles des études. Méthodes de purification HIC nécessitent le plus souvent la détermination empirique d'un milieu privilégié, et la structure du ligand, la densité de ligand, et de la matrice des propriétés de perles ont toutes été montré à influer sur les résultats chromatographiques 2, 3. Colonne automatisé le scoutisme est une approche efficace pour la sélection d'un support pour l'optimisation ultérieure HIC et 4 de purification des protéines. La méthode de la colonne automatisé dépistage présenté peut être facilement adaptée à différents HIC stratégies de purification des protéines. Les modifications de la concentration en sel, le choix du sel, gradient de sel, et le pH peut en outre améliorer les conditions de purification, et les effets de la variation de ces paramètres essentiels ont déjà été examinés 13,14. Éluat contenant une HIC prote cible partiellement purifiéen peut encore être purifié en utilisant une technique de chromatographie en phase complémentaire, tels que chromatographie échangeuse d'ions (IEX) ou filtration sur gel / chromatographie d'exclusion de taille 9,10.
En raison de son absorption de la lumière unique et des caractéristiques d'émission, le profil d'élution de la GFP peut être identifié à l'aide en ligne et de post-terme des approches. À cette fin, ce protocole peut en outre être adaptée pour la purification de recombinants GFP-protéines de fusion, dans laquelle une protéine cible est sans rapport avec "tag" avec la GFP. Protéines cibles GFP-étiquette peut être détectée avec une lumière UV et 11 purifiée en utilisant diverses méthodes chromatographiques, y compris la stratégie de purification HIC décrit ci-dessus. Purification GFP est également devenu un aliment de base dans les laboratoires de biochimie pédagogique pour l'enseignement des techniques modernes de la science des protéines 12.
Alors que de base de purification des protéines HIC peut être effectuée en utilisant une chromatographie sensiblement moins robuste sytige, l'instrumentation présentée ici possède un certain nombre d'avantages distincts pour aider à l'obtention de résultats favorables. Avantages notables de l'utilisation d'un système hautement automatisé comprennent l'amélioration de fonctionner à fonctionner condition de reproductibilité, de gain de temps, et une diminution des possibilités de l'air d'être introduites dans le système 10. Buffer blending système contrôlé, qui est facilitée par le système Maximizer, permet une plus grande cohérence dans la préparation du tampon et de la reproductibilité expérimentale. Dessin de charge d'échantillon suffisante dans la boucle d'échantillonnage dynamique pour tous dépistage exécute en outre assure l'uniformité de l'échantillon étant ajouté à chaque colonne et permet pistes séquentielles sans interruption ou manuel de rechargement. Injection de l'échantillon contrôlé à partir de la boucle d'échantillonnage sur la colonne diminue la variabilité qui peut se produire avec un chargement manuelle de l'échantillon. Une paire de soupapes de sélection de colonne pour permettre pistes consécutives, chacune échantillon en utilisant une colonne différente HIC, sans avoir à replumb le système. Exécution mul ti-longueur d'onde d'analyse est particulièrement bénéfique lors du dosage d'une protéine avec un profil unique spectrophotométrique. En plus de la GFP, les cytochromes, flavoprotéines et autres hème contenant des protéines peuvent bénéficier de cette technique. Dispositifs de surveillance de la conductivité et le pH permettent de vérifier en temps réel des conditions expérimentales. Collecte de l'éluat de Split fraction permet une manipulation fraction améliorée et permet le transfert facile pour les méthodes d'analyse post-terme qui nécessitent un volume d'échantillon minime (par exemple ELISA, SDS-PAGE, western blot, et Experion microfluidique électrophorèse). Pendant le fonctionnement de la seconde fraction déconnecté collecteur nécessite une synchronisation manuelle, il permet une flexibilité maximale dans le choix collecteur de fractions. Les inconvénients les plus importants à l'utilisation d'un tel système de chromatographie robuste pour la colonne HIC le scoutisme et la purification des protéines incluent le temps initial et les dépenses budgétaires liées à l'acquisition instrument et la formation des opérateurs.
t "> Le protocole présenté ici utilise un Bio-Rad DuoFlow chromatographie système;. Cependant, l'instrumentation aussi robuste d'autres fabricants, tels que l'Avant ÄKTA de GE Healthcare, peuvent également être utilisés et sont capables de produire des résultats équivalents système de chromatographie Même comparables ont des caractéristiques uniques de programmation (par exemple, la méthode, les limites nomenclature des composants, préférences de l'opérateur, et l'évolutivité) qui devraient être considérés avant d'entamer une procédure de purification ou de l'acquisition instrument.Déclarations de divulgation
Sélectionnez réactifs de chromatographie et de l'instrumentation supplémentaire ont été offerts par Bio-Rad.
Remerciements
Ce travail a été financé par les Instituts nationaux de la santé et de subvention GM086822 National Science Foundation majeure des instruments de recherche de subvention DBI-0960313. Les auteurs tiennent à remercier les Drs. Jon Miyake & Donna Hardy (Bio-Rad) et Jennifer Loertscher (Seattle University) pour leur expertise technique. Sélectionnez réactifs de chromatographie et de l'instrumentation supplémentaire a été généreusement fourni par la société Bio-Rad.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| DuoFlow BioLogic Pathfinder 20 Système | Bio-Rad | 7602257 | Comprend un système de Maximizer, mélangeur, poste de travail F10, AVR7-3 de soupape, UV Quadtec / détecteur de Vis avec cellule d'écoulement, collecteur de fractions BIOFRAC, logiciels BioLogic, et kit de démarrage |
| AVR9-8-flux Sélectionnez la vanne | Bio-Rad | 7600408 | Haut-pression à la valve, 9-port, en position 8, 3500 psi (233 bars) limite, pour une utilisation avec un système DuoFlow BioLogic |
| Vanne de dérivation SV3T-2 | Bio-Rad | 7600410 | Electrovanne, 3-port, en position 2, 30 psi (2 bars) limite, pour une utilisation avec un système DuoFlow BioLogic |
| Volet clapet de répartition | Bio-Rad | ||
| tique = LSR & parentCategoryGUID = 22c495f1-36ff-44a3-9140-ee7e54d0b1ba "target =" _blank "> DynaLoop 25 Kit | Bio-Rad | 7500451 | Glisse-piston kit boucle d'échantillonnage, comprend 25 ml DynaLoop coulissant boucle piston, kit de pièces DynaLoop (# 750-0450) |
| Collecteur de fraction BIOFRAC | Bio-Rad | 7410002 | Deux col fraction lecteurs utilisés |
| BIOFRAC microplaque adaptateur de tête goutte | Bio-Rad | 7410088 | |
| Adaptateur BIOFRAC plaque de microtitration | Bio-Rad | & Country = Etats-Unis & lang = fr & ProductID = 741-0017 "target =" _blank "> 7410017 | |
| Optique UV Module | Bio-Rad | 7500202 | |
| Lampe halogène | Bio-Rad | < un target = "_blank"> 7601331 | |
| Econo dégradé la pompe | Bio-Rad | 7319001 | une pompe à gradient pour la purification de protéines à basse pression, et un kit de tube comprend raccords |
| Experion système | Bio-Rad | bio-rad.com/prd/en/US/adirect/biorad? cmd = BRCatgProductDetail & ProductID = 224301 "target =" _blank "> 7007001 | |
| Kit Experion Analyse Pro260 | Bio-Rad | 7007102 | |
| HiTrap kit HIC sélection de la colonne | GE Healthcare | 28-4110-07 | Comprend 7 x 1 ml pré-emballés colonnes des médias HIC pour le scoutisme |
| Raccords de GE Healthcare colonne à Bio-Rad | GE Healthcare | 18111251 18111257 et |
Références
- Cummins, P. M., O'Connor, B. F. Hydrophobic interaction chromatography. Methods Mol. Biol. 681, 431-437 (2011).
- Nagrath, D., Xia, F., Cramer, S. M. Characterization and modeling of nonlinear hydrophobic interaction chromatographic systems. J. Chromatogr. A. 1218, 1219-1226 (2011).
- To, B. C., Lenhoff, A. M. Hydrophobic interaction chromatography of proteins. IV. Protein adsorption capacity and transport in preparative mode. J. Chromatogr. A. 1218, 427-440 (2011).
- Huddleston, J. G., Wang, R., Lyddiatt, A. On the use of mild hydrophobic interaction chromatography for "method scouting" protein purification strategies in aqueous two-phase systems: a study using model proteins. Biotechnol Bioeng. 44, 626-635 (1994).
- Arun, K. H., Kaul, C. L., Ramarao, P. Green fluorescent proteins in receptor research: an emerging tool for drug discovery. J. Pharmacol. Toxicol. Methods. 51, 1-23 (2005).
- Terrizzi, S. C., Banh, C., Brossay, L.A Protocol for the Production of KLRG1 Tetramer. J. Vis. Exp. (35), e1701-e1701 (2010).
- Murphy, P. J. M., Morishima, Y., Kovacs, J. J., Yao, T. P., Pratt, W. B. Regulation of the dynamics of hsp90 action on the glucocorticoid receptor by acetylation/deacetylation of the chaperone. J. Biol. Chem. 280, 33792-33799 (2005).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 Magnetosome Associated Protein MamAΔ41. J. Vis. Exp. (37), 10-3791 (2010).
- Kong, Y., Li, X., Bai, G., Ma, G., Su, Z. An automatic system for multidimensional integrated protein chromatography. J. Chromatogr. A. 1217, 6898-6904 (2010).
- Camper, D. V., Viola, R. E. Fully automated protein purification. Anal. Biochem. 393, 176-181 (2009).
- Hammon, J., Palanivelu, D. V., Chen, J., Patel, C., Minor, D. L. A green fluorescent protein screen for identification of well-expressed membrane proteins from a cohort of extremophilic organisms. Protein Sci. 18, 121-133 (2009).
- Wu, Y. Using green and red fluorescent proteins to teach protein expression, purification, and crystallization. Biochem. Mol. Biol. Educ. 36, 43-54 (2008).
- Queiroz, J. A., Tomaz, C. T., Cabral, J. M. Hydrophobic interaction chromatography of proteins. J. Biotechnol. 87, 143-159 (2001).
- McCue, J. T. Theory and use of hydrophobic interaction chromatography in protein purification applications. Methods Enzymol. 463, 405-414 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon