Method Article
Automated interazione idrofobica colonna di selezione cromatografia per l'utilizzo in purificazione di proteine
In questo articolo
Riepilogo
Un metodo automatizzato per identificare adatti cromatografia interazione idrofoba (HIC) mezzi da utilizzare nel processo di purificazione di proteine viene presentato. Il metodo utilizza un sistema di media pressione cromatografia liquida compreso il miscuglio tampone automatizzata, dinamico ciclo di iniezione del campione, selezione di colonna sequenziale, multi-lunghezza d'onda di analisi, e la frazione raccolta divisione eluato.
Abstract
A differenza di altri metodi cromatografici per proteine purificante (gel ad esempio filtrazione, affinità, e scambio ionico), cromatografia di interazione idrofoba (HIC) richiede comunemente determinazione sperimentale (denominato screening o "scouting") per selezionare il mezzo più adatto cromatografica per purificare una proteina dato 1. Il metodo qui presentato descrive un metodo automatizzato per scouting per un supporto ottimale HIC da utilizzare nella purificazione di proteine.
HIC separa proteine e di altre biomolecole da un lisato grezzo sulla base delle differenze di idrofobicità. Simile a cromatografia di affinità (AC) e cromatografia a scambio ionico (IEX), HIC è in grado di concentrare la proteina di interesse mentre avanza attraverso il processo cromatografico. Le proteine più adatti per la purificazione da HIC sono quelli con le regioni superficie idrofoba e in grado di sopportare l'esposizione a concentrazioni di sale in eccesso di 2 munizioni Mnio solfato ((NH 4) 2 SO 4). HIC è spesso scelta come metodo di purificazione di proteine prive di una etichetta di affinità, e quindi inadatto per AC, e quando IEX non fornisce adeguata purificazione. Frazioni idrofobe sulla superficie della proteina temporaneamente legarsi ad un ligando non polare accoppiata ad un inerte, matrice immobile. L'interazione tra proteina e legante sono altamente dipendenti dalla concentrazione salina del buffer che fluisce attraverso la colonna cromatografica, con alte concentrazioni ioniche rafforzamento della proteina-ligando e rendendo la proteina immobile (cioè vincolato all'interno della colonna) 2. Come diminuzione delle concentrazioni di sale, la proteina-ligando dissipa, la proteina diventa nuovamente mobile e eluisce dalla colonna. Vari mezzi di HIC sono commercialmente disponibili in preconfezionati colonne, ciascuna contenente uno dei diversi ligandi idrofobi (ad esempio S-butile, butile, ottile, e fenil) reticolato a varie densità di perline di agarosio di una specificadiametro ific 3. Colonna di scouting automatizzato consente di adottare un approccio efficiente per determinare quali media HIC dovrebbe essere impiegato per i futuri, gli esperimenti di ottimizzazione più esaurienti e purificazione della proteina funziona 4.
La proteina viene purificata specifico ecco ricombinante proteina verde fluorescente (GFP), tuttavia, il metodo può essere adattato per purificare altre proteine con una o più regioni superficie idrofoba. GFP serve come una proteina modello utile, grazie alla sua stabilità, unico picco di assorbanza della luce a 397 nm, e la fluorescenza quando esposti a luce UV 5. Lisato batterico contenente GFP di tipo selvatico è stato preparato in un tampone ad alto sale, caricata in un Bio-Rad sistema mezzo cromatografia DuoFlow pressione del liquido, e adsorbiti colonne HiTrap HIC contenenti diversi supporti HIC. La proteina è stata eluita dalle colonne e analizzato in linea-e post-run metodi di rilevamento. Buffer blending, dinamica campione ansa di iniezione, col sequenzialeselezione UMN, multi-lunghezza d'onda di analisi, e la frazione raccolta divisione eluato aumentato la funzionalità del sistema e la riproducibilità del metodo sperimentale.
Protocollo
1. Buffer e Preparazione del campione
- Nota tecnica: Tutti i tamponi devono essere refrigerati e ogni passo di questo protocollo dovrebbe essere eseguita su ghiaccio o a 4 ° C, salvo diversa indicazione. La bassa temperatura è essenziale per impedire la degradazione della proteina da purificare e per garantire le condizioni operative ottimali. Mezzi di HIC può produrre risultati diversi di separazione se impiegati a temperatura ambiente, e il sistema di cromatografia deve essere utilizzato in una camera cassetta di 4 ° C a freddo o freddo.
- Preparare 500 ml dei seguenti buffer: 200 mM NaH 2 PO 4 (Buffer A1), 200 mM Na 2 HPO 4, (Buffer A2), e 4,8 M (NH 4) 2 SO 4 (B2 Buffer). Acqua deionizzata (B1 Buffer) verrà utilizzato anche. Degas il buffer di garantire ottimali condizioni operative cromatografiche. Maximizer Il sistema si fondono Buffers A1 e A2 per generare un basso contenuto di sale tampone di eluizione di fosfato, e si fondono buffer B1 e B2per generare l'alta sale di solfato di ammonio tampone di partenza (2,4 M (NH 4) 2 SO 4).
- Preparare 20 ml di campione da caricare miscelando 10 ml di lisato cellulare contenente la proteina da depurare con 10 ml di tampone B2. La concentrazione finale di solfato di ammonio nella soluzione del campione di lisato cellulare dovrebbe essere di circa 2,4 M (NH 4) 2 SO 4, rendendo equivalente al buffer di partenza. Lisato cellulare può essere preparato risospendendo il pellet cellulare batterica in tampone TE (10 mM Tris 1 mM EDTA, pH 8,0) seguita mediante sonicazione o l'aggiunta di 1 mg / ml lisozima e centrifugazione a 3.700 xg per 10 minuti.
- Filtrare il lisato-buffer di miscela attraverso un basso legame di proteina siringa 0,45 um filtro per rimuovere le particelle dalla soluzione. Conservare il campione su ghiaccio fino a quando è pronto per essere caricato nel sistema.
2. Configurazione fisica e idraulica del sistema DuoFlow Cromatografia
- Assicurarsi che l'alimentazione del dispositivo e collegamenti di comunicazione sono fatti. I dispositivi devono essere visibili nella finestra DuoFlow Biologic cromatografia software di controllo manuale. Una sintesi di dispositivi sono elencati nella Tabella 1. Un esempio del sistema e schema idraulico è in Figura 2.
- Fissare i collegamenti elettrici per le valvole alle porte della pompa workstation e sistema di Maximizer tali che porta la numerazione segue una sequenza logica. Etichettare ogni valvola con il suo numero di porta corrispondente per riferimento futuro. La workstation pompa e maximizer sistema, servono i principali collegamenti di comunicazione tra il computer / controller e sistema di cromatografia. Le valvole sarà riconosciuto automaticamente e visualizzato nel software quando è collegato ad entrambi i dispositivi.
- Nota tecnica: Durante il funzionamento del sistema di cromatografia in modalità manuale, le valvole sono controllate in modo indipendente. Fare attenzione per verificare che il percorso di flusso desiderato è configurato, in particolare quando valvole di commutazione, prima di iniziare lucidareer flusso.
- Immergere tubo in Teflon Buffers A1, A2, B1 e B2. Garantire adeguati volumi di tampone sono disponibili per intero protocollo e che il tubo continueranno a rimanere sommerso. Preparare 500 ml di buffer A1, A2 e B2 e B1 1 L di Buffer sarà adeguata.
- Plumb campione caricamento valvola e anello campione dinamico come illustrato in figura 2 e istruzioni del produttore. Collegare il ciclo campione della valvola del campione (posizione 3) utilizzando il minor lunghezza del tubo possibile. Questo ridurrà la diluizione del campione durante il processo di caricamento del campione.
- Ridurre al minimo la lunghezza del tubo tra il campione, pompa di caricamento del campione, e il caricamento della valvola di aspirazione del campione (posizione 2). Ciò farà diminuire la quantità di campione necessaria per caricare il ciclo campione.
- Preparare 8 coppie di uguale dimensione di 1/16 "di tubo in PEEK OD, con ogni coppia unite da un sindacato 1/4-28 female-to-1/4-28 femminile. Collegare le coppie per 1-8 posizioni della colonna due Le valvole di selezione. La 7 sindacalis collegato in linea di posizioni di selezione di colonna valvole 2-8 sarà in seguito sostituito dalle colonne cromatografiche da testare. L'unione in linea collegata con la posizione 1 sarà mantenuto come un by-pass cromatografia su colonna.
- Nota tecnica: Assicurare ciascuna coppia di tubi è collegato alla stessa posizione su entrambe le valvole di selezione di colonna.
- Accendere sia il 4 lunghezze d'onda UV / Vis Detector (QuadTec) lampada e fissa lunghezza d'onda 280 nm della lampada UV Detector. Le lunghezze d'onda da misurare dal QuadTec di questo protocollo sono 214 nm, 280 nm e 397 nm. Misura 280 nm sia con la lunghezza d'onda fissa Detector UV e QuadTec fornisce ridondanza del sistema e garantisce la validità dei dati.
- Confermare tutti i rilevatori sono tarati secondo le istruzioni del produttore. Il regolatore di contropressione è necessario per ridurre l'accumulo di bolle d'aria in rivelatori e deve essere installato a valle dei rivelatori, ma a monte del monitor pH.
- Il sistema presentato comprende due fraction collezionisti, che fornisce la convenienza sostanziale per la post-conduzione di analisi dell'eluato. Fissare i collezionisti frazione, flusso valvola splitter e controller splitter come illustrato nella figura 2. Il raccoglitore di frazioni collegato alla posizione 1 della valvola splitter raccogliere frazioni di eluato 900 pl in provette 12 ml di coltura, mentre la frazione collettore collegato alla posizione 2 raccoglierà 100 frazioni di eluato pl a 96 piastre di microtitolazione pure.
- Il 2 collettore di frazioni di posizione, la valvola splitter, splitter e di controllo sono gestiti in linea della workstation cromatografia. Il controllore splitter è contenuta all'interno di un Bio-Rad pompa Econo gradiente, tuttavia, il componente pompa del dispositivo non viene utilizzato. A "Split%" opzione impostazione verrà visualizzata sul Pump Gradiente Econo quando la valvola splitter è collegato ad esso.
- Set Split% a 10. La frazione 1 collettore posizione raccoglierà 90% del eluato (900 pl / frazione), e il 2 raccoglitore di frazioni posizione raccoglierà10% (100 pl / frazione). I collettori frazione avanzeranno in sincronia permettendo numeri frazione di due collettori di corrispondono l'uno all'altro.
- Sostituire lo standard collettore testa frazione goccia sul collettore Posizione 2 frazione con una testa goccia micropiastra. La testa goccia micropiastra ha un'apertura più piccola, che permette la raccolta di dimensioni delle gocce più piccole del 50% (cioè 25 pl, invece dello standard 50 ml) ed è particolarmente utile quando la raccolta di frazioni ≤ 500 pl.
- Utilizzando il pannello di controllo sullo schermo, impostare il 2 collettore di frazioni grado di raccogliere le frazioni in piastre da 96 pozzetti e passare ad una velocità di 1 campione / minuto. Il controllore splitter e Posizione 2 raccoglitore di frazioni verrà avviata manualmente subito dopo l'inizio della corsa cromatografia prima.
- 2 Lavare il raccoglitore di frazioni di posizione e cadere la testa micropiastra con il Tampone B1.
3. Linee adescamento sistema, metodo eseguire la programmazione, e Equilibratzione HIC Colonne
- Con il sistema di tubature di ingresso Maximizer sommerso in Buffers degasate A1, A2, B1 e B2, primi della workstation pompe, lavare ciclo del campione, e lavare il sistema di cromatografia per le istruzioni del produttore. Priming Completare il passaggio con le prese d'aria Maximizer 4 di sistema (A1, A2, B1 e B2) al fine di eliminare le bolle d'aria rimanenti.
- Preparazione del sistema richiede funzionamento manuale del controller di sistema tramite il software BioLogic. Conferma corretto posizionamento della valvola campione carico e valvole di selezione di colonna prima di iniziare il flusso tampone.
- Preparare per avviare un manuale 1 ml / minuto di flusso tampone di eluizione (0% B) attraverso il sistema, come descritto nei passi 3.4-3.5.
- Nella finestra di installazione del software BioLogic programma, selezionare "Utilizza Blending Buffer" e "tampone fosfato con solfato di ammonio". Conferma Buffers A1, A2, B1 e B2 elencate nella finestra di configurazione corrispondano a quelli preparati.
- Impostare manualmente la velocità di flusso di 1 ml / minuto di tampone di eluizione(0% B). Osservare contropressione, conducibilità, tracciati UV, e il pH restare coerente ed entro i limiti di normale funzionamento. Anomalie indicano l'aria o il blocco della colonna che dovrebbe essere affrontato prima di procedere.
- Lavare tutte le 8 linee di selezione delle colonne con 5 ml di tampone di eluizione. A tale scopo, prima fermare il flusso, impostando entrambe le valvole di selezione di colonna alla posizione 2, e riprendendo il 1 ml / minuto di flusso, 0% B. Ripetere l'operazione per le linee di selezione delle colonne in posizioni 3-8.
- Collegare 1 ml colonne HIC HITRAP alle posizioni 2-8 di valvole di selezione delle colonne. Completare i passaggi 3.8-3.13 con una colonna alla volta. Prendete nota delle quali è collocato colonna HIC in cui la valvola posizione di selezione. Una sintesi delle caratteristiche multimediali della colonna HIC è elencato nella tabella 2.
- La connessione fisica di GE Healthcare colonne HITRAP al Bio-Rad DuoFlow sistema richiede una serie di accessori che utilizzano 1/4-28, M6 e raccordi Luer. Rimuovere il raccordo che collega le 2 valvole di posizione di selezione delle colonne. ALIGN il Bio-Rad e GE Healthcare raccordi come illustrato in figura 3.
- Fissare raccordi colonna a monte al DuoFlow. Evitare di inglobare bolle d'aria nella colonna o tubo con fermezza il fissaggio dei raccordi delle colonne a monte del raccordo a monte della valvola di selezione. Eseguire tampone di eluizione attraverso i raccordi fino a quando tutta l'aria viene espulsa e una grossa goccia di tampone è presente. Temporaneamente interrompere il flusso del buffer.
- Rimuovere il tappo collegata all'ingresso colonna e una goccia grande di basso contenuto di sale tampone (0% B) sulla parte superiore della colonna. Fissare la colonna per i raccordi a monte. Avendo sia in entrata colonna e raccordo di ingresso traboccante gocce di tampone assicura un collegamento privo di bolle d'aria.
- Se la colonna viene utilizzata per la prima volta, agganciare l'estremità di uscita colonna. Fissare la presa per i raccordi colonna a valle e valvola di tubi di selezione. Verificare che tutti i raccordi siano correttamente serrate.
- Impostare il limite di contropressione a 40 psi. Lavare la colonna with 5 volumi di colonna (5 volumi di colonna = 5 ml) di tampone di eluizione (0% B) con un flusso di 1 ml / minuto. Continua lavaggio della colonna, se necessario, fino a pH, tracciati UV e di contropressione sono stabilizzati.
- Lavare la colonna con 10 volumi della colonna (10 ml) di tampone di partenza (100% B) ad una portata di 1 ml / minuto. Continua lavaggio della colonna, se necessario, fino a parametri di sistema elencati nella fase precedente come pure conducibilità sono stabilizzati.
- La colonna HIC preparato sopra è ora pronto per il caricamento del campione. Una volta che tutte le colonne da testare vengono preparati, passare manualmente le valvole di selezione delle colonne alla posizione 1 (unione) e interrompere il flusso del buffer.
4. Sample Loading
- Immergere campione di tubo di ingresso nel campione di 20 ml per iniziare il processo di caricamento del campione nel ciclo del campione dinamico. Dalla finestra di impostazione manuale del software BioLogic, passare ciclo di carico del campione / lavaggio della valvola alla posizione 1 (campione) e la valvola di carico del campione di eliminare.
- Avviare un'azione dil'anello pompa campione caricamento, l'elaborazione del campione nel tubo della pompa ad una portata di 1 ml / minuto fino a subito dopo il campione raggiunge la valvola di caricamento del campione. Questo rimuove tampone e / o aria dalla linea di carico del campione.
- Arrestare il flusso della pompa di carico e passare la valvola di carico campione da Purge da caricare. Riavviare il ciclo pompa campione di carico ad una portata di 1 ml / minuto fino a 10 ml di campione è stato prelevato nel ciclo campione dinamica.
- Campione sufficiente è ora caricato nel ciclo di campionamento dinamico per un massimo di 10 corse sequenziali colonna HIC scouting.
5. Programmazione del Metodo Software ed esecuzione del Protocollo Colonna Scouting
- Dalla finestra di installazione del software BioLogic, selezionare i dispositivi del sistema contrassegnati con l'asterisco nella tabella 1.
- Selezionare 6 colonne HIC per il dosaggio. Programma un gradiente lineare sale discendente e 6-colonna metodo scouting, come illustrato nella Tabella 3. Il programma è un metodo modificatione della configurazione software BioLogic colonna HIC ed è stato ottimizzato per l'applicazione corrente.
- A 6 colonne metodo scout è raccomandato a causa di limitazioni collettore di frazioni. Tutte le colonne 7 può essere esplorato se il metodo di programma viene regolato per raccogliere frazioni volumi maggiori. Non aggiungere la fase di scouting fino a quando il programma è comunque completo, come selezionare la funzione di scouting impedisce la modifica successiva.
- Inizia la corsa scouting. Manualmente iniziare tampone di partenza (100% B) di flusso, 1 ml / minuto. Premere start sul controller splitter per iniziare eluato 90% -10% stream-splitting tra il collettore 12 ml cultura frazione tubo (posizione 1) e il 96 e collettore di frazioni piastra (posizione 2), rispettivamente. Nota tecnica: Richiamare il 96 e collettore di frazioni piastra è gestito dal software in linea biologica.
- Eseguire il metodo di programma. Subito dopo l'avvio del metodo run del programma, premere start sul pannello di controllo sullo schermo della linea piastra a 96 pozzetti fraction collettore. Se i due collettori frazione non sono al 100% sincrono, far avanzare manualmente la linea 96 e collettore di frazioni piatto come gli altri anticipi di raccolta della frazione per il secondo tubo di raccolta delle frazioni.
- Osservare la visualizzazione in tempo reale per confermare i parametri di esecuzione previsti. B contropressione, conducibilità, e% (Figura 4) sono gestiti parametri che possono essere monitorati per garantire la colonna a colonna riproducibilità delle condizioni di esecuzione. Posizionamento della valvola, pH, e il caricamento del campione devono essere monitorati. Tracciati UV possono essere confrontati per verificare simile flusso passante picchi di eluizione.
- Utilizzare in linea-e post-run tecniche di analisi dell'eluato per identificare il profilo di eluizione e purificazione della proteina di interesse (cioè "proteina target").
- Per i campioni che contengono GFP, osservare l'eluizione in linea con assorbimento UV unica della proteina a 397 nm. Confrontare il GFP-397 assorbanza specifica nm tracciando al generale proteina assorbanza 280 nm analisi per stimare relativa separazionee la purificazione utilizzando i diversi mezzi di comunicazione HIC essere esplorato (Figura 5).
- Post-run analisi di GFP e altre proteine bersaglio può essere realizzata con metodi diversi. Aliquote di pl 5-50 dalle frazioni da 96 pozzetti in piastra possono essere trasferiti in una piastra fresca e analizzato per il contenuto proteico specifico mediante ELISA o western blot, e il contenuto proteico totale di ogni frazione può essere analizzato mediante SDS-PAGE convenzionale o un Experion elettroforesi microfluidica sistema. GFP fluorescenza può essere rilevato in provette 12 ml di coltura che utilizzano la luce UV (Figura 6).
- Identificazione della maggior parte dei media promettenti HIC può essere determinata per confronto di eluizione GFP rispetto ad altre proteine presenti nel campione. Purificazione con i mezzi più promettenti HIC può essere ottimizzata in funzione di altri parametri, incluso il tipo e la concentrazione di tampone inizio e pH.
- Nota tecnica: Al termine dell'esperimento, porre tutte le linee di ingresso in B1 Buffer (degassatoH 2 O) e lavare accuratamente le pompe, valvole e tutti i tubi con acqua. Seguire le istruzioni del fabbricante per la pulizia e la conservazione a lungo termine del sistema di cromatografia e colonne HIC.
6. Rappresentativi Risultati:
Rappresentativa gradiente salino HIC, conduttività, e la pressione colonna delle piste esplorazione sono presentati in Figura 4. La variazione nella concentrazione di sale (linea blu), come misurata dalla percentuale di tampone tratto di alta sale linee del buffer è tipico della metodologia HIC. Poiché la concentrazione di sale diminuisce, proteine associato alla eluiscono colonna. Conducibilità (linea rossa), che corrisponde alla concentrazione di sale osservato, viene misurata in-linea immediatamente dopo i rivelatori QuadTec e UV. Il off-set tra gradiente salino e tracciati conducibilità indica il tempo necessario per il buffer di viaggiare dal buffer di ingresso, attraverso il sistema, e al monitor conduttività. Durante il ciclo di campionatura, tha la pressione del sistema (linee grigie) e pH rimangono relativamente costanti.
La Figura 5 mostra cromatogrammi di sequenza piste colonna HIC scouting. La in-linea di rilevamento di proteina totale (A 280, linea blu) e GFP (397 A, linea verde) viene eseguita misurando l'assorbanza della luce a 280 nm e 397 nm, rispettivamente. È possibile approssimare l'abbondanza relativa GFP e separazione per ogni corsa scouting confrontando le due linee. GFP legato alle colonne HIC testati con diversi gradi di affinità e del suo profilo di eluizione varia. Selezione di una colonna HIC preferito per le purificazioni future si basa sull'individuazione della colonna che produce più nitido il picco di eluizione GFP e la massima separazione da altre proteine.
In Figura 6, provette di coltura per Frazioni 10, 12, 14, 16 e 18 del FF Phenyl (alta sub) esplorazione conduzione sono state visualizzate sotto ambiente (fluorescente) e ultra leggerovioletta (UV) della luce. I tubi sono stati visti entrambi i faccia-forward (pannelli a sinistra) e top-down (pannelli di destra) al fine di osservare la caratteristica spettro di emissione GFP. GFP (verde) è chiaramente rilevata in Frazione 14 in entrambe le immagini UV. Queste Post-Run dati corrispondono bene con l'in-linea di rivelazione di GFP misurando l'assorbanza dell'eluato a 397 nm (A 397, linea verde), che identifica anche Frazione 14 come contenente il picco principale di GFP eluito. Il blu diffusa nel pannello UV sinistra è la luce emessa dalla lampada UV.
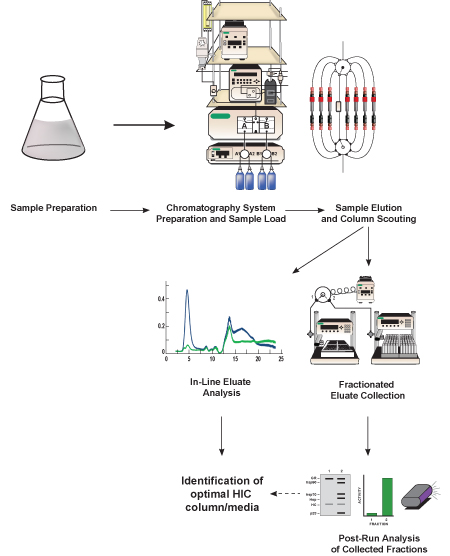
Figura 1. Rappresentazione schematica di questo protocollo. Lisato batterico contenente proteina di interesse (GFP, proteina bersaglio) viene preparato, diluita in un alto contenuto di sale equivalente tampone al buffer di inizio cromatografia, e filtrata. Una volta che il sistema di cromatografia liquida viene preparato, campione viene caricato e la proteina bersaglio è separata da altre proteine i contenutin il lisato usando un mezzo di cromatografia idrofobica contenuta in una preconfezionati colonna HIC. Il metodo di separazione viene ripetuta più volte utilizzando diversi supporti cromatografia (denominata colonna scouting) per determinare quale supporto prevede la separazione migliore GFP. Le proteine eluite (eluato) viene analizzata in linea, con rivelatori inclusi nel sistema di cromatografia e viene raccolto in frazioni più piccole per la successiva (post-run) analisi. Sulla base dell'analisi in-linea e post-conduzione di attività GFP e separazione, una colonna HIC ottimale e medie cromatografica sono identificati.
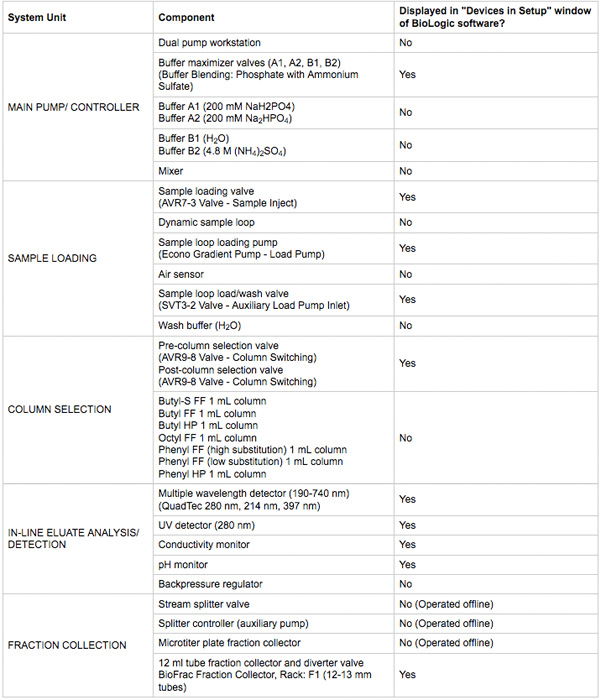
Tabella 1. Principali componenti del sistema di cromatografia utilizzati in questo protocollo.
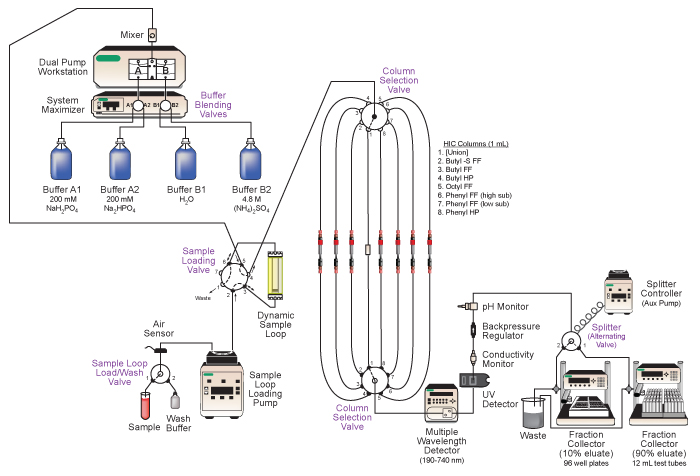
Figura 2. Schema di Bio-Rad DuoFlow media pressione sistema di cromatografia liquida impiegato. Caratteristiche principali della SYstaminali comprendono la miscelazione automatica di buffer, il caricamento del campione per tirature di colonna sequenziali, la selezione automatica di colonne cromatografiche differenti, in-linea analisi dell'eluato, e tandem raccolta dell'eluato frazionato. Vedere il testo e la Tabella 1 per i dettagli.
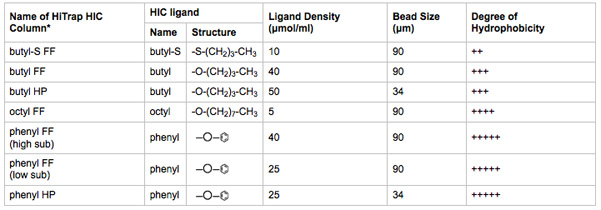
Caratteristiche Tabella 2. Biofisica di media HIC testato. Il nome della colonna HIC HiTrap è indicativa del legante, densità di ligando, e la dimensione tallone.
* FF = rapido flusso; = HP ad alte prestazioni. Maggiori dimensioni tallone aumenta la capacità di legame e la portata. Dimensioni ridotte tallone aumenta la risoluzione cromatografica. Informazioni tratte dalla letteratura fornito dal produttore.

Figura 3. Collegamento della colonna GE Healthcare HiTrap HIC a Bio-Rad DuoFlow system.To il dado a monte Delrin 1/4-28 unond ghiera (A1), un maschio Luer-femmina Raccordo 1/4-28 (B1) e maschio 1/16 "-femmina raccordo Luer (C) sono collegati. I raccordi sono allegare alla colonna HiTrap dopo essere stato lavata con tampone e avente tutte le bolle rimosso. L'uscita della colonna è collegato ad una femmina 1/16 "a maschio raccordo M6 (D), Luer maschio-femmina a M6 raccordo (E), e Luer femmina-femmina 1 / 4-28 raccordo (B 2). Questo insieme è collegato al dado a valle Delrin 1/4-28 e puntale (A 2). Il pannello superiore mostra i raccordi separato e il pannello inferiore mostra i raccordi assemblati.
| Passo # | Volume (ml) | Descrizione | Parametri | |
| 1 | 0,00 | Raccogliere 1,0 mL frazioni durante la marcia tutto | ||
| 2 | 0,00 | Switch Colonne | Colonna HIC 1 (Posizione 2) | |
| 3 | 0,00 | Flusso isocratica | pH: 6,80 100% B | Volume: 2,00 mL Flusso: 1,00 mL / min |
| 4 | 2,00 | Zero Baseline | QuadTec | |
| 5 | 2,00 | Zero Baseline | Detector UV | |
| 6 | 2,00 | Iniettare Campione | Esempio di carico Loop dinamico | Iniettare Auto Valve Volume: 0,50 mL Flusso: 1,00 mL / min |
| 7 | 3,00 | Flusso isocratica | pH: 6,80 100% B | Volume: 5,00 mL Flusso: 1,00 mL / min |
| 8 | 8,00 | Sfumatura lineare | pH: 6,80 100% B -> B 0% | Volume: 10,00 mL Flusso: 1,00 mL/ Min |
| 9 | 18,00 | Flusso isocratica | pH: 6,80 0% B | Volume: 3,00 mL Flusso: 1,00 mL / min |
| 10 | 21,00 | Flusso isocratica | pH: 6,80 100% B | Volume: 5,00 mL Flusso: 1,00 mL / min |
| 11 | 26,00 | Cambia Colonne | Unione (Posizione 1) | |
| Fine | 26,00 | Fine del protocollo | Automaticamente ripete con 5 colonne aggiuntive HIC (Posizioni 3-7) | |
| Scout tipo | Numero di run: 6 | Numero di Passi Scoperto: 1 | ||
Tabella 3. Software del protocollo BioLogic per HIC metodo di scouting impiegato.

Figura 4. Rappresentativa gradiente salino HIC, conduttività, e la pressione della colonna. Poiché la concentrazione di sale (linea blu) diminuisce, conducibilità (linea rossa) fa lo stesso. L'off-set tra il gradiente di sale e tracciati di conducibilità indica il tempo necessario per il buffer per viaggiare dal buffer di ingresso al monitor di conducibilità. La pressione del sistema (linee grigie) rimane relativamente costante per tutta la durata della corsa scouting.
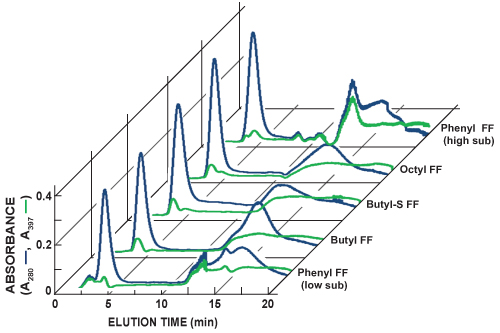
Figura 5. Cromatogrammi compilata colonna sequenziale HIC HiTrap scouting piste. La in-linea di rilevamento di proteina totale (A 280, linea blu) e GFP (397 A, linea verde) viene eseguita misurando l'assorbanza della luce a 280 nm e 397 nm, rispettivamente. In questa serie di esperimenti, più acuta il picco di eluizione GFP è stata osservata con la FF Phenyl (alta sub) column. Il Phenyl FF (alta sub) colonna inoltre sembra fornire la massima separazione tra GFP e altre proteine. Ulteriori 1 colonne HITRAP ml HIC testato inclusa la sostituzione Phenyl flusso veloce bassa (fenil FF (bassa sub)), il flusso di butile veloce (butile FF), butil-S flusso veloce (butil-S FF), e ottile flusso veloce (ottile FF) .
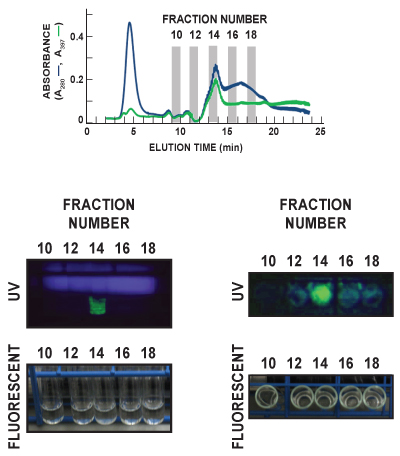
Figura 6. Rappresentante post-run visualizzazione di GFP in eluato campione. Frazioni di eluato sono state raccolte ad una velocità di 1/minuto, e ciascuno è stato analizzato per il contenuto GFP. In questa figura rappresentativa, provette di coltura per Frazioni 10, 12, 14, 16 e 18 del FF Phenyl (alta sub) esplorazione conduzione sono state visualizzate sotto ambiente (fluorescente) e la luce ultravioletta (UV). I tubi sono stati visti entrambi i faccia-forward (pannelli a sinistra) e top-down (pannelli di destra). Il blu diffusa nel pannello UV sinistra è la luce emessa dalla lampada UV. GFP (green) è chiaramente individuato in Fraczione 14 in entrambe le immagini UV. Il pannello superiore indica la proteina totale (A280, linea blu) e GFP (A 397, linea verde) tracciati cromatogramma delle 5 frazioni essere visualizzato.
Discussione
Tecniche di cromatografia liquida hanno dimostrato prezioso per la preparazione di proteine altamente purificate necessari per lo svolgimento di 6 immunologica, biochimica 7 e 8 studi strutturali. Metodi di purificazione HIC più spesso richiedono determinazione empirica di un mezzo preferito, e la struttura ligando, densità di ligando, e matrice proprietà tallone tutti hanno dimostrato di impatto risultati cromatografici 2, 3. Colonna Automated scouting è un approccio efficace per la selezione di un mezzo di HIC per l'ottimizzazione e la successiva purificazione di proteine 4. Il metodo automatizzato colonna esplorazione presentato può essere facilmente adattato alle strategie di varie proteine HIC purificazione. Alterazioni concentrazione salina, scelta di sale, gradiente salino, e il pH può ulteriormente migliorare le condizioni di purificazione, e gli effetti delle variazioni di questi parametri essenziali sono stati precedentemente recensione 13,14. HIC eluato contenente una prote bersaglio parzialmente purificatoin può essere ulteriormente purificato utilizzando una tecnica cromatografica complementare, come cromatografia a scambio ionico (IEX) o gel filtrazione / cromatografia per esclusione dimensionale 9,10.
A causa della sua assorbanza di luce unico e caratteristiche di emissione, il profilo di eluizione di GFP può essere identificato utilizzando in-linea e post-run approcci. A tal fine, questo protocollo può ulteriormente essere adattato per la purificazione di ricombinanti di fusione GFP-proteine, in cui una proteina bersaglio è correlato "tag" con GFP. Proteine bersaglio GFP-etichetta può essere rilevato con luce UV 11 e purificato usando vari metodi cromatografici, compresa la strategia di purificazione HIC sopra descritto. Depurazione GFP è diventata anche un fiocco pedagogico nei laboratori di biochimica per l'insegnamento di tecniche moderne della scienza delle proteine 12.
Mentre base purificazione della proteina HIC può essere condotta utilizzando un sostanzialmente meno robusto cromatografia sygambo, la strumentazione qui presentata ha un numero di vantaggi distinti per aiutare a ottenere risultati favorevoli. Notevoli vantaggi di utilizzare un sistema altamente automatizzato includono il miglioramento delle run-to-run condizioni di riproducibilità, risparmio di tempo e diminuzione opportunità per l'aria di essere introdotte nel sistema 10. Sistema di controllo miscelazione tampone, che viene facilitata dalla massimizzatore sistema, consente maggiore coerenza nella preparazione tampone e riproducibilità sperimentale. Disegno abbastanza carico campione nel ciclo del campione dinamico per tutti i scouting corre successiva garantisce l'uniformità del campione che viene aggiunto ad ogni colonna e permette la replica in sequenza senza interruzioni o manuale ricarica. Iniezione del campione controllato dal circuito campione attraverso la colonna diminuisce variabilità che può verificarsi con caricamento manuale del campione. Una coppia di valvole di selezione di colonna per consentire corse campioni consecutivi, ciascuno utilizzando una colonna HIC differente, senza dover rinnovare gli impianti idraulici del sistema. Esecuzione di mul ti-lunghezza d'onda analisi è particolarmente vantaggioso quando saggiando una proteina con un unico profilo spettrofotometrico. Oltre a GFP, citocromi, flavoproteine e altri eme contenenti proteine possono beneficiare di questa tecnica. Dispositivi di controllo di conducibilità e pH per consentire la verifica delle condizioni sperimentali in tempo reale. Frazione collezione Split eluato consente una gestione migliore frazione e consente il trasferimento facile per Post-Run metodi di analisi che richiedono un volume minimo di campione (ad esempio ELISA, SDS-PAGE, western blot, e Experion elettroforesi microfluidica). Durante il funzionamento il secondo in linea collettore di frazioni richiede sincronizzazione manuale, permette la massima flessibilità nella scelta frazione collettore. Gli inconvenienti più significativi a utilizzare un sistema robusto cromatografia per la colonna HIC scouting e purificazione della proteina comprende il tempo iniziale e spese di bilancio connesse con l'acquisizione dello strumento e la formazione degli operatori.
t "> Il protocollo qui presentato utilizza un Bio-Rad DuoFlow sistema di cromatografia. tuttavia, strumentazione altrettanto robusto da altri produttori, come il Avant AKTA da GE Healthcare, possono anche essere utilizzati e sono in grado di produrre risultati equivalenti sistema di cromatografia Anche comparabile hanno caratteristiche uniche (ad esempio il metodo di programmazione, i limiti nomenclatura dei componenti, le preferenze dell'operatore, e scalabilità) che devono essere considerati prima di avviare una procedura di purificazione o di acquisizione dello strumento.Divulgazioni
Selezionare reagenti cromatografia e strumentazione supplementare sono stati forniti da Bio-Rad.
Riconoscimenti
Questo lavoro è stato finanziato dal National Institutes of Health di sovvenzione GM086822 e National Science Foundation importante ricerca strumentazione concessione DBI-0960313. Gli autori desiderano ringraziare Drs. Jon Hardy & Donna Miyake (Bio-Rad) e Jennifer Loertscher (Seattle University) alla loro competenza tecnica. Selezionare reagenti cromatografia e strumentazione supplementare stati generosamente fornito da Bio-Rad.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Commenti (opzionale) |
| BioLogic DuoFlow Pathfinder 20 Sistema | Bio-Rad | 7602257 | Include il sistema di Maximizer, mixer, workstation F10, AVR7-3 valvole, QuadTec UV / Vis con rivelatore di cella di flusso, collettore di frazioni BioFrac, software BioLogic e starter kit |
| AVR9-8 stream-selezionare valvola | Bio-Rad | 7600408 | Valvola di alta pressione, 9-port, 8 posizioni, 3.500 psi (233 bar) limite, per l'utilizzo con sistema biologico DuoFlow |
| Valvola deviatrice SV3T-2 | Bio-Rad | 7600410 | Elettrovalvola, a 3 porte, 2-posizione, 30 psi (2 bar) limite, per l'utilizzo con sistema biologico DuoFlow |
| Flusso splitter valvola | Bio-Rad | ||
| verticale = LSR & parentCategoryGUID = "target =" 22c495f1-36ff-44a3-9140-ee7e54d0b1ba _blank "> DynaLoop 25 Kit | Bio-Rad | 7500451 | Sliding-pistone ciclo kit campione, include 25 ml DynaLoop scorrevole anello del pistone, DynaLoop parti kit (# 750-0450) |
| Raccoglitore di frazioni BioFrac | Bio-Rad | 7410002 | Due frazione col lettori usati |
| BioFrac micropiastra goccia adattatore testa | Bio-Rad | 7410088 | |
| BioFrac microtiter piastra di adattamento | Bio-Rad | & Country = US & lang = en & ProductID = "target =" _blank 741-0017 "> 7410017 | |
| UV Ottica Module | Bio-Rad | 7500202 | |
| Lampada alogena | Bio-Rad | < un target = "_blank"> 7601331 | |
| Econo Gradient Pump | Bio-Rad | 7319001 | Pompa gradiente a bassa pressione purificazione della proteina, comprende tubi e raccordi kit |
| Experion sistema | Bio-Rad | bio-rad.com/prd/en/US/adirect/biorad? cmd = BRCatgProductDetail & ProductID = "target =" 224301 _blank "> 7.007.001 | |
| Experion Pro260 Analisi Kit | Bio-Rad | 7007102 | |
| HiTrap HIC colonna kit di selezione | GE Healthcare | 28-4110-07 | Include 7 x 1 ml preconfezionati colonne di mezzi di HIC per scouting |
| GE Healthcare-to-Bio-Rad colonna raccordi | GE Healthcare | 18111251 e 18111257 |
Riferimenti
- Cummins, P. M., O'Connor, B. F. Hydrophobic interaction chromatography. Methods Mol. Biol. 681, 431-437 (2011).
- Nagrath, D., Xia, F., Cramer, S. M. Characterization and modeling of nonlinear hydrophobic interaction chromatographic systems. J. Chromatogr. A. 1218, 1219-1226 (2011).
- To, B. C., Lenhoff, A. M. Hydrophobic interaction chromatography of proteins. IV. Protein adsorption capacity and transport in preparative mode. J. Chromatogr. A. 1218, 427-440 (2011).
- Huddleston, J. G., Wang, R., Lyddiatt, A. On the use of mild hydrophobic interaction chromatography for "method scouting" protein purification strategies in aqueous two-phase systems: a study using model proteins. Biotechnol Bioeng. 44, 626-635 (1994).
- Arun, K. H., Kaul, C. L., Ramarao, P. Green fluorescent proteins in receptor research: an emerging tool for drug discovery. J. Pharmacol. Toxicol. Methods. 51, 1-23 (2005).
- Terrizzi, S. C., Banh, C., Brossay, . L.A Protocol for the Production of KLRG1 Tetramer. J. Vis. Exp. (35), e1701-e1701 (2010).
- Murphy, P. J. M., Morishima, Y., Kovacs, J. J., Yao, T. P., Pratt, W. B. Regulation of the dynamics of hsp90 action on the glucocorticoid receptor by acetylation/deacetylation of the chaperone. J. Biol. Chem. 280, 33792-33799 (2005).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 Magnetosome Associated Protein MamAΔ41. J. Vis. Exp. (37), 10-3791 (2010).
- Kong, Y., Li, X., Bai, G., Ma, G., Su, Z. An automatic system for multidimensional integrated protein chromatography. J. Chromatogr. A. 1217, 6898-6904 (2010).
- Camper, D. V., Viola, R. E. Fully automated protein purification. Anal. Biochem. 393, 176-181 (2009).
- Hammon, J., Palanivelu, D. V., Chen, J., Patel, C., Minor, D. L. A green fluorescent protein screen for identification of well-expressed membrane proteins from a cohort of extremophilic organisms. Protein Sci. 18, 121-133 (2009).
- Wu, Y. Using green and red fluorescent proteins to teach protein expression, purification, and crystallization. Biochem. Mol. Biol. Educ. 36, 43-54 (2008).
- Queiroz, J. A., Tomaz, C. T., Cabral, J. M. Hydrophobic interaction chromatography of proteins. J. Biotechnol. 87, 143-159 (2001).
- McCue, J. T. Theory and use of hydrophobic interaction chromatography in protein purification applications. Methods Enzymol. 463, 405-414 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon