Method Article
Automatisierte Hydrophobe Interaktions-Chromatographie Spaltenauswahl für den Einsatz in Protein Purification
In diesem Artikel
Zusammenfassung
Ein automatisiertes Verfahren zur Identifizierung von geeigneten hydrophoben Interaktionschromatographie (HIC) Medien, die in dem Verfahren der Proteinreinigung verwendet werden vorgestellt. Das Verfahren nutzt eine Mitteldruck-Flüssigkeits-Chromatographie-System einschließlich automatisierter Puffer Blending, dynamisches Probenschleife Injektion, sequentielle Spalte Auswahl, Multi-Wellenlängen-Analyse-und Split-Fraktion Eluat Sammlung.
Zusammenfassung
Im Gegensatz zu anderen chromatographischen Methoden zur Aufreinigung von Proteinen (zB Gelfiltration, Affinität und Ionenaustausch), hydrophobe Interaktions-Chromatographie (HIC) erfordert häufig experimentelle Bestimmung (so genannte Screening oder "Scouting"), um die am besten geeigneten chromatographischen Medium wählen zur Reinigung eines bestimmten Proteins 1. Die hier vorgestellte Methode beschreibt ein automatisiertes Konzept für Scouting für eine optimale HIC-Medien in Proteinreinigung verwendet werden.
HIC trennt Proteine und andere Biomoleküle aus einer rohen Lysat auf Unterschiede in der Hydrophobie der Basis. Ähnlich wie Affinitätschromatographie (AC) und Ionenaustauschchromatographie (IEX), HIC kann die Konzentration des Proteins von Interesse, da sie durch das chromatographische voranschreitet. Proteine besten für die Reinigung durch HIC geeignet sind, umfassen solche mit hydrophoben Oberflächenbereiche und in der Lage, um die Exposition zu widerstehen, um Konzentrationen von mehr als 2 M Salz Munitionnium-Sulfat ((NH 4) 2 SO 4). HIC wird oft als ein Reinigungsverfahren für Proteine fehlt ein Affinitäts-Tag gewählt und somit ungeeignet für Wechselstrom, und wenn IEX keine ausreichende Reinigung bereitzustellen. Hydrophobe Reste, die an das Protein binden Deckschicht zeitweilig in eine unpolare Liganden, der mit einem inerten, unbeweglich Matrix. Die Wechselwirkung zwischen Protein und dem Liganden sind stark abhängig von der Salzkonzentration des Puffers fließt durch die Chromatographiesäule, mit hohen Ionenkonzentrationen Stärkung der Protein-Ligand-Interaktion und dass das Protein unbeweglich (dh innerhalb der Säule gebunden) 2. Wie Salzkonzentrationen Abnahme, das Protein-Ligand-Wechselwirkung abführt, das Protein wieder wird mobil und von der Säule eluiert. Mehrere HIC Medien sind kommerziell erhältlich in vorverpackten Spalten, die jeweils eine von mehreren hydrophoben Liganden (zB S-Butyl, Butyl, Octyl und Phenyl) bei unterschiedlichen Dichten eine Agarose-Kügelchen mit einem spec vernetztIFIC Durchmesser 3. Automatisierte Spalte Scouting ermöglicht eine effiziente Methode zur Bestimmung des HIC-Medien für die Zukunft, mehr erschöpfend Optimierung Experimente verwendet werden sollte und Proteinreinigung läuft 4.
Die spezifische Protein, das hier gereinigte rekombinante grün fluoreszierendes Protein (GFP), doch, kann dieser Ansatz zur Reinigung von anderen Proteinen, mit einem oder mehreren hydrophoben Oberflächenbereiche ausgebildet werden. GFP dient als nützliches Modell Protein aufgrund seiner Stabilität, einzigartige Licht Absorptionspeak bei 397 nm und Fluoreszenz, wenn sie mit UV-Licht 5 ausgesetzt. Bakterienlysates Wildtyp-GFP wurde in einem Hochsalz-Puffer hergestellt, geladen in einem Bio-Rad DuoFlow Mitteldruck-Flüssigkeits-Chromatographie-System und adsorbiert HiTrap HIC-Säulen, die unterschiedliche HIC Medien. Das Protein wurde von den Säulen eluiert und mittels in-line und Nachlauf Nachweisverfahren. Buffer Blending, dynamisches Probenschleife Injektion, sequentielle colUMN Auswahl, Multi-Wellenlängen-Analyse, und getrennte Fraktion angesehen Eluat erhöht die Funktionalität des Systems und Reproduzierbarkeit der experimentellen Ansatz.
Protokoll
1. Puffer-und Probenvorbereitung
- Technischer Hinweis: Alle Puffer sollte im Kühlschrank gelagert werden und jeder Schritt dieses Protokoll sollte auf Eis oder bei 4 ° C durchgeführt werden, sofern nicht anders angegeben. Die niedrige Temperatur ist wichtig, den Abbau des Proteins zu reinigenden zu verhindern und um optimale Betriebsbedingungen zu gewährleisten. HIC-Medien kann zu unterschiedlichen Ergebnissen führen, wenn die Trennung bei Raumtemperatur betrieben, und das Chromatographie-System sollte in einem 4 ° C kalten Raum oder Cold-Box betrieben werden.
- Bereiten Sie 500 ml der folgenden Puffer: 200 mM NaH 2 PO 4 (Puffer A1), 200 mM Na 2 HPO 4, (Buffer A2), und 4,8 M (NH 4) 2 SO 4 (Buffer B2). Entionisiertes Wasser (Puffer B1) wird ebenfalls verwendet werden. Degas der Puffer, um eine optimale chromatographische Betriebsbedingungen. Das System wird Maximalstelle vermischen Puffer A1 und A2 eine salzarme Phosphat Elutionspuffer zu erzeugen, und es wird Puffer B1 und B2 zu mischendie hohe Salz Ammoniumsulfat-Start-Puffer (2,4 M (NH 4) 2 SO 4) zu erzeugen.
- Es werden 20 ml Probe durch Mischen von 10 ml Zelllysat, enthaltend das Protein mit 10 ml Puffer B2 gereinigt werden geladen werden. Die endgültige Ammoniumsulfatkonzentration von dem Zelllysat Probelösung sollte ca. 2,4 M (NH 4) 2 SO 4 sein, so dass es etwa vergleichbar mit dem Start-Puffer. Zelllysat kann durch Resuspendieren des bakteriellen Zellpellet in TE-Puffer (10 mM Tris 1 mM EDTA, pH 8,0) durch Ultraschall oder der Zugabe von 1 mg / ml Lysozym und Zentrifugation bei 3.700 × g für 10 Minuten hergestellt werden.
- Filtern des Lysats-Puffer-Mischung durch eine niedrige Proteinbindung 0,45 um Spritzenfilter um Partikel aus der Lösung zu entfernen. Halten Sie die Probe auf Eis, bis es bereit ist, in das System geladen werden soll.
2. Physikalische Setup und Installateure von DuoFlow Chromatographie-System
- Stellen Sie sicher, alle Geräte-Stromversorgung und Kommunikation Verbindungen hergestellt sind. Geräte sichtbar sein soll in der Biologic DuoFlow Chromatographie-Software Handsteuerung Fenster. Eine Zusammenfassung der Vorrichtungen sind in Tabelle 1 aufgeführt. Eine Darstellung des Systems und Sanitär-Diagramm ist in Abbildung 2.
- Befestigen Sie elektrische Anschlüsse für die Ventile an die Pumpe und Workstation-System Maximizer-Ports, so dass die Port Nummerierung folgt einer logischen Reihenfolge. Beschriften Sie jedes Ventil mit ihren jeweiligen Port-Nummer für später auf. Die Pumpe und Workstation-System Maximizer als die wichtigsten Kommunikations-Verbindungen zwischen dem Computer / Controller und Chromatographie-System dienen. Die Ventile werden automatisch erkannt und angezeigt, wenn in der Software entweder auf Gerät verbunden ist.
- Technischer Hinweis: Bei Betrieb des Chromatographie-System im manuellen Modus, Ventile werden unabhängig voneinander geregelt. Achten Sie darauf, ob die gewünschten Strömungsweg konfiguriert ist, insbesondere wenn Schaltventile, vor Beginn der BuffER fließen.
- Tauchen Teflonschlauch in Puffer A1, A2, B1 und B2. Für ausreichende Volumina Puffer stehen für ganze Protokoll und dass Schläuche, die auch weiterhin unter Wasser. Vorbereiten 500 ml Puffer A1, A2 und B2 und 1 l Puffer B1 als ausreichend erscheinen.
- Plumb Probe Ladeventil und dynamische Probenschleife wie in Abbildung 2 und den Anweisungen des Herstellers dargestellt. Verbinden Sie die Probenschleife auf die Probe Ventileingang (Position 3) mit dem kleinsten Stück Schlauch möglich. Dies wird Probenverdünnung während der Probe Belastung zu minimieren.
- Minimieren Sie die Schlauchlänge zwischen der Probe, Probe-Ladepumpe und Probenbeladung Ventileingang (Position 2). Dies verringert die Menge der Probe notwendig, um die Probenschleife zu laden.
- Planen 8 identisch bemessen Paare von 1/16 "OD PEEK-Schlauch, wobei jedes Paar miteinander durch eine 1/4-28 female-to-1/4-28 Überwurfmutter. Verbinden der Paare zu den Positionen 1-8 des Zweisäulen Auswahl Ventile. Die 7 Unions in-line auf die Spalte Auswahlventil Positionen 2-8 verbunden wird später durch den Chromatographiesäulen zu testenden ersetzt werden. Die Vereinigung verbunden inline mit Position 1 wird als Chromatographiesäule Bypass aufrechterhalten werden.
- Technischer Hinweis: Stellen Sie sicher, jedes Paar von Schläuchen an der gleichen Position ist auf beiden Spalte Auswahl Ventile verbunden.
- Schalten Sie beide 4-Wellenlänge UV / Vis-Detektor (Quadtec) Lampen-und Festnetz-Wellenlänge 280 nm UV-Detektor Lampe. Die Wellenlängen, die von der Quadtec für dieses Protokoll Messung folgender 214 nm, 280 nm und 397 nm. Messen 280 nm sowohl mit dem Festnetz-Wellenlänge UV-Detektor und Quadtec bietet Redundanz und sichert die Gültigkeit der Daten.
- Bestätigen Sie alle Detektoren werden pro Anweisungen des Herstellers kalibriert. Die Überströmventil erforderlich ist, um Luft in Blasensammelkammer Detektoren zu verringern und sollte installiert stromabwärts von den Detektoren, aber stromaufwärts des pH-Monitor werden.
- Das hier vorgestellte System besteht aus zwei fraction Kollektoren, die erheblichen Komfort bietet für Post-Run Eluatanalyse. Befestigen Sie die Fraktionssammler, Stream-Splitter Ventil und Verteiler-Controller wie in Abbildung 2 dargestellt. Der Fraktionssammler verbunden zu 1 des Splitters Ventilstellung sammeln 900 ul Eluat-Fraktionen in 12 ml Kulturröhrchen, während der Fraktionssammler auf Position 2 verbunden werden 100 mu l Eluat-Fraktionen in Mikrotiterplatten mit 96 Vertiefungen zu sammeln.
- Die Position 2 Fraktionssammler, Split-Ventil und Verteiler-Controller betrieben werden offline von der Chromatographie-Workstation. Der Splitter-Controller in einem Bio-Rad Econo Gradientenpumpe enthalten, aber die Pumpe Bestandteil der Vorrichtung nicht verwendet wird. A "% Split"-Einstellung Option wird auf der Econo Gradientenpumpe angezeigt werden, wenn der Split-Ventil mit ihm verbunden ist.
- Set zu 10% Split. Die Position 1 Fraktionssammler sammelt 90% des Eluats (900 ul / Fraktion), und die Position 2 Fraktionssammler sammeln10% (100 ul / Fraktion). Die Fraktionssammler wird synchron voranzutreiben Berücksichtigung Bruchteil Zahlen der beiden Sammler zu einander entsprechen.
- Ersetzen Sie die Standard-Fraktionssammler Drop-Kopf auf der Position 2 Fraktionssammler mit einem Mikroplatten-Drop Kopf. Die Mikrotiterplatte Drop Kopf hat eine kleinere Blende, die Sammlung von 50% ermöglicht kleinere Tropfengrößen (dh 25 ul statt der üblichen 50 ul) und ist besonders vorteilhaft bei der Erhebung ≤ 500 ul-Fraktionen.
- Verwendung der Display-Bedienfeld, stellen Sie die Position 2 Fraktionssammler zu Fraktionen im 96-well Platten und vorab mit einer Rate von 1 Probe / Minute zu sammeln. Der Splitter-Controller und Position 2 Fraktionssammler wird manuell unmittelbar nach dem Beginn des ersten Chromatographielauf begonnen werden.
- Spülen Sie die Position 2 Fraktionssammler und Mikroplatten-Drop-Kopf mit Puffer B1.
3. Priming System Lines, Programmierung Run-Methode, und EquilibratIng. HIC-Säulen
- Mit System Maximizer Zuleitungen in entgastem Puffer A1, A2, B1 und B2, die Workstation Prime Pumpen unter Wasser, spülen Probenschleife, und spülen Sie das Chromatographie-System den Anweisungen des Herstellers. Komplettes Grundieren Schritt mit allen 4 Maximizer System Einlässe (A1, A2, B1 und B2), um die verbleibenden Luftblasen zu entfernen.
- Vorbereiten des Systems erfordert manuelle Betrieb des System-Controller über die BioLogic Software. Bestätigen Sie die korrekte Positionierung der Probe Last Ventil und Spaltenauswahl Ventile vor Beginn der Puffer fließen.
- Bereiten Sie sich darauf ein Handbuch 1 ml / min Fluss der Elutionspuffer (0% B) durch das System, wie in Schritten von 3,4 bis 3,5 beschrieben starten.
- Im Setup-Fenster des Programms BioLogic Software, wählen Sie "Buffer Blending" und "Phosphatpuffer mit Ammoniumsulfat". Bestätigen Puffer A1, A2, B1 und B2 im Setup-Fenster aufgelistet entsprechen denen vorbereitete.
- Manuelles Setzen der Flussrate auf 1 ml / min Elutionspuffer(0% B). Beachten Gegendruck, bleiben Leitfähigkeit, UV-Kurven, und pH-Wert konsistent und innerhalb der normalen Betriebsgrenzen. Abnormitäten zeigen, Luft oder Spalte Blockade, die vor dem Verfahren behandelt werden sollte.
- Spülen Sie alle 8 Spaltenauswahlleitungen mit 5 ml Elutionspuffer. Tun Sie dies, indem zunächst das Anhalten der Strömung, setzen beide Spalte Auswahl Ventile in Position 2, und die Wiederaufnahme der 1 ml / min Durchfluss, 0% B Wiederholen Sie dies für Spaltenauswahlleitungen in Positionen 3-8.
- Verbinden Sie 1 ml HiTrap HIC-Säulen, um Positionen 2-8 der Spalte Auswahl Ventile. Führen Sie die Schritte 3,8-3,13 mit einer Spalte zu einer Zeit. Beachten Sie die HIC-Säule in dem Auswahlventil Position gebracht wird. Eine Zusammenfassung der HIC-Säule Medien Eigenschaften ist in Tabelle 2 aufgeführt.
- Die physikalische Verbindung von GE Healthcare HiTrap Spalten in die Bio-Rad DuoFlow System erfordert eine Reihe von Armaturen verwendet 1/4-28, M6, und Luer-Fittings. Entfernen Sie die Union den Anschluss der Position 2 Spalte Auswahl Ventile. EinLIGN des Bio-Rad und GE Healthcare Armaturen wie in Abbildung 3 dargestellt.
- Bringen Sie vor dem Spalte Armaturen DuoFlow. Vermeiden Sie Lufteinschlüsse in der Spalte oder der Schlauch durch festes Anbringen der Upstream-Spalte Beschläge an den Upstream Auswahl Ventilarmatur. Führen Elutionspuffer durch die Anschlussstücke, bis die Luft ausgestoßen wird und eine große Tropfen Puffer vorhanden ist. Vorübergehend Anschlagpuffer fließen.
- Entfernen des Stopfens mit dem Säulenkopf und stellen einen starken Abfall der salzarme Puffer (0% B) auf dem Kopf der Kolonne. Befestigen Sie die Spalte auf den vorgelagerten Armaturen. Mit sowohl der Einlass-und Spalte Einlassfitting überfüllt mit Tropfen Puffer sorgt für eine Verbindung frei von Luftblasen.
- Wenn die Spalte für das erste Mal verwendet wird, brechen Sie die Spalte Auslaßende. Befestigen Sie den Ausgang zum nachgeschalteten Kolonne Armaturen und Schläuche Ventil Auswahl. Überprüfen Sie alle Anschlüsse fest angezogen sind.
- Stellen Sie den Gegendruck auf 40 psi. Die Säule wird wi-ten 5 Säulenvolumina (5 Säulenvolumina = 5 ml) Elutionspuffer (0% B) bei einer Flussrate von 1 ml / Minute. Weiter Säule zu waschen, wenn nötig, bis der pH-, UV-Kurven und Gegendruck stabilisiert haben.
- Waschen Säule mit 10 Säulenvolumina (10 ml) Start-Puffer (100% B) bei einer Flussrate von 1 ml / Minute. Weiter Säule zu waschen, wenn notwendig, bis der Systemparameter in dem vorhergehenden Schritt als die Leitfähigkeit des genannten stabilisiert haben.
- Der HIC-Säule oben hergestellt ist nun bereit für Probenbeladung. Wenn alle Spalten zu prüfenden bereit sind, manuell schalten die Ventile Spalte Auswahl an Position 1 (Union) und Stop-Puffer fließen.
4. Probenauftragsstrategien
- Tauchen Probeneinlass Schlauch in 20 ml-Probe, um den Prozess des Ladens Probe in die Probenschleife dynamischen beginnen. Von der manuellen Einstellung Fenster des BioLogic Software, schalten Probenschleife Last / waschen Ventil auf Position 1 (Sample) und der Probe Laden Ventil zu reinigen.
- Initiieren von Maßnahmendie Probenschleife Ladepumpe, Erstellung Probe in der Pumpenschlauch mit einer Fließgeschwindigkeit von 1 ml / min bis unmittelbar nach Probe die Probe Ladeventil. Dies entfernt Puffer und / oder Luft aus der Probe sein muss.
- Stoppen Sie den Fluss der Ladepumpe und schalten Sie die Probe Ladeventil von Purge zu laden. Starten der Probenschleife Ladepumpe mit einer Fließgeschwindigkeit von 1 ml / min bis 10 ml der Probe in die Probenschleife dynamischen gezogen.
- Eine ausreichende Probe wird nun in das dynamische Probenschleife geladen für bis zu 10 aufeinanderfolgenden HIC-Säule Scouting läuft.
5. Die Programmierung der Software-Methode und Ausführen des Column Scouting-Protokoll
- Im Setup-Fenster auf dem BioLogic Software, wählen Sie die System-Geräte mit einem Stern in der Tabelle 1 gekennzeichnet.
- Wählen Sie 6 HIC-Säulen bis Assay. Programm eine lineare absteigend Salzgradienten und 6-Spalte Scouting Verfahren, wie in Tabelle 3 dargestellt. Verfahren Programm ist ein modificatIon der BioLogic Software HIC-Säule Setup und hat für die aktuelle Anwendung optimiert worden.
- Ein 6-Säule Scouting-Methode wird empfohlen, wegen Fraktionssammler Einschränkungen. Alle 7 Spalten werden kann, wenn das Programm gescoutet Verfahren wird eingestellt, um größere Fraktion Bände zu sammeln. Fügen Sie nicht den Scouting-Schritt, bis das Programm ist ansonsten komplett, wie die Auswahl der Scouting-Funktion verhindert, dass die anschließende Bearbeitung.
- Beginnen Sie mit der Scouting-Lauf. Manuell beginnen Start-Puffer (100% B) fließen, 1 ml / min. Drücken Sie starten am Splitter Regler auf 90% -10% Eluat Stream-Splitting zwischen der 12 ml Tube Kultur Fraktionssammler (Position 1) und der 96-Well Platte Fraktionssammler (Position 2), bzw. beginnen. Technischer Hinweis: Erinnern Sie die 96-Well Platte Fraktionssammler betrieben wird offline von der BioLogic Software.
- Führen Sie das Programm-Methode. Unmittelbar nach dem Start des Programms Methode run, drücken Sie Start auf dem Bedienfeld auf dem Bildschirm des Offline-96-Well Platte fraction Sammler. Wenn die beiden Fraktionssammler nicht 100% synchron, manuell vor der Offline-96-Well Platte Fraktionssammler wie die anderen Fraktionssammler Fortschritte auf der zweiten Fraktion Collection Tube.
- Beachten Sie die Echtzeit-Anzeige zu erwartenden Run Parameter zu bestätigen. Gegendruck, Leitfähigkeit und% B (Abbildung 4) sind Parameter, die überwacht werden, um Spalte zu Spalte Reproduzierbarkeit von Lauf zu gewährleisten ausgeführt werden kann. Ventilstellzeit, pH und Probenbeladung sollten ebenfalls überwacht werden. UV-Kurven können im Vergleich zu ähnlichen Flow-Through-Elutionspeaks zu überprüfen.
- Nutzen in-line und Nachlauf Eluatanalyse Techniken, um die Elutionsprofil und Reinigung des Proteins von Interesse (dh "Zielprotein") zu identifizieren.
- Für Proben, die GFP, beobachten Sie die Elution in-line mit dem Protein der einzigartigen UV-Absorption bei 397 nm. Vergleichen Sie die GFP-spezifischen Absorption 397 nm Verfolgung der allgemeinen Protein 280 nm Absorption Tracing zu schätzen relativen Trennungund Reinigung unter Verwendung der verschiedenen Medien die HIC erkundet (Abb. 5).
- Post-run-Analyse der GFP und andere Zielproteine kann durch mehrere Verfahren erreicht werden. Aliquots von 5-50 ul aus den 96-Well-Platte Fraktionen können, um eine frische Platte übertragen werden und im Hinblick auf spezifische Protein-Gehalt durch ELISA oder Western-Blot und Gesamtproteingehalt von jeder Fraktion kann unter Verwendung herkömmlicher SDS-PAGE analysiert werden oder ein Experion Mikrofluidik-Elektrophorese-System. GFP-Fluoreszenz in 12 ml Kulturröhrchen mit UV-Licht (6) detektiert werden.
- Identifizierung der vielversprechendsten HIC Medien können durch Vergleich der Elution GFP relativ zu anderen Proteinen in der Probe enthalten sind, bestimmt. Reinigung mit den vielversprechendsten HIC Medien können dann unter anderen Umständen, zum Beispiel Art und Konzentration der Start-Puffer und pH-Wert optimiert werden.
- Technischer Hinweis: Am Ende des Experiments, platzieren Sie bitte alle Zuleitungen in Puffer B1 (entgastH 2 O) und spülen Sie die Pumpen, Ventile, Schläuche und alles mit Wasser. Folgen den Anweisungen des Herstellers für die Reinigung und langfristige Lagerung von Chromatographie und HIC-Säulen.
6. Repräsentative Ergebnisse:
Vertreter HIC Salzgradienten, Leitfähigkeit, Druck und Spalte der Scouting-Läufe sind in Abbildung 4 dargestellt. Die Veränderung der Salzkonzentration (blaue Linie), wie durch den Prozentsatz der Puffer von High-Salz-Puffer gemessen Linien gezeichnet ist typisch für die HIC-Methodik. Da die Salzkonzentration abnimmt, Proteine an der Säule zu eluieren gebunden. Leitfähigkeit (rote Linie), die zu beachten Salzkonzentration entspricht, wird in-line unmittelbar nach den Quadtec und UV-Detektoren gemessen. Die zwischen Salzgradienten und Leitfähigkeit Kurven Off-Set zeigt die Zeit, Puffer erforderlich, um aus dem Puffer Einlaß finden, durch das System, und die Leitfähigkeit Monitor. Während das Beispiel auszuführen, ter Systemdruck (graue Linien) und pH-Wert relativ konstant bleiben.
Abbildung 5 zeigt Chromatogramme der sequentiellen HIC-Säule Scouting läuft. Die In-Line-Nachweis von Gesamt-Protein (A 280, blaue Linie) und GFP (A 397, grüne Linie) wird durch Messung der Absorption von Licht bei 280 nm und 397 nm erreicht, jeweils. Es ist möglich, etwa die relative Abundanz GFP und Trennung für jeden Lauf Scouting durch Vergleich der beiden Leitungen. GFP der geprüften HIC-Säulen mit einem unterschiedlichen Grad der Affinität und der Elutionsprofil variiert gebunden. Auswahl eines bevorzugten HIC-Säule für die zukünftige Reinigungen wird auf die Identifizierung der Spalte, die die schärfsten GFP Elutionspeak und größte Trennung von anderen Proteinen produziert basiert.
In Abbildung 6 wurden Kulturröhrchen für die Fraktionen 10, 12, 14, 16 und 18 des Phenyl-FF (high sub) Scouting-Lauf unter Umgebungsbedingungen Raum visualisiert werden (fluoreszierend) Licht und ultraViolett (UV) Licht. Die Röhrchen wurden beide Gesichts-Forward (linkes Bild) und top-down (rechte Bilder) angesehen, um die charakteristischen GFP Emissionsspektrum zu beobachten. GFP (grün) zeigt sich deutlich in Fraktion 14 in beiden UV-Bildern erkannt. Diese nach dem Lauf-Daten gut entsprechen der In-Line-Nachweis von GFP durch Messen Eluat Absorption bei 397 nm (A 397, grüne Linie), die auch identifiziert Fraktion 14 als mit dem Hauptpeak der eluierten GFP. Die diffuse blaue in der linken UV-Panel wird Licht von der UV-Lampe emittiert wird.
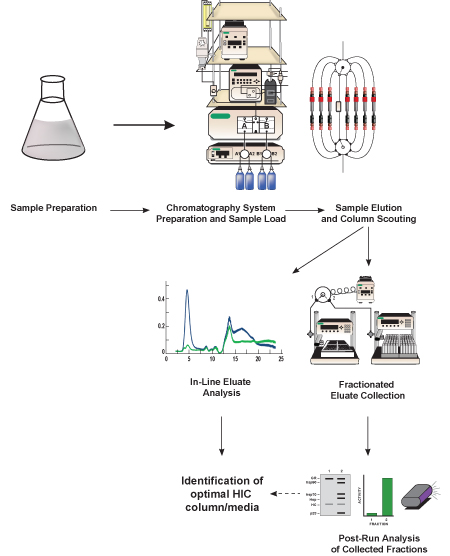
Abbildung 1. Schematische Darstellung dieses Protokolls. Bakterienlysates Protein von Interesse (GFP, Zielproteins) hergestellt, verdünnt in einem Hochsalz-Puffer entspricht der Chromatographie Startpuffernummer und filtriert. Sobald die Flüssigkeit Chromatographie-System hergestellt wird, die Probe geladen und das Zielprotein wird von anderen Proteinen getrennt enthalten in das Lysat unter Verwendung eines hydrophoben Chromatographiemedium in einer abgepackten HIC-Säule enthalten ist. Das Trennverfahren wird mehrere Male mit unterschiedlichen Chromatographiemedien (bezeichnet als Spalte Scouting), um festzustellen, welche Medien das beste GFP Trennung bereitstellt wiederholt. Die eluierten Proteine (Eluat) analysiert, in-line mit Hilfe von Detektoren in der Chromatographie-System enthalten, und es wird in kleinere Fraktionen für die nachfolgende (Nachlauf) Analyse gesammelt. Basierend auf dem in-line und Nachlauf-Analyse der GFP-Aktivität und Trennung, eine optimale HIC-Säule und chromatographischen Mediums identifiziert.
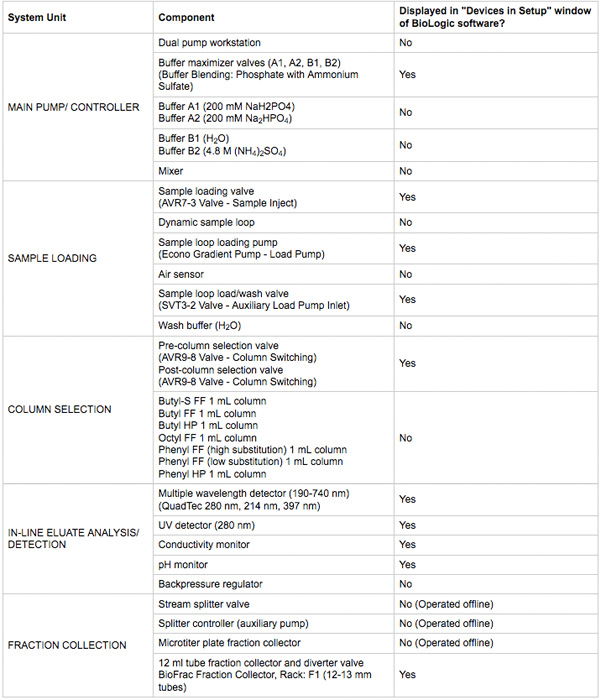
Tabelle 1. Key-Chromatographie-System-Komponenten in diesem Protokoll verwendet.
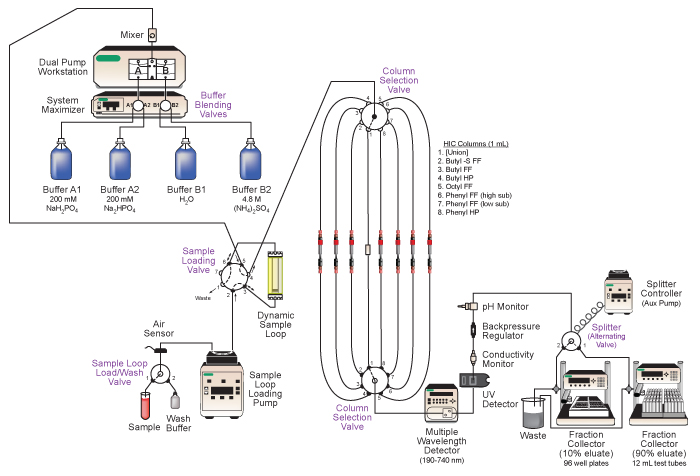
Abbildung 2. Schematische Darstellung der Bio-Rad DuoFlow Mitteldruck-Flüssigkeits-Chromatographie-System eingesetzt. Key Features der systammen umfassen automatisierte-Blending, das Laden der Probe für sequentielle Spalte verläuft, automatische Auswahl von verschiedenen Chromatographiesäulen, Inline-Analyse des Eluats und Tandem-Sammlung des fraktionierten Eluats. Siehe Text und Tabelle 1 für weitere Einzelheiten.
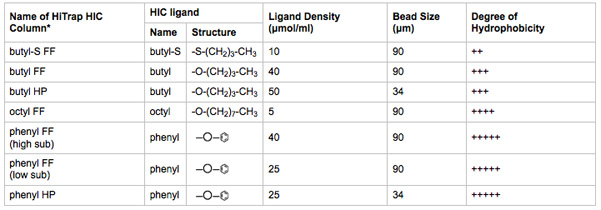
Tabelle 2. Biophysikalischen Eigenschaften von HIC-Medien getestet. Der Name des HiTrap HIC-Säule ist bezeichnend für den Liganden, Ligandendichte und Korngröße.
* FF = schnell; HP = High Performance. Größere Perlgröße Ligandenbindung erhöht Kapazität und Durchsatz. Kleinere Korngröße erhöht chromatographische Auflösung. Informationen aus der Literatur des Herstellers gewonnen.

Abbildung 3. Anschluss von GE Healthcare HiTrap HIC-Säule an Bio-Rad DuoFlow system.To der Upstream 1/4-28 Delrin Mutter einND Zwinge (A1), ein männlicher Luer-zu-Frau-Montage 1/4-28 (B1) und männlichen 1/16 "-zu-Frau-Luer-Anschluss (C) verbunden sind. Die Beschläge sind mit dem HiTrap Spalte, nachdem sie anhängen mit Puffer gespült und mit allen Luftblasen entfernt werden. Die Spalte Auslass ist mit einer weiblichen 1/16 "-zu-Mann M6 Fitting (D) verbunden, männlichen Luer-Fitting für weibliche M6 (E), und weibliche Luer-zu-Frau ein / 4-28 Halterung (B 2). Diese gesamte Anordnung ist mit dem stromabwärtigen 1/4-28 Delrin und Nippel (A 2) verbunden ist. Die obere Graphik zeigt die Armaturen getrennt und die untere Graphik zeigt die Beschläge montiert.
| Schritt # | Volumen (ml) | Beschreibung | Parameter | |
| 1 | 0,00 | Sammeln Sie 1,0 ml Fraktionen während der gesamten Laufzeit | ||
| 2 | 0,00 | Schweizch Spalten | HIC-Säule 1 (Position 2) | |
| 3 | 0,00 | Isokratische Durchfluss | pH-Wert: 6,80 100% B | Volumen: 2,00 ml Flow: 1,00 ml / min |
| 4 | 2,00 | Null-Linie | Quadtec | |
| 5 | 2,00 | Null-Linie | UV-Detektor | |
| 6 | 2,00 | Inject Probe | Sample- Dynamische Wiederholungsmodus | Auto Einspritzventil Volumen: 0,50 ml Flow: 1,00 ml / min |
| 7 | 3,00 | Isokratische Durchfluss | pH-Wert: 6,80 100% B | Volumen: 5,00 ml Flow: 1,00 ml / min |
| 8 | 8,00 | Linearer Verlauf | pH-Wert: 6,80 100% B -> 0% B | Volumen: 10,00 mL Flow: 1,00 ml/ Min |
| 9 | 18,00 | Isokratische Durchfluss | pH-Wert: 6,80 0% B | Volumen: 3,00 ml Flow: 1,00 ml / min |
| 10 | 21,00 | Isokratische Durchfluss | pH-Wert: 6,80 100% B | Volumen: 5,00 ml Flow: 1,00 ml / min |
| 11 | 26,00 | Schalter Spalten | Gewerkschaft (Position 1) | |
| Ende | 26,00 | Ende des Protokolls | Automatisch wiederholt mit 5 zusätzlichen HIC-Säulen (Positionen 3-7) | |
| Scout-Typ | Anzahl der Pisten: 6 | Anzahl der Schritte ausgekundschaftet: 1 | ||
Tabelle 3. BioLogic Software-Protokoll für die HIC-Scouting-Verfahren eingesetzt.

Abbildung 4. Vertreter HIC Salzgradienten, Leitfähigkeit, Druck und Spalte. Da die Salzkonzentration (blaue Linie) sinkt, tut Leitfähigkeit (rote Linie) sowie. Die Offset-Salzgradienten zwischen Leitfähigkeit und Kurven gibt die Zeit für den Puffer erforderlich, um aus dem Puffer Einlass zu dem Leitfähigkeitskontrollgerät finden. Systemdruck (graue Linien) relativ konstant bleibt für die Dauer der Scouting-Lauf.
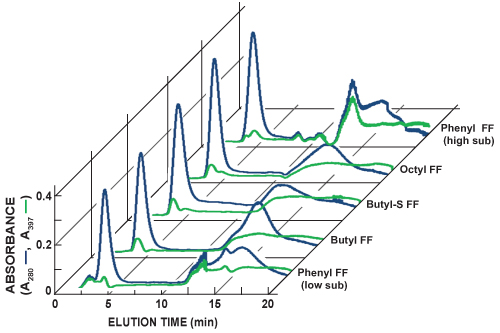
Abbildung 5. Zusammengestellt Chromatogramme von sequentiellen HiTrap HIC-Säule Scouting läuft. Die In-Line-Nachweis von Gesamt-Protein (A 280, blaue Linie) und GFP (A 397, grüne Linie) wird durch Messung der Absorption von Licht bei 280 nm und 397 nm erreicht, jeweils. In dieser Reihe von Experimenten wurde die schärfste GFP Elutionspeak mit dem Phenyl FF (high sub) c beobachtetolumn. Die Phenyl FF (high sub)-Säule schien auch die größte Trennung zwischen GFP und andere Proteine bereitzustellen. Zusätzliche 1 ml HiTrap HIC-Säulen getestet enthalten Phenyl schnellen Strömung geringer Substitution (Phenyl FF (low sub)), Butyl-Fast Flow (Butyl-FF), Butyl-S-Fast-Flow (Butyl-S-FF) und Octyl Fast Flow (Octyl-FF) .
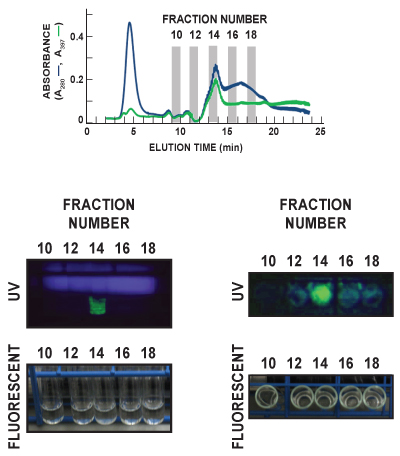
Abbildung 6. Vertreter nach dem Lauf Visualisierung von GFP in Probeneluat. Eluat-Fraktionen wurden mit einer Rate von 1/Minute gesammelt, und jede wurde GFP-Gehalt analysiert. In dieser repräsentativen Figur, waren Kulturröhrchen für die Fraktionen 10, 12, 14, 16 und 18 des Phenyl-FF (high sub) Scouting Lauf visualisiert unter Umgebungsbedingungen Zimmer (fluoreszierend) Licht und Ultraviolett (UV) Licht. Die Röhrchen wurden beide Gesichts-Forward (linkes Bild) und top-down (rechte Bilder) angesehen. Die diffuse blaue in der linken UV-Panel wird Licht von der UV-Lampe emittiert wird. GFP (grün) zeigt sich deutlich in Frac erkannttion 14 in beiden UV-Bildern. Das obere Feld zeigt den Gesamt-Protein (A280, blaue Linie) und GFP (A 397, grüne Linie) Chromatogramm Kurven der 5 Fraktionen als visualisiert.
Diskussion
Flüssigchromatographie Techniken wurden von unschätzbarem Wert zur Herstellung von hoch gereinigten Proteinen notwendig für die Durchführung von immunologischen 6, biochemische 7, 8 und strukturelle Studien nachgewiesen. HIC Reinigungsverfahren meist eine empirische Bestimmung einer bevorzugten Medium und Ligandenstruktur, Ligandendichte, und Matrix Wulst Eigenschaften alle haben gezeigt, dass chromatographischen Ergebnissen 2, 3 auswirken. Automatisierte Spalte Scouting ist ein effizienter Ansatz für die Auswahl eines HIC-Medium für die spätere Optimierung und Reinigung von Proteinen 4. Die automatisierte Spalte Scouting vorgestellte Methode kann leicht an verschiedene HIC Proteinreinigung Strategien angepasst werden. Änderungen der Salzkonzentration, die Wahl von Salz, Salzgradienten und pH-Wert kann weiter zu verbessern Reinigungsbedingungen, und die Wirkungen der Variation dieser wichtigen Parameter wurden bereits 13,14 Bewertung. HIC Eluats, das eine teilweise gereinigte Ziel proteIn kann weiter gereinigt werden unter Verwendung eines komplementären chromatographischen Technik, z. B. Ionenaustauschchromatographie (IEX) oder Gelfiltration / Größenausschlusschromatographie 9,10.
Aufgrund seiner einzigartigen Licht-Absorption und Emission Eigenschaften kann das Elutionsprofil von GFP identifiziert mit In-Line-und Nachlauf Ansätze werden. Zu diesem Zweck kann das Protokoll weiter zur Reinigung von rekombinanten GFP-Fusionsproteine angepasst werden, bei dem eine unabhängige Zielprotein "Tag" mit GFP. GFP-markierten Target-Proteine können mit UV-Licht 11 und unter Verwendung verschiedener chromatographischer Methoden, einschließlich der HIC Reinigungsstrategie oben beschrieben detektiert werden. GFP Reinigung ist auch zu einem pädagogischen Grundnahrungsmittel in Biochemie-Labors für die Lehren der modernen Wissenschaft Techniken Protein 12.
Während grundlegende HIC Proteinreinigung können unter Verwendung eines im wesentlichen weniger robust Chromatographie sy werdenStamm weist die Instrumentierung hier vorgestellten eine Reihe von Vorteilen zur Erlangung günstige Ergebnisse zu unterstützen. Bemerkenswerte Vorteile der Verwendung eines hoch automatisiertes System umfassen die Run-to-Run Zustand Reproduzierbarkeit, Zeitersparnis verbessert, und verringert Chancen für Luft in das System 10 eingeführt werden. System-gesteuerten Puffer Mischung, die durch das System Maximalstelle erleichtert wird, ermöglicht eine erhöhte Konsistenz in Puffer Herstellung und experimentelle Reproduzierbarkeit. Zeichnung genügend Probe in die dynamische Last Probenschleife für alle Scouting läuft weiter eine Übereinstimmung der Probe, die zu jeder Spalte hinzugefügt und ermöglicht es beim sequentiellen läuft ohne Unterbrechung oder automatisch geladen. Kontrollierte Probeninjektion aus der Probenschleife auf die Säule sinkt Variabilität, die bei manueller Beladung Probe auftreten kann. Ein Paar von Spaltenauswahlleitungen Ventile ermöglichen aufeinanderfolgenden Probe läuft, von denen jeder mit einem anderen HIC-Säule, ohne das System replumb. Darstellende mul ti-Wellenlängen-Analyse ist besonders vorteilhaft, wenn das Testen einer Protein mit einer einzigartigen spektrophotometrische Profil. Zusätzlich zu GFP kann Cytochromen, Flavoproteinen und anderen Häm-Proteinen von dieser Technik profitieren. Leitfähigkeit und pH-Überwachungseinrichtungen können für die Überprüfung der Echtzeit experimentellen Bedingungen. Split Bruchteil Eluat Sammlung ermöglicht eine verbesserte Bruchteil Handhabung und ermöglicht die einfache Übertragung für Post-Run Analysemethoden, die eine minimale Probenvolumen (zB ELISA, SDS-PAGE, Western Blot, und Experion Mikrofluidik-Elektrophorese) erfordern. Beim Betrieb der zweiten Fraktionssammler offline erfordert manuelle Synchronisation, ermöglicht es maximale Flexibilität bei der Auswahl Fraktionssammler. Die bedeutendsten Nachteile bei Verwendung eines solchen robusten Chromatographie-System für die HIC-Säule Scouting und Reinigung von Proteinen gehören die Anfangszeit und die Haushaltsausgaben mit Instrument Erwerb und Bedienerschulung assoziiert.
t "> Das hier vorgestellte Protokoll nutzt eine Bio-Rad DuoFlow Chromatographie-System;. aber ebenso robuste Messgeräte anderer Hersteller, wie zB die ÄKTA Avant von GE Healthcare, können ebenfalls verwendet werden und sind in der Lage gleichwertige Ergebnisse sogar vergleichbar Chromatographie-System haben einzigartige Eigenschaften (z. B. Methode der Programmierung Komponente Nomenklatur, der Präferenz des Betreibers und Skalierbarkeit Einschränkungen), die vor Einleitung einer Reinigungsprozedur oder Instrument Erwerb berücksichtigt werden sollten.Offenlegungen
Wählen Chromatographiereagenzien und ergänzende Instrumente wurden von Bio-Rad zur Verfügung gestellt.
Danksagungen
Diese Arbeit wurde vom National Institutes of Health Zuschuss GM086822 und National Science Foundation Großforschungseinrichtungen Instrumentation Grant DBI-0960313 gefördert. Die Autoren bedanken sich bei Dr. danken. Jon Miyake & Donna Hardy (Bio-Rad) und Jennifer Loertscher (Seattle University) für ihre fachliche Unterstützung. Wählen Chromatographiereagenzien und ergänzende Instrumente wurden großzügigerweise von Bio-Rad zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| BioLogic DuoFlow Pathfinder 20 System | Bio-Rad | 7602257 | Inklusive System Maximizer, Mixer, F10-Workstation, AVR7-3 Ventil, Quadtec UV / Vis-Detektor mit Durchflusszelle, BioFrac Fraktionssammler, BioLogic Software und Starter-Kit |
| Avr9-8-Stream-Ventil wählen | Bio-Rad | 7600408 | Hochdruckventil, 9-Port, 8-Stellung, 3500 psi (233 bar) begrenzen, zur Verwendung mit biologischen System DuoFlow |
| Umschaltventil SV3T-2 | Bio-Rad | 7600410 | Magnetventil, 3-Port, 2-Stellung, 30 psi (2 bar) begrenzen, zur Verwendung mit biologischen System DuoFlow |
| Stream-Verteilerventil | Bio-Rad | ||
| Tical LSR = & = parentCategoryGUID 22c495f1-36ff-44a3-9140-ee7e54d0b1ba "target =" _blank "> dynaloop 25 Kit | Bio-Rad | 7500451 | Sliding-Kolben-Probenschleife Kit enthält 25 ml dynaloop Gleitkolben Schleife, dynaloop Teilesatz (# 750-0450) |
| BioFrac Fraktionssammler | Bio-Rad | 7410002 | Zwei Bruchteil col Lektoren eingesetzt |
| BioFrac Mikroplatten-Drop-Kopf-Adapter | Bio-Rad | 7410088 | |
| BioFrac Mikrotiterplatte Adapter | Bio-Rad | & Country = US & lang = de & ProductID = 741-0017 "target =" _blank "> 7410017 | |
| UV-Optik-Modul | Bio-Rad | 7500202 | |
| Halogenlampe | Bio-Rad | < ein target = "_blank"> 7601331 | |
| Econo Gradientenpumpe | Bio-Rad | 7319001 | Gradientenpumpe für Niederdruck-Reinigung von Proteinen, enthält Schläuche und Armaturen-Kit |
| Experion-System | Bio-Rad | bio-rad.com/prd/en/US/adirect/biorad? cmd = BRCatgProductDetail & ProductID = 224301 "target =" _blank "> 7007001 | |
| Experion Pro260 Analysis Kit | Bio-Rad | 7007102 | |
| HiTrap HIC-Säule Auswahl-Kit | GE Healthcare | 28-4110-07 | Inklusive 7 x 1 ml vorgepackte Säulen des HIC Medien für Scouting |
| GE Healthcare-to-Bio-Rad Spalte Armaturen | GE Healthcare | 18111251 und 18111257 |
Referenzen
- Cummins, P. M., O'Connor, B. F. Hydrophobic interaction chromatography. Methods Mol. Biol. 681, 431-437 (2011).
- Nagrath, D., Xia, F., Cramer, S. M. Characterization and modeling of nonlinear hydrophobic interaction chromatographic systems. J. Chromatogr. A. 1218, 1219-1226 (2011).
- To, B. C., Lenhoff, A. M. Hydrophobic interaction chromatography of proteins. IV. Protein adsorption capacity and transport in preparative mode. J. Chromatogr. A. 1218, 427-440 (2011).
- Huddleston, J. G., Wang, R., Lyddiatt, A. On the use of mild hydrophobic interaction chromatography for "method scouting" protein purification strategies in aqueous two-phase systems: a study using model proteins. Biotechnol Bioeng. 44, 626-635 (1994).
- Arun, K. H., Kaul, C. L., Ramarao, P. Green fluorescent proteins in receptor research: an emerging tool for drug discovery. J. Pharmacol. Toxicol. Methods. 51, 1-23 (2005).
- Terrizzi, S. C., Banh, C., Brossay, . L.A Protocol for the Production of KLRG1 Tetramer. J. Vis. Exp. (35), e1701-e1701 (2010).
- Murphy, P. J. M., Morishima, Y., Kovacs, J. J., Yao, T. P., Pratt, W. B. Regulation of the dynamics of hsp90 action on the glucocorticoid receptor by acetylation/deacetylation of the chaperone. J. Biol. Chem. 280, 33792-33799 (2005).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 Magnetosome Associated Protein MamAΔ41. J. Vis. Exp. (37), 10-3791 (2010).
- Kong, Y., Li, X., Bai, G., Ma, G., Su, Z. An automatic system for multidimensional integrated protein chromatography. J. Chromatogr. A. 1217, 6898-6904 (2010).
- Camper, D. V., Viola, R. E. Fully automated protein purification. Anal. Biochem. 393, 176-181 (2009).
- Hammon, J., Palanivelu, D. V., Chen, J., Patel, C., Minor, D. L. A green fluorescent protein screen for identification of well-expressed membrane proteins from a cohort of extremophilic organisms. Protein Sci. 18, 121-133 (2009).
- Wu, Y. Using green and red fluorescent proteins to teach protein expression, purification, and crystallization. Biochem. Mol. Biol. Educ. 36, 43-54 (2008).
- Queiroz, J. A., Tomaz, C. T., Cabral, J. M. Hydrophobic interaction chromatography of proteins. J. Biotechnol. 87, 143-159 (2001).
- McCue, J. T. Theory and use of hydrophobic interaction chromatography in protein purification applications. Methods Enzymol. 463, 405-414 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten