Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La purificación de Hsp104, una proteína Disaggregase
En este artículo
Resumen
Aquí se describe un protocolo para la purificación de gran actividad Hsp104, un AAA hexameric + proteína de la levadura, que se acopla la hidrólisis de ATP con el desglose de proteínas. Este esquema se aprovecha de una construcción de His6-etiquetados para la purificación de afinidad de E. coli Seguido por cromatografía de intercambio aniónico, His6-tag con la eliminación de la proteasa TEV, y la cromatografía de exclusión por tamaño.
Resumen
Hsp104 es un hexameric AAA + proteína 1 de la levadura, que se acopla la hidrólisis del ATP a la proteína de desagregación 2-10 (Fig. 1). Esta actividad se imparte dos ventajas selectivas clave. En primer lugar, la renaturalización de los agregados desordenados por Hsp104 faculta la supervivencia de hongos después de varios mal plegamiento de proteínas, destaca, como golpe de calor 3,5,11,12. En segundo lugar, la remodelación de las fibrillas de amiloide-beta cruzada por Hsp104 permite a la levadura para explotar miles de priones (amiloides infecciosas) como un reservorio de beneficios y las variaciones hereditarias fenotípica 13-22. Sorprendentemente, Hsp104 directamente remodelaciones oligómeros preamyloid y fibrillas de amiloide, incluyendo los que forman parte de las proteínas de priones de levadura Sup35 y 23-30 Ure2. Esta funcionalidad-amiloide remodelación es una faceta especializada de la levadura Hsp104. La E. orthologue coli, CLPB, no oligómeros preamyloid remodelar o fibrillas de amiloide 26,31,32.
Ortólogos Hsp104 se encuentran en todos los reinos de la vida, excepto, sorprendentemente, los animales. En efecto, si las células animales poseen un sistema enzimático que desglose las parejas de proteínas para la renaturalización (en lugar de la degradación) sigue siendo desconocido 33-35. Por lo tanto, nosotros y otros han propuesto que Hsp104 podría ser desarrollado como un agente terapéutico para diversas enfermedades neurodegenerativas relacionadas con el mal plegamiento de proteínas específicas en oligómeros preamyloid tóxicos y fibrillas de amiloide 4,7,23,36-38. No existen tratamientos que afectan directamente a las especies agregados asociados a estas enfermedades. Sin embargo, se disuelve Hsp104 oligómeros tóxicos y fibrillas de amiloide compuesto de alfa-sinucleína, que se relacionan con la enfermedad de Parkinson 23, así como las formas de PrP-amiloide 39. Es importante destacar que Hsp104 reduce la agregación de proteínas y mejora la neurodegeneración en modelos de roedores de la enfermedad de Parkinson y la enfermedad de Huntington 23 38. Lo ideal sería que, para optimizar el tratamiento y minimizar los efectos secundarios, Hsp104 sería diseñado y potenciado para remodelar de forma selectiva agregados específicos en el centro de la enfermedad en cuestión 4,7. Sin embargo, la limitada comprensión estructural y mecánica de cómo Hsp104 desagrega un repertorio diverso de las estructuras de agregados y proteínas no relacionadas frustra los esfuerzos 30,40-42.
Para comprender la estructura y el mecanismo de Hsp104, es esencial para el estudio de la proteína pura y reconstituir su actividad disaggregase con un mínimo de componentes. Hsp104 es una proteína con un pI 102kDa de ~ 5.3, que hexamerizes en presencia de ADP o ATP, o en las concentraciones de proteínas en ausencia de nucleótidos 43-46. Aquí se describe un protocolo optimizado para la purificación de la muy activa, estable Hsp104 de E. coli. El uso de E. coli permite simplificar en gran escala de producción y nuestro método se puede realizar de forma rápida y fiable para numerosos Hsp104 variantes. Nuestro protocolo aumenta Hsp104 pureza y simplifica 6-Su etiqueta de la eliminación en comparación con un método de purificación previa de E. coli 47. Por otra parte, el protocolo es más fácil y conveniente de dos protocolos más recientes 26,48.
Protocolo
1. Expresión de Hsp104
- El plásmido utilizado para la purificación de E. coli, pPROEX-HTB-Hsp104, contiene el Hsp104 abierto marco de lectura bajo el control inducible del promotor trc 26. El plásmido produce con su Hsp104 un N-terminal 6-etiqueta que se puede quitar por escisión de la proteasa TEV. Transformar pPROEX-HTB-Hsp104 en el codón-optimizado E. coli BL21-CodonPlus-RIL células (Stratagene, Agilent Technologies) mediante un procedimiento típico de la transformación bacteriana (por ejemplo, de acuerdo con las instrucciones del fabricante). Es importante usar un codón de E. optimizado coli cepa Hsp104 porque tiene un sesgo codón inusual.
- Inocular un cultivo de 100 ml 2XYT (Receta USB.: 16 g / L de caseína peptona, 10 g / L de extracto de levadura, 5 g / l de NaCl, pH 7,0) suplementado con ampicilina y 100μg/mL 34μg/mL cloranfenicol con transformantes fresca y crecer durante la noche a 37 ° C con agitación a 200 rpm.
- Inocular 10 ml de la cultura durante la noche en 6 X 1L 2XYT 100μg/mL con ampicilina y el cloranfenicol 34μg/mL en frascos de 2 litros. Agitar a 250rpm a 37 ° C hasta 600 OD = desde 0.4 hasta 0.6. Dejar de temblar y reducir la temperatura a 15 ° C. Permiten a las células para equilibrar no agitado durante 30 minutos en la incubadora hasta que llega a 15 ° C. Una vez que 15 ° C se alcanza induce la expresión de proteínas mediante la adición de IPTG a una concentración final de 1mM. Reanudar agitación a 250rpm durante la noche (16.12 horas).
2. Lisis de células y
- Las células por centrifugación de la cosecha (en un rotor de pre-enfriado) a 4.000 rpm durante 20 minutos a 4 ° C (se utiliza una centrífuga Sorvall RC 3BP +). Los pasos siguientes deben realizarse inmediatamente, porque Hsp104 actividad se ve disminuida cuando E. células de E. coli están congelados. Por otra parte, todos los pasos posteriores se deben realizar en hielo oa 4 º C.
- Resuspender pellets de células en preenfriado (en hielo) de 10 ml buffer de lisis (40 mm de HEPES-KOH pH 7,4, KCl 500 mm, 20 mm MgCl 2, 2,5% (w / v) de glicerol, 20 mM imidazol, pepstatina 5μM A, cóctel completo inhibidor de la proteasa (1 EDTA sin tablet/50mL), y 2 mM β-mercaptoetanol).
- Lisis de las células con una francesa de prensa (Emulsiflex) homogeneizador que utiliza un intercambiador de calor sumergido en agua helada. Antes de su uso, asegurar que todos los grupos de células se han solubilizado. Después de equilibrar homogeneizador con tampón de lisis, dos pasadas por el cilindro con una presión de 15,000-18,000 psi es suficiente para la lisis completa. Si la prensa francesa no está disponible, la incubación con lisozima seguido por ultrasonidos se puede utilizar (véase la discusión). Guardar una pequeña muestra de células lisadas para el análisis de SDS-PAGE (1μL) (lisado en la fig. 2).
- Retirar los restos celulares por centrifugación a 16.000 rpm durante 20 minutos a 4 ° C (se utiliza un RC5C Sorvall centifuge +). Conservar el sobrenadante para el próximo paso y salvar una pequeña muestra (1μL) del sobrenadante para análisis SDS-PAGE (Carga Ni en la fig. 2).
3. Hsp104 Purificación
- Mezcla de sobrenadante del paso 2.4 con 12 ml (2 ml de Ni-Sepharosa cuentas por 1 litro de células) del 50% mezcla de tampón de lisis equilibrado Sepharose Ni-cuentas (GE).
- Rotar la muestra lentamente durante 3 horas a 4 ° C de tal manera que Ni-Sepharose queda flotante y espuma se reduce al mínimo. Reducción de los tiempos de incubación son posibles, pero se reducirá el rendimiento. A 4 ° C en presencia de inhibidores de la proteasa, se produce muy poca degradación, y tres horas de Ni-Sepharose tiempo de incubación no disminuye la actividad del producto final. Recoger Ni-Sepharose por centrifugación durante 2 min a 4 ° C a 2.000 rpm (Eppendorf 5810R centrífuga). Guardar una pequeña muestra de sobrenadante para análisis SDS-PAGE (1μL) y desechar el resto (de flujo a través Ni (FT) en la fig. 2).
- Lave el recuperado Ni-Sepharose con 25 volúmenes de columna de tampón de lavado (40 mm HEPES-KOH pH 7,4, 150 mM KCl, 20 mM MgCl 2, 2,5% (w / v) de glicerol, 20 mM imidazol, 2 mM β-mercaptoetanol), 5 volúmenes de columna de tampón de lavado con KCl 1M para eliminar los contaminantes vinculados a Hsp104 electrostáticamente, y 25 volúmenes de columna de tampón de lavado. Recoger Ni-Sepharose después de cada lavado por centrifugación durante 2 min a 4 ° C a 2.000 rpm (Eppendorf 5810R centrífuga). Después de cada ciclo de lavado y centrifugación, eliminar tampón por aspiración.
- Para eluir Hsp104, mezcla de Ni-Sepharosa con tampón de elución de 1 ml (40 mm de HEPES-KOH pH 7,4, 150 mM KCl, 20 mM MgCl 2, 2,5% (w / v) de glicerol, 350mm imidazol, 2 mM β-mercaptoetanol) por 1 ml de Ni-Sepharose y girar a 4 ° C durante 20 minutos. La alta concentración de imidazol interrumpe el cordón de Ni-Su 6 interacción. Quitar Ni-Sepharose con columnas vacías 1,2 mL giro (Bio-Rad) por centrifugación durante 2 min a 4 ° C a 2.000 rpm (Eppendorf 5810R centrífuga). Guardar 1μL de eluido de análisis SDS-PAGE (eluido Ni en la fig. 2). Por cada litro de células, ~ 15 mg de Hsp104 se obtiene en este paso.
- Buffer eluido cambio en Q Buffer (20 mM Tris-HCl pH 8, 0,5 mM EDTA, 5 mM MgCl2, 50 mM NaCl) con MWCO 30.000 Amicon Ultra (Millipore) 15 ml unidades concentrador centrífugo. En primer lugar, concentrado de proteína de ~ 1,5 ml a continuación, añadir 14.5mL de Buffer Q para diluir la proteína de 10 veces. Repita 3 veces para el intercambio de buffer. El aumento del pH y baja en sal asegura que Hsp104 tiene una alta carga negativa.
- Purificar Hsp104 a través de cromatografía de intercambio aniónico con una memoria intermedia de Q de recursos equilibrada Q columna de 6 ml (GE). Antes de la inyección, la proteína se filtra a través de una baja en proteínas de unión Millex GP PES membrana 0.22μM filtro de jeringa (Millipore). Contamos con un caudal de 1mL/min. Lavar débilmente las proteínas de unión con el volumen de la columna 1 del 20% de búfer Q + (20 mM Tris-HCl pH 8, 0,5 mM EDTA, 5 mM de MgCl 2, 1 M NaCl). Eluir Hsp104 con gradiente lineal (20% -50% de búfer Q +) en 5 volúmenes de columna (Fig. 3). Recoger fracciones de 1 ml. Hsp104 y las variantes más típicamente eluyen a ~ 400 mm de NaCl (31mS/cm). Guardar las muestras de las fracciones de pico (1μL) para análisis SDS-PAGE (Fig. 3, recuadro).
- Para quitar 6-Su etiqueta, proteína de intercambio con el concentrador Amicon centrífuga como se describe anteriormente (véase el paso 3.5) en división de amortiguación (20 mM HEPES-KOH pH 7,4, KCl 140 mm y 10 mm MgCl 2). Use proTEV proteasa (Promega) o AcTEV de la proteasa (Invitrogen) de acuerdo con las instrucciones del fabricante. Para Hsp104, hemos encontrado que el aumento de las proporciones de la proteasa TEV: Hsp104 se requieren para la escisión completa. Nosotros usamos una proporción de 1 por unidad de la proteasa 12μg Hsp104. División se debe realizar a 30 ° C durante 2-4 horas, seguido de una incubación de 16 horas a 4 ° C. La concentración final de Hsp104 debe estar entre 20-75μM monómero. Agotan los restantes Hsp104 His6 marca y la proteasa TEV con Ni-Sepharose (GE) mediante la adición de Ni-Sepharose en exceso a la cantidad de Hsp104 en la división de reacción (suponiendo que cuentas se puede unir 15 mg de proteína por ml de resina de relleno). Eliminar las perlas con columnas de centrifugado vacío (Bio-Rad) por centrifugación durante 2 minutos a 2.000 rpm a 4 ° C. Recoger muestras antes y después de la escisión (1μL) para el análisis de SDS-PAGE para asegurar la división, y la eliminación de proteínas uncleaved (Fig. 4).
- Cambio en el tamaño del buffer de exclusión (20 mM HEPES-KOH pH 7,4, KCl 140 mm, 10 mm MgCl 2, 0,1 mM EDTA, 1 mM DTT) con MWCO 30.000 Amicon Ultra (Millipore) como se describe en el paso 3.5.
- Además Hsp104 purificar por cromatografía de exclusión por tamaño. Uso de exclusión por tamaño Superose buffer equilibrado 6 o columna Superdex 200 (ambos de GE) (Fig. 5). Antes de la inyección, la proteína se filtra a través de una baja en proteínas de unión Millex GP PES membrana 0.22μM filtro de jeringa (Millipore). Por menos de 10 mg de proteína, el tamaño de las columnas 10/300 (24ml) se pueden utilizar y las fracciones de 0,5 ml se recogen. Para las muestras superiores a 10 mg, la columna de tamaño 12/60 (120 ml) debe ser utilizado y fracciones de 1 ml se recogen. Consulte las instrucciones del fabricante para los caudales y volúmenes de muestra para ser cargado. Después de la purificación, las fracciones Hsp104 se agrupan como se muestra en la figura. 5 y se concentró en las unidades de concentrador centrífugo Amicon (Millipore). Hsp104 se almacena como se describe a continuación. Debido a la pérdida de material en la separación de Hsp104 productos de degradación y los contaminantes del rendimiento final de purificado de larga duración Hsp104 es de ~ 1-3mg por litro a partir de la cultura.
4. Hsp104 Disaggregase Actividad
- Después de la purificación, es una buena práctica para evaluar Hsp104 actividad en un ensayo de disgregación. Por lo general, utilizamos un ensayo de reactivación de la luciferasa 2 (Fig. 6). En este ensayo, Hsp104 en conjunto con el sistema de chaperonas Hsp70 (Hsp70 y Hsp40) desagrega desnaturalizado urea-agregados luciferasa de luciérnaga 2. Luciferasa soluble cataliza la oxidación de la luciferina a oxyluciferin, una reacción que libera la luz. Por luminiscencia de vigilancia, la reactivación relativa, y la desagregación por lo tanto, de la luciferasa se puede determinar. Hsp104 debe ser capaz de colaborar de forma sinérgica con la co-chaperona Hsp70 sistema. La cantidad de luminiscencia recuperado depende de la exacta Hsp70: par Hsp40 utilizado. Nosotros habitualmente emplean Hsp72 y Hsp40 (diseño del ensayo). Como mínimo, los activos Hsp104 debería producir un aumento de 5 veces en la reactivación de la luciferasa en comparación con la reactivación de Hsp72: Hsp40 sola (Fig. 6). Hsp104 preparaciones que no llegan a este nivel de actividad se descartan.
5. Hsp104 de almacenamiento
- Para almacenamiento a corto plazo, Hsp104 pueden mantenerse a 4 ° C en tampón de exclusión por tamaño. Sin embargo, la actividad se reducirá después de 2-3 días a 4 ° C y bruscamente después de una semana a 4 ° C. Para los ensayos de disgregación se recomienda Hsp104 debe ser utilizado tan pronto como sea posible después de la purificación. Lo ideal sería que Hsp104 debe utilizarse inmediatamente para los ensayos de desagregación amiloide.
- Si la proteína se debe almacenar a largo plazo, Hsp104 se intercambia en el buffer de almacenamiento (20 mM HEPES-KOH pH 7,4, KCl 140 mm, 10 mm MgCl 2, 0,1 mM EDTA, 1 mM TDT, el 10% de glicerol (w / v)). Alícuotas de 100μl se congelaron en nitrógeno líquido y almacenadas a -80 ° C. Ciclos de congelación-descongelación reducir drásticamente la actividad Hsp104y debe ser evitado. Se recomienda descongelar lentamente Hsp104 en el hielo. Amiloide disaggregase actividad disminuirá bruscamente después de un mes a -80 ° C.
6. Los resultados representativos y cifras:
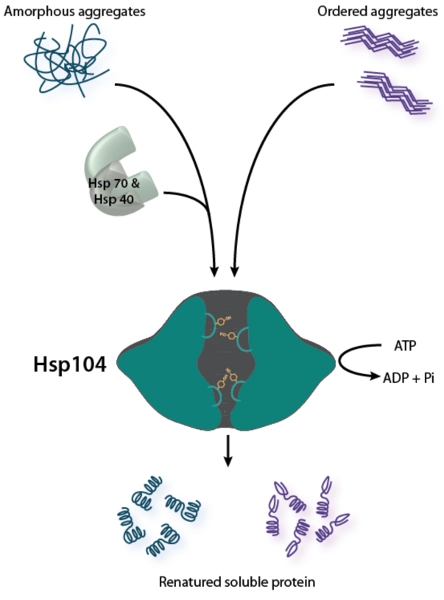
Figura 1. Hsp104 es un disaggregase bifuncionales. Desagregación de los agregados desordenados (que se muestra a la izquierda) se requiere la cooperación del sistema de chaperona Hsp70 (Hsp70 y Hsp40) 2. Remodelaciones Hsp104 ordenó agregados amiloides (como se muestra a la derecha) sin la ayuda de Hsp70 y Hsp40 in vitro, pero Hsp70 y Hsp40 puede mejorar Hsp104 actividad contra amiloide 26,28. Para ambos tipos de estructuras agregadas, Hsp104 parejas hidrólisis de ATP a la translocación del sustrato a través de su canal central para promover la desagregación. Tirosina-teniendo lazos de poro participar y el sustrato de transporte a través del canal central 49-52.

Figura 2. SDS-PAGE análisis de Ni-sefarosa etapa de purificación de afinidad. Lisado, carga Ni, Ni FT y las muestras Ni eluido se fraccionaron por SDS-PAGE con un 20.4% Tris-HCl 1,0 Criterio gel (Bio-Rad) y se tiñeron con Coomassie . Tenga en cuenta que no todos los Hsp104 es capaz de unirse a la Ni-sefarosa. Amplia gama de marcadores de peso molecular (Bio-Rad) se muestran (carril de la izquierda).
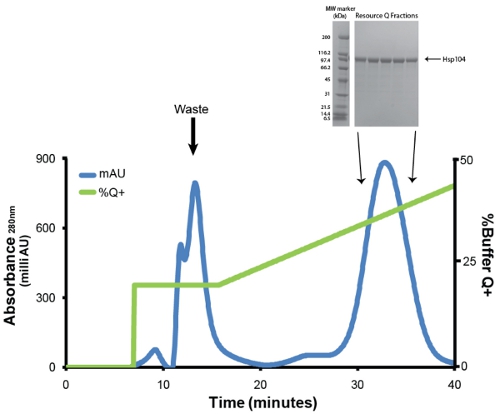
Figura 3. Recursos de purificación Q de Ni-sefarosa eluido. Rastro azul representa la absorbancia a 280 nm rastro y el verde representa buffer% Q + (máximo del 50%). El primer pico que eluye a 20% Q + contiene impurezas, productos de degradación y mal doblada Hsp104. El segundo pico y las principales contiene plegada correctamente y activa Hsp104. Caudal fue 1ml/min. Gradiente de 20 a 50% Q + es de 30 minutos o 5 volúmenes de columna. Recuadro: fracciones de los picos son resueltas por SDS-PAGE análisis utilizando un 4-20% Tris-HCl 1,0 Criterio gel (Bio-Rad) y se tiñeron con Coomassie. Amplia gama de marcadores de peso molecular (Bio-Rad) se muestran (izquierda).

Figura 4. SDS-PAGE análisis de paso proTEV escisión de la proteasa. 6-Su Hsp104 de Recursos purificación Q fue tratada con proteasa proTEV durante 4 horas a 30 ° C y luego 16 horas a 4 ° C. Las muestras fueron fraccionadas por SDS-PAGE con un 4-20% Tris-HCl 1,0 Criterio gel (Bio-Rad) y se tiñeron con Coomassie. Tenga en cuenta que proTEV escinde Hsp104 migra más rápidamente. VET proteasa y uncleaved Hsp104 se han agotado con Ni-Sepharose como se describe en el Paso 3.7. Amplia gama de marcadores de peso molecular (Bio-Rad) se muestran (izquierda).
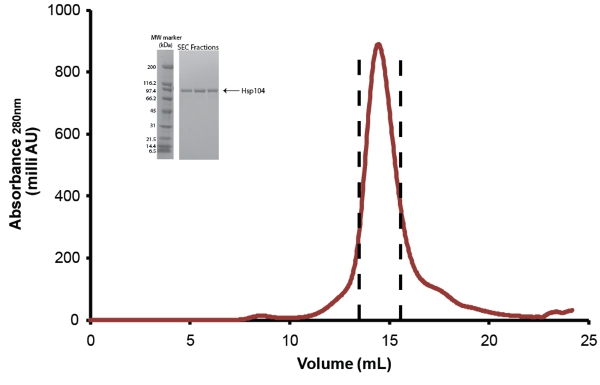
Figura 5. De exclusión por tamaño de purificación de Hsp104. Escinde Hsp104 fue purificado a través de un Superose 6 columna de filtración en gel (10/300, GE). Caudal = 0.4ml/min. El pico entre las líneas de trazos representa fracciones reunidas. Recuadro: fracciones de los picos son resueltas por SDS-PAGE análisis utilizando un 4-20% Tris-HCl 1,0 Criterio gel (Bio-Rad) y se tiñeron con Coomassie. Amplia gama de marcadores de peso molecular (Bio-Rad) se muestran (izquierda).
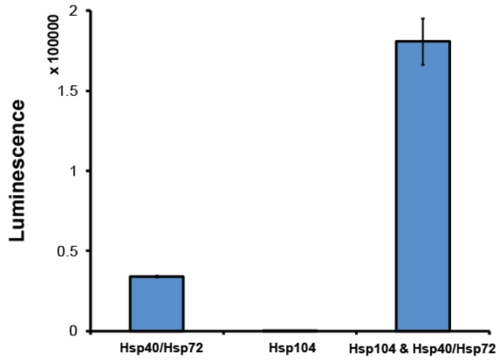
Figura 6. Ensayo de reactivación de la luciferasa. Desnaturalizado agregados luciferasa de luciérnaga (50nm) se incubaron con Hsp72 y Hsp40 (1μM) (ambos de los diseños de ensayo), Hsp104 (6μM monómero) o Hsp104, Hsp72 y Hsp40 de 90 minutos a 25 ° C. Luciferasa desnaturalizado sólo es plenamente reactivada en la presencia de ambos Hsp104 y Hsp40/Hsp72. Luminiscencia recuperado se mide en un lector de placas M1000 Infinito (Tecan). Los valores representan la media ± SEM (n = 3).
Discusión
Cronología: Para la máxima actividad Hsp104 se recomienda que el esquema de purificación se complete toda la mayor rapidez posible. Sin embargo, el número de etapas de purificación hace un exigente calendario que no siempre es práctico. Si las etapas de purificación se lleva a cabo lo más rápidamente posible, el tiempo desde el final de la expresión a través de la noche a la 02.04 horas de incubación a 30 ° C con TEV proteasa es de aproximadamente 9-11 horas. Un lugar potencial para hacer una pausa e...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por una subvención del NIH (5T32GM008275-22) y la American Heart beca predoctoral Asociación (a EAS), un interfaz química-biología beca del NIH (2T32GM071339-06A1) (a MED), y subvenciones de la NIH (1DP2OD002177-01 y NS067354 0110), la Ellison Medical Foundation y la Fundación Bill y Melinda Gates (a JS).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
|---|---|---|---|
| BL21-CodonPlus-RIL células competentes | Stratagene, Agilent Technologies | 230255 | |
| 2XYT caldo | USB | 75864 | |
| Completo, minibar, EDTA libre de tabletas de inhibidores de la proteasa | Roche | 1836170 | |
| A pepstatina | Sigma | P4265 | |
| Ni-Sepharose 6 Fast Flow | GE Healthcare | 17-5318-02 | |
| Amicon Ultra-15 unidades centrífugas filtro (MWCO 30.000) | Millipore | UFC903008 | |
| Recursos Q - columna 6 ml | GE Healthcare | 17-1179-01 | |
| proTEV de la proteasa | Promega | V6052 | |
| AcTEV de la proteasa | Invitrogen | 12575015 | |
| Superose 6 10/300 GL | GE Healthcare | 17-5172-01 | |
| Hsp40 | Diseño del ensayo | SPP-400 | |
| Hsp72 | Diseño del ensayo | ADI-NSP-555 |
Referencias
- Erzberger, J. P., Berger, J. M. Evolutionary relationships and structural mechanisms of AAA+ proteins. Annu Rev Biophys Biomol Struct. 35, 93-114 (2006).
- Glover, J. R., Lindquist, S. Hsp104, Hsp70, and Hsp40: A Novel Chaperone System that Rescues Previously Aggregated Proteins. Cell. 94, 73-82 (1998).
- Parsell, D. A., Kowal, A. S., Singer, M. A., Lindquist, S. Protein disaggregation mediated by heat-shock protein Hsp104. Nature. 372, 475-478 (1994).
- Vashist, S., Cushman, M., Shorter, J. Applying Hsp104 to protein-misfolding disorders. Biochem Cell Biol. 88, 1-13 (2010).
- Parsell, D. A., Sanchez, Y., Stitzel, J. D., Lindquist, S. Hsp104 is a highly conserved protein with two essential nucleotide-binding sites. Nature. 353, 270-273 (1991).
- Doyle, S. M., Wickner, S. Hsp104 and ClpB: protein disaggregating machines. Trends Biochem Sci. 34, 40-48 (2009).
- Shorter, J. Hsp104: a weapon to combat diverse neurodegenerative disorders. Neurosignals. 16, 63-74 (2008).
- Glover, J. R., Lum, R. Remodeling of protein aggregates by Hsp104. Protein Pept Lett. 16, 587-597 (2009).
- Mogk, A., Haslberger, T., Tessarz, P., Bukau, B. Common and specific mechanisms of AAA+ proteins involved in protein quality control. Biochem Soc Trans. 36, 120-125 (2008).
- Grimminger-Marquardt, V., Lashuel, H. A. Structure and function of the molecular chaperone Hsp104 from yeast. Biopolymers. 93, 252-276 (2010).
- Sanchez, Y., Lindquist, S. L. HSP104 required for induced thermotolerance. Science. 248, 1112-1115 (1990).
- Sanchez, Y., Taulien, J., Borkovich, K. A., Lindquist, S. Hsp104 is required for tolerance to many forms of stress. Embo J. 11, 2357-2364 (1992).
- Alberti, S., Halfmann, R., King, O., Kapila, A., Lindquist, S. A systematic survey identifies prions and illuminates sequence features of prionogenic proteins. Cell. 137, 146-158 (2009).
- Halfmann, R., Alberti, S., Lindquist, S. Prions, protein homeostasis, and phenotypic diversity. Trends Cell Biol. 20, 125-1233 (2010).
- Shorter, J., Lindquist, S. Prions as adaptive conduits of memory and inheritance. Nat Rev Genet. 6, 435-450 (2005).
- True, H. L., Berlin, I., Lindquist, S. L. Epigenetic regulation of translation reveals hidden genetic variation to produce complex traits. Nature. 431, 184-187 (2004).
- True, H. L., Lindquist, S. L. A yeast prion provides a mechanism for genetic variation and phenotypic diversity. Nature. 407, 477-483 (2000).
- Tyedmers, J., Madariaga, M. L., Lindquist, S. Prion switching in response to environmental stress. PLoS Biol. 6, e294-e294 (2008).
- Chernoff, Y. O., Lindquist, S. L., Ono, B., Inge-Vechtomov, S. G., Liebman, S. W. Role of the chaperone protein Hsp104 in propagation of the yeast prion-like factor [psi+]. Science. 268, 880-884 (1995).
- Halfmann, R., Lindquist, S. Epigenetics in the extreme: prions and the inheritance of environmentally acquired traits. Science. 330, 629-632 (2010).
- Satpute-Krishnan, P., Langseth, S. X., Serio, T. R. Hsp104-dependent remodeling of prion complexes mediates protein-only inheritance. PLoS Biol. 5, e24-e24 (2007).
- Sweeny, E. A., Shorter, J. Prion proteostasis: Hsp104 meets its supporting cast. Prion. 2, 135-140 (2008).
- Lo Bianco, C. Hsp104 antagonizes alpha-synuclein aggregation and reduces dopaminergic degeneration in a rat model of Parkinson disease. J Clin Invest. 118, 3087-3097 (2008).
- Narayanan, S., Walter, S., Reif, B. Yeast prion-protein, sup35, fibril formation proceeds by addition and substraction of oligomers. Chembiochem. 7, 757-765 (2006).
- Savistchenko, J., Krzewska, J., Fay, N., Melki, R. Molecular chaperones and the assembly of the prion Ure2p in vitro. J Biol Chem. 283, 15732-15739 (2008).
- Shorter, J., Lindquist, S. Hsp104 catalyzes formation and elimination of self-replicating Sup35 prion conformers. Science. 304, 1793-1797 (2004).
- Shorter, J., Lindquist, S. Destruction or potentiation of different prions catalyzed by similar Hsp104 remodeling activities. Mol Cell. 23, 425-438 (2006).
- Shorter, J., Lindquist, S. Hsp104, Hsp70 and Hsp40 interplay regulates formation, growth and elimination of Sup35 prions. Embo J. 27, 2712-2724 (2008).
- Doyle, S. M. Asymmetric deceleration of ClpB or Hsp104 ATPase activity unleashes protein-remodeling activity. Nat Struct Mol Biol. 14, 114-122 (2007).
- Wendler, P. Atypical AAA+ subunit packing creates an expanded cavity for disaggregation by the protein-remodeling factor Hsp104. Cell. 131, 1366-1377 (2007).
- Hinault, M. P. Stable alpha-synuclein oligomers strongly inhibit chaperone activity of the Hsp70 system by weak interactions with J-domain co-chaperones. J Biol Chem. 285, 38173-38182 (2010).
- Tipton, K. A., Verges, K. J., Weissman, J. S. In vivo monitoring of the prion replication cycle reveals a critical role for Sis1 in delivering substrates to Hsp104. Mol Cell. 32, 584-591 (2008).
- Bieschke, J., Cohen, E., Murray, A., Dillin, A., Kelly, J. W. A kinetic assessment of the C. elegans amyloid disaggregation activity enables uncoupling of disassembly and proteolysis. Protein Sci1. 8, 2231-2241 (2009).
- Cohen, E., Bieschke, J., Perciavalle, R. M., Kelly, J. W., Dillin, A. Opposing activities protect against age-onset proteotoxicity. Science. 313, 1604-1610 (2006).
- Cohen, E. Reduced IGF-1 signaling delays age-associated proteotoxicity in mice. Cell. 139, 1157-1169 (2009).
- Cushman, M., Johnson, B. S., King, O. D., Gitler, A. D., Shorter, J. Prion-like disorders: blurring the divide between transmissibility and infectivity. J Cell Sci. 23, 1191-11201 (2010).
- Carmichael, J. Bacterial and yeast chaperones reduce both aggregate formation and cell death in mammalian cell models of Huntington's disease. Proc Natl Acad Sci. 97, 9701-9705 (2000).
- Vacher, C., Garcia-Oroz, L., Rubinsztein, D. C. Overexpression of yeast hsp104 reduces polyglutamine aggregation and prolongs survival of a transgenic mouse model of Huntington's disease. Hum Mol Genet. 14, 3425-3433 (2005).
- Liu, Y. H. Heat Shock Protein 104 Inhibited the Fibrillization of Prion Peptide 106-126 and Disassembled Prion peptide 106-126 Fibrils in vitro. Int J Biochem Cell Biol. , (2011).
- Wendler, P., Saibil, H. R. Cryo electron microscopy structures of Hsp100 proteins: crowbars in or out. Biochem Cell Biol. 88, 89-96 (2010).
- Wendler, P. Motor mechanism for protein threading through Hsp104. Mol Cell. 34, 81-92 (2009).
- Lee, S., Sielaff, B., Lee, J., Tsai, F. T. CryoEM structure of Hsp104 and its mechanistic implication for protein disaggregation. Proc Natl Acad Sci. 107, 8135-8140 (2010).
- Parsell, D. A., Kowal, A. S., Lindquist, S. Saccharomyces cerevisiae Hsp104 protein. Purification and characterization of ATP-induced structural changes. J Biol Chem. 269, 4480-4487 (1994).
- Schirmer, E. C., Queitsch, C., Kowal, A. S., Parsell, D. A., Lindquist, S. The ATPase activity of Hsp104, effects of environmental conditions and mutations. J Biol Chem. 273, 15546-15552 (1998).
- Schirmer, E. C., Ware, D. M., Queitsch, C., Kowal, A. S., Lindquist, S. L. Subunit interactions influence the biochemical and biological properties of Hsp104. Proc Natl Acad Sci. 98, 914-919 (2001).
- Hattendorf, D. A., Lindquist, S. L. Cooperative kinetics of both Hsp104 ATPase domains and interdomain communication revealed by AAA sensor-1 mutants. EMBO J. 21, 12-21 (2002).
- Schirmer, E. C., Lindquist, S. Purification and properties of Hsp104 from yeast. Methods Enzymol. 290, 430-444 (1998).
- Hattendorf, D. A., Lindquist, S. L. Analysis of the AAA sensor-2 motif in the C-terminal ATPase domain of Hsp104 with a site-specific fluorescent probe of nucleotide binding. Proc Natl Acad Sci. 99, 2732-2737 (2002).
- Lum, R., Niggemann, M., Glover, J. R. Peptide and protein binding in the axial channel of Hsp104. Insights into the mechanism of protein unfolding. J Biol Chem. 283, 30139-30150 (2008).
- Lum, R., Tkach, J. M., Vierling, E., Glover, J. R. Evidence for an unfolding/threading mechanism for protein disaggregation by Saccharomyces cerevisiae Hsp104. J Biol Chem. 279, 29139-29146 (2004).
- Tessarz, P., Mogk, A., Bukau, B. Substrate threading through the central pore of the Hsp104 chaperone as a common mechanism for protein disaggregation and prion propagation. Mol Microbiol. 68, 87-97 (2008).
- Weibezahn, J. Thermotolerance requires refolding of aggregated proteins by substrate translocation through the central pore of ClpB. Cell. 119, 653-665 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados