Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Purification de Hsp104, une protéine Disaggregase
Dans cet article
Résumé
Ici, nous décrivons un protocole pour la purification de la très active Hsp104, un AAA + hexamérique protéines de la levure, qui couple l'hydrolyse d'ATP à la désagrégation des protéines. Ce schéma exploite une construction His6-marqués pour la purification d'affinité à partir E. coli Suivie par chromatographie échangeuse d'anions, His6-tag retrait avec la protéase TEV, et chromatographie d'exclusion stérique.
Résumé
Hsp104 est un hexamère AAA + 1 à partir de protéines de la levure, qui couple l'hydrolyse d'ATP à la protéine de désagrégation 2-10 (Fig. 1). Cette activité confère deux grands avantages sélectifs. Tout d'abord, la renaturation des agrégats désordonnés par Hsp104 permet la survie de la levure après diverses protéines-repliement souligne, notamment 3,5,11,12 choc thermique. Deuxièmement, le remodelage des fibrilles amyloïdes bêta par la Croix-Hsp104 permet d'exploiter la levure prions myriades (amyloïdes infectieux) comme un réservoir de bénéfique et héritable variation phénotypique 13-22. Remarquablement, Hsp104 remodèle directement oligomères preamyloid et fibrilles amyloïdes, y compris ceux comprenant des protéines prion de levure et de SUP35 URE2 23-30. Cette fonctionnalité amyloïde remodelage est une facette spécialisée de la levure Hsp104. Le E. orthologue coli, CLPB, ne parvient pas à transformer ou oligomères preamyloid fibrilles amyloïdes 26,31,32.
Orthologues Hsp104 se trouvent dans tous les règnes de la vie, sauf, perplexingly, les animaux. En effet, si les cellules animales possèdent aucun système enzymatique que la désagrégation de protéines aux couples de renaturation (plutôt que de la dégradation) demeure inconnue 33-35. Ainsi, nous et d'autres ont proposé que Hsp104 pourrait être développé comme un agent thérapeutique pour diverses maladies neurodégénératives liées au mauvais repliement de protéines spécifiques dans les oligomères preamyloid toxiques et fibrilles amyloïdes 4,7,23,36-38. Il n'y a pas de traitements qui ciblent directement les espèces agrégées associées à ces maladies. Pourtant, Hsp104 dissout oligomères toxiques et fibrilles amyloïdes composé d'alpha-synucléine, qui sont liés à la maladie de Parkinson 23 ainsi que les formes de PrP amyloïde 39. Surtout, Hsp104 réduit l'agrégation des protéines et améliore la neurodégénérescence dans des modèles rongeurs de la maladie de Parkinson et la maladie de Huntington 23 38. Idéalement, pour optimiser le traitement et de minimiser les effets secondaires, Hsp104 serait conçu et potentialisé de façon sélective remodeler agrégats spécifiques au centre de la maladie en question 4,7. Cependant, la compréhension limitée structurelles et mécanistiques sur la manière dont Hsp104 désagrège un tel répertoire varié de structures agrégées et les protéines non liées frustre ces efforts 30,40-42.
Pour comprendre la structure et le mécanisme de Hsp104, il est essentiel d'étudier la protéine pure et reconstituer son activité disaggregase avec des composants minimes. Hsp104 est une protéine 102kDa avec un pI de 5,3 ~, qui hexamerizes, en présence de l'ADP ou l'ATP, ou à des concentrations élevées de protéines en l'absence de 43-46 nucléotides. Ici, nous décrivons un protocole optimisé pour la purification de très actif, stable Hsp104 de E. coli. L'utilisation de E. coli permet simplifiée production à grande échelle et à notre méthode peut être effectuée rapidement et de manière fiable pour de nombreuses variantes Hsp104. Notre protocole augmente Hsp104 pureté et simplifie son 6-tag retrait par rapport à un procédé de purification préalable de E. coli 47. Par ailleurs, notre protocole est plus facile et pratique de deux protocoles les plus récents 26,48.
Protocole
1. Expression de Hsp104
- Le plasmide utilisé pour la purification dans E. coli, pPROEX-HTB-Hsp104, contient les Hsp104 ouvert cadre de lecture sous le contrôle du promoteur inductible TRC 26. Le plasmide produit Hsp104 avec un N-terminale Sa 6-tag qui peut être enlevée par clivage de la protéase TEV. Transformez pPROEX-HTB-Hsp104 en codon optimisé E. coli BL21-CodonPlus-RIL cellules (Stratagene, Agilent Technologies) en utilisant une procédure de transformation bactérienne typique (par exemple, conformément aux instructions du fabricant). Il est important d'utiliser un codon optimisé E. coli souche parce Hsp104 a un biais de codons inhabituels.
- Inoculer une culture 100mL 2xYT (Recette USB.: 16g / L de peptone de caséine, extrait de levure 10g / L, 5g / L de NaCl, pH 7,0) additionné de 100μg/mL ampicilline et chloramphénicol 34μg/mL avec transformants frais et poussent nuit à 37 ° C avec agitation à 200rpm.
- Inoculer 10 ml de la culture de la nuit en 6 X 1L 2xYT avec 100μg/mL ampicilline et chloramphénicol dans des flacons 34μg/mL 2L. Agiter à 250rpm à 37 ° C jusqu'à DO 600 = 0.4 à 0.6. Arrêter de trembler et de réduire la température à 15 ° C. Laisser les cellules de s'équilibrer unagitated pendant 30min dans l'incubateur jusqu'à ce qu'il atteigne 15 ° C. Une fois à 15 ° C est atteinte induire l'expression de protéines par addition d'IPTG à une concentration finale de 1 mM. Reprendre agitation à 250rpm nuit (12-16 heures).
2. La récolte des cellules et Lysis
- Récolte des cellules par centrifugation (dans un rotor prérefroidi) à 4000 rpm pendant 20min à 4 ° C (nous utilisons un Sorvall RC 3BP + centrifugeuse). Les étapes suivantes doivent être effectuées immédiatement, car l'activité est diminuée Hsp104 lorsque E. coli cellules sont congelées. Par ailleurs, toutes les mesures ultérieures doivent être effectuées sur la glace ou à 4 ° C.
- Culots cellulaires Remettre en suspension dans prechilled (sur glace) 10mL de tampon de lyse (40 mM HEPES-KOH pH 7,4, KCl 500mm, 20mm MgCl 2, 2,5% (p / v) de glycérol, 20 mM imidazole, 5 um pepstatine A, cocktail complet inhibiteur de la protéase (1 EDTA sans tablet/50mL), et 2mm β-mercaptoéthanol).
- Lyse des cellules avec un français de presse (EmulsiFlex) homogénéisateur qui utilise un échangeur de chaleur immergé dans l'eau glacée. Avant utilisation, s'assurer que tous les amas cellulaires ont été solubilisés. Après équilibration homogénéisateur avec un tampon de lyse, deux passes à travers le cylindre à une pression de 15,000-18,000 psi est suffisante pour la lyse complète. Si une presse française n'est pas disponible, l'incubation avec le lysozyme suivie par sonication peut être utilisée (voir la discussion). Enregistrer un petit échantillon de cellules lysées pour l'analyse SDS-PAGE (1 microlitre) (lysat dans la Fig. 2).
- Enlevez les débris cellulaires par centrifugation à 16000 rpm pendant 20min à 4 ° C (nous utilisons un RC5C Sorvall centifuge +). Conservez surnageant pour l'étape suivante et enregistrez un petit échantillon (1 microlitre) de surnageant pour analyse SDS-PAGE (Charge Ni dans la Fig. 2).
3. Purification Hsp104
- Mélanger surnageant de l'étape 2.4 avec 12 mL (2 ml Ni-Sépharose billes par 1L de cellules) de lisier de 50% de tampon de lyse équilibrée Ni-Sépharose perles (GE).
- Rotation de l'échantillon lentement pendant 3 heures à 4 ° C tel que Ni-Sépharose demeure flottante et mousse est minimisé. Temps d'incubation plus courtes sont possibles, mais va diminuer le rendement. A 4 ° C en présence d'inhibiteurs de protéase, peu de dégradation se produit, et un temps de 3 heures d'incubation Ni-Sépharose ne diminue pas l'activité du produit final. Recueillir Ni-Sépharose par centrifugation pendant 2 min à 4 ° C à 2000 rpm (Eppendorf 5810R centrifugeuse). Enregistrer un petit échantillon de surnageant pour analyse SDS-PAGE (1 microlitre) et jeter le reste (flux de NI, par (FT) dans la Fig. 2).
- Laver les récupérer Ni-Sépharose avec 25 volumes de colonne de tampon de lavage (40 mM HEPES-KOH pH 7,4, 150 mM KCl, 20 mM MgCl 2, 2,5% (p / v) de glycérol, 20 mM imidazole, 2 mM β-mercaptoéthanol), 5 volumes de colonne de tampon de lavage avec du KCl 1M pour éliminer les contaminants liés électrostatiquement à Hsp104, et 25 volumes de colonne de tampon de lavage. Recueillir Ni-Sépharose après chaque lavage par centrifugation pendant 2 min à 4 ° C à 2000 rpm (Eppendorf 5810R centrifugeuse). Après chaque cycle de lavage et de centrifugation, éliminer le tampon par aspiration.
- Pour éluer Hsp104, mélanger Ni-Sépharose avec 1mL de tampon d'élution (40 mM HEPES-KOH pH 7,4, 150 mM KCl, 20 mM MgCl 2, 2,5% (p / v) glycérol, 350mm imidazole, 2 mM β-mercaptoéthanol) par 1ml Ni-Sepharose et rotation à 4 ° C pendant 20 minutes. La forte concentration d'imidazole perturbe le Ni-Bead Ses six interaction. Retirer Ni-Sépharose avec colonnes de centrifugation vide 1,2 ml (Bio-Rad) par centrifugation pendant 2 min à 4 ° C à 2000 rpm (Eppendorf 5810R centrifugeuse). Enregistrer 1 microlitre d'éluat pour analyse SDS-PAGE (éluat Ni dans la Fig. 2). Pour chaque litre de cellules, ~ 15 mg de Hsp104 est obtenue à cette étape.
- Éluat échange de tampon dans la mémoire tampon Q (20 mM Tris-HCl pH 8, 0,5 mm d'EDTA, 5mM MgCl 2, 50 mM NaCl) à l'aide MWCO 30000 Amicon Ultra (Millipore) 15ml unités concentrateur centrifuge. Tout d'abord, concentré de protéines à ~ 1,5 ml puis ajouter 14.5mL de tampon Q pour diluer la protéine de 10 fois. Répétez 3 fois pour l'échange de tampon. L'augmentation du pH et de faible teneur en sel assure que Hsp104 a une forte charge négative.
- Purifier Hsp104 via chromatographie échangeuse d'anions en utilisant un tampon Q équilibrée des ressources Q 6 mL colonne (GE). Avant l'injection, la protéine est filtré à travers un faible liaison protéique Millex GP PES membrane 0.22μM filtre seringue (Millipore). Nous employons un débit de 1mL/min. Laver faiblement protéines de liaison avec 1 volume de colonne de tampon de 20% Q + (20 mM Tris-HCl pH 8, 0,5 mm d'EDTA, 5mM MgCl 2, 1 M de NaCl). Eluer Hsp104 avec gradient linéaire (20% -50% de tampon Q +) plus de 5 volumes de colonne (Fig. 3). Collecter des fractions de 1ml. Hsp104 et la plupart des variantes typiquement éluer à ~ 400mm de NaCl (31mS/cm). Enregistrer des échantillons de fractions de pic (1 microlitre) pour analyse SDS-PAGE (Fig. 3, en médaillon).
- Pour retirer son 6-tag, les protéines d'échange en utilisant le concentrateur Amicon centrifuge décrit ci-dessus (voir étape 3.5) dans le tampon de clivage (20mM HEPES-KOH pH 7,4, KCl 140mm, et 10mm MgCl 2). Utilisez proTEV protéase (Promega) ou AcTEV protéase (Invitrogen) selon les instructions du fabricant. Pour Hsp104, nous avons constaté que des ratios plus élevés de la VET de protéase: Hsp104 sont nécessaires pour un clivage complet. Nous utilisons un ratio de 1 unité de protéase par 12μg Hsp104. Décolleté doit être effectuée à 30 ° C pendant 2-4 heures, suivie d'une incubation de 16 heures à 4 ° C. La concentration finale de Hsp104 devrait se situer entre 20 75μM monomère. Appauvrissent tout reste Hsp104 His6-marqués et la protéase TEV avec Ni-Sepharose (GE) en ajoutant Ni-Sépharose en excès à la quantité de Hsp104 dans la réaction de clivage (supposons perles peuvent se lier 15mg de protéines par ml de résine emballé). Retirer perles avec colonnes de centrifugation vide (Bio-Rad) par centrifugation pendant 2min à 2000 rpm à 4 ° C. Prélever des échantillons avant et après clivage (1 microlitre) pour analyse SDS-PAGE pour assurer le clivage, et l'élimination des protéines non clivée (fig. 4).
- Bourse dans le buffer d'exclusion stérique (20mm HEPES-KOH pH 7,4, KCl 140mm, 10 mM MgCl2, 0,1 mM EDTA, 1mM DTT), en utilisant MWCO 30000 Amicon Ultra (Millipore) tel que décrit dans l'étape 3.5.
- Purifier davantage Hsp104 via chromatographie d'exclusion stérique. Utilisez Superose taille du tampon d'exclusion équilibrée 6 ou colonne Superdex 200 (tous deux de GE) (fig. 5). Avant l'injection, la protéine est filtré à travers un faible liaison protéique Millex GP PES membrane 0.22μM filtre seringue (Millipore). Pour moins de 10mg de protéines, de l'10/300 colonnes de taille (24ml) peuvent être utilisés et les fractions de 0,5 ml sont collectées. Pour les échantillons de plus de 10mg, la colonne de taille 12/60 (120ml) devraient être utilisés et fractions de 1 ml sont collectées. Reportez-vous aux instructions du fabricant pour des débits et des volumes d'échantillons d'être chargés. Après purification, les fractions sont regroupées Hsp104 comme indiqué dans la Fig. 5 et concentrée dans les unités de Amicon concentrateur centrifuge (Millipore). Hsp104 est stocké comme décrit ci-dessous. En raison de la perte de matière à séparer Hsp104 produits de dégradation et de contaminants le rendement final de purifier pleine longueur Hsp104 est ~ 1-3mg par litre de commencer la culture.
4. Hsp104 Disaggregase activité
- Après purification, il est de bonne pratique pour évaluer l'activité Hsp104 dans un essai de désagrégation. Généralement, nous employons un dosage de la luciférase réactivation 2 (fig. 6). Dans cet essai, Hsp104 en conjonction avec le système de chaperon Hsp70 (Hsp70 et HSP40) désagrège urée-dénaturé agrégats luciférase de luciole 2. Soluble luciférase catalyse l'oxydation de la luciférine à oxyluciférine, une réaction qui libère la lumière. Par la luminescence de surveillance, la réactivation relative, et donc la désagrégation, de la luciférase peut être déterminée. Hsp104 doit être capable de collaborer avec la synergie de co-chaperon Hsp70 système. Le montant de la luminescence récupéré dépend de la Hsp70 exacte: paire HSP40 utilisé. Nous avons régulièrement recours Hsp72 et HSP40 (Assay Designs). Au minimum, actif Hsp104 devrait produire une augmentation de 5 fois dans la réactivation de la luciférase par rapport à la réactivation par Hsp72: HSP40 seul (Fig. 6). Hsp104 préparations qui ne parviennent pas à atteindre ce niveau d'activité sont jetés.
5. Hsp104 stockage
- Pour stockage à court terme, Hsp104 peuvent être conservés à 4 ° C dans d'exclusion de taille de mémoire tampon. Cependant, l'activité va diminuer après 2-3 jours à 4 ° C et fortement après 1 semaine à 4 ° C. Pour les essais de désagrégation nous recommandons que Hsp104 devrait être utilisé dès que possible après la purification. Idéalement, Hsp104 doit être utilisée immédiatement pour des essais de désagrégation amyloïde.
- Si la protéine doit être stocké à long terme, Hsp104 est échangé dans un tampon de stockage (20mm HEPES-KOH pH 7,4, KCl 140mm, 10 mM MgCl2, 0,1 mM EDTA, 1 mM de DTT, glycérol 10% (p / v)). Aliquotes 100 ul sont encliquetage congelés dans l'azote liquide et stockés à -80 ° C. Cycles gel-dégel réduire drastiquement l'activité Hsp104et devrait être évitée. Nous recommandons lentement dégel Hsp104 sur la glace. -Amyloïde disaggregase activité diminuer fortement après un mois à -80 ° C.
6. Les résultats représentatifs et chiffres:
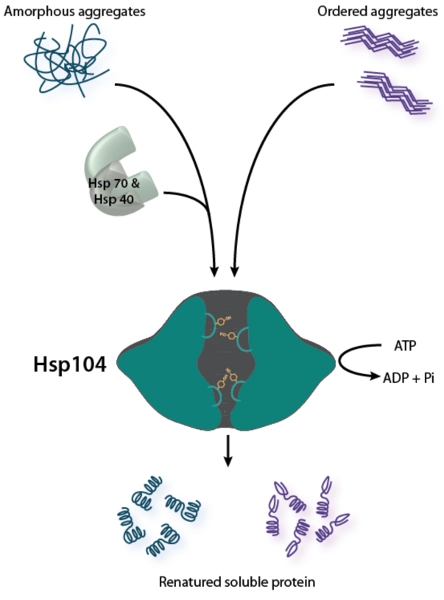
Figure 1. Hsp104 est un disaggregase bifonctionnels. Désagrégation des agrégats désordonnés (indiqué sur la gauche) nécessite la coopération du système de chaperon Hsp70 (Hsp70 et HSP40) 2. Remodèle Hsp104 commandé agrégats amyloïdes (montré à droite) sans l'aide de Hsp70 et HSP40 in vitro, mais Hsp70 et HSP40 peut améliorer Hsp104 activité contre 26,28 amyloïde. Pour les deux types de structures globales, Hsp104 couples ATP hydrolyse à la translocation du substrat à travers son canal central pour promouvoir la désagrégation. Boucles interstitielles Tyrosine portant engager et substrat de navette à travers le canal central 49-52.

Figure 2. Analyse SDS-PAGE de Ni-sépharose étape de purification par affinité. Lysat, Charge Ni, Ni FT et des échantillons ont été fractionnés éluat Ni par SDS-PAGE en utilisant un 4-20% Tris-HCl 1.0mm Critère gel (Bio-Rad) et colorées au bleu de Coomassie . Notez que tous les Hsp104 est capable de se lier à la Ni-sépharose. Large gamme de marqueurs de poids moléculaire (Bio-Rad) sont représentés (voie de gauche).
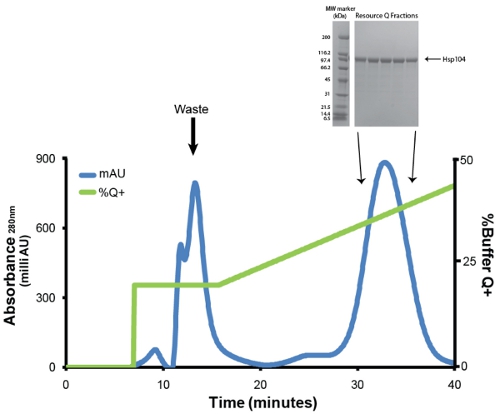
Figure 3. Resource Q purification de Ni-sépharose éluat. Trace bleue représente l'absorbance à 280nm et oligo-vert représente Tampon% Q + (maximum à 50%). Le premier pic, qui élue à 20% Q + contient des impuretés, des produits de dégradation et mal plié Hsp104. Le deuxième pic et les grandes contient correctement repliée et active Hsp104. Le débit était de 1mL/min. Dégradé de 20-50% Q + est de 30 minutes ou 5 volumes de colonne. En médaillon: fractions de pic sont résolus par analyse SDS-PAGE en utilisant un 40-20% de Tris-HCl 1.0mm Critère gel (Bio-Rad) et colorées au bleu de Coomassie. Large gamme de marqueurs de poids moléculaire (Bio-Rad) sont affichés (à gauche).

Figure 4. Analyse SDS-PAGE de l'étape proTEV clivage de la protéase. Sa 6-Hsp104 de Resource Q de purification a été traité avec de la protéase proTEV pendant 4 heures à 30 ° C puis 16 heures à 4 ° C. Les échantillons ont été fractionnés par l'SDS-PAGE en utilisant un 40-20% de Tris-HCl 1.0mm Critère gel (Bio-Rad) et colorées au bleu de Coomassie. Notez que proTEV clivé Hsp104 migre plus rapidement. VET protéase et non clivée Hsp104 ont été épuisées avec Ni-Sépharose comme décrit dans l'étape 3.7. Large gamme de marqueurs de poids moléculaire (Bio-Rad) sont affichés (à gauche).
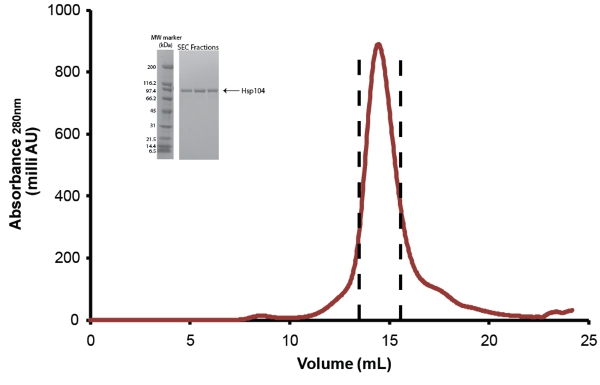
Figure 5. Taille-exclusion purification de Hsp104. Clivées Hsp104 a encore été purifié par une colonne de Superose 6 filtration sur gel (10/300, GE). = Débit 0.4ml/min. Le sommet entre les lignes en pointillés représente fractions regroupées. En médaillon: fractions de pic sont résolus par analyse SDS-PAGE en utilisant un 40-20% de Tris-HCl 1.0mm Critère gel (Bio-Rad) et colorées au bleu de Coomassie. Large gamme de marqueurs de poids moléculaire (Bio-Rad) sont affichés (à gauche).
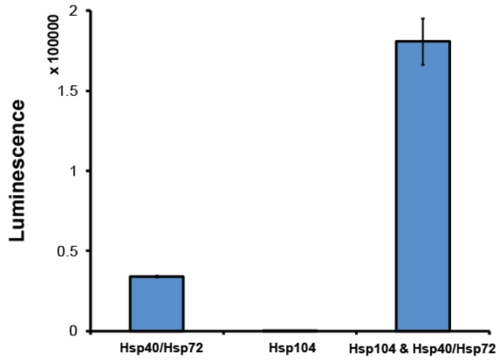
Figure 6. Dosage de la réactivation luciférase. Dénaturé agrégats luciférase de luciole (50 nM) ont été incubées soit avec Hsp72 et HSP40 (1 uM) (tous deux de Assay Designs), Hsp104 (6 microns monomère) ou Hsp104, Hsp72 et HSP40 pour 90min à 25 ° C. Luciférase dénaturé n'est pleinement réactivé, en présence de deux Hsp104 et Hsp40/Hsp72. Luminescence récupéré est mesuré sur une plaque de Infini M1000 (Tecan) lecteur. Les valeurs représentent la moyenne ± SEM (n = 3).
Access restricted. Please log in or start a trial to view this content.
Discussion
Chronologie: Pour Hsp104 activité maximale, nous recommandons que le schéma de purification entière soit achevée aussi rapidement que possible. Cependant, le nombre d'étapes de purification rend un horaire exigeant qui ne peuvent pas toujours être pratique. Si les étapes de purification sont effectués aussi rapidement que possible, le temps de la fin de l'expression du jour au lendemain grâce à l'2-4 heures d'incubation à 30 ° C avec TEV protéase est d'environ 9-11 heures. Un lieu...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été soutenu par une subvention du NIH (5T32GM008275-22) et une bourse de l'American Heart Association prédoctoral (à EAS); une bourse de l'interface chimie-biologie du NIH (2T32GM071339-06A1) (à MED) et des subventions de la NIH (1DP2OD002177-01 et NS067354-0110), Le Ellison Medical Foundation et la Fondation Bill et Melinda Gates Foundation (JS).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
|---|---|---|---|
| BL21-CodonPlus-RIL cellules compétentes | Stratagene, Agilent Technologies | 230255 | |
| 2xYT bouillon | USB | 75864 | |
| Complète, mini, de l'EDTA-libres comprimés inhibiteur de protéase | Roche | 1836170 | |
| Pepstatine A | Sigma | P4265 | |
| Ni-Sépharose 6 Fast Flow | GE Healthcare | 17-5318-02 | |
| Amicon Ultra-15 centrifuges unités de filtration (MWCO 30000) | Millipore | UFC903008 | |
| Resource Q - colonne de 6ml | GE Healthcare | 17-1179-01 | |
| proTEV protéase | Promega | V6052 | |
| AcTEV protéase | Invitrogen | 12575015 | |
| Superose 6 10/300 GL | GE Healthcare | 17-5172-01 | |
| HSP40 | Assay Designs | PSP-400 | |
| Hsp72 | Assay Designs | ADI-NSP-555 |
Références
- Erzberger, J. P., Berger, J. M. Evolutionary relationships and structural mechanisms of AAA+ proteins. Annu Rev Biophys Biomol Struct. 35, 93-114 (2006).
- Glover, J. R., Lindquist, S. Hsp104, Hsp70, and Hsp40: A Novel Chaperone System that Rescues Previously Aggregated Proteins. Cell. 94, 73-82 (1998).
- Parsell, D. A., Kowal, A. S., Singer, M. A., Lindquist, S. Protein disaggregation mediated by heat-shock protein Hsp104. Nature. 372, 475-478 (1994).
- Vashist, S., Cushman, M., Shorter, J. Applying Hsp104 to protein-misfolding disorders. Biochem Cell Biol. 88, 1-13 (2010).
- Parsell, D. A., Sanchez, Y., Stitzel, J. D., Lindquist, S. Hsp104 is a highly conserved protein with two essential nucleotide-binding sites. Nature. 353, 270-273 (1991).
- Doyle, S. M., Wickner, S. Hsp104 and ClpB: protein disaggregating machines. Trends Biochem Sci. 34, 40-48 (2009).
- Shorter, J. Hsp104: a weapon to combat diverse neurodegenerative disorders. Neurosignals. 16, 63-74 (2008).
- Glover, J. R., Lum, R. Remodeling of protein aggregates by Hsp104. Protein Pept Lett. 16, 587-597 (2009).
- Mogk, A., Haslberger, T., Tessarz, P., Bukau, B. Common and specific mechanisms of AAA+ proteins involved in protein quality control. Biochem Soc Trans. 36, 120-125 (2008).
- Grimminger-Marquardt, V., Lashuel, H. A. Structure and function of the molecular chaperone Hsp104 from yeast. Biopolymers. 93, 252-276 (2010).
- Sanchez, Y., Lindquist, S. L. HSP104 required for induced thermotolerance. Science. 248, 1112-1115 (1990).
- Sanchez, Y., Taulien, J., Borkovich, K. A., Lindquist, S. Hsp104 is required for tolerance to many forms of stress. Embo J. 11, 2357-2364 (1992).
- Alberti, S., Halfmann, R., King, O., Kapila, A., Lindquist, S. A systematic survey identifies prions and illuminates sequence features of prionogenic proteins. Cell. 137, 146-158 (2009).
- Halfmann, R., Alberti, S., Lindquist, S. Prions, protein homeostasis, and phenotypic diversity. Trends Cell Biol. 20, 125-1233 (2010).
- Shorter, J., Lindquist, S. Prions as adaptive conduits of memory and inheritance. Nat Rev Genet. 6, 435-450 (2005).
- True, H. L., Berlin, I., Lindquist, S. L. Epigenetic regulation of translation reveals hidden genetic variation to produce complex traits. Nature. 431, 184-187 (2004).
- True, H. L., Lindquist, S. L. A yeast prion provides a mechanism for genetic variation and phenotypic diversity. Nature. 407, 477-483 (2000).
- Tyedmers, J., Madariaga, M. L., Lindquist, S. Prion switching in response to environmental stress. PLoS Biol. 6, e294-e294 (2008).
- Chernoff, Y. O., Lindquist, S. L., Ono, B., Inge-Vechtomov, S. G., Liebman, S. W. Role of the chaperone protein Hsp104 in propagation of the yeast prion-like factor [psi+]. Science. 268, 880-884 (1995).
- Halfmann, R., Lindquist, S. Epigenetics in the extreme: prions and the inheritance of environmentally acquired traits. Science. 330, 629-632 (2010).
- Satpute-Krishnan, P., Langseth, S. X., Serio, T. R. Hsp104-dependent remodeling of prion complexes mediates protein-only inheritance. PLoS Biol. 5, e24-e24 (2007).
- Sweeny, E. A., Shorter, J. Prion proteostasis: Hsp104 meets its supporting cast. Prion. 2, 135-140 (2008).
- Lo Bianco, C. Hsp104 antagonizes alpha-synuclein aggregation and reduces dopaminergic degeneration in a rat model of Parkinson disease. J Clin Invest. 118, 3087-3097 (2008).
- Narayanan, S., Walter, S., Reif, B. Yeast prion-protein, sup35, fibril formation proceeds by addition and substraction of oligomers. Chembiochem. 7, 757-765 (2006).
- Savistchenko, J., Krzewska, J., Fay, N., Melki, R. Molecular chaperones and the assembly of the prion Ure2p in vitro. J Biol Chem. 283, 15732-15739 (2008).
- Shorter, J., Lindquist, S. Hsp104 catalyzes formation and elimination of self-replicating Sup35 prion conformers. Science. 304, 1793-1797 (2004).
- Shorter, J., Lindquist, S. Destruction or potentiation of different prions catalyzed by similar Hsp104 remodeling activities. Mol Cell. 23, 425-438 (2006).
- Shorter, J., Lindquist, S. Hsp104, Hsp70 and Hsp40 interplay regulates formation, growth and elimination of Sup35 prions. Embo J. 27, 2712-2724 (2008).
- Doyle, S. M. Asymmetric deceleration of ClpB or Hsp104 ATPase activity unleashes protein-remodeling activity. Nat Struct Mol Biol. 14, 114-122 (2007).
- Wendler, P. Atypical AAA+ subunit packing creates an expanded cavity for disaggregation by the protein-remodeling factor Hsp104. Cell. 131, 1366-1377 (2007).
- Hinault, M. P. Stable alpha-synuclein oligomers strongly inhibit chaperone activity of the Hsp70 system by weak interactions with J-domain co-chaperones. J Biol Chem. 285, 38173-38182 (2010).
- Tipton, K. A., Verges, K. J., Weissman, J. S. In vivo monitoring of the prion replication cycle reveals a critical role for Sis1 in delivering substrates to Hsp104. Mol Cell. 32, 584-591 (2008).
- Bieschke, J., Cohen, E., Murray, A., Dillin, A., Kelly, J. W. A kinetic assessment of the C. elegans amyloid disaggregation activity enables uncoupling of disassembly and proteolysis. Protein Sci1. 8, 2231-2241 (2009).
- Cohen, E., Bieschke, J., Perciavalle, R. M., Kelly, J. W., Dillin, A. Opposing activities protect against age-onset proteotoxicity. Science. 313, 1604-1610 (2006).
- Cohen, E. Reduced IGF-1 signaling delays age-associated proteotoxicity in mice. Cell. 139, 1157-1169 (2009).
- Cushman, M., Johnson, B. S., King, O. D., Gitler, A. D., Shorter, J. Prion-like disorders: blurring the divide between transmissibility and infectivity. J Cell Sci. 23, 1191-11201 (2010).
- Carmichael, J. Bacterial and yeast chaperones reduce both aggregate formation and cell death in mammalian cell models of Huntington's disease. Proc Natl Acad Sci. 97, 9701-9705 (2000).
- Vacher, C., Garcia-Oroz, L., Rubinsztein, D. C. Overexpression of yeast hsp104 reduces polyglutamine aggregation and prolongs survival of a transgenic mouse model of Huntington's disease. Hum Mol Genet. 14, 3425-3433 (2005).
- Liu, Y. H. Heat Shock Protein 104 Inhibited the Fibrillization of Prion Peptide 106-126 and Disassembled Prion peptide 106-126 Fibrils in vitro. Int J Biochem Cell Biol. , (2011).
- Wendler, P., Saibil, H. R. Cryo electron microscopy structures of Hsp100 proteins: crowbars in or out. Biochem Cell Biol. 88, 89-96 (2010).
- Wendler, P. Motor mechanism for protein threading through Hsp104. Mol Cell. 34, 81-92 (2009).
- Lee, S., Sielaff, B., Lee, J., Tsai, F. T. CryoEM structure of Hsp104 and its mechanistic implication for protein disaggregation. Proc Natl Acad Sci. 107, 8135-8140 (2010).
- Parsell, D. A., Kowal, A. S., Lindquist, S. Saccharomyces cerevisiae Hsp104 protein. Purification and characterization of ATP-induced structural changes. J Biol Chem. 269, 4480-4487 (1994).
- Schirmer, E. C., Queitsch, C., Kowal, A. S., Parsell, D. A., Lindquist, S. The ATPase activity of Hsp104, effects of environmental conditions and mutations. J Biol Chem. 273, 15546-15552 (1998).
- Schirmer, E. C., Ware, D. M., Queitsch, C., Kowal, A. S., Lindquist, S. L. Subunit interactions influence the biochemical and biological properties of Hsp104. Proc Natl Acad Sci. 98, 914-919 (2001).
- Hattendorf, D. A., Lindquist, S. L. Cooperative kinetics of both Hsp104 ATPase domains and interdomain communication revealed by AAA sensor-1 mutants. EMBO J. 21, 12-21 (2002).
- Schirmer, E. C., Lindquist, S. Purification and properties of Hsp104 from yeast. Methods Enzymol. 290, 430-444 (1998).
- Hattendorf, D. A., Lindquist, S. L. Analysis of the AAA sensor-2 motif in the C-terminal ATPase domain of Hsp104 with a site-specific fluorescent probe of nucleotide binding. Proc Natl Acad Sci. 99, 2732-2737 (2002).
- Lum, R., Niggemann, M., Glover, J. R. Peptide and protein binding in the axial channel of Hsp104. Insights into the mechanism of protein unfolding. J Biol Chem. 283, 30139-30150 (2008).
- Lum, R., Tkach, J. M., Vierling, E., Glover, J. R. Evidence for an unfolding/threading mechanism for protein disaggregation by Saccharomyces cerevisiae Hsp104. J Biol Chem. 279, 29139-29146 (2004).
- Tessarz, P., Mogk, A., Bukau, B. Substrate threading through the central pore of the Hsp104 chaperone as a common mechanism for protein disaggregation and prion propagation. Mol Microbiol. 68, 87-97 (2008).
- Weibezahn, J. Thermotolerance requires refolding of aggregated proteins by substrate translocation through the central pore of ClpB. Cell. 119, 653-665 (2004).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon