Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Dos tipos de ensayos para la detección de espermatozoides quimioatracción rana
En este artículo
Resumen
Los huevos y los recubrimientos extracelular alrededor de los huevos con frecuencia liberación péptidos, proteínas y pequeñas moléculas que se comunican con el esperma para guiarlos hacia el óvulo promoviendo así la fecundación. Utilizando el esperma de rana se describen y comparan dos tipos de ensayos para detectar los espermatozoides quimioatracción - ensayos de esperma y la acumulación de pruebas de esperma de seguimiento.
Resumen
Quimioatracción espermatozoides en los invertebrados puede ser lo suficientemente robusta que se puede colocar una pipeta que contiene el péptido atractivo en una suspensión de esperma y microscópicamente visualizar la acumulación de esperma en todo el pipeta de 1. Quimioatracción espermatozoides en los vertebrados como ranas, roedores y seres humanos es más difícil de detectar y requiere ensayos cuantitativos. Estos ensayos son de dos tipos principales - los ensayos que cuantifican el movimiento del esperma a una fuente de quimiotáctica, llamados ensayos de la acumulación de esperma, y los ensayos que en realidad seguimiento de las trayectorias de natación de los espermatozoides individuales.
Los ensayos de la acumulación de esperma están permitiendo a decenas o cientos relativamente rápido de los ensayos a realizar en un solo día, lo que permite curvas de dosis-respuesta y los cursos de tiempo para llevar a cabo de forma relativamente rápida. Este tipo de ensayos se han utilizado ampliamente para caracterizar muchos sistemas bien establecidos quimioatracción - por ejemplo, la quimiotaxis de neutrófilos al bacpéptidos terial y la quimiotaxis de espermatozoides al líquido folicular. Los ensayos de los espermatozoides de seguimiento puede ser más mano de obra, pero ofrecen datos adicionales sobre cómo chemoattractancts alteran realmente el camino que los espermatozoides nadar tomar. Este tipo de ensayo es necesaria para demostrar la orientación del movimiento de los espermatozoides con respecto al eje de degradado chemoattrractant y visualizar resulta característica o cambios en la orientación que llevan los espermatozoides más cerca del óvulo.
A continuación se describen los métodos utilizados para cada uno de estos dos tipos de ensayos. El ensayo de la acumulación de semen utilizado se llama "doble cámara" ensayo. Espermatozoides de anfibios se encuentran en una inserción de placa de cultivo de tejidos con un piso de filtro de policarbonato con poros de 12 micras de diámetro. Insertos con los espermatozoides se colocan en los pozos de la placa de cultivo de tejido que contiene tampón y un chemoatttractant cuidadosamente pipeta en el fondo del pozo donde el piso y la pared (ver fig. 1). Después de la incubación, el inserto superior que contiene el depósito de los espermatozoides es cuidadosamente removed, y los espermatozoides en la cavidad inferior que han pasado a través de la membrana se eliminan, se sedimentaron y contadas por hemocitómetro o citómetro de flujo.
El ensayo de seguimiento de esperma utiliza una cámara Zigmond desarrollado originalmente para la observación de la quimiotaxis de neutrófilos y modificado para la observación de los espermatozoides por Giojalas y compañeros de trabajo 2,3. La cámara se compone de una lámina de vidrio grueso en el que dos canales verticales que se han mecanizado. Estos están separados por una plataforma de observación de 1 mm de ancho. Después de la aplicación de una cubierta de vidrio, los espermatozoides se cargan en un canal, el agente quimiotáctico en el otro y el movimiento de los espermatozoides individuales visualizado por microscopía de vídeo. Las imágenes de vídeo se analiza el uso de software para identificar dos dimensiones los movimientos celulares en el plano xy como una función del tiempo (XYT conjuntos de datos) que forman la trayectoria de cada uno de los espermatozoides.
Protocolo
1. Materiales y los buffers usados
- Buffer Ringer ovocito (1,5 x OR2) contiene 124 mM NaCl, 3,75 mM KCl, 1,5 mM CaCl 2, 1,5 mM de MgCl 2, 1,5 mM Na 2 HPO 4, 10 mM Hepes, pH 7,8. Buffer de fertilización (F-1) contiene 41,25 mM NaCl, 1,25 mM KCl, 0,25 mM CaCl 2, 0,06 mM de MgCl2, 0,5 mM Na 2 HPO 4, 2,5 mM Hepes, pH 7,8.
- Xenopus laevis agua huevo se prepara según Sugiyama et al. 4. Se describen brevemente, recién generado huevos de rana en gelatina se arremolinaban en un pequeño volumen de F-1 buffer de 30 minutos y el medio condicionado removido por micropipeta. Este medio, denominado "agua de huevo", también se puede utilizar para preparar purificada allurin, el quimioatrayente primario en este extracto de jalea. Los espermatozoides son obtenidos a partir comercialmente criados Xenopus laevis o Xenopus tropicalis.
- Vea la Tabla de materiales para los puntos que son necesarios en el tque ensayo.
2. Un ensayo de doble cámara de quimiotaxis espermática rana
- Anestesiar a la rana por inmersión en agua que contiene 0,07% de benzocaína, decapitar con un par de tijeras afiladas carborundum, y la médula dobles para asegurar la eutanasia. Cortar la piel del abdomen para exponer los músculos. Haga cortes en la línea media y lateral de los músculos abdominales y se retraen. Retraer con suavidad los intestinos y la grasa blanca para revelar, en forma de frijol testículos. Recorte el tejido conectivo con unas tijeras pequeñas, teniendo cuidado de evitar que los vasos sanguíneos. Quitar un testículo, lavar la sangre que pueda usar 1,5 x OR2 buffer, y luego rodar el testículo en el papel de filtro para eliminar el exceso de tampón y los pequeños vasos sanguíneos adherentes, y luego colocar el testículo en un plato de plástico Pitre en 0,2 ml de 1,5 x OR2 buffer. Llene una jeringa de 5 ml con 2 ml de 1,5 x OR2 buffer, suavemente empuje 10-20 agujeros en los testículos durante la mayor parte de la superficie en un extremo, inserte la aguja en el extremo opuesto e inyectar suavemente tampón para eliminar los espermatozoides. Por otra parte, unpuede inyectar buffer, mientras que meter los orificios de salida para eliminar los espermatozoides. Transferencia de la suspensión de esperma utilizando una micropipeta con una punta de corte (para evitar corte de los espermatozoides) a un tubo de microcentrífuga y el lugar en el hielo.
- Estimar el número de espermatozoides rana obtenida diluyendo 1:100 espermatozoides en 1,5 x O-2 y tomar una muestra de 20 l de la suspensión de esperma mezclada y contar el número de células por medio de un hemocitómetro y los grandes un área de 2 mm. Utilizando el número de hemocitómetro y frecuencia de muestreo calcular la densidad de los espermatozoides y el número total de espermatozoides cosechado. Este total es generalmente de 2 - 6 x 10 7 espermatozoides en un volumen de 2 ml, aproximadamente, cuando ambos testículos se utilizan. Diluir la suspensión de esperma de valores de 1,5 x OR2 buffer para obtener una densidad de esperma de 2 x 10 7 / ml. Utilizar el esperma de ensayo de 2 a 3 horas de preparación. Evaluar la motilidad de los espermatozoides mediante la dilución de 5 l de 1:10 espermatozoides con F-1 buffer y el movimiento de la visualización utilizando la óptica de contraste de fase. Al menos el 40% al 50% de los espermatozoidesdeben ser móviles. Incluso los preparativos adecuados que contienen un gran número de espermatozoides inmóviles la mayor parte de los cuales son inmaduros.
- Prepare un nuevo 24-así placa de plástico de cultivo de tejidos por micropipetting 700 l de tampón de F1 en cada pocillo. Cada pozo debe ser de 15 mm de diámetro en la parte inferior.
- Iniciar una serie de ensayos mediante la dilución de 100 l de suspensión de esperma con 900 l de tampón F1 a temperatura ambiente (alrededor de 21 a 23 ° C) en un tubo de microcentrífuga para activar la motilidad del esperma por choque osmótico. Cada espermatozoide tiempo fresco se activa de esta manera, el esperma debe ser utilizado dentro de 1-2 minutos.
- Lugar a 12 micras de porosidad de inserción (12 mm od) en un buffer lleno, así, asegúrese de que la colocación de inserción es fuera del centro dejando un espacio a un lado. Inmediatamente la transferencia de 400 l de motilidad activa en el pozo de una micropipeta con una punta de corte. Solicitar la suspensión de esperma en la pared del elemento filtrante y dejar que se agote en el filtro en la parte inferior de the inserción, la suspensión de esperma no se debe pipetear directamente en el filtro.
- Cuidadosamente micropipeta 50 l de agente quimiotáctico en el pozo en el espacio entre el bien y el elemento filtrante fuera del centro. Hay que tener cuidado para depositar la caída en el lateral y fondo del pozo se encuentran y retirar la pipeta sin alteraciones en el sistema. En concreto, el émbolo de la micropipeta se debe empujar únicamente a la primera parada con el fin de expulsar completamente la muestra, pero no hay burbujas de aire.
- Repita los pasos 2.5 y 2.6 para comenzar los ensayos que sean necesarios, a continuación, se incuba la placa hasta que el primer ensayo se ha iniciado incubó 50 minutos. Por lo general, se puede comenzar un ensayo cada 45 a 60 segundos. Tenga en cuenta que el ensayo puede ser racionalizado por una persona con experiencia, o por dos personas que trabajan juntas. En este caso, una o dos filas de ensayos se puede iniciar con un mayor stock de espermatozoides móviles y más rápido pipeteo siempre que el esperma se utilizan siempre de 1 a 2 minutos deactivación.
- Deje de cada ensayo en la secuencia de empezar. En primer lugar, con atención constante del elemento filtrante con una mano y con la otra retire con cuidado la mayor parte o la totalidad de la suspensión de esperma en la Cámara Alta por micropipeta o por aspiración con una pipeta Pasteur. Inmediatamente, utilizando unas pinzas finas, sacar el elemento filtrante y el descarte. Se debe tener cuidado en este paso por lo menos, los espermatozoides restantes se extendió por el filtro de elevar artificialmente los valores para el paso de los espermatozoides.
- De cada placa, así, la transferencia de la suspensión de esperma todo a un tubo de microcentrífuga. Es importante mezclar la suspensión de esperma en el pozo antes de la retirada ya que los espermatozoides tienden a asentarse en la parte inferior. Añadir 15 l de 25% de formaldehído a una concentración final de 0,5% v / v y refrigerar si el número de espermatozoides no se hacen el mismo día.
- Se precipitan los espermatozoides en cada tubo con un 10 segunda vuelta botón en una microcentrífuga personal con una velocidad máxima de 2000 x g. Quitar todos menos 100 l de supernathormiga de cada tubo, entonces resuspender el precipitado en ese volumen. Tomar 20 l de suspensión de esperma, diluir 1:10 con agua destilada, y el conteo de espermatozoides en un hemocitómetro utilizando un objetivo de 40x de un microscopio vertical. Utilice la cuenta y los factores de dilución para calcular el número total de espermatozoides que han pasado por el filtro en cada ensayo.
3. Esperma de rana seguimiento de ensayo utilizando una cámara Zigmond
- Prepare la estación de trabajo microscopio invertido para grabar en vídeo. Utilizamos una Nikon Elipse TE300 microscopio invertido equipado con una cámara Sony DXC-390 3-chip de la cámara de color de vídeo analógica o una Hamamatsu ORCA-03G cámara digital blanco y negro. La diapositiva de cámara Zigmond debe basarse en la etapa de arriba-lado-abajo con una apertura suficiente en la platina de cristal para dar cabida a una cubierta de 22x40 mm. Esta disposición es necesaria por el hecho de que el esperma de rana son incapaces de nadar contra la gravedad. Enfoque sea una lente de objetivo 4x o 10x en la plataforma de observación que corre entre los doscanales.
- Prueba para asegurarse de que la cámara está enfocada y centrada en la plataforma de observación. Si la cámara Sony es utilizada, el resultado se envía a un monitor de vídeo y un convertidor A / D (frame grabber), capaz de digitalizar 7 fotogramas por segundo a partir de la señal de vídeo. La corriente digital se procesa mediante un ordenador funcionando a 3 GHz o superior preferiblemente con 4 Gb de RAM o más. A pesar de que el uso de software Scion Image (una costumbre versión para Windows de NIH Image) el control de un Scion CG-7 de adquisición de imágenes, estos productos ya no están disponibles. Una solución actual es utilizar el software Image J con VirtualDub Plug-in para la captura de cámara de vídeo analógica. Si la cámara Hamamatsu se utiliza, su salida digital es procesada por el software Olympus cellSens y se visualiza en el monitor del ordenador. En ambos casos, los datos se almacenan o bien en un disco duro interno o externo, como una pila de 8-bit TIFF. El uso de software Scion Image requiere la conversión de la secuencia de imágenes Tiff a una pila con la imagen J.
- El campo microscópico debe incluir la mayor parte o la totalidad del ancho de la plataforma de observación. El uso de contraste de fase o la óptica de campo oscuro para los mejores resultados. La distancia entre la superficie de la plataforma de observación y la parte inferior de la cubierta de vidrio debe ser de 15 a 20 micras según lo determinado por el diferencial se centra en cada superficie.
- Prepare el quimioatrayente en una concentración adecuada en tampón F1. Prepare Xenopus laevis esperma como se describió anteriormente y almacenar en 1,5 x OR2 buffer en hielo hasta su uso.
- Montar la cámara Zigmond. Comience con una cámara limpia y seca. El uso de un lugar micropipeta una línea de aceite de silicona (4 l) de unos 5 mm y paralelo al borde exterior de cada canal. Coloque un vaso mm cubierta de 22x40 en la cámara permitiendo que el aceite de silicona para repartir uniformemente hasta el borde exterior de cada canal. Si los experimentos preliminares muestran que la adhesión de espermatozoides es un problema, puede ser necesario para cubrir la tapa de vidrio con nitrocelulosa según lo sugerido por Fabro et al. 3. Alterntivamente, la inclusión de proteína en la tampones utilizados (por ejemplo, BSA al 1%) también puede reducir la adherencia de esperma.
- Invertir en la cámara y el lugar en el corte circular en la platina del microscopio con cuidado de que la cubierta de cristal no hace contacto con el escenario. Esta configuración invertida es necesaria para que los espermatozoides a través de la Xenopus a la plataforma. A diferencia de los espermatozoides de mamíferos, los espermatozoides Xenopus no son lo suficientemente fuertes como para nadar contra la gravedad para llegar a la plataforma.
- Active 20 l de esperma Xenopus en 1,5 x OR2 buffer de mezcla 1:10 con tampón F1 a temperatura ambiente. Usando una micropipeta con una punta de corte, de inmediato la transferencia de 70 l de la motilidad del esperma-activa en la pila. Esto se logra mediante la celebración de la micropipeta en un ángulo bajo y colocando la punta en la abertura lateral del canal. La suspensión de células expulsado llena el canal y el puente por la acción capilar. A continuación, llenar el canal opuesto de la misma manera con una solución chemoatttractant.
- Empezar grabando a menos de 3 minutos (Xenopus esperma tienen una vida útil limitada la movilidad) y continuar durante 5 minutos. Al final de la filmación, desmontar la cámara y lavar los bebederos y la plataforma de observación con un chorro de agua a presión y luego etanol a partir de una botella con atomizador. Eliminar el aceite de silicona de la cara superior con toallitas de papel con cuidado de no contaminar la plataforma de observación y las depresiones.
- Si es necesario, convertir los datos de vídeo capturados con una secuencia de imágenes Tiff o pila usando el software Image J. A continuación, abra el archivo de la imagen J y en los primeros 21 cuadros (3 segundos) elegir un máximo de 50 espermatozoides para ser rastreados. Para evitar sesgos, optó por el esperma de todas las regiones del campo de observación y sin conocimiento de los datos de su trayectoria. La captura de dos dimensiones las trayectorias de células en el plano xy como una función del tiempo (XYT conjuntos de datos) para cada uno de esperma por punto y hacer clic con el ratón usando el plug-in MtrackJ módulo de Imagen de J. trayectorias visualizar y calcular la trayectoria dedistancias, los componentes del eje y la velocidad en MtrackJ. Por otra parte, llevar a cabo estas operaciones y su posterior análisis numérico (por ejemplo, la direccionalidad, la quimiotaxis de los parámetros y los histogramas de parámetros) por la importación de datos XYT pone en Microsoft Excel.
- Trayectorias de parcela para cada espermatozoide en Excel para detectar los patrones generales de movimiento, incluyendo los patrones lineales, curvilíneas y circulares, así como las características tales como giros. Utilizar datos XYT establece para calcular la velocidad media curvilínea, Travel Net a lo largo del X (pendiente) - y el eje Y, y los parámetros de orientación como el ángulo promedio de viajes en relación con el eje de degradado.
4. Los resultados representativos:
Importantes parámetros técnicos en el ensayo de dos cámaras son el tamaño y forma de la cámara, la porosidad de la membrana, y la duración de la incubación. El tamaño de la cámara alta la celebración de los espermatozoides no debe ser tan grande en diámetro que requieren un gran volumen de esperma (prepreferentemente en la de 0,5 ml o menos) ni tampoco la cámara alta a ser tan profunda como para crear una columna alta de la suspensión celular (<1 cm). El volumen de solución de cámara baja que rodea el inserto de la cámara superior deben coincidir exactamente con el nivel de la suspensión celular en la inserción a fin de no crear una presión hidrostática de transmembrana que artificialmente obligaría a los espermatozoides a través de la membrana. La colocación de la pieza vacía en el fondo del pozo primero, seguido por los resultados de carga de esperma en una presión hidrostática hacia arriba inicial que impide que los espermatozoides van través de la membrana durante la carga. Elección del tamaño de la membrana de poro es determinado por el tamaño de los espermatozoides, y la disponibilidad comercial de los insertos de membrana porosa. Nos encontramos con que los ensayos con el esperma de rana puede utilizar ya sea 8 o 12 m de diámetro, aunque los poros 12 poro ofrecer para el paso de un mayor número de espermatozoides que permite contar más precisa. Tamaños de poro superiores a 12 micras no parecen estar disponibles comercialmente. Una alternativa al uso de TIinserta ncidencia la cultura es el uso de las membranas neurosonda diseñados para ensayos de quimiotaxis en placas de 96 pocillos. Estos ofrecen un rendimiento potencial mayor y una amplia gama de diámetros de los poros. A pesar de esperma de mamíferos más grandes que parecen requerir un diámetro de poro grande, hemos logrado analizaron la quimiotaxis de los espermatozoides de ratón con insertos con 12 poros micras (Burnett, observaciones no publicadas). Por el contrario, de menor tamaño de los poros puede ser adecuado para las pequeñas de esperma (por ejemplo, los erizos de mar), aunque todavía no hemos probado esta posibilidad.
Una de las desventajas de la prueba de dos cámaras se describe es que los espermatozoides se colocan en la cámara superior por lo tanto resultan inevitablemente en algún pasaje de espermatozoides por gravedad, lo que disminuye la relación señal a fondo. Esto es necesario por el hecho de que el esperma Xenopus no son lo suficientemente vigoroso como en su movilidad para nadar en contra de la gravedad como son los espermatozoides de mamíferos. Otra dificultad en el ensayo de esperma Xenopus es el hecho de que su motilidad lel tiempo es corto IFE - 5 a 15 minutos después de la activación. Esta restricción es la base de la necesidad de activar un nuevo lote de esperma cada 2 a 3 minutos en la realización de múltiples ensayos. Como resultado, los estudios de tiempo de los cursos han demostrado que el pasaje más esperma se produce en los primeros 20 minutos de ensayo 5. A pesar de que el uso de un período de incubación de 50 minutos, este período podría probablemente se reducirá a 20 o 30 minutos. Por el contrario, los espermatozoides de ratón que siguen siendo móviles durante horas, se ha utilizado hasta un período de 2 horas de ensayo con buenos resultados (Burnett, observaciones no publicadas).
En el ensayo de doble cámara utilizando el esperma de rana, el número total de espermatozoides pasan a través de la membrana porosa es típicamente 10 a 20,000, o de 1 a 2% de los espermatozoides colocados en el inserto de la cámara superior. Presencia de un gradiente quimiotáctico en la cámara baja puede aumentar el pasaje de los espermatozoides hasta en un 4 a 10 veces. La figura 2 muestra una curva dosis-respuesta típica a cabo con este ensayo. Un extracto de Xenopus huevo jalea ("agua de huevo") que contiene el allurin chemoattractant proteína conocida (círculos rojos), fue colocado en la cámara de fondo en una serie de diluciones. La proteína de huevo total de agua contenida en cada ensayo se da en microgramos / ensayo - la cantidad entregada en el original, un volumen de 50 l. Dado que la proteína entregada formará un gradiente de difusión, el rango de concentración real de proteínas que responden a los espermatozoides no se conoce, pero se puede estimar a ser de 5 a 10 veces menor que la concentración de proteínas de la caída de entrega. Por esta razón, nos indica la cantidad de proteína introducida, no la concentración. Por lo general, llevamos a cabo ensayos por duplicado o triplicado para cada dosis y media el resultado, entonces replicar el experimento 3 o 4 veces utilizando el esperma de diferentes machos en cada experimento. La media y error estándar de la media se calcula para cada dosis con el error estándar de la media suele ser de 5 a 10% de la media. Tenga en cuenta que las proteínas sin KNOwn la actividad quimiotáctica, como la albúmina sérica bovina (círculos, fig. 2) puede producir un nivel bajo, no específica aumento en el pasaje de los espermatozoides a través de la membrana. Una observación interesante es que la curva dosis-respuesta para el agua de huevo es multifásica - una fase de aumento y una fase de descenso. Este tipo de relación multifásica es común que los quimioatrayentes esperma, la respuesta de los espermatozoides humanos de líquido folicular muestra una relación bifásica seis similares que se cree ser útil para que las altas concentraciones de chemoattractant se encuentra en las proximidades de un huevo puede servir para disminuir aún más las respuestas de la búsqueda por parte de los espermatozoides.
De vez en cuando nos encontramos con que los valores de control para esta prueba son más altas que lo normal, lo que reduce el aumento de veces producido por un chemoattractant. Por lo general, esto puede deberse a la rotura mecánica del elemento filtrante durante el ensayo. Por lo tanto, es importante que las inserciones no se alteran durante la carga de los espermatozoides o los chemoattractant, durante la incubación del ensayo o cuando la pieza se retira. Particularmente importante es que el depósito de espermatozoides en el inserto se elimina mediante micropipeta o la succión antes de levantar la tapa para extraerla del pozo. Esto asegura que los espermatozoides no son arrastrados a través de la membrana porosa en la cámara inferior de la pieza se retira.
Importantes parámetros técnicos en el ensayo de cámara Zigmond incluyen la distancia entre la plataforma cubre objetos y la observación, la ampliación de la observación de vídeo, el tipo de óptica utilizada, y la velocidad de fotogramas. Distancia entre la plataforma de observación es generalmente de 10 a 15 micras, aunque esta distancia se puede variar la cantidad de aceite de silicona utilizada para la interfaz entre el vidrio y la cubierta de la diapositiva de cámara - el aceite, mayor será la distancia. Un avión delgada de líquido aumenta la cantidad de tiempo necesario para un gradiente de forma, así como la longevidad de la pendiente, una vez formado. Un avión grueso de líquido permite una más rápida gformación Radient pero el gradiente tiene una vida útil más corta y menos estabilidad. La dinámica de la formación de pendiente se puede visualizar mediante el uso de un colorante fluorescente o un fluorescente dextrano en el quimioatrayente bien y utilizando microscopía de fluorescencia para ver la dinámica. El reactivo de la prueba debe corresponder en el peso molecular de la chemoattractant se utilizan y la dinámica determinada utilizada para juzgar a los minutos que se debe permitir la formación de pendiente y el registro de los movimientos de los espermatozoides.
El aumento que se usa debe ser (objetivo 4x o 10x) baja en general, si la plataforma de observación todo debe ser visualizada como en las condiciones de ensayo que hemos descrito. Por otro lado, un mayor aumento (40x o 63x objetivo) puede ser útil si uno se propone seguir la trayectoria de los segmentos relativamente corto, o si desea resolver los movimientos del flagelo. El seguimiento se puede realizar ya sea por métodos semi-manual como se describe en este documento o por el seguimiento automatizado tal como se practica en más soppaquetes de software tales como histicated MetaMorph o pista Imaris. En cualquier caso, la facilidad de seguimiento es muy dependiente de contraste de la imagen, ya sea por parte del operador o de software asistida por el reconocimiento de objetos. Aunque la óptica brillante de campo puede ser utilizado en algunos casos, el uso de la óptica de contraste de fase o campo oscuro óptica se requiere normalmente. Finalmente, la velocidad de fotogramas depende de la resolución en el tiempo deseado en el seguimiento. Si semi-manual se utilizan métodos como en nuestro procedimiento, es probablemente limitado a la velocidad de fotogramas relativamente baja - 4 a 8 fotogramas por segundo - debido a la naturaleza del trabajo intensivo de registro de datos. Por otro lado, las observaciones de vídeo tasa puede ser necesario para una respuesta rápida, como las formas de onda del flagelo. Con frecuencia, los objetivos experimentales son mejor servidos por hacer más lenta la velocidad de fotogramas y los experimentos más rápido experimentos velocidad de fotogramas por separado ya que uno también desea modificar otros parámetros como la ampliación, la óptica, o procesamiento digital de imágenes.
Los resultados típicos de la Zigmcámara de ensayo de seguimiento de la OND consiste en un conjunto de trayectorias como las observadas para el esperma de rana cincuenta en el video clip de la película 1. En contra de una imagen de la plataforma de observación, las trayectorias de los espermatozoides individuales trazados en rojo para un experimento de control (sin presencia del gradiente quimiotáctico). Las trayectorias de células de dos dimensiones en el plano xy como una función del tiempo para cada uno de los espermatozoides se pueden trazar y registrados por MtrackJ e importados en Microsoft Excel. Para el análisis de trayectoria, se designa el eje gradiente quimiotáctico en el eje X y el eje Y como eje ortogonal, de conformidad con la convención originalmente desarrollado por Fabro et al. 3. Como se muestra en el diagrama de la Figura 3, la trayectoria real que se se compone de los pasos, la suma de cuya longitud es igual a la distancia recorrida curvilínea en la trayectoria (azul / flechas de oro). La distancia de la red y la orientación de los viajes en cada espermatozoide es un vector que conecta el primer y último punto de la trayectoria (flecha roja en diagonal). LaTravel Net puede ser separada en sus componentes del eje X y eje Y de componentes (flechas rojas punteadas, también llamado red delta X y delta neto Y, respectivamente).
Debido a que la quimiotaxis de los vertebrados en el esperma puede implicar cambios relativamente sutiles en el sentido de la marcha, un gran número de espermatozoides (100 a 300), seleccionados al azar, son analizados para cada condición que a menudo requieren datos agrupados 4-6 experimentos independientes. Para efectos de ilustración, sin embargo, vamos a utilizar los datos de esperma de rana sólo cincuenta. La Tabla 1 muestra los parámetros comunes que se utilizan para detectar cambios en el transporte de esperma. El recorrido neto medio a lo largo del eje X se incrementará significativamente si, en presencia de un quimioatrayente, la población de espermatozoides en su conjunto sigue trayectorias que alinear más estrechamente con el gradiente. En nuestro ejemplo, la media neta del eje X aumento de los viajes más de tres veces en presencia de agua de huevo. También se puede trazar un histograma de la red de eje X de viaje para la población de espermatozoides que tiene la ventaja la ventaja de que pequeñas subpoblaciones de espermatozoides de respuesta pueden ser detectados. Dos parámetros desarrollados por Fabro et al. 3 también puede ayudar a detectar esas poblaciones. Tanto el porcentaje de espermatozoides que muestran neto positivo de recorrido del eje X (% Dx> 0) y el porcentaje de espermatozoides que muestran desplazamiento lineal neto no superior a 45 grados desde el eje de degradado (% Dx / | DY |> 1) puede aumentar considerablemente si toda la población de espermatozoides es sensible a la chemoattractant o por cantidades menores pero significativos si las subpoblaciones de espermatozoides son muy sensibles. Nuestro ejemplo en la Tabla 1 muestra un aumento de ambos parámetros de esperma de rana cincuenta expuesto a un gradiente de agua de huevo. Tenga en cuenta que al azar no orientado movimiento dará valores distintos de cero para ambos parámetros del 50% y 25% respectivamente, los valores de control superiores a este (como los de la Tabla 1) representar a un fondo ya sea debido a una serie de muestras de baja o a un sesgo en la orientación de los espermatozoides en particular en el diseño experimental.
contenido "Direccionalidad> de espermatozoides se desplazan en respuesta a los agentes quimioatrayente puede ser evaluado directamente por theta, el ángulo entre el vector de desplazamiento neto de cada espermatozoide y el gradiente (X)-eje. Nuestro ejemplo en la Tabla 1 muestra que la media theta disminuido de espermatozoides nadando en un gradiente de agua de huevo lo que indica que las trayectorias de los espermatozoides como la población se alinea mejor con el gradiente. Similar a la red de eje X de viaje (ver arriba), Thetas para la población de espermatozoides se puede expresar como una distribución, un enfoque también es sensible a las subpoblaciones de espermatozoides de respuesta y que se ha estudiado recientemente por Gakamsky et al 7.Finalmente, la velocidad curvilínea y la instantánea de los espermatozoides individuales también se pueden extraer de los datos que describen las trayectorias de dos dimensiones de células en el plano xy como una función del tiempo. Uno puede encontrar que hay un aumento en la velocidad, así como un cambio en la orientación de los viajes, lo que sugiere una respuesta chemokinetic, así comouna respuesta quimiotáctica.
Estos datos representan un punto de partida para el análisis de las trayectorias de los espermatozoides. Un análisis más detallado podría incluir mediciones de la linealidad y la curvatura de la trayectoria de un momento a momento como base llevado a cabo por Bohmer et al. 8 y Shiba et al. 9, la detección automática de vueltas realizadas por Burnett et al. 10, y la no linealidad como medido por el análisis fractal 11,12. A condición de que los espermatozoides nadar estas trayectorias son monitoreados a mayor aumento, se podría también movimientos de la imagen real de flagelar y señales de calcio tiempo llevado por varios laboratorios 8,9,13,14,15,16. Estos estudios han demostrado que tanto los invertebrados y los espermatozoides de mamíferos responden a factores quimiotácticos por las curvas cerradas de los espermatozoides hacia la fuente de gradiente quimiotáctico. Estos giros son acompañados por las curvas de flagelos que alteran la orientación de esperma tanto como un timón que, en las curvas que parecen iniciado por definir li, de las olaske señales de calcio a través de la propagación del flagelo. Por lo tanto, el objetivo final de seguimiento de los espermatozoides es correlacionar la dinámica del sistema de señalización con los cambios en la propulsión flagelar que sirven de base a la orientación de esperma en un gradiente quimiotáctico. Estos objetivos todavía no se han alcanzado en el esperma de Xenopus que viajan en un movimiento helicoidal 17, presentan poca curvatura en su trayectoria 10, y cuyas señales de calcio aún no han sido controlados.
Aunque nos hemos centrado aquí en detalle los métodos de análisis que utilizamos para Xenopus laevis espermatozoides, tanto en la cámara de ensayo de dos espermatozoides y la acumulación de la cámara Zigmond ensayo de seguimiento se pueden utilizar los espermatozoides de mamíferos, si se hacen ciertas modificaciones. Ambos ensayos se realizaron a 37 ° C si se desea, mediante el uso de una diapositiva más cálido y, en el ensayo de cámara Zigmond, una platina del microscopio más cálido. Por lo general, los espermatozoides de mamíferos se pueden aislar, capacitados y se incubaron con un adecuado buffers de mamíferosquimiotácticos d, pero el análisis de datos será similar a lo que se describe aquí para las especies de anfibios. Otra diferencia es que la cámara Zigmond se suele colocar en posición vertical en el escenario de un microscopio vertical ya que los espermatozoides de mamíferos, a diferencia de los espermatozoides Xenopus, se puede nadar en la plataforma de observación. Aún no probado, estos dos ensayos pueden ver la aplicación a los espermatozoides de un número de especies en el trabajo futuro.

Figura 1. Esquema del ensayo de dos cámaras. Los espermatozoides se colocan en una inserción de la parte inferior de la que es un filtro de policarbonato con poros de 12 micras. Una solución es quimioatrayente cuidadosamente con pipeta en el pozo para iniciar la formación de un gradiente de concentración.
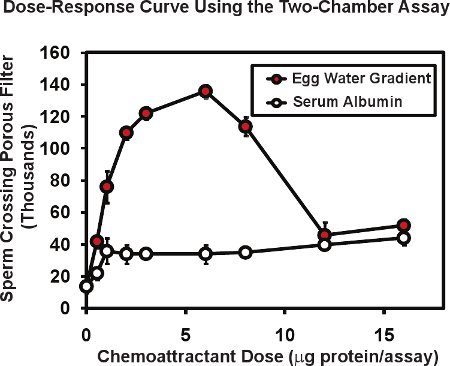
Figura 2. Los datos representativos para el esperma de rana con el esperma chemotaxi de dos cámarass ensayo. Agua de huevo preparado a partir de X. huevos laevis exhibe una dosis de varias fases de actividad de la curva que es característico de quimioatrayentes esperma. Albúmina de suero bovino aumenta el paso de espermatozoides sólo un poco - un efecto no específico de la proteína. Figura modificada de Al-Anzi y Chandler 5.
Movie 1. Un video que muestra las trayectorias de rana esperma trazado en rojo en la plataforma de observación de una cámara Zigmond. La anchura de la plataforma es de 1 mm. Haga clic aquí para ver el clip de vídeo.
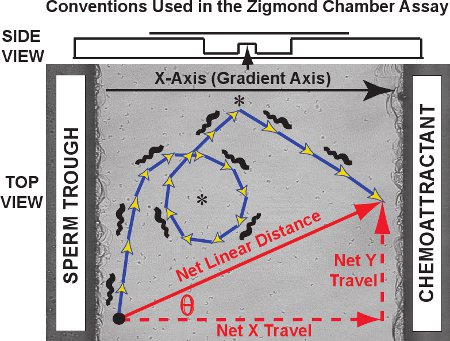
Convenios de la Figura 3. Axis, una trayectoria curvilínea de esperma y un vector de desplazamiento lineal red están ubicados en la plataforma de observación Zigmond cámara. Los datos obtenidos son de tres tipos. En primer lugar, las trayectorias de los espermatozoides a sí mismos (azul / flechas de oro) puede revelar Su patrones específicosch como círculos y vueltas (asteriscos). Distancia y la velocidad curvilínea curvilíneo se puede medir la trayectoria. En segundo lugar, la distancia lineal neto viajado más de toda la trayectoria, la red X (pendiente), componente del eje de los viajes, la red de los componentes del eje Y de los viajes y la theta ángulo entre el eje X y el vector de desplazamiento neto se puede calcular para cada trayectoria y en comparación, como una distribución en todo el esperma de seguimiento. Tercero, los cambios instantáneos en la velocidad y dirección de desplazamiento de los segmentos dentro de las trayectorias individuales pueden ser estudiados de forma individual o como una población. Arriba, una vista lateral de la cámara se presenta en un diagrama.

Tabla 1. Parámetros de uso frecuente en el análisis de los datos de la cámara Zigmond.
Access restricted. Please log in or start a trial to view this content.
Discusión
Quimiotaxis de células en movimiento, ya sea el movimiento ameboide o nadar flagelos potencia se encuentra en muchos contextos biológicos y el estudio de este fenómeno requiere la disponibilidad de ensayos de práctica y confiable. Algunos ejemplos de este fenómeno, como la atracción de los espermatozoides de un huevo de erizo de mar o la recolección de las células de moho del lodo para formar un cuerpo fructífero, tienen un impacto visual inmediato. La cuantificación de este fenómeno ha llevado a cabo en una ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Damos las gracias al Laboratorio WM Keck Bioimagen para el uso de su estación de trabajo de video microscopía. Este estudio fue financiado por la NSF IBN-0615435 concesión.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre de la pieza | Empresa | Número de catálogo | Comentarios |
| Placas de 24 pocillos | Becton-Dickenson | 35/1147 | |
| 12 inserciones mm de diámetro exterior con una membrana de poro de 12 micras | Millipore | PIXP01250 | Antes utilizábamos Costar, Corning placa Transwell # 3403-ahora suspendido |
| Zigmond cámara | Neurosonda | Z02 | |
| El aceite de silicona | General Electric | SF1154 | Equivalente a Dow Corning de fluidos 550 |
| Image J software | Wayne Rasband, Oficina de Servicios de Investigación, Instituto Nacional de Salud Mental | Descarga gratuita en http://rsbweb.nih.gov/ij | De programa de Java que se ejecuta en Windows, LinUX y Mac |
| MtrackJ software | Erik Meijering / Imagescience / Grupo de Imágenes Biomédicas , Erasmus MC - University Medical Center Rotterdam | Descarga gratuita en http://www.imagescience.org/meijering/software/mtrackj/ | De programa de Java que se ejecuta en Windows, Linux y Mac |
| Virtual Dub software | Licencia Pública General de GNU de software | Descarga gratis a través http://www.virtualdub.org/index.html | Instrucciones de configuración en la página web de J de la imagen en plugins, sólo para Windows |
| cellSens software | Olimpo | Véase el sitio web: http://www.olympusamerica.com/seg_section/product.asp? producto = 1070 | Los controles y toma imágenes de una variedad de cámaras. También tiene capacidad de procesamiento de imágenes |
Referencias
- Ward, G. E., Brokaw, C. J., Garbers, D. L., Vacquier, V. D. Chemotaxis of Arbacia punctulata spermatozoa to resact, a peptide from the egg jelly layer. J. Cell Biol. 101, 2324-2329 (1985).
- Olivera, R. G., Tomasi, L., Rovasio, R. A., Giojalas, L. C. Increased velocity and induction of chemotactic response in mouse spermatozoa by follicular and oviductal fluids. J. Reprod. Fertil. 115, 23-27 (1999).
- Fabro, G., Rovasio, R. A., Civalero, S., Frenkel, A., Caplan, S. R., Eisenbach, M., Giojalas, L. C. Chemotaxis of capacitated rabbit spermatozoa to follicular fluid revealed by a novel directionality-based assay. Biol. Reprod. 67, 1565-1571 (2002).
- Sugiyama, H., Burnett, L., Xiang, X., Olson, J., Willis, S., Miao, A., Akema, T., Bieber, A. L., Chandler, D. E. Purification and multimer formation of allurin, a sperm chemoattractant from Xenopus laevis egg jelly. Mol. Reprod. Dev. 76, 527-536 (2009).
- Al-Anzi, B., Chandler, D. Xenopus laevis egg jelly releases a sperm chemoattractant during spawning. Dev. Biol. 198, 366-375 (1998).
- Ralt, D., Goldenberg, M., Fetterolf, P., Thompson, D., Dor, J., Mashiach, S., Garbers, D. L., Eisenbach, M. Sperm attraction to a follicular factor(s) correlates with human egg fertilizability. Proc. Natl. Acad. Sci. U.S.A. 88, 2840-2844 (1991).
- Gakamsky, A., Schechtman, E., Caplan, S. R., Eisenbach, M. Analysis of chemotaxis when the fraction of responsive cells is small--application to mammalian sperm guidance. Int. J. Dev. Biol. 52, 481-487 (2008).
- Böhmer, M., Van, Q., Weyand, I., Hagen, V., Beyermann, M., Matsumoto, M., Hoshi, M., Hildebrand, E., Kaupp, U. B. Ca2+ spikes in the flagellum control chemotactic behavior of sperm. EMBO J. 24, 2741-2752 (2005).
- Shiba, K., Baba, S. A., Inoue, T., Yoshida, M. Ca2+ bursts occur around a local minimal concentration of attractant and trigger sperm chemotactic response. Proc. Natl. Acad. Sci. U.S.A. 105, 19312-19317 (2008).
- Burnett, L. A., Sugiyama, H., Bieber, A. L., Chandler, D. E. Egg jelly proteins stimulate directed motility in Xenopus laevis sperm. Mol. Reprod. Dev. 78, 450-462 (2011).
- Abaigar, T., Barbero, J., Holt, W. V. Trajectory variance and autocorrelations within single sperm tracks as population level descriptors of sperm track complexity, predictability and energy generating ability. J. Androl. , Forthcoming (2011).
- Mortimer, S. T., Swan, M. A., Mortimer, D. Fractal analysis of capacitating human spermatozoa. Hum. Reprod. 11, 1049-1054 (1996).
- Guerrero, A., Carneiro, J., Pimentel, A., Wood, C. D., Corkidi, G., Darszon, A. Strategies for locating the female gamete: the importance of measuring sperm trajectories in three spatial dimensions. Mol. Hum. Reprod. 17, 511-523 (2011).
- Yoshida, M., Yoshida, K. Sperm chemotaxis and regulation of flagellar movement by Ca2+. Mol. Hum. Reprod. 17, 457-465 (2011).
- Spehr, M., Schwane, K., Riffell, J. A., Zimmer, R. K., Hatt, H. Odorant receptors and olfactory-like signaling mechanisms in mammalian sperm.Mol. Cell. Endocrinol. 250, 128-136 (2006).
- Veitinger, T., Riffell, J. R., Veitinger, S., Nascimento, J. M., Triller, A., Chandsawangbhuwana, C., Schwane, K., Geerts, A., Wunder, F., Berns, M. W., Neuhaus, E. M., Zimmer, R. K., Spehr, M., Hatt, H. Chemosensory Ca2+ dynamics correlate with diverse behavioral phenotypes in human sperm. J. Biol. Chem. 286, 17311-17325 (2011).
- Tholl, N., Naqvi, S., McLaughlin, E., Boyles, S., Bieber, A. L., Chandler, D. E. Swimming of Xenopus laevis sperm exhibits multiple gears and its duration is extended by egg jelly constituents. Biol. Bull. 220, 174-185 (2011).
- Eisenbach, M. Sperm chemotaxis. Rev. Reprod. 4, 56-66 (1999).
- Riffell, J. A., Zimmer, R. K. Sex and flow: the consequences of fluid shear for sperm-egg interactions. J. Exp. Biol. 210, 3644-3660 (2007).
- Corkidi, G., Taboada, B., Wood, C. D., Guerrero, A., Darszon, A. Tracking sperm in three-dimensions. Biochem. Biophys. Res. Commun. 373, 125-129 (2008).
- Himes, J. E., Riffell, J. A., Zimmer, C. A., Zimmer, R. K. Sperm chemotaxis as revealed with live and synthetic eggs. Biol Bull. 220, 1-5 (2011).
- Sun, F., Giojolas, L. C., Rovasio, R. A., Tur-Kaspa, I., Sanchez, R., Eisenbach, M. Lack of species-specificity in mammalian sperm chemotaxis. Dev. Biol. 255, 423-427 (2003).
- Guidobaldi, H. A., Teves, M. E., Uñates, D. R., Anastasía, A., Giojalas, L. C. Progesterone from the cumulus cells is the sperm chemoattractant secreted by the rabbit oocyte cumulus complex. PLoS One. 3, e3040-e3040 (2008).
- Oren-Benaroya, R., Orvieto, R., Gakamsky, A., Pinchasov, M., Eisenbach, M. The sperm chemoattractant secreted from human cumulus cells is progesterone. Hum. Reprod. 23, 2339-2345 (2008).
- Teves, M. E., Guidobaldi, H. A., Uñates, D. R., Sanchez, R., Miska, W., Publicover, S. J., Morales Garcia, A. A., Giojalas, L. C. Molecular mechanism for human sperm chemotaxis mediated by progesterone. PLoS One. 4, 8211-82 (2009).
- Blengini, C. S., Teves, M. E., Uñates, D. R., Guidobaldi, H. A., Gatica, L. V., Giojalas, L. C. Human sperm pattern of movement during chemotactic re-orientation towards a progesterone source. Asian J. Androl. 13, 769-773 (2011).
- Strünker, T., Goodwin, N., Brenker, C., Kashikar, N. D., Weyand, I., Seifert, R., Kaupp, U. B. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. J. Exp. Med. 115, 453-465 (1962).
- Zigmond, S. H., Lauffenburger, D. A. Assays of leukocyte chemotaxis. Annu. Rev. Med. 37, 149-155 (1986).
- Villanueva-Diaz, C., Vadillo-Ortega, F., Kably-Ambe, A., Diaz-Pérez, M. A., Krivitzky, S. K. Evidence that human follicular fluid contains a chemoattractant for spermatozoa. Fertil. Steril. 54, 1180-1182 (1990).
- Villanueva-Diaz, C., Arizs-Martinez, J., Bermejo-Martinez, L., Vadillo-Ortega, F. Progesterone induces human sperm chemotaxis. Fertil. Steril. 64, 1183-1188 (1995).
- Olson, J., Xiang, X., Ziegert, T., Kittleson, A., Rawls, A., Bieber, A., Chandler, D. E. A. llurin a 21 kD sperm chemoattractant from Xenopus egg jelly, is homologous to mammalian sperm-binding proteins. Proc. Natl. Acad. Sci. U.S.A. 98, 11205-11210 (2001).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados