È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Due tipi di saggi per chemiotassi Frog rilevamento sperma
In questo articolo
Riepilogo
Uova e rivestimenti extracellulare intorno uova di frequente rilascio peptidi, proteine e piccole molecole che comunicano con lo sperma per guidarli verso l'ovulo promuovendo in tal modo la fecondazione. Con sperma rana che descrivere e confrontare due classi di test utilizzato per rilevare chemiotassi degli spermatozoi - analisi di accumulo dello sperma e test di tracciamento degli spermatozoi.
Abstract
Chemiotassi degli spermatozoi negli invertebrati può essere sufficientemente robusto che si può mettere una pipetta contenente il peptide attraente in una sospensione di spermatozoi e microscopicamente visualizzare accumulo di sperma intorno alla pipetta 1. Chemiotassi degli spermatozoi nei vertebrati come rane, roditori ed esseri umani è più difficile da rilevare e richiede analisi quantitative. Tali dosaggi sono di due tipi principali - saggi che quantificare il movimento degli spermatozoi ad una fonte di chemoattractant, i cosiddetti saggi di accumulo degli spermatozoi, e saggi che in realtà traccia le traiettorie individuali di nuoto degli spermatozoi.
Saggi di accumulo degli spermatozoi sono decine permettendo relativamente rapido o centinaia di test da fare in un solo giorno, consentendo in tal modo le curve dose-risposta e corsi di tempo per essere eseguiti in modo relativamente rapido. Questi tipi di test sono stati ampiamente utilizzati per caratterizzare molti sistemi chemiotassi ben consolidato - per esempio, chemiotassi dei neutrofili al bacpeptidi materiali e chemiotassi degli spermatozoi al liquido follicolare. Test di tracciamento degli spermatozoi può essere più laborioso, ma offrono ulteriori dati su come chemoattractancts effettivamente alterare i percorsi di nuoto che lo sperma prendere. Questo tipo di test è necessario per dimostrare l'orientamento del movimento degli spermatozoi rispetto all'asse gradiente chemoattrractant e visualizzare trasforma caratteristica o cambiamenti di orientamento che portano lo sperma più vicino al uovo.
Qui si descrivono i metodi utilizzati per ciascuno di questi due tipi di test. Il saggio di accumulazione sperma utilizzato è chiamato un saggio "bicamerale". Spermatozoi anfibi sono inseriti in un inserto piastra di coltura dei tessuti con un pavimento filtro in policarbonato con pori di diametro 12 micron. Inserti con spermatozoi vengono inseriti in pozzi colture di tessuti piastra contenente tampone e un chemoatttractant attentamente pipettati nella parte inferiore e dove il pavimento incontra il muro (vedi fig. 1). Dopo l'incubazione, l'inserto superiore che contiene il serbatoio degli spermatozoi viene accuratamente removed, e lo sperma nella camera di fondo che sono passati attraverso la membrana vengono rimossi, pellettato e poi contati da emocitometro o citometria a flusso.
Il test di tracciamento degli spermatozoi utilizza una camera di Zigmond originariamente sviluppato per l'osservazione chemiotassi dei neutrofili e modificato per l'osservazione di spermatozoi da parte Giojalas e collaboratori 2,3. La camera è costituito da una lastra di vetro di spessore in cui due depressioni verticali sono state lavorate. Questi sono separati da una piattaforma di osservazione 1 mm di larghezza. Dopo l'applicazione di una copertura in vetro, gli spermatozoi vengono caricati in una mangiatoia, l'agente chemiotattico nell'altra e il movimento degli spermatozoi singoli visualizzati al microscopio video. Riprese video viene poi analizzata utilizzando software per identificare bidimensionale movimenti delle cellule nel piano xy in funzione del tempo (XYT set di dati) che formano la traiettoria di ogni sperma.
Protocollo
1. Materiali e tamponi usati
- Buffer Ringer ovocita di (1,5 x OR2) contiene 124 mM NaCl, 3.75 mM KCl, 1,5 mM CaCl 2, 1,5 mM MgCl 2, 1,5 mM Na 2 HPO 4, 10 Hepes mM, pH 7.8. Buffer fecondazione (F-1) contiene 41,25 mM NaCl, 1,25 mM KCl, 0,25 mM CaCl 2, 0,06 mM MgCl 2, 0.5 mM Na 2 HPO 4, 2,5 Hepes mM, pH 7.8.
- Xenopus laevis acqua uovo è preparato secondo Sugiyama et al. 4. Brevemente descritto, appena deposto le uova uova di rana in gelatina sono roteato in un piccolo volume di F-1 buffer per 30 minuti e il mezzo condizionato rimosso da micropipetta. Questo mezzo, denominato "acqua uovo", può essere utilizzato anche per preparare purificata allurin, il fattore chemiotattico primario in questo estratto gelatina. Spermatozoi sono ottenuti da commercialmente allevati Xenopus laevis o Xenopus tropicalis.
- Vedere la tabella materiali per gli elementi specifici necessari in tlo saggio.
2. Una bicamerale per il test chemiotassi degli spermatozoi rana
- Anestetizzare la rana per immersione in acqua contenente 0,07% benzocaina, decapitare con un paio di forbici taglio carborundum, e midollo doppio per assicurare l'eutanasia. Tagliare via la pelle dell'addome per esporre muscolare. Tagli linea mediana e laterale del muscolo addominale e ritrattare. Delicatamente ritrattare intestino grasso e di rivelare bianco, a forma di fagiolo testicoli. Troncare tessuto connettivo con una forbici facendo attenzione ad evitare i vasi sanguigni. Rimozione di un testicolo, lavare via il sangue con 1,5 x OR2 buffer, quindi scorrere il testicolo su carta da filtro per rimuovere il tampone in eccesso e piccoli vasi sanguigni aderenti, e quindi inserire il testicolo in un piatto di plastica Pitre in 0,2 ml di 1,5 x OR2 buffer. Riempire una siringa da 5 ml con 2 ml di 1,5 x OR2 tampone, colpire delicatamente 10-20 buchi nel testicolo su gran parte della superficie ad una estremità, inserire l'ago dalla parte opposta, iniettare delicatamente tampone per scovare sperma. In alternativa, sipuò iniettare buffer mentre colpendo i fori di uscita per scovare sperma. Trasferire la sospensione degli spermatozoi utilizzando una micropipetta con un cut-off punta (evitando taglio dello sperma) in una provetta e luogo sul ghiaccio.
- Stimare il numero di spermatozoi rana ottiene diluendo 1:100 sperma in 1,5 x O-2 e prendendo un campione di 20 ml di sospensione sperma miscelato e contando il numero di cellule utilizzando un emocitometro e la grande 1 mm 2 zona. Utilizzando il conteggio emocitometro e rapporto di campionamento calcolare la densità dello sperma e il numero totale di spermatozoi raccolti. Il totale è di solito 2 - 6 x 10 7 dello sperma in un volume di circa 2 ml, quando entrambi i testicoli sono usati. Diluire la sospensione sperma magazzino con 1,5 x OR2 tampone per ottenere una densità dello sperma di 2 x 10 7 / ml. Utilizzare lo sperma di analisi entro 2 o 3 ore di preparazione. Valutare la motilità degli spermatozoi diluendo 5 ml di sperma 1:10 con F-1 buffer e visualizzare il movimento con ottica a contrasto di fase. Almeno il 40% al 50% dello spermadevono essere mobili. Anche preparativi adeguati conterrà un gran numero di spermatozoi immotile maggior parte dei quali sono immaturi.
- Preparare un nuovo 24-plastica e piastra di coltura dei tessuti da micropipetting 700 ml di buffer di F1 in ogni pozzetto. Ogni bene dovrebbe essere di circa 15 mm di diametro sul fondo.
- Inizia una serie di test diluendo 100 ml di sospensione degli spermatozoi con 900 ml di buffer di F1 a temperatura ambiente (circa 21 a 23 ° C) in una provetta per attivare la motilità dello sperma da shock osmotico. Ogni volta lo sperma fresco viene attivato in questo modo, gli spermatozoi devono essere utilizzati entro 1-2 minuti.
- Inserire una porosità 12 micron inserire (12 mm od) in un buffer pieno di bene, assicurarsi che il posizionamento inserto è fuori centro, lasciando lo spazio ad un lato. Trasferire immediatamente il 400 ml di motilità degli spermatozoi attivi nel bene da una micropipetta con un cut-off punta. Applicare la sospensione dello sperma alla parete dell'inserto filtro e farlo correre giù sul filtro nella parte inferiore del secoloe inserire, la sospensione dello sperma non dovrebbe essere pipettati direttamente sul filtro.
- Attentamente micropipetta 50 ml di agente chemiotattico nel pozzo nello spazio tra il pozzo e il fuori centro filtro. Bisogna stare attenti a depositare la caduta in cui il lato e fondo del pozzo si incontrano e ritirare la pipetta senza alcun disturbo al sistema. In particolare, lo stantuffo sulla micropipetta deve essere spinto solo fino alla prima fermata in modo da espellere completamente il campione, ma non bolle d'aria.
- Ripetere i passi 2.5 e 2.6 qui sopra per avviare test come numero di copie necessario, incubare la piastra fino a quando il test è iniziato incubato 50 minuti. Tipicamente, si può iniziare un saggio ogni 45 a 60 secondi. Si noti che il test può essere semplificato da una persona esperta o da due persone che lavorano insieme. In questo caso, una o due file di test può essere avviato con uno stock maggiore di spermatozoi mobili e veloci pipettaggio a condizione che gli spermatozoi sono sempre utilizzati entro 1 o 2 minuti diattivazione.
- Fermare ogni test nella sequenza iniziata. In primo luogo, con attenzione costante l'inserto del filtro con una mano e con l'altra togliere con cura tutti o quasi tutti della sospensione dello sperma nella camera superiore con micropipetta o per aspirazione con una pipetta Pasteur. Immediatamente, utilizzando una pinzetta sottile, estrarre l'inserto del filtro e scartare. La cura deve essere utilizzato in questa fase, almeno lo sperma rimanente essere spazzato attraverso il filtro artifactually innalzamento dei valori per il passaggio degli spermatozoi.
- Da ogni piastra bene, trasferire la sospensione intero sperma in una provetta da microcentrifuga. E 'importante mescolare la sospensione degli spermatozoi nel pozzo prima del ritiro dal spermatozoi tendono a depositarsi sul fondo. Aggiungere 15 ml di formaldeide al 25% ad una concentrazione finale dello 0,5% v / v e conservare in frigorifero, se il numero degli spermatozoi non sono fatte lo stesso giorno.
- Pellet lo sperma in ogni tubo con un 10 secondo giro pulsante su una microcentrifuga personale aventi una velocità massima di 2000 x g. Rimuovere tutti ma 100 l di supernatformica da ciascuna provetta, poi risospendere il precipitato in quel volume. Prelevare 20 ml di sospensione di spermatozoi, diluire 1:10 con acqua distillata, e numero di spermatozoi in un emocitometro utilizzando un obiettivo 40x su un microscopio verticale. Utilizzare i conteggi ed i fattori di diluizione per calcolare il numero totale di spermatozoi che passava attraverso il filtro di ogni test.
3. Rana inseguimento test spermatozoi utilizzando una camera di Zigmond
- Preparare la workstation microscopio invertito per videoregistrazione. Usiamo una Nikon Elipse TE300 microscopio invertito dotate di un DXC-390 di Sony 3-chip di telecamera a colori analogica o un ORCA-03G Hamamatsu fotocamera digitale monocromatica. La slitta camera Zigmond deve poggiare sul palco up-side-down con una sufficiente apertura nella piastra palco per ospitare un vetro di copertura 22x40 mm. Questa disposizione è reso necessario dal fatto che lo sperma rana non sono in grado di nuotare contro la gravità. Messa a fuoco sia una lente obiettivo 4x e 10x sulla piattaforma di osservazione che corre tra i duedepressioni.
- Test per assicurarsi che la fotocamera è mirato e centrato sulla piattaforma di osservazione. Se la fotocamera Sony è utilizzato, l'output viene inviato a un monitor e ad un convertitore A / D (frame grabber) in grado di digitalizzare 7 fotogrammi al secondo dal segnale video. Il flusso digitale è elaborato utilizzando un computer che esegue a 3 GHz o superiore preferibilmente con 4 Gb di RAM. Anche se usiamo software Image Scion (una versione personalizzata di Windows del NIH Image) il controllo di un rampollo CG-7 frame grabber, questi prodotti non sono più disponibili. Una soluzione attuale è quella di utilizzare il software J immagine con una VirtualDub Plug-in per la cattura analogica videocamera. Se la fotocamera è usata Hamamatsu, la sua uscita digitale viene elaborata dal software Olympus cellSens e visualizzati sul monitor del computer. In entrambi i casi, i dati vengono salvati su di un disco rigido interno o esterno come una pila a 8-bit TIFF. Utilizzo di software Image Scion richiede la conversione della sequenza di immagini Tiff a una pila utilizzando immagini J.
- Il campo microscopico dovrebbe includere tutte o gran parte della larghezza di piattaforma di osservazione. Utilizzare contrasto di fase o ottiche campo scuro per i migliori risultati. La distanza tra la superficie piattaforma di osservazione e la parte inferiore del vetro di copertura dovrebbe essere 15-20 micron come determinato dal differenziale concentrandosi su ogni superficie.
- Preparare la chemiotattico ad una idonea concentrazione nel buffer F1. Preparare Xenopus laevis sperma come descritto in precedenza e conservare in 1,5 x OR2 tampone sul ghiaccio fino al momento dell'uso.
- Montare la camera Zigmond. Inizia con una camera di asciutto e pulito. Utilizzando un luogo micropipetta una linea di olio di silicone (4 mL) di circa 5 mm e parallele al bordo esterno di ogni canale. Inserire una copertura in vetro 22x40 mm su la camera permette l'olio di silicone per diffondere in modo uniforme verso il bordo esterno di ogni canale. Se esperimenti preliminari dimostrano che attaccare lo sperma è un problema, che si possano desiderare di rivestire il vetro di copertura con nitrocellulosa come suggerito da Fabro et al. 3. Alterntivamente, l'inclusione di proteine nei buffer (ad es 1% BSA) può anche ridurre attaccare sperma.
- Invertire la camera e posto sopra il ritaglio circolare in fase di microscopio facendo attenzione che il vetro di copertura non fa contatto con il palcoscenico. Questa configurazione invertita è necessario portare lo sperma di Xenopus dal trogolo sulla piattaforma. A differenza di sperma nei mammiferi, lo sperma di Xenopus non sono forti abbastanza per nuotare contro la gravità per raggiungere la piattaforma.
- Attivare 20 l di sperma Xenopus in 1,5 x OR2 buffer 1:10 miscelazione con tampone F1 a temperatura ambiente. Usando una micropipetta con una punta tagliata, trasferire immediatamente 70 ml di motilità degli spermatozoi attivato nel trogolo. Questo si ottiene tenendo la micropipetta con un angolo basso e mettendo la punta all'apertura laterale della vasca. La sospensione cellulare espulso riempie il trogolo e ponte per azione capillare. Successivamente, riempire la mangiatoia di fronte nello stesso modo usando una soluzione chemoatttractant.
- Iniziare videoregistrazione in 3 minuti (spermatozoi Xenopus hanno una durata limitata motilità) e proseguire per 5 minuti. Alla fine della videoregistrazione, smontare la camera e lavare gli abbeveratoi e piattaforma di osservazione con un flusso a pressione d'acqua e poi di etanolo da un flacone con spruzzatore. Rimuovere l'olio di silicone dalle superfici superiore con salviette di carta facendo attenzione a non contaminare la piattaforma di osservazione e le depressioni.
- Se necessario, convertire i dati video acquisiti in un sequenza di immagini Tiff o stack con J software Image. Quindi aprire il file immagine in J e nei primi 21 fotogrammi (3 secondi) scegliere fino a 50 spermatozoi per essere rintracciati. Per evitare distorsioni, ha scelto di sperma da tutte le regioni del campo di osservazione e senza la conoscenza dei propri dati traiettoria. Cattura bidimensionale traiettorie cella nel piano xy in funzione del tempo (XYT set di dati) per ogni spermatozoo da puntare e fare clic del mouse utilizzando il plug-in MtrackJ modulo per immagini J. Visualizza traiettorie e calcolare la traiettoriadistanze, i componenti degli assi e delle velocità all'interno MtrackJ. In alternativa, effettuare queste operazioni e ulteriori analisi numerica (es. direzionalità, parametri chemiotassi e istogrammi dei parametri) importando i dati XYT mette in Microsoft Excel.
- Traiettorie trama per ogni spermatozoo in Excel per individuare modelli generali del movimento, ivi compresa lineare, i modelli curvilinei, e circolare così come le caratteristiche come la giri. Utilizzare i dati XYT set per calcolare la velocità media curvilineo, viaggio lungo la rete X (gradiente) - e l'asse Y, e parametri di orientamento come l'angolo medio di viaggio rispetto all'asse gradiente.
4. Rappresentante dei risultati:
Importanti parametri tecnici nel test di due camere sono di dimensioni e forma della camera, la porosità della membrana, e la lunghezza di incubazione. La dimensione della camera alta tenendo lo sperma non dovrebbe essere così grande in diametro da richiedere una grande quantità di sperma (prepreferenza quello 0,5 ml o meno) né la camera alta è così profonda da creare una colonna alta di sospensione cellulare (<1 cm). Il volume di tampone camera inferiore che circonda l'inserto superiore camera deve corrispondere esattamente al livello della sospensione di cellule in l'inserto in modo da non creare una pressione idrostatica transmembrana che artifactually forza degli spermatozoi attraverso la membrana. Posizionamento dell'inserto vuoto nella parte inferiore e per primo, seguito da risultati sperma di carico in una prima pressione idrostatica verso l'alto che impedisce allo sperma di passare attraverso la membrana durante il caricamento. Scelta della dimensione dei pori della membrana è determinata dalla dimensione degli spermatozoi, e la disponibilità commerciale di inserti membrana porosa. Troviamo che i test con lo sperma rana può utilizzare sia a 8 o 12 micron di diametro pori anche se 12 micron pori consentire la circolazione di un numero maggiore di spermatozoi permettendo conteggio più accurato. Dimensioni dei pori maggiore di 12 micron non sembrano essere disponibili in commercio. Un'alternativa all'utilizzo di TIinserti cultura ssue è l'uso delle membrane Neuroprobe progettato per le analisi chemiotassi in piastre da 96 pozzetti. Queste offrono un rendimento potenzialmente maggiore e una più ampia gamma di diametri dei pori. Sebbene gli spermatozoi più grandi mammiferi sembrerebbe richiedere un diametro dei pori più grandi, abbiamo analizzato con successo la chemiotassi degli spermatozoi mouse utilizzando inserti con 12 micron pori (Burnett, osservazioni non pubblicate). Al contrario, le dimensioni dei pori più piccoli potrebbe essere sufficiente per i più piccoli dello sperma (per esempio, riccio di mare), anche se non abbiamo ancora testato questa possibilità.
Uno svantaggio della bicamerale test descritto è che gli spermatozoi vengono inseriti nella camera superiore così che derivi inevitabilmente in qualche passaggio dello sperma dalla forza di gravità, diminuendo così il rapporto segnale-fondo. Ciò è reso necessario dal fatto che lo sperma di Xenopus non sono abbastanza forti nella loro motilità di nuotare contro la gravità come lo sono gli spermatozoi dei mammiferi. Un'altra difficoltà nel saggiare lo sperma di Xenopus è il fatto che la loro motilità lIFE tempo è breve - 5 a 15 minuti dopo l'attivazione. Questa restrizione è la base per la necessità di attivare un nuovo gruppo di spermatozoi ogni 2 o 3 minuti nello svolgimento test multipli. Di conseguenza, gli studi di sviluppo nel tempo hanno dimostrato che il passaggio più sperma si verifica entro i primi 20 minuti di test 5. Anche se usiamo un periodo di incubazione di 50 minuti, questo periodo potrebbe essere probabile corto circuito a 20 o 30 minuti. Al contrario, per gli spermatozoi che rimangono mobili del mouse per ore, abbiamo usato fino ad un periodo di 2 ore di test con buoni risultati (Burnett, osservazioni non pubblicate).
Nella bicamerale test utilizzando lo sperma di rana, il numero totale di spermatozoi passano attraverso la membrana porosa è tipicamente 1-20 o circa l'1-2% dello sperma posto nella inserto camera superiore. Presenza di un gradiente chemiotattico nella camera inferiore può aumentare il passaggio degli spermatozoi fino a 4 a 10 volte. La figura 2 illustra una tipica curva dose-risposta eseguiti con questa analisi. Un estratto di Xenopus uovo gelatina ("acqua uovo") contenente la proteina nota allurin chemiotattico (cerchi rossi), è stata collocata nella camera di fondo, a una serie di diluizioni. Il totale delle proteine dell'uovo acqua contenuta in ogni test è dato in microgrammi / saggio - l'importo consegnato in originale volume di 50 microlitri. Dal momento che la proteina consegnato formeranno un gradiente di diffusione, l'intervallo di concentrazione reale di proteine che lo sperma rispondere non è noto, ma può essere stimato in 5 a 10 volte inferiore alla concentrazione di proteine della goccia consegnato. Per questo motivo, indichiamo la quantità di proteine introdotte, non la concentrazione. Di solito si eseguono test di doppio o triplo, per ogni dose media e il risultato, abbiamo quindi replicare l'esperimento tutto 3 o 4 volte con lo sperma di maschi diversi in ogni esperimento. L'errore medio e standard della media è calcolata per ogni dose con l'errore standard della media di solito è 5 al 10% della media. Si noti che le proteine senza knochemiotattico attività wn come albumina di siero bovino (cerchi aperti, fig. 2) può produrre un basso livello, aumento aspecifico nel passaggio degli spermatozoi attraverso la membrana. È interessante osservare che la curva dose-risposta per l'acqua uovo è multifasico - una fase di crescita e una fase di diminuzione. Questo tipo di relazione multifasico è comune per chemiotattici spermatozoi, la risposta di sperma umano di liquido follicolare mostra un 6 simile rapporto bifasica che si ritiene essere utile in che alte concentrazioni di chemoattractant trovano nelle vicinanze di un uovo può servire a diminuire ulteriormente le risposte alla ricerca da parte dello sperma.
Capita di trovare che i valori di controllo per questo saggio sono più alti del normale, riducendo così l'aumento volte prodotta da un fattore chemiotattico. Di solito, questo può essere ricondotti a distruzione meccanica degli inserti del filtro durante il test. Quindi, è importante che inserisce non sono disturbati durante il caricamento della sperma o il Chemoattractant, nel corso del saggio o quando l'inserto è stato rimosso. Particolarmente importante è che il serbatoio degli spermatozoi nel foglietto viene rimosso dalla micropipetta o di aspirazione prima di sollevare l'inserto fuori dal pozzo. Questo assicura che gli spermatozoi non sono spazzate attraverso la membrana porosa nella camera di fondo come l'inserto è stato rimosso.
Importanti parametri tecnici nel test di camera di Zigmond includono la distanza tra la piattaforma coprioggetti e osservazione, l'ingrandimento di osservazione video, il tipo di ottica usato, e il frame rate. Distanza tra la piattaforma di osservazione è di solito 10-15 micron, anche se questa distanza può essere variata la quantità di olio di silicone utilizzato come interfaccia tra il vetro di copertura e la diapositiva camera - l'olio più, maggiore è la distanza. Un piano sottile di liquido aumenta la quantità di tempo necessario per un gradiente per formare così come la longevità del gradiente di una volta formate. Un aereo più spessa di liquido permette una più rapida gformazione radient ma il gradiente ha una durata più breve e meno stabilità. La dinamica di formazione di pendenze possono essere visualizzati utilizzando un colorante fluorescente o un destrano fluorescente nel chemoattractant bene e usando la microscopia a fluorescenza per visualizzare le dinamiche. Il reagente di test deve essere abbinata a peso molecolare del fattore chemiotattico in uso e le dinamiche determinato utilizzato per valutare quanti minuti dovrebbe essere consentito per la formazione di pendenze e la registrazione dei movimenti degli spermatozoi.
L'ingrandimento utilizzato deve essere basso (obiettivo 4x o 10x) complessivo se la piattaforma di osservazione l'intero deve essere visualizzato come nelle condizioni di analisi che abbiamo descritto. D'altra parte, una maggiore ingrandimento (obiettivo 40x o 63x) può essere utile se si intende monitorare segmenti di traiettoria relativamente breve, o se desidera risolvere movimenti flagellare. Monitoraggio può essere effettuato da semi-manuale metodi descritti in questo documento o per il monitoraggio automatico come praticato in più soppacchetti software histicated come MetaMorph o traccia Imaris. In entrambi i casi, la facilità di monitoraggio dipende molto il contrasto delle immagini che si tratti dal gestore o dal software assistito il riconoscimento di oggetti. Anche se l'ottica in campo chiaro può essere utilizzato in alcuni casi, l'uso di ottiche contrasto di fase o campo scuro ottica è comunemente richiesto. Infine, il frame rate dipende dalla risoluzione tempo desiderato in inseguimento. Se semi-manuale metodi sono utilizzati come nella nostra procedura, si è probabilmente limitato a frame rate relativamente basso - da 4 a 8 fotogrammi al secondo - a causa della natura del lavoro intensivo dei dati di registrazione. D'altra parte, le osservazioni video tasso può essere richiesto per reagire rapidamente, come le forme d'onda flagellare. Spesso, gli obiettivi sperimentali sono meglio serviti facendo esperimenti frame rate più lento e più veloce esperimenti frame rate separatamente poiché si vuole anche di modificare altri parametri come ingrandimento, l'ottica, o di elaborazione delle immagini digitali.
I risultati tipici per il Zigmtest camera condo monitoraggio consistono in un insieme di traiettorie simili a quelli visti per cinquanta sperma rana nel video clip di Movie 1. Contro l'immagine della piattaforma di osservazione, le traiettorie di spermatozoi individuali sono tracciate in rosso per un esperimento di controllo (non presente gradiente chemiotattico). Bidimensionale traiettorie cella nel piano xy in funzione del tempo per ogni spermatozoo possono essere tracciati e registrati da MtrackJ e importati in Microsoft Excel. Per l'analisi della traiettoria, si designa l'asse chemoattractant sfumatura come asse X e l'asse Y come asse ortogonale, in coerenza con la convenzione originariamente sviluppato da Fabro et al. 3. Come mostrato nel grafico di figura 3, la traiettoria reale presa è composto da passi, la somma di cui lunghezza è uguale alla distanza curvilinea percorsa in traiettoria (blu / frecce d'oro). La distanza netta e l'orientamento di viaggio da ogni spermatozoo è un vettore che collega il punto primo e l'ultimo della traiettoria (freccia rossa diagonale). Ilviaggi rete può essere separato nelle sue componenti dell'asse X e Y componente (rosso frecce tratteggiate, anche chiamato net X delta e netto delta Y, rispettivamente).
Perché chemiotassi negli spermatozoi dei vertebrati può comportare cambiamenti relativamente sottili in direzione di marcia, un gran numero di spermatozoi (da 100 a 300), scelti a caso, di solito sono analizzati per ogni condizione che spesso richiedono dati raccolti 4-6 esperimenti indipendenti. Ai fini di illustrazione, tuttavia, useremo i dati di solo cinquanta sperma rana. La tabella 1 illustra i parametri comunemente utilizzati per rilevare i cambiamenti nel viaggio dello sperma. Il viaggio netta media rispettivamente lungo l'asse X destinati ad aumentare se, in presenza di un fattore chemiotattico, la popolazione degli spermatozoi nel suo complesso segue traiettorie che un più stretto allineamento con il gradiente. Nel nostro esempio, la media netta asse X corsa aumentata di tre volte in presenza di acqua uovo. Si può anche tracciare un istogramma di rete corsa dell'asse x per la popolazione degli spermatozoi, che ha il vantaggio tage che i piccoli sottopopolazioni di sperma reattiva può essere rilevato. Due parametri sviluppata da Fabro et al. 3 può anche aiutare a individuare tali popolazioni. Sia la percentuale di spermatozoi che mostra netta positiva corsa dell'asse x (% Ax> 0) e la percentuale di spermatozoi che mostrano netti viaggio lineare non superiore a 45 gradi dall'asse del gradiente (% Ax / | ΔY |> 1) può aumentare notevolmente se l'intera popolazione degli spermatozoi è sensibile al fattore chemiotattico o per importi minori ma comunque significative se sottopopolazioni di spermatozoi sono sensibili. Il nostro esempio nella tabella 1 mostra un aumento in entrambi i parametri di sperma rana fifty esposti ad un gradiente di acqua uovo. Si noti che casuale non orientati movimento daranno valori diversi da zero per entrambi i parametri del 50% e 25% rispettivamente, i valori di controllo superiore a questo (come quelli nella tabella 1) rappresentano uno sfondo a causa di un numero di campioni a bassa o ad una distorsione delle orientamento spermatozoi particolare al disegno sperimentale.
contenuto "Direzionalità> di viaggio dello sperma nella risposta agli agenti chemiotattico può essere valutato direttamente dal theta, l'angolo tra il vettore di viaggio netti per ogni sperma e il gradiente (X)-asse. Il nostro esempio nella tabella 1 mostra che la media è diminuita theta per il nuoto degli spermatozoi in un gradiente di acqua uovo indica che le traiettorie dello sperma come una popolazione erano più in linea con il gradiente. Simile al netto di corsa dell'asse x (vedi sopra), thetas per la popolazione degli spermatozoi può essere espresso come una distribuzione, un approccio sensibile anche di sottopopolazioni di sperma reattivo e quello che è stato recentemente studiato da Gakamsky et al 7.Infine, le velocità curvilinea e istantanei per gli spermatozoi possono anche essere estratte dai dati che descrivono bidimensionale traiettorie cella nel piano xy in funzione del tempo. Si potrebbe scoprire che c'è un aumento di velocità così come un cambiamento di orientamento di viaggio, suggerendo così una risposta chemiocinetica così comeuna risposta chemiotattica.
Questi dati rappresentano un punto di partenza per l'analisi delle traiettorie degli spermatozoi. Ulteriori analisi potrebbero includere misure di linearità traiettoria e curvatura su un momento per momento come base svolte da Bohmer et al. 8 e Shiba et al. 9, il rilevamento automatico dei giri effettuati da Burnett et al. 10, e non linearità come misurato attraverso l'analisi frattale 11,12. A condizione che lo sperma nuoto queste traiettorie sono monitorati a più alto ingrandimento, si potrebbe anche mozioni immagine flagellare e tempo reale i segnali di calcio come trasportato da diversi laboratori 8,9,13,14,15,16. Tali studi hanno dimostrato che sia invertebrati e spermatozoi dei mammiferi rispondono a fattori chemiotattici da curve strette dello sperma in pendenza verso la sorgente chemoattractant. Questi si sono accompagnate da curve flagellare che alterano l'orientamento dello sperma tanto quanto un timone che, curve che sembrano iniziata da definire, onde lisegnali di calcio ke propagazione attraverso il flagello. Così, l'obiettivo finale di monitoraggio degli spermatozoi è di correlare segnalazione dinamica dei sistemi con i cambiamenti nella propulsione flagelli che servono come base dell'orientamento dello sperma in un gradiente chemiotattico. Questi obiettivi devono ancora essere raggiunto nello sperma di Xenopus che viaggiano con un movimento elicoidale 17, presentano bassa curvatura nelle loro traiettorie 10, e il cui calcio segnali devono ancora essere controllati.
Anche se ci siamo concentrati qui in dettaglio i metodi di analisi che utilizziamo per gli spermatozoi di Xenopus laevis, sia i due spermatozoi test camera di accumulo e il saggio camera Zigmond di monitoraggio può essere utilizzato per lo sperma nei mammiferi, se alcune modifiche sono fatti. Entrambi i test può essere effettuato a 37 ° C se lo si desidera, mediante l'uso di uno scivolo più caldo e, nel saggio camera Zigmond, una fase più calda microscopio. Tipicamente, lo sperma dei mammiferi saranno isolati, capacitati e incubate con opportuni buffer di uno dei mammiferid chemiotattici, ma l'analisi dei dati sarà simile a quanto descritto qui per specie di anfibi. Una ulteriore differenza è che la camera Zigmond è di solito collocato in posizione verticale sul palcoscenico di un microscopio in posizione verticale in quanto gli spermatozoi dei mammiferi, a differenza degli spermatozoi di Xenopus, possono nuotare fino sulla piattaforma di osservazione. Ancora testato, questi due saggi possono vedere l'applicazione allo sperma di un certo numero di specie in futuri lavori.

Figura 1. Schema della bicamerale test. Spermatozoi vengono inseriti in un inserto la cui parte inferiore è un filtro in policarbonato con 12 micron pori. Una soluzione chemiotattico è attentamente pipettati nel pozzetto di avviare la formazione di un gradiente di concentrazione.
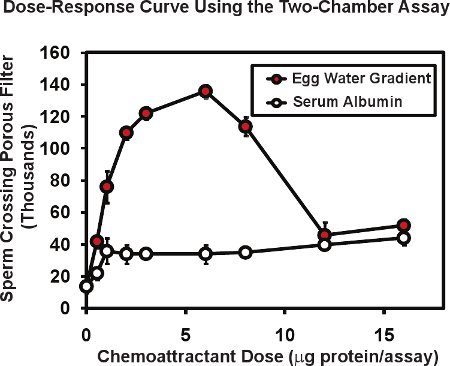
Dati rappresentante Figura 2. Rana di spermatozoi utilizzando la bicamerale spermatozoi chemotaxis saggio. Acqua uovo preparata da X. uova laevis mostra una multifase curva dose-attività che è caratteristica di fattori chemiotattici sperma. Sieroalbumina bovina passaggio degli spermatozoi aumenta solo di poco - un effetto non specifico di proteine. Figura modificata da Al-Anzi & Chandler 5.
Movie 1. Un video che mostra le traiettorie degli spermatozoi rana tracciate in rosso sulla piattaforma di osservazione di una camera Zigmond. La larghezza della piattaforma è di 1 mm. Clicca qui per vedere il video clip.
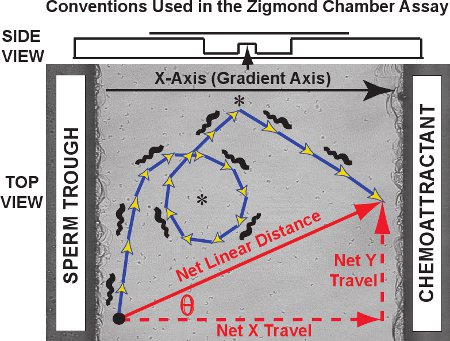
Convenzioni Asse Figura 3., Una traiettoria curvilinea dello sperma e un vettore di rete viaggio lineari sono tracciate sulla piattaforma di osservazione camera Zigmond. I dati ottenuti sono di tre tipi. In primo luogo, le traiettorie degli spermatozoi stessi (blu / frecce d'oro) può rivelare particolari su modellich come cerchi e si trasforma (asterischi). Distanza curvilinea curvilinee e velocità può essere misurata per il percorso traiettoria. In secondo luogo, la distanza netta lineare percorribile l'intero percorso, la rete X (gradiente) componente asse del viaggio, la rete componente asse Y del viaggio e del theta angolo tra l'asse X e il vettore di viaggio rete può essere calcolato per ogni traiettoria e confrontati come una distribuzione su tutti i tracciati degli spermatozoi. In terzo luogo, i cambiamenti istantanei di velocità e direzione di marcia per segmenti all'interno di percorsi individuali possono essere studiati singolarmente o in una popolazione. Sopra, una vista laterale della camera è presentato in un diagramma.

Tabella 1. Parametri frequentemente utilizzati in analisi dei dati dalla camera di Zigmond.
Access restricted. Please log in or start a trial to view this content.
Discussione
Chemiotassi di cellule in movimento da entrambe movimento ameboide o flagelli alimentato il nuoto è presente in molti contesti biologici e lo studio di questo fenomeno richiede la disponibilità di test pratici e affidabili. Alcuni esempi del fenomeno, come l'attrazione degli spermatozoi per un uovo di riccio di mare o la raccolta di cellule stampo melma per formare un corpo fruttifero, hanno immediato impatto visivo. La quantificazione di questo fenomeno è stata intrapresa in diversi modi, come descritto da Eisen...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Ringraziamo il Bioimmagini WM Keck Laboratorio per l'uso della propria postazione di lavoro microscopia video. Questo studio è stato supportato da NSF concedere IBN-0615435.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome della voce | Azienda | Numero di catalogo | Commenti |
| 24-pozzetti | Becton, Dickinson | 35/1147 | |
| 12 inserti mm di diametro esterno di 12 micron pori della membrana | Millipore | PIXP01250 | In precedenza avevamo usato Costar-Corning piastra transwell # 3403, ora sospeso |
| Zigmond camera | Neuroprobe | Z02 | |
| Olio di silicone | General Electric | SF1154 | Equivalente a Fluido Dow Corning 550 |
| Immagine J software | Wayne Rasband, servizi Settore di Ricerca, Istituto Nazionale di Salute Mentale | Download gratuito all'indirizzo http://rsbweb.nih.gov/ij | Programma Java che gira su Windows, LinUX e Mac |
| MtrackJ software | Erik Meijering / Imagescience / Biomedical Imaging Group , Erasmus MC - University Medical Center di Rotterdam | Scaricabile gratuitamente dal http://www.imagescience.org/meijering/software/mtrackj/ | Programma Java che gira su Windows, Linux e Mac |
| Virtual Dub software | GNU General Public licenza software | Download gratuito tramite http://www.virtualdub.org/index.html | Istruzioni di installazione sul sito Immagine J sotto plugins, solo per Windows |
| cellSens software | Olimpo | Vedere il sito: http://www.olympusamerica.com/seg_section/product.asp? prodotto = 1070 | Controlli e acquisisce immagini da una serie di telecamere. Ha anche capacità di elaborazione immagini |
Riferimenti
- Ward, G. E., Brokaw, C. J., Garbers, D. L., Vacquier, V. D. Chemotaxis of Arbacia punctulata spermatozoa to resact, a peptide from the egg jelly layer. J. Cell Biol. 101, 2324-2329 (1985).
- Olivera, R. G., Tomasi, L., Rovasio, R. A., Giojalas, L. C. Increased velocity and induction of chemotactic response in mouse spermatozoa by follicular and oviductal fluids. J. Reprod. Fertil. 115, 23-27 (1999).
- Fabro, G., Rovasio, R. A., Civalero, S., Frenkel, A., Caplan, S. R., Eisenbach, M., Giojalas, L. C. Chemotaxis of capacitated rabbit spermatozoa to follicular fluid revealed by a novel directionality-based assay. Biol. Reprod. 67, 1565-1571 (2002).
- Sugiyama, H., Burnett, L., Xiang, X., Olson, J., Willis, S., Miao, A., Akema, T., Bieber, A. L., Chandler, D. E. Purification and multimer formation of allurin, a sperm chemoattractant from Xenopus laevis egg jelly. Mol. Reprod. Dev. 76, 527-536 (2009).
- Al-Anzi, B., Chandler, D. Xenopus laevis egg jelly releases a sperm chemoattractant during spawning. Dev. Biol. 198, 366-375 (1998).
- Ralt, D., Goldenberg, M., Fetterolf, P., Thompson, D., Dor, J., Mashiach, S., Garbers, D. L., Eisenbach, M. Sperm attraction to a follicular factor(s) correlates with human egg fertilizability. Proc. Natl. Acad. Sci. U.S.A. 88, 2840-2844 (1991).
- Gakamsky, A., Schechtman, E., Caplan, S. R., Eisenbach, M. Analysis of chemotaxis when the fraction of responsive cells is small--application to mammalian sperm guidance. Int. J. Dev. Biol. 52, 481-487 (2008).
- Böhmer, M., Van, Q., Weyand, I., Hagen, V., Beyermann, M., Matsumoto, M., Hoshi, M., Hildebrand, E., Kaupp, U. B. Ca2+ spikes in the flagellum control chemotactic behavior of sperm. EMBO J. 24, 2741-2752 (2005).
- Shiba, K., Baba, S. A., Inoue, T., Yoshida, M. Ca2+ bursts occur around a local minimal concentration of attractant and trigger sperm chemotactic response. Proc. Natl. Acad. Sci. U.S.A. 105, 19312-19317 (2008).
- Burnett, L. A., Sugiyama, H., Bieber, A. L., Chandler, D. E. Egg jelly proteins stimulate directed motility in Xenopus laevis sperm. Mol. Reprod. Dev. 78, 450-462 (2011).
- Abaigar, T., Barbero, J., Holt, W. V. Trajectory variance and autocorrelations within single sperm tracks as population level descriptors of sperm track complexity, predictability and energy generating ability. J. Androl. , Forthcoming (2011).
- Mortimer, S. T., Swan, M. A., Mortimer, D. Fractal analysis of capacitating human spermatozoa. Hum. Reprod. 11, 1049-1054 (1996).
- Guerrero, A., Carneiro, J., Pimentel, A., Wood, C. D., Corkidi, G., Darszon, A. Strategies for locating the female gamete: the importance of measuring sperm trajectories in three spatial dimensions. Mol. Hum. Reprod. 17, 511-523 (2011).
- Yoshida, M., Yoshida, K. Sperm chemotaxis and regulation of flagellar movement by Ca2+. Mol. Hum. Reprod. 17, 457-465 (2011).
- Spehr, M., Schwane, K., Riffell, J. A., Zimmer, R. K., Hatt, H. Odorant receptors and olfactory-like signaling mechanisms in mammalian sperm.Mol. Cell. Endocrinol. 250, 128-136 (2006).
- Veitinger, T., Riffell, J. R., Veitinger, S., Nascimento, J. M., Triller, A., Chandsawangbhuwana, C., Schwane, K., Geerts, A., Wunder, F., Berns, M. W., Neuhaus, E. M., Zimmer, R. K., Spehr, M., Hatt, H. Chemosensory Ca2+ dynamics correlate with diverse behavioral phenotypes in human sperm. J. Biol. Chem. 286, 17311-17325 (2011).
- Tholl, N., Naqvi, S., McLaughlin, E., Boyles, S., Bieber, A. L., Chandler, D. E. Swimming of Xenopus laevis sperm exhibits multiple gears and its duration is extended by egg jelly constituents. Biol. Bull. 220, 174-185 (2011).
- Eisenbach, M. Sperm chemotaxis. Rev. Reprod. 4, 56-66 (1999).
- Riffell, J. A., Zimmer, R. K. Sex and flow: the consequences of fluid shear for sperm-egg interactions. J. Exp. Biol. 210, 3644-3660 (2007).
- Corkidi, G., Taboada, B., Wood, C. D., Guerrero, A., Darszon, A. Tracking sperm in three-dimensions. Biochem. Biophys. Res. Commun. 373, 125-129 (2008).
- Himes, J. E., Riffell, J. A., Zimmer, C. A., Zimmer, R. K. Sperm chemotaxis as revealed with live and synthetic eggs. Biol Bull. 220, 1-5 (2011).
- Sun, F., Giojolas, L. C., Rovasio, R. A., Tur-Kaspa, I., Sanchez, R., Eisenbach, M. Lack of species-specificity in mammalian sperm chemotaxis. Dev. Biol. 255, 423-427 (2003).
- Guidobaldi, H. A., Teves, M. E., Uñates, D. R., Anastasía, A., Giojalas, L. C. Progesterone from the cumulus cells is the sperm chemoattractant secreted by the rabbit oocyte cumulus complex. PLoS One. 3, e3040-e3040 (2008).
- Oren-Benaroya, R., Orvieto, R., Gakamsky, A., Pinchasov, M., Eisenbach, M. The sperm chemoattractant secreted from human cumulus cells is progesterone. Hum. Reprod. 23, 2339-2345 (2008).
- Teves, M. E., Guidobaldi, H. A., Uñates, D. R., Sanchez, R., Miska, W., Publicover, S. J., Morales Garcia, A. A., Giojalas, L. C. Molecular mechanism for human sperm chemotaxis mediated by progesterone. PLoS One. 4, 8211-82 (2009).
- Blengini, C. S., Teves, M. E., Uñates, D. R., Guidobaldi, H. A., Gatica, L. V., Giojalas, L. C. Human sperm pattern of movement during chemotactic re-orientation towards a progesterone source. Asian J. Androl. 13, 769-773 (2011).
- Strünker, T., Goodwin, N., Brenker, C., Kashikar, N. D., Weyand, I., Seifert, R., Kaupp, U. B. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. J. Exp. Med. 115, 453-465 (1962).
- Zigmond, S. H., Lauffenburger, D. A. Assays of leukocyte chemotaxis. Annu. Rev. Med. 37, 149-155 (1986).
- Villanueva-Diaz, C., Vadillo-Ortega, F., Kably-Ambe, A., Diaz-Pérez, M. A., Krivitzky, S. K. Evidence that human follicular fluid contains a chemoattractant for spermatozoa. Fertil. Steril. 54, 1180-1182 (1990).
- Villanueva-Diaz, C., Arizs-Martinez, J., Bermejo-Martinez, L., Vadillo-Ortega, F. Progesterone induces human sperm chemotaxis. Fertil. Steril. 64, 1183-1188 (1995).
- Olson, J., Xiang, X., Ziegert, T., Kittleson, A., Rawls, A., Bieber, A., Chandler, D. E. A. llurin a 21 kD sperm chemoattractant from Xenopus egg jelly, is homologous to mammalian sperm-binding proteins. Proc. Natl. Acad. Sci. U.S.A. 98, 11205-11210 (2001).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon