A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שני סוגים של מבחני עבור Chemoattraction גילוי זרע צפרדע
In This Article
Summary
ביצים ציפוי תאית סביב ביצים לעתים קרובות שחרור פפטידים, חלבונים ומולקולות קטנות אשר לתקשר עם זרע כדי להנחות אותם אל הביצה ובכך לקדם את ההפריה. שימוש בזרע צפרדע אנו מתארים ולהשוות שני מעמדות של מבחני לשמש כדי לזהות chemoattraction זרע - הצטברות זרע מבחני ומעקב מבחני הזרע.
Abstract
Chemoattraction זרע חסרי חוליות יכולים להיות חזקים מספיק שאפשר במקום טפטפת המכיל את פפטיד אטרקטיבי לתוך ההשעיה זרע מיקרוסקופית לדמיין הצטברות זרע סביב פיפטה 1. Chemoattraction זרע בעלי חוליות כגון צפרדעים, מכרסמים ובני אדם קשה יותר לזהות דורש מבחני כמותי. מבחני אלה שני סוגים עיקריים - מבחני כי לכמת תנועה זרע למקור של chemoattractant, שנקרא הצטברות מבחני זרע, מבחני שבעצם המסלול מסלולי השחייה של זרע בודדים.
הצטברות מבחני זרע עשרות המאפשר מהיר יחסית או מאות מבחני להיעשות ביום אחד, ובכך לאפשר תגובה מינון עקומות וקורסים זמן להתבצע במהירות יחסית. אלו סוגים של מבחני נעשה שימוש נרחב כדי לאפיין רבים מערכות chemoattraction מבוססת היטב - לדוגמה, chemotaxis נויטרופילים כדי BACפפטידים terial ו chemotaxis זרע בנוזל הזקיקים. מעקב מבחני זרע יכול להיות עבודה יותר אינטנסיבית אבל להציע נתונים נוספים על אופן chemoattractancts למעשה לשנות את נתיבי שחייה לקחת זרע. סוג זה של assay יש צורך להוכיח את הכיוון של תנועת הזרע יחסית לציר שיפוע chemoattrractant וכדי להמחיש פונה מאפיין או שינויים בכיוון זה להביא את הזרע קרוב יותר אל הביצית.
כאן אנו מתארים את השיטות של כל אחד אלה שני סוגים של מבחני. הצטברות זרע assay מנוצל נקרא "שתי קאמרית" assay. זרע דוחי ממוקמים להכניס תרבות צלחת רקמה עם רצפת פוליקרבונט בעל מסנן בקוטר 12 מיקרומטר הנקבוביות. הוספת עם זרע ממוקמים בתוך התרבות רקמות בארות צלחת ובה חיץ chemoatttractant pipetted בזהירות לתוך קרקעית הבאר שבו הרצפה פוגש את הקיר (ראו איור. 1). לאחר דגירה, להכניס העליון המכיל את מאגר הזרע בזהירות removed, והזרע בתא התחתון שעברו דרך הממברנה מוסרים, pelleted וספר מכן על ידי hemocytometer או cytometer לזרום.
Assay מעקב זרע מנצל קאמרית Zigmond שפותחה במקור עבור התבוננות chemotaxis נויטרופילים ואת שונה להסתכלות על ידי הזרע של Giojalas ועמיתים לעבודה 2,3. תא מורכב שקופית זכוכית עבה שלתוכו שתי שקתות אנכי כבר במכונה. אלה מופרדים באמצעות פלטפורמה 1 תצפית רחב מ"מ. לאחר היישום של זרע זכוכית, מכסים נטענים לתוך השוקת אחד, סוכן chemoattractant לתוך השני התנועה של הזרע במיקרוסקופ על ידי הפרט דמיינו וידאו. קטעי וידאו מנותח ולאחר מכן באמצעות תוכנה לזיהוי דו מימדי תנועות תא במישור xy כפונקציה של זמן (xyt ערכות נתונים) היוצרות את המסלול של כל הזרע.
Protocol
1. חומרים המשמשים מאגרים
- מאגר Ringer של הביצית (1.5 x OR2) מכיל 124 mM NaCl, KCl mM 3.75, 1.5 mM CaCl 2, 1.5 מ"מ MgCl 2, 1.5 mM Na 2 HPO 4, 10 Hepes מ"מ, pH 7.8. מאגר הפריה (F-1) מכיל 41.25 mM NaCl, KCl mM 1.25, 0.25 mM CaCl 2, 0.06 mM MgCl 2, 0.5 mM Na 2 HPO 4, 2.5 Hepes מ"מ, pH 7.8.
- Xenopus מים laevis ביצה מוכנה פי סוגיאמה et al. 4. תיאר בקצרה, הוליד טרי צפרדע ביצים קרוש הם הסתחררו בנפח קטן של חיץ F-1 במשך 30 דקות ו המדיום מותנה להסיר micropipette. המדיום הזה, שמכונה "ביצת מים", יכול לשמש גם כדי להכין מטוהרים allurin, chemoattractant העיקרי בתמצית זו ג'לי. זרע מתקבלים bred מסחרית Xenopus laevis או Xenopus tropicalis.
- ראה טבלה של חומרים עבור פריטים ספציפיים הדרושים tהוא assay.
2. Assay שני קאמרית chemotaxis זרע צפרדע
- להרדים את הצפרדע על ידי טבילה במים המכיל 0.07% בנזוקאין, לערוף באמצעות מספריים קצוות carborundum, ומוח כפול על מנת להבטיח המתת חסד. לחתוך עור הבטן כדי לחשוף שרירים. לבצע חתכים לרוחב קו האמצע ואת שרירי הבטן לסגת. בעדינות לחזור במעיים שומן לחשוף לבן, שעועית בצורת האשכים. לחתוך רקמות החיבור באמצעות מספריים בסדר להיות זהירים ולהימנע כלי הדם. הסרת אשך, לשטוף את כל הדם באמצעות 1.5 x OR2 חיץ, ואז לגלגל את testis על נייר פילטר להסיר חיץ עודף קטן חסיד כלי הדם, ולאחר מכן למקם את testis בצלחת pitre פלסטיק 0.2 מ"ל של 1.5 חיץ OR2 x. ממלאים מזרק עם 5 מ"ל 2 מ"ל של חיץ OR2 1.5 x, בעדינות לתקוע 10-20 חורים testis על פני רוב השטח בקצה אחד, הכנס את המחט בקצה השני בעדינות להזריק חיץ כדי לרוקן את הזרע. לחילופין, אחדיכול להזריק חיץ תוך דוקר את חורי היציאה לשטוף את הזרע. מעבירים את ההשעיה הזרע באמצעות micropipette עם קצה ניתוק (הימנעות הגז של הזרע) כדי צינור microcentrifuge ומניחים על קרח.
- להעריך את מספר הזרע צפרדע מתקבל על ידי דילול 1:100 זרע 1.5 x-2 או ולקיחת דגימה של 20 μl ההשעיה זרע מעורבת ספירת תאים באמצעות hemocytometer ואת גדול 1 2 שטח מ"מ. שימוש לספור hemocytometer יחס הדגימה לחשב צפיפות הזרע את המספר הכולל של זרע שנקטפו. בסך הכל זה בדרך כלל 2-6 x 10 7 זרע בהיקף של כ - 2 מ"ל כאשר שני האשכים נמצאים בשימוש. לדלל את ההשעיה זרע מניות עם חיץ 1.5 OR2 x להשיג צפיפות הזרע של 2 x 10 7 / מ"ל. השתמש זרע assay בתוך 2 עד 3 שעות של הכנה. הערכת תנועתיות הזרע על ידי דילול 5 μl של 1:10 זרע עם חיץ F-1 ותנועה בניגוד חזותי באמצעות אופטיקה שלב. לפחות 40% עד 50% של הזרעיש ניעתי. גם ההכנות מתאים יכיל מספר גדול של זרע immotile שרובן לא בשלה.
- הכן חדש 24 גם צלחת פלסטיק בתרבית רקמה על ידי micropipetting 700 μl של חיץ F1 היטב לתוך כל אחד. כל טוב צריך להיות בערך 15 מ"מ קוטר בתחתית.
- התחל סדרה של מבחני ידי דילול 100 μl של השעיה זרע עם 900 μl של חיץ F1 בטמפרטורת החדר (כ 21-23 ° C) בצינור microcentrifuge להפעיל את תנועתיות הזרע על ידי הלם אוסמוטי. כל הזמן זרע חדש מופעל באופן זה, הזרע חייב לשמש בתוך 1-2 דקות.
- מניחים 12 מיקרומטר להכניס נקבוביות (12 מ"מ OD) לתוך מאגר מלא היטב, לוודא את מיקום הכנס הוא מחוץ למרכז משאיר חלל בצד אחד. מיד להעביר 400 μl של תנועתיות הזרע לתוך הבאר מופעל על ידי micropipette בעל קצה חתוכים. החל את ההשעיה זרע לקיר של להכניס את המסנן ולאפשר לו לרוץ למטה על המסנן בתחתית הדואר להכניס; ההשעיה הזרע לא צריך להיות pipetted ישירות על גבי המסנן.
- בזהירות micropipette 50 μl של סוכן chemoattractant לתוך הבאר במרחב בין טוב לבין להכניס מחוץ למרכז המסנן. יש להיזהר להפקיד את הירידה בו את הצד התחתון של הבאר להיפגש למשוך את פיפטה עם הפרעה אין למערכת. באופן ספציפי, הבוכנה על micropipette יש דחף היחידה לעצור הראשונה כדי להוציא לחלוטין את המדגם, אך לא בועות אוויר.
- חזור על שלבים 2.5 ו -2.6 לעיל כדי להתחיל מבחני רבות ככל הדרוש, ואז דגירה את הצלחת עד assay הראשון התחיל כבר מודגרות 50 דקות. בדרך כלל, אפשר להתחיל assay כל 45 עד 60 שניות. שים לב assay יכול להיות יעיל על ידי אדם מנוסה, או על ידי שני אנשים עובדים יחד. במקרה זה, אחת או שתי שורות של מבחני יכול להיות יזם עם מלאי גדול יותר של זרע ניעתי מהר pipetting ובלבד זרע משמשים תמיד בתוך 1 עד 2 דקות שלההפעלה.
- עצור כל assay ברצף התחיל. ראשית, יציב לסנן בקפידה את הכנס ביד אחת עם אחרים בזהירות להסיר את רוב או את כל השעיה הזרע בחדר העליון על ידי micropipette או על ידי שאיבה עם פיפטה פסטר. מיד, בעזרת פינצטה בסדר, להוציא את הכנס לסנן ולמחוק. טיפול יש להשתמש בשלב זה, לפחות הזרע שנותרו להיסחף דרך המסנן artifactually העלאת ערכי למעבר הזרע.
- מתוך כל צלחת היטב, להעביר את ההשעיה זרע כולו צינור microcentrifuge. חשוב לערבב את ההשעיה זרע גם לפני הנסיגה מאז הזרע נוטים ליישב לתחתית. הוסף 15 μl של פורמלדהיד 25% בריכוז סופי של 0.5% v / v ושמים במקרר אם ספירת זרע לא נעשים באותו יום.
- גלולה הזרע בתוך צינור זה באמצעות 10 ספין second כפתור ללחוץ על microcentrifuge אישי בעל מהירות מקסימלית של 2000 x ז הסר את כל אבל 100 μl של supernatנמלה מצינור אחד, אז resuspend גלולה בהיקף זה. קח 20 μl של השעיה זרע, לדלל 1:10 עם מים מזוקקים, ואת ספירת הזרע על hemocytometer באמצעות מטרה 40X על מיקרוסקופ זקוף. השתמש ספירת וגורמים דילול כדי לחשב את המספר הכולל של זרע שעבר המסנן כל assay.
3. זרע צפרדע מעקב assay באמצעות תא Zigmond
- הכן את העבודה מיקרוסקופ הפוכה עבור צילום וידיאו. אנו משתמשים Elipse Nikon TE300 מיקרוסקופ הפוך מצויד גם DXC-390 סוני 3 שבב מצלמה צבע וידאו אנלוגי או מצלמה ORCA-03G Hamamatsu דיגיטלי בצבע. השקופית קאמרית Zigmond חייב לנוח על הבמה למעלה בצד למטה עם פתח מספיק הצלחת שלב כדי להכיל זכוכית לכסות 22x40 מ"מ. הסדר זה חייבה העובדה זרע צפרדע אינם מסוגלים לשחות נגד כוח הכבידה. פוקוס או עדשה או אובייקטיבי 4x 10x על התצפית ריצה בין שנישקתות.
- מבחן כדי לוודא שהמצלמה ממוקדת התרכזו התצפית. אם המצלמה סוני משמש, הפלט נשלח צג וידאו ו-A / D ממיר (grabber מסגרת) מסוגל digitizing 7 פריימים לשנייה מן אות וידאו. זרם דיגיטלי מעובד באמצעות מחשב שפועל במהירות 3 גיגהרץ או יותר רצוי עם 4 GB או יותר של זיכרון RAM. למרות שאנו משתמשים בתוכנה Scion תמונה (גירסה מותאמת אישית של Windows NIH תמונה) שליטה CG-7 נצר grabber מסגרת, מוצרים אלה אינם זמינים עוד. הפתרון הנוכחי הוא להשתמש J תוכנה תמונה עם VirtualDub Plug-in עבור לכידת וידאו אנלוגי המצלמה. אם המצלמה Hamamatsu משמש, הפלט הדיגיטלי שלה הוא מעובד על ידי תוכנות cellSens אולימפוס ומוצגים על צג המחשב. בשני המקרים, הנתונים נשמר בכונן הקשיח או פנימי או חיצוני כמו ערימה TIFF 8-bit. השימוש בתוכנה תמונה Scion דורש המרה של רצף התמונה Tiff מחסנית באמצעות תמונה ג'
- שדה מיקרוסקופיים צריך לכלול רוב או את כל רוחב הפלטפורמה תצפית. שימוש בניגוד שלב או אופטיקה שדה כהה לקבלת התוצאות הטובות ביותר. המרחק בין משטח התצפית הפלטפורמה התחתונה של הזכוכית המכסה צריך להיות 15-20 מיקרומטר כפי שנקבע על ידי ההפרש התמקדות פני כל.
- הכן את chemoattractant בריכוז מתאים במאגר F1. הכנת הזרע Xenopus laevis כפי שתואר לעיל ולאחסן במאגר OR2 1.5 x על הקרח עד לשימוש.
- להרכיב את תא Zigmond. התחל עם חדר נקי ויבש. באמצעות מקום micropipette שורה של שמן סיליקון (4 μl) על 5 מ"מ מן ובמקביל בקצה החיצוני של כל אפיק. מניחים כוס 22x40 מ"מ לכסות על החדר המאפשר שמן סיליקון כדי להתפשט באופן שווה על הקצה החיצוני של כל שוקת. אם ניסויים ראשוניים מראים כי דבק זרע מהווה בעיה, אפשר צורך המעיל זכוכית מכסים nitrocellulose כפי שהוצע על ידי Fabro et al. 3. Alternatively, הכללתם של חלבון מאגרים בשימוש (למשל BSA 1%) יכול גם להפחית דבק הזרע.
- הפוך את החדר ואת המקום על נתק החוזר בשלב מיקרוסקופ נזהר כי הזכוכית המכסה אינה ליצור קשר עם הבמה. תצורה זו הפוכה הדרוש על מנת להביא זרע Xenopus מן השוקת על הרציף. שלא כמו יונקים זרע, זרע Xenopus אינם חזקים מספיק כדי לשחות נגד כוח המשיכה להגיע אל הרציף.
- הפעלת 20 μl של זרע Xenopus במאגר OR2 1.5 x 01:10 על ידי ערבוב עם חיץ F1 בטמפרטורת החדר. שימוש micropipette עם טיפ לחתוך, מיד להעביר 70 μl של תנועתיות הזרע פעילה לתוך השוקת. זו מושגת על ידי קיום micropipette בזווית נמוכה ומיקום קצה בפתיחת בצד השוקת. השעיית תא נפלט ממלא את השוקת ולגשר על ידי פעולה נימי. בשלב הבא, למלא את השוקת ממול באותו אופן באמצעות פתרון chemoatttractant.
- בגין מצלמים בתוך 3 דקות (זרע Xenopus יש אורך חיים מוגבל תנועתיות) ולהמשיך במשך 5 דקות. בסוף בווידיאו, לפרק את החדר ולשטוף שקתות פלטפורמת תצפית עם זרם של מים בלחץ ולאחר מכן אתנול מבקבוק להשפריץ. הסר שמן סיליקון מהשכבות העליונות עם מגבונים נייר נזהרים שלא לזהם את פלטפורמת תצפית שקתות.
- במידת הצורך, להמיר את הנתונים וידאו שנתפסו רצף Tiff תמונה או מחסנית באמצעות תוכנה J תמונה. ואז לפתוח את הקובץ ב J תמונה של 21 מסגרות הראשון (3 שניות) לבחור עד 50 הזרע להיות במעקב. כדי למנוע הטיה, בחרה הזרע מכל האזורים של השדה תצפית ללא ידיעת הנתונים המסלול שלהם. לכידת דו מימדי מסלולים תא במישור xy כפונקציה של זמן (xyt ערכות נתונים) עבור כל הזרע על ידי הצבע ולחץ על העכבר באמצעות התוספת MtrackJ מודול עבור תמונה מסלולי י המחש לחשב מסלולמרחקים, מהירויות מרכיבי ציר בתוך MtrackJ. לחלופין, לבצע פעולות אלה וגם אנליזה נומרית נוספת (למשל, כיווניות chemotaxis פרמטרים היסטוגרמות פרמטר) על ידי ייבוא נתונים xyt קובע לתוך Microsoft Excel.
- מגרש מסלולים עבור כל זרע ב-Excel כדי לזהות דפוסים הכללי של התנועה, כולל דפוסי ליניארי curvilinear, עגולים, כמו גם תכונות כגון פונה. לנצל נתונים xyt קובע לחשב מהירות curvilinear הממוצע, נטו לנסוע לאורך X (שיפוע) - ואת ציר Y, ואת הפרמטרים אוריינטציה כגון זווית ממוצע של נסיעה יחסית לציר שיפוע.
4. נציג תוצאות:
פרמטרים טכניים חשובים assay שני קאמרית הם גודלו וצורתו של החדר, את נקבוביות של הממברנה, ומשך הדגירה. גודלו של החדר העליון מחזיק את הזרע לא צריך להיות כל כך גדול בקוטר כמו לדרוש כמויות גדולות של זרע (מראשferably 0.5 מ"ל או פחות) ולא את החדר העליון צריכה להיות עמוקה כדי ליצור עמודה גבוהה של השעיה תא (<1 ס"מ). נפח המאגר קאמרית נמוך סביב להכניס לתא העליון צריך להתאים במדויק את רמת ההשעיה תא להכניס את כדי לא ליצור לחץ הידרוסטטי הטרנסממברני כי היה artifactually כוח הזרע דרך הממברנה. המיקום של הכנס הריק לתחתית הבאר הראשונה, ואחריו טעינת תוצאות זרע הלחץ ההידרוסטטי הראשונית מעלה כי מונע מהזרע הולך דרך הממברנה במהלך הטעינה. בחירת גודל הנקבוביות הממברנה נקבעת על ידי גודל של הזרע, ואת הזמינות המסחרית של מוסיף קרום נקבובי. אנו מוצאים כי מבחני עם זרע צפרדע יכול לנצל או 8 או 12 מיקרומטר קוטר הנקבוביות למרות נקבובית 12 מיקרומטר לספק מעבר של מספרים גבוהים יותר של הזרע ומאפשר ספירה מדויקת יותר. גודל הנקבוביות יותר מ 12 מיקרומטר לא מופיעים להיות זמין מסחרית. תחליף לשימוש טימוסיף ssue התרבות הוא השימוש של ממברנות Neuroprobe מיועד מבחני chemotaxis ב 96-גם הצלחות. אלה מציעים פוטנציאל התפוקה גדולה יותר ומגוון רחב יותר של קוטר הנקבוביות. למרות זרע יונקים גדולים, כנראה, דורש בקוטר נקבוביות גדולות, יש לנו assayed בהצלחה הזרע באמצעות העכבר chemotaxis מוסיף 12 עם נקבוביות מיקרומטר (ברנט, תצפיות לא פורסם). לעומת זאת, גדלים נקבוביות קטנות עשוי להיות מתאים זרע קטן יותר (למשל קיפודי ים) למרות שאנחנו לא נבדק עדיין את האפשרות הזאת.
אחד החסרונות של assay שתי החדר המתואר הוא זרע ממוקמים בתא העליון ובכך בהכרח וכתוצאה מכך מעבר חלק זרע על ידי כוח המשיכה, וכך להקטין את האות יחס ברקע. זו חייבה העובדה זרע Xenopus אינם נמרצת מספיק תנועתיות שלהם לשחות נגד הכבידה וכך גם זרע יונקים. קושי נוסף assaying זרע Xenopus היא העובדה כי תנועתיות l שלהםזמן האיפה הוא קצר - 5 עד 15 דקות לאחר ההפעלה. הגבלה זו היא הבסיס צורך להפעיל קבוצה חדשה של זרע כל 2 עד 3 דקות בעת ביצוע מבחני מרובים. כתוצאה מכך, כמובן, מחקרים הראו כי זמן מעבר הזרע ביותר מתרחשת בתוך 20 הדקות הראשונות של assay 5. למרות שאנו משתמשים תקופת הדגירה של 50 דקות, תקופה זו עלולות להיות לקצר ל -20 או 30 דקות. לעומת זאת, עבור הזרע עכבר שנותרו ניעתי במשך שעות, השתמשנו עד לתקופה 2 שעה של assay עם תוצאות טובות (ברנט, תצפיות לא פורסם).
ב assay שני תא זרע באמצעות צפרדע, המספר הכולל של העברת הזרע דרך הממברנה נקבובי הוא בדרך כלל 1-20 או על 1-2% של הזרע להציב להכניס לתא העליון. נוכחות של צבע chemoattractant בתא התחתון יכולים להגדיל את מעבר הזרע ככל לקפל 4-10. איור 2 מדגים מנה טיפוסית בתגובה עקומת הופיע עם assay הזה. Extrמעשה Xenopus ביצה וריבה ("מים ביצה") המכיל את chemoattractant ידוע חלבון allurin (עיגולים אדומים), הושם בתא התחתון על סדרה של דילולים. ביצה הכולל מים חלבון הכלול assay כל נתון מיקרוגרם / assay - הסכום נמסר בהיקף 50 μl המקורי. מאז חלבון נשא יהוו שיפוע דיפוזיה, טווח ריכוז בפועל של חלבון זרע להגיב אינו ידוע אך ניתן להעריך להיות פי 5 עד 10 נמוך יותר ריכוז חלבון הירידה נמסר. מסיבה זו, אנו מציינים את כמות החלבון הציג, לא ריכוז. בדרך כלל אנחנו מבצעים מבחני לשכפל או בשלושה עותקים עבור כל מנה ממוצעת התוצאה, אנחנו ואז לשכפל את הניסוי כולו 3 או 4 פעמים באמצעות זרע מהזכרים שונות כל ניסוי. השגיאה אומרת ורמת מתכוון מחושב עבור כל מנה עם שגיאת תקן של הממוצע בדרך כלל להיות 5-10% מן הממוצע. שים לב חלבונים ללא knochemoattractant wn פעילות כגון שור בסרום (עיגולים פתוח, איור 2.) אלבומין עשויה לייצר רמה נמוכה, הלא ספציפית עלייה מעבר הזרע דרך הממברנה. תצפית מעניינת היא כי התגובה עקומת המינון מים הביצית multiphasic - עולה שלב ושלב בירידה. סוג זה של יחסים multiphasic נפוץ chemoattractants זרע; התגובה של נוזל הזרע האנושי הזקיקים מראה 6 דומה היחסים biphasic כי הוא חשב להיות שימושי כי ריכוזים גבוהים של chemoattractant נמצא בסביבה של ביצה יכול לשמש כדי להפחית תגובות חיפוש נוסף מצד הזרע.
מדי פעם אנו מוצאים את ערכי בקרה assay זה גבוה מהרגיל, ובכך להקטין את גידול של פי המיוצר על ידי chemoattractant. בדרך כלל, זה ניתן לייחס הפרעה מכנית של להכניס את המסנן במהלך assay. לפיכך, חשוב כי מכניס לא מוטרדים בעת טעינת הזרע או chemoattractant, במהלך הדגירה assay או מתי להכניס את מוסר. חשוב במיוחד כי המאגר זרע להכניס את מוסר על ידי micropipette או שאיבה לפני הרמת להכניס מתוך הבאר. הדבר מבטיח כי הזרע לא נסחפים דרך הממברנה נקבובי לתא התחתון כמו להכניס מוסר.
פרמטרים טכניים חשובים assay הקאמרית Zigmond כוללים את המרחק בין המצע coverglass ואת התצפית, את ההגדלה של התבוננות וידאו, סוג של אופטיקה בשימוש, ואת מסגרת הדולר. מרחק בין התצפית היא בדרך כלל 10-15 מיקרומטר למרות המרחק הזה ניתן לשנות על ידי כמות של שמן סיליקון המשמשים ממשק בין זכוכית מכסים את השקופית קאמרית - שמן יותר, כך גדל המרחק. מטוס דקה של נוזל מגדיל את כמות הזמן הדרוש כדי ליצור שיפוע, כמו גם את תוחלת החיים של שיפוע יצרו פעם. מטוס עבה יותר של נוזל מאפשר גרם מהירה יותרהיווצרות radient אך שיפוע יש חיים קצרים יותר ויציבות פחות. הדינמיקה של היווצרות צבע ניתן דמיינו באמצעות צבע פלואורסצנטי או dextran ניאון chemoattractant הבאר באמצעות מיקרוסקופ פלואורסצנטי כדי להציג את הדינמיקה. מגיב המבחן צריך להיות בהתאמה משקל מולקולרי כדי chemoattractant בשימוש הדינמיקה נקבע בעבר שופט כמה דקות צריך להיות מותר ליצירת שיפוע הקלטה של תנועות הזרע.
ההגדלה צריכה להיות (אובייקטיבי 4x או 10x) הכוללת נמוכה אם את פלטפורמת תצפית כולו להיות דמיינו כמו התנאים assay שתיארנו. מצד שני, הגדלה גבוהה (40X אובייקטיבי או 63x) עשוי להיות שימושי אם מישהו מתכוון לעקוב אחר מגזרים מסלול קצר יחסית או רוצה לפתור תנועות flagellar. מעקב יכול להתבצע גם על ידי חצי ידני שיטות כמתואר במאמר זה או על ידי מעקב אוטומטי כפי מתורגל לספוג יותרחבילות תוכנה histicated כגון MetaMorph או מסלול Imaris. בכל מקרה, להקל על המעקב תלויים מאוד לעומת תמונה בין אם זה על ידי המפעיל או על ידי הכרה תוכנה סייעה האובייקט. למרות אופטיקה בשדה בהיר עשוי לשמש במקרים מסוימים, השימוש אופטיקה בניגוד שלב או darkfield אופטיקה נדרש בדרך כלל. לבסוף, את המסגרת הדולר תלוי בהחלטת הזמן הרצוי מעקב. אם חצי ידני שיטות משמשים בהליך שלנו, אחת היא מוגבלת ככל הנראה מסגרת הדולר נמוך יחסית - 4-8 מסגרות לשנייה - בשל אופי העבודה האינטנסיבית של נתונים ההקלטה. מצד שני, שיעור תצפיות וידאו עשויות להידרש התגובות מהיר כגון צורות גל flagellar. לעתים קרובות, מטרות הניסוי מוגשות על ידי מיטב איטי עושה מסגרת הדולר ניסויים מהר קצב הניסויים מסגרת בנפרד שכן אחד שרוצה לשנות גם פרמטרים אחרים כגון הגדלה, אופטיקה, או עיבוד תמונה דיגיטלית.
תוצאות אופיינית עבור Zigmמעקב ond assay קאמרית כוללים סדרה של מסלולים כמו אלו ראו במשך הזרע fifty צפרדע וידאו קליפ של סרט 1. נגד תמונה של התצפית, מסלולים של זרע בודדים לייחס באדום עבור ניסוי הביקורת (לא נוכח שיפוע chemoattractant). דו מימדי מסלולים תא במישור xy כפונקציה של הזמן עבור כל זרע ניתן להתוות ומחובר על ידי MtrackJ ו המיובאים לתוך Microsoft Excel. ניתוח המסלול, אנו לייעד את ציר שיפוע chemoattractant כמו ציר ה-X לבין ציר Y כציר אורתוגונליים, עולה בקנה אחד עם האמנה פותחה במקור על ידי Fabro et al. 3. כפי שמוצג בתרשים של איור 3, את המסלול בפועל נלקח מורכב של צעדים, סכום שאורכו שווה למרחק curvilinear נסע מסלול (כחול / חיצים זהב). המרחק אוריינטציה נטו של נסיעה על ידי כל זרע הוא וקטור המחבר את הנקודה הראשונה והאחרונה של מסלול (חץ אלכסוני אדום).נסיעה נטו ניתן לחלק המרכיבים ציר ה-X ו-Y ציר רכיב (חיצים אדום מקווקו, שמכונה גם נטו דלתא X ו דלתא Y net, בהתאמה).
מכיוון chemotaxis בתאי זרע חוליות יכולים לערב משמרות עדין יחסית בכיוון הנסיעה, מספר גדול של זרע (100-300), שנבחרו באקראי, מנותחים בדרך כלל עבור כל תנאי המחייב לעתים קרובות נתונים ונקווה 4-6 ניסויים עצמאיים. לצורך המחשה, לעומת זאת, נשתמש נתוני זרע רק חמישים צפרדע. טבלה 1 מציגה פרמטרים הנפוצות לזהות שינויים לנסוע הזרע. נסיעה נטו כלומר לאורך ציר ה-X יגדל באופן משמעותי אם, בנוכחות chemoattractant, האוכלוסייה הזרע בכללותו כדלקמן מסלולים כי הדוק יותר להתיישר עם שיפוע. בדוגמה שלנו, הנסיעות הממוצע נטו ציר ה-X גדל מעל פי שלוש בנוכחות של מים ביצה. אפשר גם העלילה היסטוגרמה של נסיעות ציר ה-X נטו עבור האוכלוסייה זרע אשר יש לו את advan tage כי subpopulations קטן יותר של הזרע תגובה יזוהו. שני פרמטרים שפותחה על ידי Fabro et al. 3 גם יכול לעזור לזהות אוכלוסיות כאלה. שני אחוז הזרע מראה נטו חיובי ציר ה-X נסיעות (% ΔX> 0) ואחוז הזרע מראה לנסוע ליניארי נטו לא יותר מ 45 מעלות מהציר שיפוע (% ΔX / | ΔY |> 1) יכול להגדיל באופן דרמטי אם האוכלוסייה כולה זרע רגיש chemoattractant או על ידי כמויות קטנות יותר אבל עדיין משמעותי אם subpopulations הזרע רגישים. דוגמה שלנו טבלה 1 מראה מגדילה בשני פרמטרים זרע צפרדע fifty נחשף מפל מים ביצה. שים לב תנועה אקראית בלתי מכוונת ייתן שאינו אפס ערכים עבור שני פרמטרים אלה של 50% ו -25% בהתאמה; ערכים שליטה גבוהה יותר מאשר זו (כגון אלה טבלה 1) מייצגים רקע בשל מספר נמוך או מדגם או כדי הטיה בכיוון זרע מסוים כדי לתכנן את הניסוי.
תוכן "> כיווניות של נסיעות זרע בתגובה סוכני chemoattractant ניתן להעריך באופן ישיר על ידי תטא, את הזווית בין וקטור של נסיעה נטו זרע כל שיפוע (X) ציר. שלנו למשל טבלה 1 מראה כי תטא אומר ירד לשחייה הזרע שיפוע ביצה מים המציין כי מסלולי זרע כאוכלוסייה היו מיושר טוב יותר עם שיפוע. דומות לנסוע ציר ה-X נטו (ראה לעיל), thetas לאוכלוסייה זרע יכול לבוא לידי ביטוי כמו הפצה, גישה רגישה גם כדי subpopulations הזרע תגובה אחת כי נחקרה לאחרונה על ידי Gakamsky ואח' 7.לבסוף, מהירויות curvilinear ומיידי עבור זרע בודדים ניתן גם להפיק את הנתונים המתארים דו מימדי מסלולים תא במישור xy כפונקציה של הזמן. אפשר למצוא כי יש עלייה מהירות, כמו גם שינוי הכיוון של הנסיעה, ובכך מציע מענה chemokinetic כמו גםבתגובה chemotactic.
נתונים אלה מייצגים נקודת המוצא של ניתוח מסלולי הזרע. ניתוח נוסף יכול לכלול מדידות הליניאריות ואת עקמומיות מסלול על רגע רגע על ידי בסיס כפי שביצעו Bohmer et al. 8 ו שיבא et al. 9, איתור אוטומטי של פונה כפי שבוצעו על ידי ברנט et al. 10, ואת הליניאריות כאשר תעיד על ידי ניתוח פרקטלית 11,12. ובלבד זרע שחייה מסלולים אלה מנוטרים בהגדלה גבוהה, אפשר גם תנועות תמונה flagellar אמת סידן הזמן אותות נשאו על ידי מעבדות מספר 8,9,13,14,15,16. מחקרים אלו הוכיחו כי הן חוליות והזרע היונקים להגיב chemoattractants על ידי פניות חדות של הזרע עד שיפוע לכיוון מקור chemoattractant. פונה אלה מלווה כפיפות flagellar אשר משנים כיוון זרע כמה הגה היה, עיקולים שנראים ביוזמת מוגדר, גל like אותות סידן ומתפשטים דרך השוטון. לפיכך, המטרה הסופית של מעקב הזרע הוא לתאם עם מערכת האיתות דינמיקה שינויים הנעה flagellar כי לשמש בסיס נטייה זרע צבע chemotactic. מטרות אלו טרם הגיעו בתאי זרע Xenopus אשר לנסוע בתנועה הסליל 17, התערוכה עקמומיות נמוך מסלולים שלהם 10, אותות אשר סידן עדיין להיות במעקב.
למרות התמקדנו כאן על המפרט את שיטות assay אנו משתמשים בזרע laevis Xenopus, הן שתי זרע קאמרית הצטברות assay assay ואת המעקב Zigmond תא יכול לשמש זרע יונקים אם שינויים מסוימים עשויים. מבחני הן יכולות להתבצע על 37 מעלות צלזיוס אם רוצים, על ידי שימוש של שקופית חם, ב assay הקאמרית Zigmond, שלב מיקרוסקופ חם. בדרך כלל, זרע יונקים יהיו מבודדים, capacitated וטופחו באמצעות מאגרים יונקים המתאיםchemoattractants ד ', אך ניתוח נתונים יהיה דומה למה שמתואר כאן מין אמפיבי. הבדל נוסף הוא כי קאמרית Zigmond מושם בדרך כלל זקוף על הבמה של מיקרוסקופ זקוף מאז זרע יונקים, בניגוד זרע Xenopus, יכול לשחות עד לבמה תצפית. כאשר נבדק עדיין, אלה שני מבחני עשוי לראות יישום זרע של מספר מינים בעבודה בעתיד.

באיור 1. תרשים סכמטי של assay שתי החדר. זרע ממוקמים להוסיף את החלק התחתון של אשר מסנן פוליקרבונט עם נקבוביות 12 מיקרומטר. הפתרון הוא chemoattractant pipetted בזהירות לתוך הבאר כדי ליזום היווצרות מפל ריכוזים.
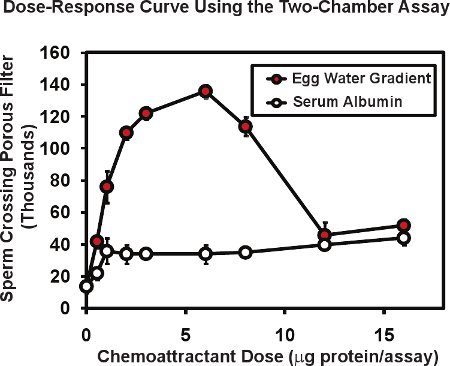
באיור 2. נציג נתונים עבור הזרע צפרדע באמצעות שני תא זרע chemotaxis assay. מים ביצה שהוכן X. ביצים laevis מפגין עקומת multiphase מינון הפעילות האופיינית chemoattractants הזרע. שור בסרום אלבומין מעבר הזרע מגביר רק במעט - אפקט ספציפי של חלבון. איור שונה מאל-Anzi & צ'נדלר 5.
סרט 1. הסרטון מראה זרע מסלולי צפרדע להתוות אדום על התצפית של חדר Zigmond. רוחב הפלטפורמה היא 1 מ"מ. לחץ כאן כדי לראות את הסרטון.
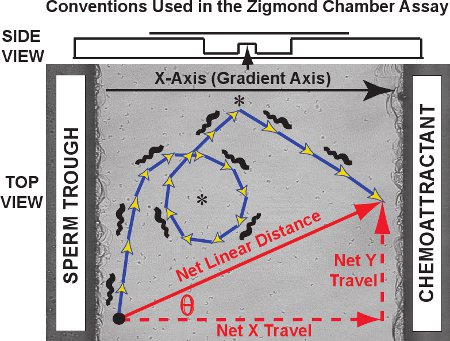
באיור 3. מוסכמות ציר מסלול curvilinear זרע וקטור עבור נסיעות ליניארי נטו נרשמות על פלטפורמת תצפית קאמרית Zigmond. הנתונים שהתקבלו הם משלושה סוגים. ראשית, מסלולי הזרע עצמם (כחול / חיצים זהב) יכול לחשוף דפוסים ספציפיים such כעיגולים והופכת (כוכביות). המרחק curvilinear ואת מהירויות curvilinear ניתן למדוד את הנתיב מסלול. שנית, מרחק ליניארי נטו נסע על המסלול כולו, נטו X (שיפוע) מרכיב ציר הנסיעה, רכיב ציר Y נטו של נסיעות ואת תטא הזווית בין ציר X לבין וקטור של נסיעה נטו ניתן לחשב עבור כל מסלול ו לעומת הפצה על כל זרע במעקב. שלישית, שינוי מיידי של מהירות וכיוון הנסיעה של מגזרים בתוך מסלולים בודדים ניתן ללמוד בנפרד או כאוכלוסייה. מעל, מבט צד של החדר מוצג בתרשים.

טבלה 1. פרמטרים משמשים לעתים קרובות בניתוח נתוני החדר Zigmond.
Discussion
Chemotaxis של תאים על ידי העברת תנועה או amoeboid או שוטונים המופעל השחייה נמצא בהקשרים ביולוגיים רבים במחקר של תופעה זו מחייבת את הזמינות של מבחני מעשי ואמין. כמה דוגמאות של התופעה, כגון משיכה של זרע ביצה קיפודי ים או כינוס של תאים עובש רפש להקים גוף הפרי, יש השפעה ויזואלית מי?...
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
אנו מודים מעבדה קק WM bioimaging לשימוש של וידאו תחנת העבודה שלהם במיקרוסקופ. מחקר זה נתמך על ידי NSF מענק IBN-0615435.
Materials
| Name | Company | Catalog Number | Comments |
| שם פריט | חברה | מספר קטלוגי | תגובות |
| 24 גם צלחות | בקטון, דיקנסון | 35/1147 | |
| 12 מ"מ קוטר מוסיף החיצוני עם קרום 12 מיקרומטר נקבוביות | Millipore | PIXP01250 | השתמשנו בעבר שחקן המשנה, קורנינג צלחת transwell # 3403, כעת הופסק |
| Zigmond קאמרית | Neuroprobe | Z02 | |
| שמן סיליקון | ג'נרל אלקטריק | SF1154 | שווה נוזלים דאו קורנינג 550 |
| תמונה J תוכנה | וויין Rasband, שירותי מחקר ענף, המכון הלאומי לבריאות הנפש | הורדה חינם ב http://rsbweb.nih.gov/ij | Java התוכנית פועלת על Windows, ליןUX ו-Mac |
| MtrackJ תוכנה | אריק Meijering / Imagescience / ביו קבוצה דימות , Erasmus MC - מהמרכז הרפואי של אוניברסיטת רוטרדם | הורדה חינם ב http://www.imagescience.org/meijering/software/mtrackj/ | תוכנית Java שפועל על Windows, Linux ו-Mac |
| תוכנת Virtual Dub | GNU General Licensed אישי תוכנה | הורדה חינם דרך http://www.virtualdub.org/index.html | הוראות ההתקנה באתר תמונה J תחת plugins; עבור Windows בלבד |
| cellSens תוכנה | אולימפוס | ראה אתר: http://www.olympusamerica.com/seg_section/product.asp? מוצר = 1070 | בקרות רוכש תמונות ממגוון רחב של מצלמות. יש גם יכולת עיבוד תמונה |
References
- Ward, G. E., Brokaw, C. J., Garbers, D. L., Vacquier, V. D. Chemotaxis of Arbacia punctulata spermatozoa to resact, a peptide from the egg jelly layer. J. Cell Biol. 101, 2324-2329 (1985).
- Olivera, R. G., Tomasi, L., Rovasio, R. A., Giojalas, L. C. Increased velocity and induction of chemotactic response in mouse spermatozoa by follicular and oviductal fluids. J. Reprod. Fertil. 115, 23-27 (1999).
- Fabro, G., Rovasio, R. A., Civalero, S., Frenkel, A., Caplan, S. R., Eisenbach, M., Giojalas, L. C. Chemotaxis of capacitated rabbit spermatozoa to follicular fluid revealed by a novel directionality-based assay. Biol. Reprod. 67, 1565-1571 (2002).
- Sugiyama, H., Burnett, L., Xiang, X., Olson, J., Willis, S., Miao, A., Akema, T., Bieber, A. L., Chandler, D. E. Purification and multimer formation of allurin, a sperm chemoattractant from Xenopus laevis egg jelly. Mol. Reprod. Dev. 76, 527-536 (2009).
- Al-Anzi, B., Chandler, D. Xenopus laevis egg jelly releases a sperm chemoattractant during spawning. Dev. Biol. 198, 366-375 (1998).
- Ralt, D., Goldenberg, M., Fetterolf, P., Thompson, D., Dor, J., Mashiach, S., Garbers, D. L., Eisenbach, M. Sperm attraction to a follicular factor(s) correlates with human egg fertilizability. Proc. Natl. Acad. Sci. U.S.A. 88, 2840-2844 (1991).
- Gakamsky, A., Schechtman, E., Caplan, S. R., Eisenbach, M. Analysis of chemotaxis when the fraction of responsive cells is small--application to mammalian sperm guidance. Int. J. Dev. Biol. 52, 481-487 (2008).
- Böhmer, M., Van, Q., Weyand, I., Hagen, V., Beyermann, M., Matsumoto, M., Hoshi, M., Hildebrand, E., Kaupp, U. B. Ca2+ spikes in the flagellum control chemotactic behavior of sperm. EMBO J. 24, 2741-2752 (2005).
- Shiba, K., Baba, S. A., Inoue, T., Yoshida, M. Ca2+ bursts occur around a local minimal concentration of attractant and trigger sperm chemotactic response. Proc. Natl. Acad. Sci. U.S.A. 105, 19312-19317 (2008).
- Burnett, L. A., Sugiyama, H., Bieber, A. L., Chandler, D. E. Egg jelly proteins stimulate directed motility in Xenopus laevis sperm. Mol. Reprod. Dev. 78, 450-462 (2011).
- Abaigar, T., Barbero, J., Holt, W. V. Trajectory variance and autocorrelations within single sperm tracks as population level descriptors of sperm track complexity, predictability and energy generating ability. J. Androl. , (2011).
- Mortimer, S. T., Swan, M. A., Mortimer, D. Fractal analysis of capacitating human spermatozoa. Hum. Reprod. 11, 1049-1054 (1996).
- Guerrero, A., Carneiro, J., Pimentel, A., Wood, C. D., Corkidi, G., Darszon, A. Strategies for locating the female gamete: the importance of measuring sperm trajectories in three spatial dimensions. Mol. Hum. Reprod. 17, 511-523 (2011).
- Yoshida, M., Yoshida, K. Sperm chemotaxis and regulation of flagellar movement by Ca2+. Mol. Hum. Reprod. 17, 457-465 (2011).
- Spehr, M., Schwane, K., Riffell, J. A., Zimmer, R. K., Hatt, H. Odorant receptors and olfactory-like signaling mechanisms in mammalian sperm.Mol. Cell. Endocrinol. 250, 128-136 (2006).
- Veitinger, T., Riffell, J. R., Veitinger, S., Nascimento, J. M., Triller, A., Chandsawangbhuwana, C., Schwane, K., Geerts, A., Wunder, F., Berns, M. W., Neuhaus, E. M., Zimmer, R. K., Spehr, M., Hatt, H. Chemosensory Ca2+ dynamics correlate with diverse behavioral phenotypes in human sperm. J. Biol. Chem. 286, 17311-17325 (2011).
- Tholl, N., Naqvi, S., McLaughlin, E., Boyles, S., Bieber, A. L., Chandler, D. E. Swimming of Xenopus laevis sperm exhibits multiple gears and its duration is extended by egg jelly constituents. Biol. Bull. 220, 174-185 (2011).
- Eisenbach, M. Sperm chemotaxis. Rev. Reprod. 4, 56-66 (1999).
- Riffell, J. A., Zimmer, R. K. Sex and flow: the consequences of fluid shear for sperm-egg interactions. J. Exp. Biol. 210, 3644-3660 (2007).
- Corkidi, G., Taboada, B., Wood, C. D., Guerrero, A., Darszon, A. Tracking sperm in three-dimensions. Biochem. Biophys. Res. Commun. 373, 125-129 (2008).
- Himes, J. E., Riffell, J. A., Zimmer, C. A., Zimmer, R. K. Sperm chemotaxis as revealed with live and synthetic eggs. Biol Bull. 220, 1-5 (2011).
- Sun, F., Giojolas, L. C., Rovasio, R. A., Tur-Kaspa, I., Sanchez, R., Eisenbach, M. Lack of species-specificity in mammalian sperm chemotaxis. Dev. Biol. 255, 423-427 (2003).
- Guidobaldi, H. A., Teves, M. E., Uñates, D. R., Anastasía, A., Giojalas, L. C. Progesterone from the cumulus cells is the sperm chemoattractant secreted by the rabbit oocyte cumulus complex. PLoS One. 3, e3040-e3040 (2008).
- Oren-Benaroya, R., Orvieto, R., Gakamsky, A., Pinchasov, M., Eisenbach, M. The sperm chemoattractant secreted from human cumulus cells is progesterone. Hum. Reprod. 23, 2339-2345 (2008).
- Teves, M. E., Guidobaldi, H. A., Uñates, D. R., Sanchez, R., Miska, W., Publicover, S. J., Morales Garcia, A. A., Giojalas, L. C. Molecular mechanism for human sperm chemotaxis mediated by progesterone. PLoS One. 4, 8211-82 (2009).
- Blengini, C. S., Teves, M. E., Uñates, D. R., Guidobaldi, H. A., Gatica, L. V., Giojalas, L. C. Human sperm pattern of movement during chemotactic re-orientation towards a progesterone source. Asian J. Androl. 13, 769-773 (2011).
- Strünker, T., Goodwin, N., Brenker, C., Kashikar, N. D., Weyand, I., Seifert, R., Kaupp, U. B. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. J. Exp. Med. 115, 453-465 (1962).
- Zigmond, S. H., Lauffenburger, D. A. Assays of leukocyte chemotaxis. Annu. Rev. Med. 37, 149-155 (1986).
- Villanueva-Diaz, C., Vadillo-Ortega, F., Kably-Ambe, A., Diaz-Pérez, M. A., Krivitzky, S. K. Evidence that human follicular fluid contains a chemoattractant for spermatozoa. Fertil. Steril. 54, 1180-1182 (1990).
- Villanueva-Diaz, C., Arizs-Martinez, J., Bermejo-Martinez, L., Vadillo-Ortega, F. Progesterone induces human sperm chemotaxis. Fertil. Steril. 64, 1183-1188 (1995).
- Olson, J., Xiang, X., Ziegert, T., Kittleson, A., Rawls, A., Bieber, A., Chandler, D. E. A. l. l. u. r. i. n. a 21 kD sperm chemoattractant from Xenopus egg jelly, is homologous to mammalian sperm-binding proteins. Proc. Natl. Acad. Sci. U.S.A. 98, 11205-11210 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved