Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Deux types de tests pour la chimio-attraction Frog sperme Détection
Dans cet article
Résumé
Les œufs et les revêtements extracellulaire autour des œufs fréquemment communiqué peptides, protéines et petites molécules qui communiquent avec le sperme pour les guider vers l'ovule favorisant ainsi la fécondation. En utilisant le sperme de grenouille nous décrire et comparer deux classes de tests utilisés pour détecter la chimio-attraction des spermatozoïdes - essais d'accumulation de sperme et des tests de suivi du sperme.
Résumé
Chimio-attraction du sperme chez les invertébrés peuvent être suffisamment robuste que l'on peut placer une pipette contenant le peptide attractifs en une suspension de spermatozoïdes et de l'accumulation de sperme au microscope de visualiser autour de la pipette de 1. Chimio-attraction du sperme chez les vertébrés comme les grenouilles, les rongeurs et les humains est plus difficile à détecter et nécessite des dosages quantitatifs. Ces essais sont de deux types principaux - des dosages qui quantifier le mouvement des spermatozoïdes à une source de chimiotactique, dits tests de l'accumulation de sperme, et des essais qui fait suivre les trajectoires individuelles de natation de sperme.
Dosages d'accumulation de sperme sont relativement rapides permettant des dizaines ou des centaines de tests à faire en une seule journée, permettant ainsi aux courbes dose-réponse et des cours de temps pour être réalisée relativement rapidement. Ces types de tests ont été largement utilisées pour caractériser les nombreux systèmes chimio-attraction bien établi - par exemple, chimiotaxie des neutrophiles au bacpeptides pièces et de sperme à la chimiotaxie liquide folliculaire. Dosages de suivi du sperme peut être plus de travail mais offrent des données supplémentaires sur la façon chemoattractancts vraiment altérer les chemins de natation que le sperme prendre. Ce type de test est nécessaire pour démontrer l'orientation du mouvement des spermatozoïdes par rapport à l'axe du gradient chemoattrractant et de visualiser tourne caractéristique ou les changements d'orientation qui mettent le sperme plus proche de l'œuf.
Nous décrivons ici les méthodes utilisées pour chacune de ces deux types de tests. Le dosage de l'accumulation du sperme utilisé est appelé un "deux chambres" dosage. Le sperme d'amphibiens sont placés dans un insert plaque de culture de tissu avec un plancher de filtre en polycarbonate ayant des pores de diamètre 12 um. Inserts avec les spermatozoïdes sont placés dans des puits de culture de tissu plaque contenant du tampon et une chemoatttractant attentivement la pipette dans le fond du puits où le plancher et le mur (voir Fig. 1). Après incubation, l'insert supérieure contenant le réservoir de spermatozoïdes est soigneusement removed, et du sperme dans la chambre de fond qui ont traversé la membrane sont enlevées, granulés et ensuite comptés par hémocytomètre ou cytomètre en flux.
Le test de suivi du sperme utilise une chambre Zigmond initialement développé pour l'observation de la chimiotaxie des neutrophiles et modifiés pour l'observation de spermatozoïdes par Giojalas et collègues 2,3. La chambre se compose d'une lame de verre épais dans lequel deux auges verticaux ont été usinées. Ce sont séparées par une plate-forme d'observation de 1 mm de large. Après application d'un couvercle en verre, les spermatozoïdes sont chargés dans une auge, l'agent chimiotactique dans l'autre et le mouvement des spermatozoïdes individuels visualisées par microscopie vidéo. Des images vidéo sont ensuite analysées en utilisant le logiciel pour identifier les mouvements cellulaires à deux dimensions dans le plan xy en fonction du temps (XYT ensembles de données) qui forment la trajectoire de chaque spermatozoïde.
Protocole
1. Matériel et tampons utilisés
- Tampon Ringer ovocyte (1,5 x OR2) contient 124 mM de NaCl, 3,75 mM de KCl, 1,5 mM de CaCl2, 1,5 mM de MgCl2, 1,5 mM Na 2 HPO 4, 10 mM de HEPES, pH 7,8. Tampon fertilisation (F-1) contient 41,25 mM de NaCl, 1,25 mM de KCl, 0,25 mM de CaCl2, 0,06 mM MgCl 2, 0,5 mM Na 2 HPO 4, 2,5 mM de HEPES, pH 7,8.
- Xenopus laevis oeuf de l'eau est préparé selon Sugiyama et al. 4. Brièvement décrit, fraîchement engendré des oeufs de grenouille gelée sont tourbillonnait dans un petit volume de F-1 de tampon pendant 30 minutes et le milieu conditionné enlevé par micropipette. Ce milieu, appelée «eau d'œuf», peut également être utilisé pour préparer purifiée allurin, le chimioattractive primaires dans cet extrait de gelée. Les spermatozoïdes sont obtenus à partir commercialement élevés Xenopus laevis ou Xenopus tropicalis.
- Voir la Table des Matières pour les éléments spécifiques nécessaires à tIl dosage.
2. Un essai de deux chambres de la chimiotaxie des spermatozoïdes de grenouille
- Anesthésier la grenouille par immersion dans l'eau contenant 0,07% de benzocaïne, décapitent en utilisant une paire de ciseaux tranchant de carborundum, et la moelle doubles pour assurer l'euthanasie. Coupez la peau abdominale pour exposer les muscles. Faire des coupes médianes et latérales dans le muscle abdominal et se rétracter. Délicatement retirer l'intestin et de la graisse de révéler blanc, en forme de haricot testicules. Coupez le tissu conjonctif à l'aide de ciseaux fins une en prenant soin d'éviter les vaisseaux sanguins. Supprimer un testicule, laver toute trace de sang à l'aide de 1,5 x OR2 tampon, puis rouler le testicule sur papier filtre pour éliminer les excès de tampon et de petits vaisseaux sanguins adhérente, puis placez le testicule dans un plat en plastique Pitre dans 0,2 ml de 1,5 x OR2 tampon. Remplir une seringue de 5 ml avec 2 ml de tampon 1,5 x OR2, doucement pousser 10-20 trous dans les testicules sur la plupart de la surface à une extrémité, insérer l'aiguille à l'extrémité opposée et doucement injecter des tampons pour débusquer les spermatozoïdes. Alternativement, onpeut injecter tampon pendant que piquer des trous de sortie pour débusquer les spermatozoïdes. Transférer la suspension de spermatozoïdes à l'aide d'une micropipette avec une pointe de coupure (en évitant le cisaillement du sperme) dans un tube à centrifuger et les placer sur la glace.
- Estimation du nombre de spermatozoïdes de grenouille obtenue par dilution 1:100 du sperme dans 1,5 x OU-2 et en prenant un échantillon de 20 pi de la suspension de spermatozoïdes mixtes et compter le nombre de cellules en utilisant un hématimètre et la grande zone de 1 mm 2. En utilisant le comptage et le ratio d'échantillonnage hémocytomètre calculer la densité du sperme et le nombre total de spermatozoïdes récoltés. Ce total est généralement de 2 - 6 x 10 7 sperme dans un volume d'environ 2 ml lorsque les deux testicules sont utilisés. Diluer la suspension de spermatozoïdes stocks avec 1,5 x OR2 tampon pour obtenir une densité de spermatozoïdes de 2 x 10 7 / ml. Utilisez le sperme pour le dosage dans les 2 à 3 heures de préparation. Évaluer la motilité des spermatozoïdes en diluant 5 pl de 01h10 sperme avec F-1 de tampon et le mouvement de visualiser à l'aide optique à contraste de phase. Au moins 40% à 50% du spermedoivent être mobiles. Même les préparations appropriées contiendra un grand nombre de spermatozoïdes immobiles dont la plupart sont immatures.
- Préparez une nouvelle de 24 puits plaque en plastique culture de tissus par micropipetage 700 pi de tampon de F1 dans chaque puits. Chaque puits devrait être d'environ 15 mm de diamètre à la base.
- Démarrer une série de tests par dilution de 100 pi de suspension de spermatozoïdes avec 900 pi de tampon de F1 à température ambiante (environ 21 à 23 ° C) dans un microtube pour activer la motilité des spermatozoïdes par un choc osmotique. Chaque spermatozoïde temps frais est activé de cette manière, le sperme doit être utilisé en 1-2 minutes.
- Placez une porosité de 12 um d'insertion (12 mm OD) dans un tampon bien remplie, assurez-vous d'insérer le placement est décentré laissant un espace d'un seul côté. Transférer immédiatement 400 pl motilité du sperme activé dans le puits par une micropipette ayant un bout de coupure. Appliquer la suspension de sperme sur la paroi de la cartouche filtrante et de lui permettre de courir vers le bas sur le filtre au fond d'ee insert, la suspension du sperme ne doit pas être pipeté directement sur le filtre.
- Soigneusement micropipette 50 ul d'agent chimiotactique dans le puits dans l'espace entre le bien et l'insert hors du centre du filtre. Il faut être prudent pour déposer la baisse où les côtés et le fond du puits se rencontrer et de retirer la pipette avec aucune perturbation dans le système. Plus précisément, le piston sur la micropipette devrait être poussé que pour le premier arrêt de façon à complètement éjecter l'échantillon, mais pas de bulles d'air.
- Répétez les étapes 2.5 et 2.6 ci-dessus pour commencer des essais autant que nécessaire, puis incuber la plaque jusqu'à ce que le premier test a commencé a incubé 50 minutes. Typiquement, on peut commencer un essai toutes les 45 à 60 secondes. Notez que le dosage peut être simplifié par une personne expérimentée ou par deux personnes travaillant ensemble. Dans ce cas, une ou deux rangées de tests peut être lancée avec un plus grand stock de spermatozoïdes mobiles et plus rapide de pipetage fournissant que le sperme sont toujours utilisés dans les 1 à 2 minutes de lad'activation.
- Arrêtez chaque essai dans la séquence a commencé. D'abord, bien soutenue l'élément filtrant avec une main et avec les autres enlevez soigneusement la plupart ou tous de la suspension du sperme dans la chambre supérieure par micropipette ou par aspiration avec une pipette Pasteur. Immédiatement, l'aide d'une pincette fine, retirer la cartouche filtrante et le jeter. Des précautions doivent être utilisés à cette étape au moins, les spermatozoïdes restants seront balayés par le filtre artifactually élever les valeurs pour le passage des spermatozoïdes.
- De chaque assiette bien, le transfert de la suspension de spermatozoïdes ensemble dans un tube à centrifuger. Il est important de mélanger la suspension de spermatozoïdes dans le puits avant le retrait puisque le sperme a tendance à se déposer au fond. Ajouter 15 ul de formaldéhyde 25% à une concentration finale de 0,5% v / v et réfrigérer si la numération des spermatozoïdes ne sont pas faits le même jour.
- Pellet le sperme dans chaque tube en utilisant un 10 seconde vrille bouton poussoir sur une microcentrifugeuse personnels ayant une vitesse maximale de 2000 x g. Retirez tous, mais 100 pi d'supernatant de chaque tube, puis remise en suspension le culot dans ce volume. Prenez 20 pl de suspension de spermatozoïdes, diluer 1:10 avec de l'eau distillée, et le nombre de spermatozoïdes sur un hémocytomètre en utilisant un objectif 40x sur un microscope droit. Utilisez les chiffres et les facteurs de dilution pour calculer le nombre total de spermatozoïdes qui sont passés par le filtre dans chaque essai.
3. Test de suivi Grenouille du sperme à l'aide d'une chambre Zigmond
- Préparer le poste de travail microscope inversé pour l'enregistrement vidéo. Nous utilisons un Nikon Elipse TE300 microscope inversé équipé soit d'un Sony DXC-390 à 3 puces caméra vidéo couleur analogiques ou une Hamamatsu ORCA-03G caméra monochrome numérique. La glissière de chambre Zigmond doit reposer sur la scène jusqu'à la tête en bas avec une ouverture suffisante dans la plaque de scène pour accueillir un verre 22x40 mm couvercle. Cet arrangement est rendu nécessaire par le fait que le sperme de grenouille sont incapables de nager contre la gravité. Accent soit un objectif 4x ou 10x sur la plate-forme d'observation courant entre les deuxauges.
- Test pour vous assurer que la caméra est bien ciblé et axé sur la plate-forme d'observation. Si l'appareil photo Sony est utilisé, la sortie est envoyée à un moniteur vidéo et d'un convertisseur A / D (frame grabber) capable de numériser 7 images par seconde à partir du signal vidéo. Le flux numérique est traitée à l'aide d'un ordinateur cadencé à 3 GHz ou plus de préférence avec 4 Go de RAM ou plus. Bien que nous utilisions le logiciel Scion Image (une version personnalisée de Windows du NIH Image) contrôlant une carte d'acquisition Scion CG-7 châssis, ces produits ne sont plus disponibles. Une solution courante est d'utiliser le logiciel Image J avec un plug-in VirtualDub pour la capture vidéo de la caméra analogique. Si la caméra Hamamatsu est utilisé, sa sortie numérique est traitée par Olympus cellSens logiciels et affichées sur l'écran d'ordinateur. Dans les deux cas, les données sont sauvegardées soit sur un disque dur interne ou externe comme une pile 8-bit TIFF. Utilisation du logiciel Scion Image nécessite la conversion de la séquence d'images Tiff à une pile en utilisant l'image J.
- Le champ microscopique devrait inclure la plupart ou la totalité de la largeur plateforme d'observation. Utilisez le contraste de phase ou de l'optique en champ sombre pour les meilleurs résultats. La distance entre la surface de la plateforme d'observation et le fond du verre de couverture doit être de 15 à 20 pm tel que déterminé par le différentiel se concentrant sur chaque surface.
- Préparer le chimiotactique à une concentration appropriée dans un tampon de F1. Préparer Xenopus laevis sperme comme décrit précédemment et stocker en 1,5 x OR2 tampon sur la glace jusqu'à utilisation.
- Assemblez la chambre Zigmond. Commencez avec une chambre propre et sec. Utiliser un endroit micropipette une ligne d'huile de silicone (4 pl) d'environ 5 mm et parallèle au bord externe de chaque creux. Placez un verre 22x40 mm couvercle sur la chambre de l'huile de silicone permettant une répartition régulière de la bordure extérieure de chaque creux. Si des expériences préliminaires montrent que le sperme collant est un problème, on peut avoir besoin pour bien enrober le couvercle en verre avec de la nitrocellulose comme suggéré par Fabro et al. 3. Alterntivement, l'inclusion de protéines dans les tampons utilisés (par exemple 1% de BSA) peut également réduire collant sperme.
- Inverser la chambre et le lieu au cours de la découpe circulaire de la platine du microscope en faisant attention que le couvercle en verre ne sont pas en contact avec la scène. Cette configuration inversée est nécessaire pour amener les spermatozoïdes de Xenopus de la cuvette sur la plateforme. Contrairement à du sperme chez les mammifères, les spermatozoïdes de Xenopus sont pas assez forts pour nager contre la gravité pour atteindre la plate-forme.
- Activer 20 ul de sperme Xenopus en 1,5 x OR2 tampon en mélangeant avec un tampon de 01h10 F1 à la température ambiante. Utiliser une micropipette avec une pointe coupée, transférer immédiatement 70 pi de la motilité du sperme activé dans l'auge. Ceci est réalisé en maintenant la micropipette à un angle faible et en plaçant la pointe à l'ouverture sur le côté de l'auge. La suspension cellulaire éjecté remplit le creux et le pont par capillarité. Ensuite, remplissez le creux opposés de la même manière en utilisant une solution chemoatttractant.
- Commencez l'enregistrement vidéo dans les 3 minutes (le sperme de Xenopus ont une durée de motilité limitée) et continuer pendant 5 minutes. A la fin de l'enregistrement vidéo, de démonter la chambre et lavez-les auges et plate-forme d'observation avec un jet sous pression d'eau, puis l'éthanol à partir d'un vaporisateur. Enlever l'huile de silicone de la face supérieure avec des lingettes papier en faisant attention de ne pas contaminer la plate-forme d'observation et de creux.
- Si nécessaire, convertir les données vidéo capturées à une séquence d'image Tiff ou pile en utilisant le logiciel Image J. Puis ouvrez le fichier dans Image J et dans les 21 premiers cadres (3 secondes) choisissent jusqu'à 50 spermatozoïdes à être suivis. Pour éviter les biais, a choisi de sperme de toutes les régions du champ d'observation et sans connaissance de leurs données de trajectoire. Capturez des trajectoires cellulaires à deux dimensions dans le plan xy en fonction du temps (XYT ensembles de données) pour chaque spermatozoïde par point et clic de la souris en utilisant le plug-in MtrackJ module pour trajectoires image Visualisez J. et calculer la trajectoiredistances, des composants axe et vitesses au sein MtrackJ. Sinon, procéder à ces opérations et d'autres analyses numériques (par exemple les paramètres de directionnalité chimiotactisme, et les histogrammes des paramètres) par l'importation de données XYT ensembles dans Microsoft Excel.
- Terrain trajectoires pour chaque spermatozoïde dans Excel pour détecter les tendances générales du mouvement, y compris linéaire, curviligne modèles, et la circulaire ainsi que des fonctionnalités telles que des virages. Utiliser les données pour calculer XYT ensembles vitesse moyenne curviligne, le voyage le long du filet de X (dégradé) - et l'axe Y, et les paramètres d'orientation tels que l'angle moyen de déplacement par rapport à l'axe du gradient.
4. Les résultats représentatifs:
Important paramètres techniques dans le dosage de deux chambres sont de taille et de forme de la chambre, la porosité de la membrane, et la longueur de l'incubation. La taille de la chambre haute détenant le sperme ne doit pas être si grand que le diamètre d'exiger un grand volume de sperme (préturel, de préférence de 0,5 ml ou moins), ni la chambre haute devrait être si profond que de créer une haute colonne de suspension cellulaire (<1 cm). Le volume de tampon de la chambre basse entourant l'insert Chambre haute devrait correspondre exactement au niveau de la suspension cellulaire dans l'insert afin de ne pas créer une pression hydrostatique transmembranaire qui artifactually vigueur des spermatozoïdes à travers la membrane. Placement de l'insert vide dans le fond du puits en premier, suivi par les résultats de chargement sperme dans une pression hydrostatique à la hausse initiale qui empêche les spermatozoïdes d'aller à travers la membrane pendant le chargement. Choix de la taille des pores membranaires est déterminée par la taille des spermatozoïdes, et la disponibilité commerciale d'inserts membrane poreuse. Nous trouvons que les dosages avec le sperme de grenouille peut utiliser soit 8 ou 12 pm de diamètre des pores bien pores 12 um de fournir pour le passage d'un nombre plus élevé de spermatozoïdes permettant le comptage plus précis. Tailles de pores supérieure à 12 um ne semble pas être disponibles dans le commerce. Une alternative à l'utilisation de tiinserts de culture UMÉRO est l'utilisation des membranes Neuroprobe conçus pour des essais de chimiotactisme plaques à 96 puits. Ceux-ci offrent un débit potentiellement plus important et une plus large gamme de diamètres de pores. Bien que plus de spermatozoïdes chez les mammifères semble exiger un plus grand diamètre des pores, nous avons réussi analysés chimiotactisme des spermatozoïdes de souris utilisant des plaquettes avec 12 pores um (Burnett, observations non publiées). En revanche, les tailles des pores plus petits pourraient être adéquates pour les petits spermatozoïdes (par exemple les oursins), bien que nous n'avons pas encore testé cette possibilité.
Un inconvénient de l'essai de deux chambres décrites est que les spermatozoïdes sont placés dans la chambre supérieure donc inévitablement traduit par un passage des spermatozoïdes par la gravité, réduisant ainsi le rapport signal à fond. Ceci est rendu nécessaire par le fait que les spermatozoïdes de Xenopus sont pas suffisamment dynamiques dans leur motilité de nager à contre gravité que sont les spermatozoïdes de mammifères. Une autre difficulté à doser le sperme de Xenopus est le fait que leur motilité lle temps est court IFE - 5 à 15 minutes après l'activation. Cette restriction est la base pour avoir besoin d'activer un nouveau lot de sperme tous les 2 à 3 minutes lors de la réalisation des tests multiples. En conséquence, les études de cours à temps ont montré que le passage des spermatozoïdes se produit dans la plupart des les 20 premières minutes du test 5. Bien que nous utilisions une période d'incubation de 50 minutes, cette période pourrait vraisemblablement être court-circuité à 20 ou 30 minutes. En revanche, pour les spermatozoïdes de souris qui restent immobiles pendant des heures, nous avons utilisé jusqu'à une période de 2 heures de test avec de bons résultats (Burnett, observations non publiées).
Dans le dosage de deux chambres à l'aide de sperme de grenouille, le nombre total de spermatozoïdes de passer à travers la membrane poreuse est généralement de 10 à 20000, soit environ 1 à 2% du sperme placé dans l'insert chambre haute. Présence d'un gradient chimiotactique à la chambre basse peut augmenter le passage des spermatozoïdes jusqu'à 4 à 10 fois. La figure 2 illustre une courbe dose typique de réponse réalisée avec ce dosage. Une extracte de Xenopus oeuf en gelée («l'eau d'œuf») contenant les protéines connues allurin chimiotactique (cercles rouges), a été placé dans la chambre du bas à une série de dilutions. Les protéines d'oeuf totale d'eau contenue dans chaque essai est donné en microgrammes / test - la quantité livrée dans l'original un volume de 50 ul. Comme la protéine livrés sous forme d'un gradient de diffusion, la gamme de concentration réelle de protéines que le sperme de répondre à on ne sait pas mais peut être estimé à 5 à 10 fois plus faible que la concentration en protéines de la chute de livraison. Pour cette raison, on note la quantité de protéines introduites, non pas la concentration. Habituellement nous procédons à des tests en double ou en triple pour chaque dose et la moyenne du résultat, nous avons ensuite de reproduire toute l'expérience de 3 ou 4 fois en utilisant le sperme d'hommes différents dans chaque expérience. L'erreur moyenne et le niveau de la moyenne est calculée pour chaque dose avec l'erreur standard de la moyenne étant généralement 5 à 10% de la moyenne. Notez que les protéines, sans knol'activité chimiotactique wn tels que la sérum albumine bovine (cercles ouverts, fig. 2) peut produire un niveau bas, non spécifiques du sperme augmentation de passage à travers la membrane. Une observation intéressante est que la courbe dose-réponse pour l'eau oeuf est multiphasiques - une phase ascendante et une phase décroissante. Ce type de relation multiphasiques est commun pour chimiotactiques du sperme, la réponse du sperme humain à liquide folliculaire montre une relation semblable 6 biphasique qui est pensé être utile dans cette forte concentration de chimioattractive trouve dans le voisinage d'un oeuf peut servir à diminuer encore les réponses de recherche sur la partie du sperme.
Parfois, nous trouvons que les valeurs de contrôle pour ce test sont supérieures à la normale, réduisant ainsi la multiplication produit par un agent chimiotactique. Habituellement, cela peut être attribuée à une rupture mécanique de l'insert du filtre lors du dosage. Ainsi, il est important que les plaquettes ne sont pas dérangés pendant le chargement des spermatozoïdes ou des chemoattractant, pendant l'incubation dosage ou lorsque l'insert est supprimé. Particulièrement important est que le réservoir de spermatozoïdes dans l'insert est enlevé par micropipette ou d'aspiration avant de lever l'insert hors du puits. Cela garantit que les spermatozoïdes ne sont pas balayés à travers la membrane poreuse dans la chambre en bas que l'insert est supprimé.
Important paramètres techniques dans le dosage de la chambre Zigmond comprendre la distance entre la plate-forme de lamelle et l'observation, le grossissement de l'observation vidéo, le type de l'optique utilisée, et la cadence. Distance entre la plate-forme d'observation est généralement de 10 à 15 um, bien que cette distance peut être modifiée par la quantité d'huile de silicone utilisé pour l'interface entre le verre de couverture et la glissière de chambre - le plus de pétrole, plus la distance. Un avion mince de fluide augmente la quantité de temps nécessaire à un gradient de former ainsi que la longévité de la pente une fois formés. Un épais plan de fluide permet une g plus rapideformation de Radient mais le gradient a une courte durée de vie et moins de stabilité. La dynamique de la formation de gradient peuvent être visualisées en utilisant un colorant fluorescent ou une lampe fluorescente de dextrane dans le chimioattractive bien et en utilisant la microscopie à fluorescence pour voir la dynamique. Le réactif de test doit être adapté au poids moléculaire de la chimioattractive être utilisés et la dynamique déterminée utilisée pour juger de combien de minutes devraient être autorisés pour la formation de gradient et l'enregistrement des mouvements des spermatozoïdes.
Le grossissement utilisé devrait être faible (objectif 4x ou 10x) dans l'ensemble si la plate-forme d'observation entière doit être visualisés que dans les conditions de dosage que nous avons décrits. D'autre part, un plus fort grossissement (objectif 40x ou 63x) peut être utile si l'on al'intention de suivre la trajectoire des segments relativement courts ou des souhaits pour résoudre mouvements flagellaire. Suivi peut être effectué soit par des méthodes semi-manuel tel que décrit dans le présent document ou par le suivi automatisé tel que pratiqué dans plus soplogiciels tels que histicated MetaMorph ou Track Imaris. Dans les deux cas, la facilité de suivi est très dépendante de contraste de l'image que ce soit par l'opérateur ou par un logiciel assisté par la reconnaissance d'objets. Bien que l'optique en champ clair pourrait être utilisée dans certains cas, l'utilisation de l'optique à contraste de phase ou à fond noir optique est souvent requis. Enfin, le taux de trame dépend de la résolution en temps voulu dans le suivi. Si semi-manuel méthodes sont utilisées que dans notre procédure, on est probablement limité à la cadence relativement faible - de 4 à 8 images par seconde - en raison de la nature du travail intensif de l'enregistrement de données. D'autre part, les observations taux de vidéo peuvent être requis pour des réponses rapides tels que des formes d'ondes flagellaires. Souvent, les objectifs expérimentaux sont mieux servis en faisant des expériences plus lent taux de trame plus rapides et les expériences cadence séparément, car on souhaite aussi de modifier d'autres paramètres tels que le grossissement, l'optique, ou de traitement d'images numériques.
Les résultats typiques pour la Zigmdosage de deuxième chambre de suivi composé d'un ensemble de trajectoires comme ceux vus pendant cinquante sperme de grenouille dans le clip vidéo du film 1. Contre une image de la plate-forme d'observation, les trajectoires individuelles de sperme sont tracées en rouge pour une expérience de contrôle (pas de gradient chimiotactique présents). Les trajectoires cellulaires à deux dimensions dans le plan xy en fonction du temps pour chacun de sperme peut être tracée et enregistrée par MtrackJ et importé dans Microsoft Excel. Pour l'analyse de la trajectoire, nous désignons l'axe du gradient chimiotactique que l'axe des X et l'axe des Y à l'axe orthogonal, en conformité avec la convention initialement développé par Fabro et al. 3. Comme le montre le diagramme de la figure 3, la trajectoire réelle prise est composé d'étapes, dont la somme des longueur est égale à la distance parcourue en curviligne de la trajectoire (bleue / flèches d'or). La distance et l'orientation nette du voyage par chaque sperme est un vecteur qui relie le point premier et dernier de la trajectoire (flèche rouge en diagonale). L'voyages net peut être séparé en ses composantes de l'axe X et l'axe Y composant (flèches rouges en pointillé; aussi appelée nette delta X et delta net Y, respectivement).
Parce que le chimiotactisme dans le sperme peut impliquer des changements vertébrés relativement subtiles dans le sens du voyage, un grand nombre de spermatozoïdes (100 à 300), sélectionnés au hasard, sont habituellement analysés pour chaque condition qui nécessite souvent des données regroupées de 4 à 6 expériences indépendantes. Aux fins d'illustration, cependant, nous allons utiliser les données de seulement cinquante sperme de grenouille. Le tableau 1 illustre les paramètres couramment utilisés pour détecter des changements dans les spermatozoïdes. La moyenne de déplacement filet le long de l'axe X va augmenter notablement si, en présence d'un agent chimiotactique, la population de spermatozoïdes dans son ensemble suit des trajectoires qui correspondent plus étroitement avec le dégradé. Dans notre exemple, la moyenne nette de l'axe X de voyage ont augmenté plus de trois fois en présence de l'eau d'œuf. On peut également tracer un histogramme de filet de l'axe X de voyage pour la population de spermatozoïdes qui a l'avantage tage que les petites sous-populations de spermatozoïdes réactif peut être détecté. Deux paramètres développés par Fabro et al. 3 peut aussi aider à détecter de telles populations. Tant le pourcentage de spermatozoïdes présentant net positif de l'axe X de déplacement (% AX> 0) et le pourcentage de spermatozoïdes présentant nets de déplacement linéaire ne dépassant pas 45 degrés de l'axe du gradient (% AX / | AY |> 1) peut augmenter considérablement si la population de spermatozoïdes entier est sensible à la chimiotactique ou par petits montants, mais encore significatif si les sous-populations de spermatozoïdes sont sensibles. Notre exemple dans le tableau 1 montre les augmentations dans les deux paramètres pour le sperme de grenouille fifty exposés à un gradient d'eau d'œuf. Notez que aléatoire non-orienté le mouvement donnera des valeurs non nulles pour ces deux paramètres de 50% et 25% respectivement; valeurs de contrôle plus élevée (tels que ceux du tableau 1) représentent un fond due soit à un numéro d'échantillon est faible ou à un biais dans l'orientation du sperme particulière à la conception expérimentale.
contenu "Directionnalité> du voyage sperme dans la réponse aux agents chimiotactique peut être directement évaluée par thêta, l'angle entre le vecteur de déplacement net pour chaque spermatozoïde et le gradient de (X)-axe. Notre exemple dans le tableau 1 montre que la moyenne thêta diminué pour la baignade des spermatozoïdes dans un gradient d'eau oeuf indiquant que les trajectoires de sperme comme une population étaient mieux alignées avec le dégradé. similaires au filet de l'axe X de déplacement (voir ci-dessus), thetas pour la population de spermatozoïdes peut être exprimée comme une distribution, une approche aussi sensibles aux sous-populations de sperme réactive et celui qui a été récemment étudié par Gakamsky et coll 7.Enfin, les vitesses instantanées curvilignes et les spermatozoïdes individuels peuvent également être extraites à partir des données décrivant les trajectoires cellulaires à deux dimensions dans le plan xy en fonction du temps. On pourrait trouver qu'il ya une augmentation de la vitesse ainsi que d'un changement d'orientation du voyage, suggérant ainsi une réponse chimiocinétiques ainsi queune réponse chimiotactique.
Ces données représentent un point de départ pour l'analyse des trajectoires des spermatozoïdes. Une analyse plus poussée pourrait inclure des mesures de linéarité et de la trajectoire de courbure sur un instant par instant comme base effectuée par Bohmer et al. 8 et Shiba et al. 9, la détection automatique de tours que réalisée par Burnett et al. 10, et la non-linéarité que mesurée par l'analyse fractale 11,12. Pourvu que ces trajectoires spermatozoïdes sont suivis au plus fort grossissement, on pourrait aussi l'image mouvements flagellaires et réels signaux calciques temps réalisés par plusieurs laboratoires 8,9,13,14,15,16. Ces études ont démontré que les deux invertébrés et de mammifères de sperme répondre à chimiotactiques par les virages serrés du sperme jusqu'à gradient vers la source chimiotactique. Ces tours sont accompagnés par des coudes flagellaire qui modifient l'orientation de sperme bien comme un gouvernail serait, coudes qui semblent initiée par Li défini, vaguesignaux calciques ke se propageant dans le flagelle. Ainsi, le but ultime de suivi des spermatozoïdes est de corréler la signalisation dynamique du système à des changements dans la propulsion flagellaire qui servent de base de l'orientation des spermatozoïdes dans un gradient chimiotactique. Ces objectifs n'ont pas encore été atteint dans le sperme de xénope, qui voyage dans un mouvement hélicoïdal 17, exposition faible courbure de leurs trajectoires 10, et dont le calcium signaux doivent encore être surveillés.
Bien que nous nous sommes concentrés ici sur les détails les méthodes de dosage que nous utilisons pour les spermatozoïdes de Xenopus laevis, tant les deux test chambre d'accumulation de sperme et le dosage Zigmond suivi chambre peut être utilisée pour le sperme de mammifères, si certaines modifications sont faites. Les deux tests peuvent être effectués à 37 ° C, si désiré, par l'utilisation d'un chauffe diapositives et, dans le dosage de la chambre Zigmond, une platine de microscope les plus chauds. Typiquement, le sperme de mammifères seront isolés, capacitation et incubée à l'aide appropriée tampons mammifères unechimiotactiques D, mais l'analyse des données sera similaire à ce qui est décrit ici pour les espèces d'amphibiens. Une autre différence est que la chambre Zigmond est habituellement placé à la verticale sur la scène d'un microscope droit puisque le sperme de mammifères, contrairement aux spermatozoïdes de Xenopus, peut nager de monter sur la plate-forme d'observation. Encore non testées, ces deux tests peuvent voir l'application au sperme d'un certain nombre d'espèces dans les travaux futurs.

Figure 1. Schéma de l'essai de deux chambres. Les spermatozoïdes sont placés dans un encart en bas de ce qui est un filtre en polycarbonate avec des pores 12 um. Une solution chimiotactique est soigneusement à la pipette dans le puits pour initier la formation d'un gradient de concentration.
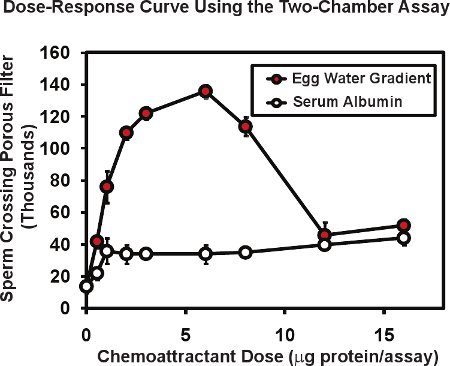
Des données représentatives Figure 2. Pour le sperme de grenouille en utilisant le sperme de deux chambres chemotaxidosage de s. L'eau d'oeufs préparés à partir de X. oeufs laevis présente une multiphasiques dose-activité de la courbe qui est caractéristique de chimiotactiques sperme. Passage de l'albumine de sérum bovin du sperme augmente légèrement - un effet non spécifique des protéines. Figure modifiée d'Al-Anzi et Chandler 5.
Vidéo 1. Un clip vidéo montrant des trajectoires de sperme de grenouille tracées en rouge sur la plate-forme d'observation d'une chambre Zigmond. La largeur de la plate-forme est de 1 mm. Cliquez ici pour regarder le clip vidéo.
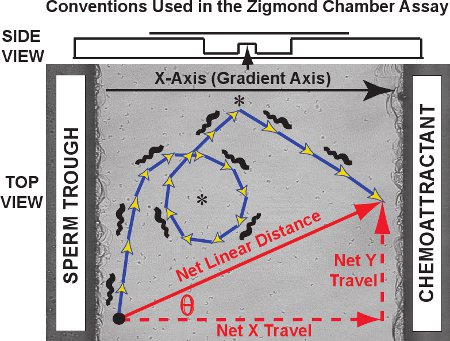
Axe conventions figure 3., Une trajectoire curviligne de sperme et un vecteur de déplacement linéaire net sont tracées sur la plate-forme d'observation Zigmond chambre. Les données obtenues sont de trois types. Tout d'abord, les trajectoires des spermatozoïdes eux-mêmes (bleu / flèches d'or) peut révéler spécifiques su modèlesch comme des cercles et des tours (astérisques). Distance curviligne et vitesses curviligne peut être mesurée pour le chemin de la trajectoire. Deuxièmement, la distance linéaire nette voyagé sur toute la trajectoire, la composante nette axe X (gradient) de voyage, la composante d'axe Y nets de déplacement et de l'angle thêta entre l'axe X et le vecteur de déplacement nets peuvent être calculés pour chaque trajectoire et comparé comme une distribution sur l'ensemble du sperme suivis. Troisièmement, les changements instantanés de vitesse et direction du déplacement des segments dans les trajectoires individuelles peuvent être étudiés individuellement ou en tant que population. Ci-dessus, une vue latérale de la chambre est présentée dans un diagramme.

Tableau 1. Paramètres fréquemment utilisés dans l'analyse des données de la chambre de Zigmond.
Discussion
Chimiotactisme des cellules en mouvement par le mouvement soit amiboïde ou de flagelles alimenté par la natation se trouve dans de nombreux contextes biologiques et l'étude de ce phénomène requiert la disponibilité des tests pratiques et fiables. Quelques exemples de ce phénomène, comme l'attraction des spermatozoïdes à un œuf de l'oursin ou le ramassage des cellules moisissure visqueuse pour former un corps de fructification, ont un impact visuel immédiat. La quantification de ce phénomène a ?...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous remercions le Laboratoire WM Keck Bioimaging pour l'utilisation de leur poste de travail vidéo microscopie. Cette étude a été soutenue par NSF Grant IBN-0615435.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de l'article | Société | Numéro de catalogue | Commentaires |
| Plaques à 24 puits | Becton-Dickenson | 35/1147 | |
| 12 mm de diamètre extérieur avec inserts membrane 12 um des pores | Millipore | PIXP01250 | Nous avons précédemment utilisé Costar-Corning plaque transwell # 3403-maintenant discontinué |
| Zigmond chambre | Neuroprobe | Z02 | |
| L'huile de silicone | General Electric | SF1154 | Equivalent à Dow Corning 550 Fluid |
| Image J logiciels | Wayne Rasband, Services Direction de la recherche, Institut national de la santé mentale | Téléchargement gratuit à http://rsbweb.nih.gov/ij | Programme Java qui s'exécute sur Windows, Linux et Mac |
| MtrackJ logiciels | Erik Meijering / Imagescience / Groupe d'imagerie biomédicale , Erasmus MC - University Medical Center de Rotterdam | Téléchargement gratuit à http://www.imagescience.org/meijering/software/mtrackj/ | Programme Java qui s'exécute sur Windows, Linux et Mac |
| Virtual Dub logiciels | GNU General Public Licence logicielle | Téléchargement gratuit via http://www.virtualdub.org/index.html | Instructions d'installation sur le site Image J sous plugins; pour Windows uniquement |
| cellSens logiciels | Olympus | Voir le site: http://www.olympusamerica.com/seg_section/product.asp? produit = 1070 | Contrôles et acquiert des images d'une variété de caméras. A également une capacité de traitement de l'image |
Références
- Ward, G. E., Brokaw, C. J., Garbers, D. L., Vacquier, V. D. Chemotaxis of Arbacia punctulata spermatozoa to resact, a peptide from the egg jelly layer. J. Cell Biol. 101, 2324-2329 (1985).
- Olivera, R. G., Tomasi, L., Rovasio, R. A., Giojalas, L. C. Increased velocity and induction of chemotactic response in mouse spermatozoa by follicular and oviductal fluids. J. Reprod. Fertil. 115, 23-27 (1999).
- Fabro, G., Rovasio, R. A., Civalero, S., Frenkel, A., Caplan, S. R., Eisenbach, M., Giojalas, L. C. Chemotaxis of capacitated rabbit spermatozoa to follicular fluid revealed by a novel directionality-based assay. Biol. Reprod. 67, 1565-1571 (2002).
- Sugiyama, H., Burnett, L., Xiang, X., Olson, J., Willis, S., Miao, A., Akema, T., Bieber, A. L., Chandler, D. E. Purification and multimer formation of allurin, a sperm chemoattractant from Xenopus laevis egg jelly. Mol. Reprod. Dev. 76, 527-536 (2009).
- Al-Anzi, B., Chandler, D. Xenopus laevis egg jelly releases a sperm chemoattractant during spawning. Dev. Biol. 198, 366-375 (1998).
- Ralt, D., Goldenberg, M., Fetterolf, P., Thompson, D., Dor, J., Mashiach, S., Garbers, D. L., Eisenbach, M. Sperm attraction to a follicular factor(s) correlates with human egg fertilizability. Proc. Natl. Acad. Sci. U.S.A. 88, 2840-2844 (1991).
- Gakamsky, A., Schechtman, E., Caplan, S. R., Eisenbach, M. Analysis of chemotaxis when the fraction of responsive cells is small--application to mammalian sperm guidance. Int. J. Dev. Biol. 52, 481-487 (2008).
- Böhmer, M., Van, Q., Weyand, I., Hagen, V., Beyermann, M., Matsumoto, M., Hoshi, M., Hildebrand, E., Kaupp, U. B. Ca2+ spikes in the flagellum control chemotactic behavior of sperm. EMBO J. 24, 2741-2752 (2005).
- Shiba, K., Baba, S. A., Inoue, T., Yoshida, M. Ca2+ bursts occur around a local minimal concentration of attractant and trigger sperm chemotactic response. Proc. Natl. Acad. Sci. U.S.A. 105, 19312-19317 (2008).
- Burnett, L. A., Sugiyama, H., Bieber, A. L., Chandler, D. E. Egg jelly proteins stimulate directed motility in Xenopus laevis sperm. Mol. Reprod. Dev. 78, 450-462 (2011).
- Abaigar, T., Barbero, J., Holt, W. V. Trajectory variance and autocorrelations within single sperm tracks as population level descriptors of sperm track complexity, predictability and energy generating ability. J. Androl. , (2011).
- Mortimer, S. T., Swan, M. A., Mortimer, D. Fractal analysis of capacitating human spermatozoa. Hum. Reprod. 11, 1049-1054 (1996).
- Guerrero, A., Carneiro, J., Pimentel, A., Wood, C. D., Corkidi, G., Darszon, A. Strategies for locating the female gamete: the importance of measuring sperm trajectories in three spatial dimensions. Mol. Hum. Reprod. 17, 511-523 (2011).
- Yoshida, M., Yoshida, K. Sperm chemotaxis and regulation of flagellar movement by Ca2+. Mol. Hum. Reprod. 17, 457-465 (2011).
- Spehr, M., Schwane, K., Riffell, J. A., Zimmer, R. K., Hatt, H. Odorant receptors and olfactory-like signaling mechanisms in mammalian sperm.Mol. Cell. Endocrinol. 250, 128-136 (2006).
- Veitinger, T., Riffell, J. R., Veitinger, S., Nascimento, J. M., Triller, A., Chandsawangbhuwana, C., Schwane, K., Geerts, A., Wunder, F., Berns, M. W., Neuhaus, E. M., Zimmer, R. K., Spehr, M., Hatt, H. Chemosensory Ca2+ dynamics correlate with diverse behavioral phenotypes in human sperm. J. Biol. Chem. 286, 17311-17325 (2011).
- Tholl, N., Naqvi, S., McLaughlin, E., Boyles, S., Bieber, A. L., Chandler, D. E. Swimming of Xenopus laevis sperm exhibits multiple gears and its duration is extended by egg jelly constituents. Biol. Bull. 220, 174-185 (2011).
- Eisenbach, M. Sperm chemotaxis. Rev. Reprod. 4, 56-66 (1999).
- Riffell, J. A., Zimmer, R. K. Sex and flow: the consequences of fluid shear for sperm-egg interactions. J. Exp. Biol. 210, 3644-3660 (2007).
- Corkidi, G., Taboada, B., Wood, C. D., Guerrero, A., Darszon, A. Tracking sperm in three-dimensions. Biochem. Biophys. Res. Commun. 373, 125-129 (2008).
- Himes, J. E., Riffell, J. A., Zimmer, C. A., Zimmer, R. K. Sperm chemotaxis as revealed with live and synthetic eggs. Biol Bull. 220, 1-5 (2011).
- Sun, F., Giojolas, L. C., Rovasio, R. A., Tur-Kaspa, I., Sanchez, R., Eisenbach, M. Lack of species-specificity in mammalian sperm chemotaxis. Dev. Biol. 255, 423-427 (2003).
- Guidobaldi, H. A., Teves, M. E., Uñates, D. R., Anastasía, A., Giojalas, L. C. Progesterone from the cumulus cells is the sperm chemoattractant secreted by the rabbit oocyte cumulus complex. PLoS One. 3, e3040-e3040 (2008).
- Oren-Benaroya, R., Orvieto, R., Gakamsky, A., Pinchasov, M., Eisenbach, M. The sperm chemoattractant secreted from human cumulus cells is progesterone. Hum. Reprod. 23, 2339-2345 (2008).
- Teves, M. E., Guidobaldi, H. A., Uñates, D. R., Sanchez, R., Miska, W., Publicover, S. J., Morales Garcia, A. A., Giojalas, L. C. Molecular mechanism for human sperm chemotaxis mediated by progesterone. PLoS One. 4, 8211-82 (2009).
- Blengini, C. S., Teves, M. E., Uñates, D. R., Guidobaldi, H. A., Gatica, L. V., Giojalas, L. C. Human sperm pattern of movement during chemotactic re-orientation towards a progesterone source. Asian J. Androl. 13, 769-773 (2011).
- Strünker, T., Goodwin, N., Brenker, C., Kashikar, N. D., Weyand, I., Seifert, R., Kaupp, U. B. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. J. Exp. Med. 115, 453-465 (1962).
- Zigmond, S. H., Lauffenburger, D. A. Assays of leukocyte chemotaxis. Annu. Rev. Med. 37, 149-155 (1986).
- Villanueva-Diaz, C., Vadillo-Ortega, F., Kably-Ambe, A., Diaz-Pérez, M. A., Krivitzky, S. K. Evidence that human follicular fluid contains a chemoattractant for spermatozoa. Fertil. Steril. 54, 1180-1182 (1990).
- Villanueva-Diaz, C., Arizs-Martinez, J., Bermejo-Martinez, L., Vadillo-Ortega, F. Progesterone induces human sperm chemotaxis. Fertil. Steril. 64, 1183-1188 (1995).
- Olson, J., Xiang, X., Ziegert, T., Kittleson, A., Rawls, A., Bieber, A., Chandler, D. E. A. l. l. u. r. i. n. a 21 kD sperm chemoattractant from Xenopus egg jelly, is homologous to mammalian sperm-binding proteins. Proc. Natl. Acad. Sci. U.S.A. 98, 11205-11210 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon