Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Zwei Arten von Assays zum Nachweis von Frog Sperm Chemotaxis
In diesem Artikel
Zusammenfassung
Eier und der extrazellulären Beschichtungen um Eier häufig Release Peptiden, Proteinen und kleinen Molekülen, die Kommunikation mit Spermien, um sie an das Ei fördert damit die Befruchtung führen. Mit Frosch Spermien wir beschreiben und vergleichen zwei Klassen von Assays verwendet, um Spermien Chemoattraktion erkennen - Sperma Anhäufung Assays und Spermien-Tracking-Tests.
Zusammenfassung
Sperm Chemotaxis bei Wirbellosen kann ausreichend robust, dass man eine Pipette mit dem attraktiven Peptid in eine Spermiensuspension Ort und mikroskopisch sichtbar Spermien Ansammlung rund um die Pipette 1. Sperm Chemotaxis bei Wirbeltieren wie Fröschen, Nagern und Menschen ist schwieriger zu erkennen und erfordert quantitative Assays. Solche Tests sind zwei Haupttypen - Tests, die Spermien Bewegung zu quantifizieren, um eine Quelle der Lockstoff, sogenannte Spermien Anhäufung Assays und Assays, die tatsächlich verfolgen den Swimming Flugbahnen der einzelnen Spermien.
Sperm Anhäufung Assays sind relativ schnell was Dutzende oder Hunderte von Tests in einem einzigen Tag durchgeführt werden, wodurch Dosis-Wirkungs-Kurven und Zeit Kurse relativ schnell durchgeführt werden. Diese Arten von Assays wurden ausgiebig zu vielen etablierten Chemoattraktion Systeme zu charakterisieren - zum Beispiel, Chemotaxis neutrophiler zu bacterial Peptide und Spermien-Chemotaxis zu Follikelflüssigkeit. Sperma-Tracking-Tests können arbeitsintensiver werden, bieten aber zusätzliche Daten, wie chemoattractancts tatsächlich verändern Schwimmen Wege, die Spermien zu nehmen. Diese Art von Test ist notwendig, um die Orientierung der Spermien Bewegung relativ zur chemoattrractant Farbverlaufsachse zu demonstrieren und zu charakteristischen Windungen oder Änderungen in der Ausrichtung, dass die Spermien näher an das Ei zu visualisieren.
Hier beschreiben wir Methoden für jede dieser beiden Arten von Tests verwendet. Die Spermien Anhäufung Test verwendet wird als "Zwei-Kammer"-Test. Amphibien-Spermien sind in einem Gewebekulturplatte Einsatz mit einem Polycarbonat-Filter Etage mit 12 Mikrometer Durchmesser Poren gelegt. Inserts mit Spermien werden in Gewebekulturplatte Vertiefungen mit Puffer und ein chemoatttractant vorsichtig in den Boden gut, wo der Boden erfüllt die Wand (siehe Abb. 1). Pipettiert platziert. Nach der Inkubation wird die oben einfügen, welche die Spermien-Reservoir sorgfältig rentfernt hat, und Spermien in die untere Kammer, die durch die Membran passiert haben, werden entfernt, pelletiert und dann von Hämozytometer oder Durchflusszytometer gezählt.
Die Spermien-Tracking-Test verwendet eine Zigmond Kammer ursprünglich zur Beobachtung Neutrophilen-Chemotaxis entwickelt und modifiziert für die Beobachtung von Spermien durch Giojalas und Mitarbeiter 2,3. Die Kammer besteht aus einer dicken Glasplatte, in die zwei senkrechte Rinnen bearbeitet worden sind. Diese werden durch eine 1 mm breite Aussichtsplattform getrennt. Nach der Anwendung eines Deckglases, Spermien in eine Mulde geladen sind, visualisiert die Lockstoff-Agent in die andere und die Bewegung der einzelnen Spermien durch Video-Mikroskopie. Video footage wird dann analysiert mit Hilfe von Software zweidimensionalen Zelle Bewegungen in der xy-Ebene als Funktion der Zeit (xyt Datensätze), dass die Flugbahn jedes Spermium Form zu identifizieren.
Protokoll
1. Materialien und Puffer verwendet
- Oocyte Ringer-Puffer (1,5 x OR2) enthält 124 mM NaCl, 3,75 mM KCl, 1,5 mM CaCl 2, 1,5 mM MgCl 2, 1,5 mM Na 2 HPO 4, 10 mM Hepes, pH 7,8. Düngung Buffer (F-1) enthält 41,25 mM NaCl, 1,25 mM KCl, 0,25 mM CaCl 2, 0,06 mM MgCl 2, 0,5 mM Na 2 HPO 4, 2,5 mM Hepes, pH 7,8.
- Xenopus laevis Ei Wasser nach Sugiyama et al. 4. Kurz beschrieben werden frisch hervorgebracht Gelee Froscheier in einem kleinen Volumen von F-1-Puffer für 30 Minuten und das konditionierte Medium durch Mikropipette entfernt verwirbelt. Dieses Medium, als "Ei Wasser", kann auch verwendet werden, um gereinigt allurin, die primäre Lockstoff in diesem Gelee-Extrakt herzustellen. Spermien sind aus kommerziell gezüchtet Xenopus laevis oder Xenopus tropicalis erhalten.
- Siehe Tabelle der Werkstoffe für bestimmte Elemente in t notwendiger Assay.
2. Ein Zwei-Kammer-Assay für Frosch Spermien-Chemotaxis
- Anesthetize der Frosch durch Eintauchen in Wasser mit 0,07% Benzocain, enthaupten Verwendung eines Paares von Carborundum eingefasst Schere, und doppelklicken Mark zur Sterbehilfe zu gewährleisten. Cut entfernt Bauchhaut, um Muskeln freizulegen. Machen Mittellinie und seitliche Einkerbungen in Bauch-Muskel-und einfahren. Vorsichtig einfahren Darm und Fett weiß, bohnenförmige Hoden zu offenbaren. Trim entfernt Bindegewebe mit einer feinen Schere darauf achten, die Blutgefäße zu vermeiden. Entfernen eines Hodens, abzuwaschen kein Blut mit 1,5 x OR2-Puffer, dann rollen die Hoden auf Filterpapier, um überschüssige Puffer und kleinen Anhänger Blutgefäßen zu entfernen, und dann die Hoden in einem Kunststoff-Pitre Gericht in 0,2 ml von 1,5 x OR2 Puffer. Füllen Sie eine 5 ml Spritze mit 2 ml 1,5 x OR2 Puffer, sanft poke 10-20 Löcher in den Hoden über den größten Teil der Fläche an einem Ende die Nadel am anderen Ende und sanft zu injizieren Puffer zu spülen Spermien. Alternativ kann einepuffern kann spritzen, während Stossen Sie die Ausfahrt Löcher zu spülen Spermien. Übertragen Sie die Spermien Suspension unter Verwendung einer Mikropipette mit einem cut-off Spitze (Vermeidung von Scherung der Spermien) zu einem Mikrozentrifugenröhrchen und auf Eis stellen.
- Schätzen Sie die Anzahl der Frosch Spermien durch Verdünnung 1:100 Spermien in 1,5 x OR-2 und unter einem 20 ul Probe des gemischten Sperma Fahrwerk und zählen die Anzahl der Zellen mit einer Zählkammer und der großen 1 mm 2 Fläche erhalten. Mit der Zählkammer zählen und Tastverhältnis berechnen Spermiendichte und die Gesamtzahl der Spermien geerntet. Diese Summe ist in der Regel 2 bis 6 x 10 7 Spermien in einem Volumen von etwa 2 ml, wenn beide Hoden verwendet. Von der Stammlösung Spermiensuspension mit 1,5 x OR2 Puffer zu einem Spermium Dichte von 2 x 10 7 / ml erhalten. Verwenden Sie die Spermien für Test innerhalb von 2 bis 3 Stunden nach der Zubereitung. Beurteilen Sie die Beweglichkeit der Spermien durch Verdünnen von 5 ul der Spermien im Verhältnis 1:10 mit F-1-Puffer und Visualisierung von Bewegung mit Phasenkontrast-Optik. Mindestens 40% bis 50% der Spermiensollte beweglich sein. Auch geeignete Präparate enthalten eine große Anzahl von unbeweglichen Spermien von denen die meisten noch nicht ausgewachsen ist.
- Bereiten Sie eine neue 24-well Kunststoff Gewebekulturplatte durch Mikropipettierung 700 ul F1-Puffer in jede Vertiefung. Jedes der gut sollte ca. 15 mm im Durchmesser an der Unterseite.
- Starten Sie eine Reihe von Tests durch Verdünnung 100 ul der Spermien-Suspension mit 900 ul F1-Puffer bei Raumtemperatur (ca. 21 bis 23 ° C) in einem Mikrozentrifugenröhrchen um die Beweglichkeit der Spermien durch osmotischen Schock zu aktivieren. Jedes Mal, wenn frisches Sperma auf diese Weise aktiviert wird, müssen die Spermien innerhalb von 1-2 Minuten verwendet werden.
- Legen Sie eine 12 mu m Porosität einfügen (12 mm od) in einen Puffer gefüllten gut, stellen Sie sicher, das Insert Platzierung ist außermittig Verlassen eines Raumes zur Seite. Sofortüberweisung 400 ul der Motilität aktiviert Spermien in den Brunnen durch eine Mikropipette mit einem Cut-off Spitze. Übernehmen Sie die Spermien Suspension auf die Wand der Filtereinsatz und lassen Sie ihn laufen bis auf den Filter im unteren Bereich the einfügen, die Spermien Suspension sollte nicht direkt auf die Filter pipettiert werden.
- Sorgfältig Mikropipette 50 ul chemoattractant Agenten in den Brunnen in den Raum zwischen dem Brunnen und der Off-Zentrum Filtereinsatz. Man muss vorsichtig sein, um die Tropfen, wo die Seiten-und Unterseite des Brunnens zu treffen und ziehen Sie die Pipette mit keiner Störung des Systems hinterlegen. Insbesondere sollte der Kolben auf der Mikropipette nur bis zum ersten Anschlag, so dass völlig Auswerfen der Probe, aber keine Luftblasen geschoben werden.
- Wiederholen Sie die Schritte 2.5 und 2.6 vor, so viele Tests beginnen je nach Bedarf, dann inkubieren der Platte, bis der erste Test begann vor 50 Minuten inkubiert wurde. Normalerweise kann man anfangen ein Test alle 45 bis 60 Sekunden. Beachten Sie, dass der Test kann durch eine erfahrene Person oder von zwei Personen gemeinsam gestrafft. In diesem Fall, ein oder zwei Reihen von Tests können mit einem größeren Bestand an beweglichen Spermien und schneller Pipettieren vorausgesetzt, dass Spermien eingeleitet werden immer innerhalb von 1 bis 2 Minuten verwendetAktivierung.
- Stoppen Sie jeden Test in der Reihenfolge gestartet. Zuerst sorgfältig stetige den Filtereinsatz mit einer Hand und mit der anderen vorsichtig die meisten oder alle der Spermien Suspension in der oberen Kammer durch Mikropipette oder durch Absaugen mit einer Pasteurpipette. Unmittelbar, mit einer feinen Pinzette, ziehen Sie den Filtereinsatz und zu verwerfen. Pflege bei diesem Schritt verwendet werden muss, zumindest die restlichen Spermien durch den Filter artifactually Erhöhung der Werte für die Spermien Durchgang gekehrt werden.
- Von jeder Platte gut, übertragen Sie die gesamte Sperma Suspension auf eine Mikrozentrifugenröhrchen. Es ist wichtig, um die Spermien Suspension in der gut mischen, bevor Rückzug seit Spermien auf dem Boden absetzen neigen. Add 15 ul 25% Formaldehyd zu einer Endkonzentration von 0,5% v / v und in den Kühlschrank, wenn die Anzahl der Spermien nicht am selben Tag.
- Pellet das Sperma in jedes Röhrchen mit einem 10 Sekunden-Taster Spin auf eine persönliche Mikrozentrifuge mit einer maximalen Geschwindigkeit von 2000 x g. Entfernen Sie alle 100 ul der übernatürlichenAmeise aus jedem Rohr, dann das Pellet in diesem Volumen. Nehmen Sie 20 ul Spermiensuspension verdünnen 1:10 mit destilliertem Wasser, und zählen Sie Sperma auf einer Zählkammer mit einem 40x-Objektiv auf einem aufrechten Mikroskop. Verwenden Sie den Grafen und Verdünnungsfaktoren auf die Gesamtzahl der Spermien, die durch den Filter in jedem Test bestanden zu berechnen.
3. Frog Spermien Tracking-Assays mit einem Zigmond Kammer
- Bereiten Sie das inverse Mikroskop-Arbeitsplatz für Videoaufnahmen. Wir verwenden eine Nikon Elipse TE300 inverse Mikroskop entweder mit einem Sony DXC-390 3-Chip-Farb analogen Videokamera oder einem Hamamatsu ORCA-03G monochrome Digitalkamera ausgestattet. Die Zigmond Kammer schieben muss auf der Bühne up-side-down Rest mit einer ausreichenden Öffnung in der Tischplatte zu einem 22x40 mm Deckglas unterzubringen. Diese Anordnung wird durch die Tatsache, dass Frosch Spermien nicht gegen die Schwerkraft zu schwimmen sind notwendig. Fokus entweder 4x oder 10x Objektiv auf der Aussichtsplattform, die zwischen den beidenTröge.
- Testen, um sicherzustellen, dass die Kamera fokussiert ist und zentriert auf der Aussichtsplattform. Wenn die Sony-Kamera verwendet wird, ist die Ausgabe auf einem Monitor und einem A / D-Wandler (Framegrabber) kann der Digitalisierung 7 Bilder pro Sekunde aus dem Videosignal gesendet. Der digitale Datenstrom wird mit einem Computer verarbeitet Betrieb mit 3 GHz oder mehr vorzugsweise mit 4 GB oder mehr RAM. Obwohl wir Scion Image Software (ein benutzerdefiniertes Windows-Version von NIH Image) Steuern eines Scion CG-7 Frame Grabber verwenden, sind diese Produkte nicht mehr verfügbar. Eine aktuelle Lösung besteht darin, Image J-Software mit einem VirtualDub-Plug-in für analoge Video-Kamera einzufangen verwenden. Wenn der Hamamatsu Kamera verwendet wird, ist die digitale Ausgabe von Olympus CEllSens Software verarbeitet und auf dem Computer-Monitor. In beiden Fällen werden die Daten entweder auf einem internen oder externen Festplatte als 8-Bit-TIFF-Stack gespeichert. Verwendung von Scion Image Software erfordert Umwandlung der TIFF-Bildsequenz, um einen Stapel mit Bild J.
- Die mikroskopischen Bereich sollten die meisten oder alle von der Aussichtsplattform Breite. Verwenden Sie Phasenkontrast oder Dunkelfeld-Optik für die besten Ergebnisse. Der Abstand zwischen der Aussichtsplattform und dem Boden des Deckglases soll 15 bis 20 um, da durch unterschiedliche Fokussierung auf jeder Oberfläche bestimmt.
- Bereiten Sie den Lockstoff in einer geeigneten Konzentration in F1-Puffer. Bereiten Xenopus laevis Spermien wie zuvor beschrieben und speichern in 1,5 x OR2 Puffer auf Eis bis zum Gebrauch.
- Montieren Sie die Zigmond Kammer. Beginnen Sie mit einem trockenen, sauberen Raum. Mit einer Mikropipette eine Linie von Silikonöl (4 ul) ca. 5 mm von und parallel zu den äußeren Rand jeder Trog. Legen Sie ein 22x40 mm Deckglas auf die Kammer ermöglicht die Silikonöl gleichmäßig auf den äußeren Rand jeder Trog verteilt. Wenn zeigen Vorversuche, dass Spermien Kleben ist ein Problem, kann man brauchen, um Fell des Deckglases mit Nitrocellulose als von Fabro et al. 3. Alterntiv ist die Aufnahme von Eiweiß im Puffer verwendet (z. B. 1% BSA) auch zu einer Verminderung Sperma kleben.
- Kehren Sie die Kammer und Ort über das kreisförmige Aussparung in dem Mikroskoptisch darauf achten, daß das Deckglas nicht in Kontakt mit der Bühne. Diese umgekehrte Konfiguration ist notwendig, um Xenopus Spermien aus dem Trog auf die Plattform zu bringen. Im Gegensatz zu Säugetieren Spermien sind Xenopus Spermien nicht stark genug, um gegen die Schwerkraft zu schwimmen, die Plattform zu erreichen.
- Aktivieren Sie 20 ul Xenopus Spermien in 1,5 x OR2 Puffer durch Mischen im Verhältnis 1:10 mit F1-Puffer bei Raumtemperatur. Mit einer Mikropipette mit einem Cut-Spitze, sofort in 70 ul der Motilität aktiviert Spermien in den Trog. Dies wird durch Halten der Mikropipette in einem flachen Winkel und dass sich die Spitze in die seitliche Öffnung der Rinne erreicht. Die Zellsuspension ausgeworfen füllt den Trog und Brücke durch Kapillarwirkung. Anschließend füllen Sie das Gegenteil Mulde in der gleichen Weise unter Verwendung eines chemoatttractant Lösung.
- Begin Videoaufnahmen innerhalb von 3 Minuten (Xenopus Spermien haben eine begrenzte Lebensdauer Motilität) und weiterhin für 5 Minuten. Am Ende der Videoaufnahmen, zerlegen die Kammer und waschen Sie die Tröge und Aussichtsplattform mit einem Wasserstrahl zu Wasser und anschließend Ethanol aus einer Spritzflasche. Silikon entfernen Öl aus dem oberen Flächen mit Papier wischt man aufpassen, nicht auf die Aussichtsplattform und Tiefen zu kontaminieren.
- Bei Bedarf konvertiert die Video-Daten erfasst, um ein TIFF-Bild-Sequenz oder Stapel mit Image J Software. Dann öffnen Sie die Datei in Image J und in den ersten 21 Frames (3 Sekunden) wählen bis zu 50 Spermien verfolgt werden. Zur Vermeidung von Verzerrungen, wählte Spermien aus allen Regionen der Beobachtungsfeld und ohne Wissen ihrer Flugbahn Daten. Erfassung zweidimensionaler Zelle Trajektorien in der xy-Ebene als Funktion der Zeit (xyt Datensätze) für jedes Spermium durch Zeigen und Klicken mit der Maus über die MtrackJ Plug-in-Modul für Bild J. Visualisieren Bahnen und berechnen FlugbahnEntfernungen Achse Komponenten und Geschwindigkeiten innerhalb MtrackJ. Alternativ Durchführung dieser Operationen und weitere numerische Analyse (z. B. Ausrichtung, Chemotaxis Parameter und Parameter-Histogramme) durch den Import von xyt Datensätze in Microsoft Excel.
- Plot Trajektorien für jedes Spermium in Excel die allgemeine Muster der Bewegung, einschließlich linearer, krummlinig und kreisförmige Muster sowie Features wie Wendungen zu erkennen. Nutzen Sie xyt Datensätze durchschnittliche krummlinigen Geschwindigkeit, netto reisen entlang der X (Gradient) zu berechnen - und Y-Achse und Ausrichtung Parameter wie die mittlere Winkel der Reise gegenüber dem Farbverlaufsachse.
4. Repräsentative Ergebnisse:
Wichtige technische Parameter in der Zwei-Kammer-Assay sind Größe und Form der Kammer, die Porosität der Membran, und die Länge der Inkubation. Die Größe der oberen Kammer hält die Spermien sollte nicht so groß im Durchmesser als ein großes Volumen an Spermien (pre benötigen, umferably 0,5 ml oder weniger), noch sollte die obere Kammer werden so tief wie auf einer hohen Säule der Zellsuspension (<1 cm) zu schaffen. Das Volumen der unteren Kammer-Puffer um die obere Kammer einlegen sollte exakt das Niveau der Zellsuspension im Einsatz, um nicht an einen transmembranen hydrostatischen Druck, dass artifactually Kraft würde Spermien durch die Membran zu schaffen. Die Platzierung des leeren Insert in den Boden gut erstens durch Spermien loading Ergebnisse in einer ersten oben hydrostatische Druck, die Spermien daran hindert, durch die Membran während des Ladens gefolgt. Wahl der Porengröße wird durch die Größe der Spermien und die kommerzielle Verfügbarkeit von porösen Membran-Einsätze bestimmt. Wir finden, dass Tests mit Frosch Sperma kann entweder nutzen 8 oder 12 Mikrometer Durchmesser Poren, obwohl 12 um Pore für den Durchtritt der höheren Anzahl von Spermien ermöglicht eine genauere Zählung geben. Porengrößen von mehr als 12 mu m scheinen nicht im Handel erhältlich sein. Eine Alternative zur Verwendung tissue Kultur Einsätzen ist die Verwendung des Neuroprobe Membranen für Chemotaxis-Assays in 96-Well-Platten ausgelegt. Diese bieten eine potenziell höheren Durchsatz und eine breitere Palette von Porendurchmesser. Obwohl größere Säuger Sperma scheint eine größere Porendurchmesser benötigen, haben wir erfolgreich Mausspermien Chemotaxis mit Wendeplatten mit 12 um Poren (Burnett, unveröffentlichte Beobachtungen) getestet. Im Gegensatz dazu können kleinere Porengrößen ausreichend für kleinere Spermien (zB Seeigel), obwohl wir noch nicht diese Möglichkeit geprüft haben.
Ein Nachteil des Zwei-Kammer-Test beschrieben ist, dass Spermien in die obere Kammer damit zwangsläufig was einige Spermien Durchgang durch die Schwerkraft platziert werden, damit die Verringerung der Signal-Hintergrund-Verhältnis. Dies wird durch die Tatsache, dass Xenopus Spermien nicht energisch genug in ihrer Beweglichkeit gegen die Schwerkraft zu schwimmen, als Säugetier-Spermien sind notwendig. Eine weitere Schwierigkeit in Assay Xenopus Spermien ist die Tatsache, dass ihre Beweglichkeit life Zeit ist kurz - von 5 bis 15 Minuten nach der Aktivierung. Diese Einschränkung ist die Grundlage für die Notwendigkeit, eine neue Charge von Spermien jeder 2 bis 3 Minuten, wenn die Durchführung mehrerer Tests zu aktivieren. Als Ergebnis haben Zeitverlauf Studien gezeigt, dass die meisten Spermien Passage tritt innerhalb der ersten 20 Minuten wurden 5. Obwohl wir einen 50-minütigen Inkubationszeit nutzen, könnte diese Frist jedoch wahrscheinlich kurzgeschlossen werden, um 20 oder 30 Minuten. Im Gegensatz zur Maus Spermien, die beweglich bleiben für Stunden haben wir bis zu einem Zeitraum von 2 Stunden der Test mit guten Ergebnissen (Burnett, unveröffentlichte Beobachtungen) verwendet.
In der Zwei-Kammer-Assay mit Frosch Sperma, ist die Gesamtzahl der Spermien durch die poröse Membran in der Regel 1 bis 20 oder über 1 bis 2% der Spermien in die obere Kammer einfügen platziert. Das Vorhandensein eines Lockstoff-Gradienten in der unteren Kammer kann Spermien Durchgang so viel wie 4 bis 10 fache erhöhen. Abbildung 2 zeigt eine typische Dosis-Wirkungs-Kurve mit diesem Assay durchgeführt. Ein extrAkt des Xenopus Ei Gelee ("Ei Wasser") mit den bekannten chemoattractant protein allurin (rote Kreise), wurde in der unteren Kammer bei einer Reihe von Verdünnungen platziert. Die gesamte Ei Wasser-Protein in jedem Test enthalten ist in Mikrogramm / Test gegeben - der Betrag in der ursprünglichen 50 ul Volumen geliefert. Da das Protein lieferte eine Diffusionsgradienten bilden wird, ist die tatsächliche Konzentrationsbereich von Protein, das Sperma zu reagieren nicht bekannt, aber können schätzungsweise 5 bis 10 mal niedriger als die Protein-Konzentration des Tropfens geliefert werden. Aus diesem Grund bezeichnen wir die Menge des Proteins eingeführt, nicht die Konzentration. In der Regel führen wir doppelte oder dreifache Assays für jede Dosis und der durchschnittlichen das Ergebnis, wir replizieren die gesamte Experiment 3 oder 4 Mal mit Sperma von verschiedenen Männern in jedem Experiment. Der Mittelwert und Standardabweichung des Mittelwertes ist für jede Dosis mit dem Standardfehler berechnet den Mittelwert typischerweise 5 bis 10% des Mittelwertes. Beachten Sie, dass Proteine ohne known chemoattractant Aktivität wie Rinderserumalbumin (offene Kreise, Abb. 2). kann zu einem niedrigen Niveau, unspezifische Erhöhung der Spermien Durchtritt durch die Membran. Eine interessante Beobachtung ist, dass die Dosis-Wirkungs-Kurve für Ei Wasser mehrphasig ist - eine steigende Phase und einer abnehmenden Phase. Diese Art von Mehrphasen-Beziehung ist üblich, dass Spermien Lockstoffe, die Reaktion des menschlichen Spermien Follikelflüssigkeit zeigt ein ähnliches biphasische Beziehung 6, dachte nützlich sein, dass hohe Konzentrationen von Lockstoff in der Nähe ein Ei gefunden wird, kann dazu dienen, weitere Suche Reaktionen vermindern auf den Teil des Spermas.
Gelegentlich finden wir, dass die Steuerwerte für diesen Assay höher als normal sind, wodurch die fache Steigerung durch einen Lockstoff produzierten. Normalerweise kann dieses mechanische Störung der Filtereinsatz während des Tests zurück. Daher ist es wichtig, dass Einsätze nicht gestört werden beim Laden der Spermien oder chemoattractant, während des Tests Inkubation oder wenn der Einsatz entfernt wird. Besonders wichtig ist, dass die Spermien-Reservoir im Einsatz von Mikropipette oder Absaugung vor dem Anheben der Einsatz aus dem Brunnen entfernt. Dies gewährleistet, dass Spermien nicht durch die poröse Membran in die untere Kammer gefegt wie der Einsatz entfernt.
Wichtige technische Parameter in der Zigmond Kammer Assay gehören der Abstand zwischen dem Deckglas und Aussichtsplattform, die Vergrößerung der Video-Beobachtung, die Art der verwendeten Optiken und die Framerate. Abstand zwischen der Aussichtsplattform ist in der Regel 10 bis 15 um, obwohl dieser Abstand durch die Menge an Silikonöl verwendet werden, um Schnittstellen zwischen Deckglas und die Kammer schieben variiert werden können - je mehr Öl, je größer der Abstand. Eine dünne Ebene der Flüssigkeit erhöht sich die Menge von Zeit für einen Gradienten zu bilden sowie die Langlebigkeit des Gradienten einst benötigt. Eine dickere Ebene der Flüssigkeit ermöglicht eine schnellere gRadient Bildung, aber die Steigung hat eine kürzere Lebensdauer und weniger Stabilität. Die Dynamik des Gradienten-Bildung kann durch die Verwendung einer fluoreszierenden Farbstoff oder einem fluoreszierenden Dextran in der Lockstoff gut und mittels Fluoreszenz-Mikroskopie, die Dynamik Blick visualisiert. Der Test Reagenz sollte in Molekulargewichts auf den Lockstoff verwendet wird und die Dynamik bestimmt verwendet werden, um zu beurteilen, wie viele Minuten sollte Gradientenbildung und die Aufnahme von Spermien Bewegungen erlaubt abgestimmt werden.
Die Vergrößerung verwendet werden insgesamt gering (4x oder 10x Objektiv) werden, wenn die gesamte Aussichtsplattform ist visualisiert werden, wie in der Assay-Bedingungen, die wir beschrieben haben. Auf der anderen Seite können höhere Vergrößerung (40x oder 63x Objektiv) nützlich sein, wenn man relativ kurze Flugbahn Segmente oder Wünsche zu überwachen, um Flagellen Bewegungen lösen will. Tracking kann entweder durch semi-manuelle Methoden durchgeführt, wie in diesem Papier als auch im automatisierten Tracking beschrieben als in mehr sop praktizierthisticated Softwarepakete wie MetaMorph oder Imaris Track. In jedem Fall ist eine einfache Nachverfolgung sehr abhängig von den Bildkontrast, ob es vom Betreiber oder durch Software-gestützte Objekterkennung werden. Obwohl Hellfeld Optik in einigen Fällen verwendet werden könnten, der Phasenkontrast-Optik verwenden oder Dunkelfeld-Optik ist allgemein erforderlich. Schließlich hängt die Bildfrequenz auf die zeitliche Auflösung bei der Verfolgung gewünscht. 4 bis 8 Bilder pro Sekunde - - Wenn semi-manuelle Methoden wie in unserem Verfahren verwendet werden, ist man wohl zu relativ niedrigen Frame-Rate begrenzt aufgrund der arbeitsintensiven Natur der Aufzeichnung von Daten. Auf der anderen Seite, kann Video-Rate Beobachtungen für schnelle Reaktionen wie Flagellen Wellenformen erforderlich sein. Häufig sind experimentelle Ziele am besten, indem Sie langsamer Framerate Experimente und schneller Bildrate Experimente getrennt, da will man auch auf andere Parameter wie Vergrößerung, Optik, oder die digitale Bildverarbeitung verändern serviert.
Typische Ergebnisse für die Zigmond Kammer-Tracking-Test besteht aus einer Reihe von Flugbahnen, wie sie für fünfzig Frosch Spermien in den Videoclip von Movie 1 gesehen. Vor ein Bild von der Aussichtsplattform sind die Flugbahnen der einzelnen Spermien in rot für einen Kontroll-Versuch (ohne Lockstoff-Gradienten vorhanden) zurückzuführen. Die zweidimensionale Zelle Trajektorien in der xy-Ebene als Funktion der Zeit für jeden Spermien können aufgezeichnet und protokolliert werden durch MtrackJ der Einfuhr in Microsoft Excel. Für Bahn-Analyse bezeichnen wir die Lockstoff-Gradienten-Achse als X-Achse und der Y-Achse als die orthogonale Achse, im Einklang mit der Konvention ursprünglich von Fabro et al. 3. Wie in dem Diagramm in Abbildung 3 gezeigt wird, die tatsächliche Flugbahn genommen wird von Schritten zusammen, die Summe von deren Länge gleich der krummlinigen Entfernung in die Flugbahn (blau / gold Pfeile) gereist. Die Netto-Abstand und die Orientierung der Reise von jedem Spermium ist ein Vektor, der den ersten und letzten Punkt der Flugbahn (rot diagonalen Pfeil). Dienet Reise in seine X-Achse Komponente und Y-Achse Komponente getrennt werden (rot gestrichelte Pfeile; auch als Net-Delta X und Delta Y net, jeweils).
Da Chemotaxis in Wirbeltieren Spermien relativ subtile Verschiebungen in Fahrtrichtung beinhalten kann, eine große Anzahl von Spermien (100-300), nach dem Zufallsprinzip ausgewählt, sind in der Regel für jede Bedingung erfordert häufig gepoolten Daten von 4 bis 6 unabhängigen Experimenten analysiert. Zum Zwecke der Darstellung, jedoch werden wir Daten von nur fünfzig Frosch Spermien. Tabelle 1 zeigt gebräuchliche Parameter verwendet werden, um Veränderungen in Spermien Reisen zu erkennen. Die mittlere Netto-Reise entlang der X-Achse deutlich erhöhen, wenn in Gegenwart von Lockstoff, folgt die Spermien Bevölkerung als Ganzes Bahnen, die enger mit der Steigung anpassen. In unserem Beispiel erhöhte sich die mittlere Netto-X-Achse über das Dreifache in Gegenwart von Ei Wasser. Man kann auch Plot ein Histogramm der Netto-X-Achse für die Spermien Bevölkerung, die den Vorteil hat, Vorteil, dass kleinere Subpopulationen reagieren Spermien nachgewiesen werden können. Zwei Parameter, die von Fabro et al. 3 entwickelt kann auch helfen, zu erkennen, wie Populationen. Sowohl der Anteil der Spermien zeigen positive Netto-X-Achse (% AX> 0) und der Anteil der Spermien zeigt net lineare Bewegung nicht größer als 45 Grad von der Farbverlaufsachse (% AX / | AY |> 1) drastisch erhöhen kann, wenn das gesamte Sperma Bevölkerung ist sensibel für die Lockstoff oder durch kleinere, aber immer noch erhebliche Mengen, wenn Subpopulationen der Spermien empfindlich sind. Unser Beispiel in Tabelle 1 zeigt, steigt in beiden Parametern für fünfzig Frosch Spermien ausgesetzt, um ein Ei Wasser-Gradienten. Beachten Sie, dass zufällige nicht-orientierten Bewegung Null-Werte für beide Parameter von 50% bzw. 25% geben; Kontrollwerte höher als dieser (wie in Tabelle 1) stellen einen Hintergrund durch entweder eine geringe Anzahl Samples oder zu einem Bias in Spermien Orientierung insbesondere auf die experimentellen Design.
content "> Richtwirkung der Spermien Reisen in Reaktion auf chemoattractant Agenten können direkt von Theta, der Winkel zwischen dem Vektor der Netto-Reisen für jedes Spermium und die Steigung (X)-Achse beurteilt werden. Unser Beispiel in Tabelle 1 zeigt, dass die mittlere theta gesunken für die Spermien schwimmen in einem Ei Wasser-Gradient zeigt, dass Spermien Trajektorien als eine Population besser wurden mit dem Gradienten ausgerichtet. Ähnlich wie bei net X-Achse (siehe oben), kann thetas für die Spermien Bevölkerung als eine Verteilung ausgedrückt werden, ein Ansatz, auch sensible auf Subpopulationen von ansprechenden Spermien und eine, die kürzlich von Gakamsky et al 7 wurde untersucht.Schließlich können krummlinige und Momentangeschwindigkeiten für einzelne Spermien auch aus den Daten die Beschreibung zweidimensionaler Zelle Trajektorien in der xy-Ebene als Funktion der Zeit gewonnen werden. Man könnte feststellen, dass es eine Erhöhung der Geschwindigkeit als auch eine Verschiebung in der Orientierung der Reise, was auf eine chemokinetische Reaktion sowieeine chemotaktische Antwort.
Diese Daten stellen einen Ausgangspunkt für die Analyse von Spermien Bahnen. Weitere Analysen könnten Messungen der Flugbahn Linearität und Krümmung auf einer von Augenblick zu Augenblick Basis, wie sie von Böhmer et al gehören. 8 und Shiba et al. 9, die automatisierte Erfassung der Umdrehungen, wie sie von Burnett et al. 10, und Nichtlinearität als gemessen durch fraktale Analyse 11,12. Vorausgesetzt, dass Spermien schwimmen diese Bahnen bei höherer Vergrößerung werden überwacht, man könnte auch image Flagellen Bewegungen und Echtzeit-Kalzium-Signale von verschiedenen Laboratorien 8,9,13,14,15,16 durchgeführt. Solche Studien haben gezeigt, dass sowohl Wirbellosen und Säugetieren Spermien Lockstoffe reagieren, indem sie scharfe Kurven der Spermien bis Gefälle in Richtung der Lockstoff-Quelle. Diese Kurven sind durch Flagellen Kurven, dass Spermien Orientierung verändern viel wie ein Ruder begleitet würden, Bögen, die durch definiert, Wellen li initiiert erscheinenke Kalzium-Signale der Ausbreitung durch die Geißel. So ist das ultimative Ziel der Spermien-Tracking zu korrelieren Signalsystem Dynamik mit den Veränderungen in Flagellen Antrieb, die als Grundlage der Spermien Orientierung dienen in einem chemotaktischen Gradienten. Diese Ziele sind noch nicht in Xenopus Spermien, die in einer spiralförmigen Bewegung 17 Reisen erreicht werden, weisen eine geringe Krümmung in ihren Bahnen 10, und deren Calcium-Signale sind noch nicht überwacht werden.
Obwohl wir hier auf Details der Testverfahren, die wir für Xenopus laevis Sperma, sowohl die Zwei-Kammer-Spermien Anhäufung Assay und der Zigmond Kammer Tracking-Assay kann für Säugetier-Spermien verwendet werden, wenn bestimmte Änderungen vorgenommen werden konzentriert. Beide Tests können bei 37 ° C, falls gewünscht, durch die Verwendung einer Folie wärmer und im Zigmond Kammer-Assay, einem Mikroskoptisch wärmer. Typischerweise wird Säugetier-Spermien isoliert, capacitated und inkubiert mit geeigneten Säugetier-Puffer eind Lockstoffe, aber Datenanalyse wird ähnlich sein, was hier für Amphibien-Arten beschrieben. Ein weiterer Unterschied ist, dass die Zigmond Kammer ist in der Regel aufrecht auf der Bühne eines aufrechten Mikroskop gelegt, da Säugetieren Spermien, im Gegensatz zu Xenopus Spermien schwimmen kann bis auf die Aussichtsplattform. Als noch nicht erprobt, können diese beiden Assays Anwendung auf Spermien aus einer Anzahl von Arten in die zukünftige Arbeit zu sehen.

Abbildung 1. Schematische Darstellung des Zwei-Kammer-Assay. Spermien sind in einem Einsatz, dessen Boden ein Polycarbonat-Filter mit 12 um Poren befindet. Ein Lockstoff Lösung wird vorsichtig in die Vertiefung pipettiert, um die Bildung eines Konzentrationsgradienten zu initiieren.
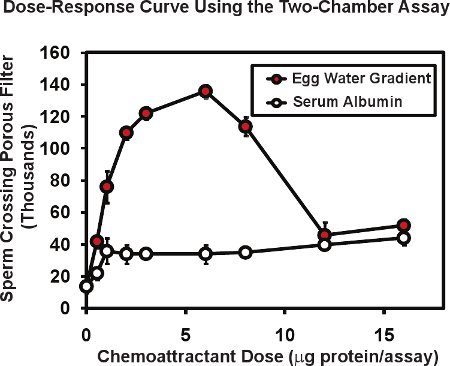
Abbildung 2. Repräsentative Daten für Frosch Spermien mit dem Zwei-Kammer-Spermien chemotaxis Test. Egg Wasser aus X. vorbereitet laevis Eiern zeigt eine mehrphasige Dosis-Wirkungs-Kurve, die charakteristisch für Spermien Lockstoffe ist. Rinderserumalbumin erhöht Spermien Durchgang nur leicht - eine unspezifische Wirkung von Protein. Abbildung von Al-Anzi & Chandler 5 geändert.
Movie 1. Ein Videoclip zeigt Frosch Spermien Trajektorien dargestellt in rot auf der Aussichtsplattform eines Zigmond Kammer. Die Breite der Plattform ist 1 mm. Klicken Sie hier, um den Videoclip zu sehen.
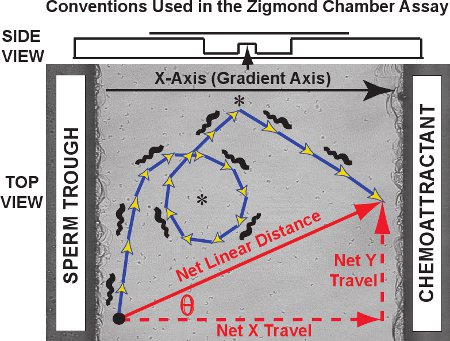
Abbildung 3. Achse Konventionen, ein Spermium krummlinige Bahn und einen Vektor für die Netto lineare Bewegung auf dem Zigmond Kammer Aussichtsplattform aufgetragen. Erhaltenen Daten sind von drei Arten. Erstens können die Spermien Trajektorien selbst (blau / gold Pfeile) zeigen bestimmte Muster such als Kreise und Wendungen (Sternchen). Curvilinear Distanz und krummlinigen Geschwindigkeiten können für die Flugbahn gemessen werden. Zweitens, die net Luftlinie über die gesamte Flugbahn, die Netto-X (Gradient) Achsen-Reise reiste, kann das net Y-Achse Bestandteil der Reise und der Winkel Theta zwischen der X-Achse und dem Vektor der Netto-Reise für jede Trajektorie berechnet werden und als eine Verteilung über alle Spermien verfolgt verglichen. Drittens sofortige Änderungen der Geschwindigkeit und Fahrtrichtung für die Segmente innerhalb der einzelnen Bahnen können entweder einzeln oder als eine Population untersucht werden. Oben ist eine Seitenansicht von der Kammer in einem Diagramm dargestellt.

Tabelle 1. Parameters häufig bei der Analyse von Daten aus dem Zigmond Kammer verwendet.
Diskussion
Chemotaxis von Zellen bewegen entweder durch amöboide Bewegung oder Flagellen-powered Schwimmen ist in vielen biologischen Zusammenhängen gefunden und Erforschung dieses Phänomens erfordert die Verfügbarkeit von praktischen und zuverlässigen Tests. Einige Beispiele für das Phänomen, wie Anziehung von Spermien einer Seeigel-Ei oder das Sammeln von Schleimpilz-Zellen zu einem Fruchtkörper zu bilden, haben unmittelbare visuelle Wirkung. Die Quantifizierung dieses Phänomens ist in eine Vielzahl von Möglichkeiten, ...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken der WM Keck Bioimaging Laboratory für die Nutzung ihrer Video-Mikroskopie Arbeitsplatz. Diese Studie wurde von der NSF gewähren IBN-0615435 gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Item | Firma | Katalog-Nummer | Kommentare |
| 24-Well-Platten | Becton-Dickinson | 35/1147 | |
| 12 mm Außendurchmesser Einsätze mit 12 mu m-Membran | Millipore | PIXP01250 | Wir bisher verwendeten Costar-Corning Transwell plate # 3403-jetzt eingestellt |
| Zigmond Kammer | Neuroprobe | Z02 | |
| Silikonöl | General Electric | SF1154 | Entspricht Dow Corning 550 Fluid- |
| Image J-Software | Wayne Rasband, Research Services Branch, National Institute of Mental Health | Kostenloser Download unter http://rsbweb.nih.gov/ij | Java-Programm, das auf Windows, Lin läuftux und Mac |
| MtrackJ Software | Erik Meijering / ImageScience / Biomedical Imaging Group , Erasmus MC - University Medical Center Rotterdam | Kostenloser Download unter http://www.imagescience.org/meijering/software/mtrackj/ | Java-Programm, das auf Windows, Linux und Mac läuft |
| Virtual Dub Software | GNU General Public Licensed Software | Kostenloser Download via http://www.virtualdub.org/index.html | Setup-Anweisungen auf dem Image J Website unter plugins, nur für Windows |
| CEllSens Software | Olymp | Siehe Website: http://www.olympusamerica.com/seg_section/product.asp? Produkt = 1070 | Bedienelemente und nimmt Bilder aus einer Vielzahl von Kameras. Auch hat Bildverarbeitungsfunktionen |
Referenzen
- Ward, G. E., Brokaw, C. J., Garbers, D. L., Vacquier, V. D. Chemotaxis of Arbacia punctulata spermatozoa to resact, a peptide from the egg jelly layer. J. Cell Biol. 101, 2324-2329 (1985).
- Olivera, R. G., Tomasi, L., Rovasio, R. A., Giojalas, L. C. Increased velocity and induction of chemotactic response in mouse spermatozoa by follicular and oviductal fluids. J. Reprod. Fertil. 115, 23-27 (1999).
- Fabro, G., Rovasio, R. A., Civalero, S., Frenkel, A., Caplan, S. R., Eisenbach, M., Giojalas, L. C. Chemotaxis of capacitated rabbit spermatozoa to follicular fluid revealed by a novel directionality-based assay. Biol. Reprod. 67, 1565-1571 (2002).
- Sugiyama, H., Burnett, L., Xiang, X., Olson, J., Willis, S., Miao, A., Akema, T., Bieber, A. L., Chandler, D. E. Purification and multimer formation of allurin, a sperm chemoattractant from Xenopus laevis egg jelly. Mol. Reprod. Dev. 76, 527-536 (2009).
- Al-Anzi, B., Chandler, D. Xenopus laevis egg jelly releases a sperm chemoattractant during spawning. Dev. Biol. 198, 366-375 (1998).
- Ralt, D., Goldenberg, M., Fetterolf, P., Thompson, D., Dor, J., Mashiach, S., Garbers, D. L., Eisenbach, M. Sperm attraction to a follicular factor(s) correlates with human egg fertilizability. Proc. Natl. Acad. Sci. U.S.A. 88, 2840-2844 (1991).
- Gakamsky, A., Schechtman, E., Caplan, S. R., Eisenbach, M. Analysis of chemotaxis when the fraction of responsive cells is small--application to mammalian sperm guidance. Int. J. Dev. Biol. 52, 481-487 (2008).
- Böhmer, M., Van, Q., Weyand, I., Hagen, V., Beyermann, M., Matsumoto, M., Hoshi, M., Hildebrand, E., Kaupp, U. B. Ca2+ spikes in the flagellum control chemotactic behavior of sperm. EMBO J. 24, 2741-2752 (2005).
- Shiba, K., Baba, S. A., Inoue, T., Yoshida, M. Ca2+ bursts occur around a local minimal concentration of attractant and trigger sperm chemotactic response. Proc. Natl. Acad. Sci. U.S.A. 105, 19312-19317 (2008).
- Burnett, L. A., Sugiyama, H., Bieber, A. L., Chandler, D. E. Egg jelly proteins stimulate directed motility in Xenopus laevis sperm. Mol. Reprod. Dev. 78, 450-462 (2011).
- Abaigar, T., Barbero, J., Holt, W. V. Trajectory variance and autocorrelations within single sperm tracks as population level descriptors of sperm track complexity, predictability and energy generating ability. J. Androl. , (2011).
- Mortimer, S. T., Swan, M. A., Mortimer, D. Fractal analysis of capacitating human spermatozoa. Hum. Reprod. 11, 1049-1054 (1996).
- Guerrero, A., Carneiro, J., Pimentel, A., Wood, C. D., Corkidi, G., Darszon, A. Strategies for locating the female gamete: the importance of measuring sperm trajectories in three spatial dimensions. Mol. Hum. Reprod. 17, 511-523 (2011).
- Yoshida, M., Yoshida, K. Sperm chemotaxis and regulation of flagellar movement by Ca2+. Mol. Hum. Reprod. 17, 457-465 (2011).
- Spehr, M., Schwane, K., Riffell, J. A., Zimmer, R. K., Hatt, H. Odorant receptors and olfactory-like signaling mechanisms in mammalian sperm.Mol. Cell. Endocrinol. 250, 128-136 (2006).
- Veitinger, T., Riffell, J. R., Veitinger, S., Nascimento, J. M., Triller, A., Chandsawangbhuwana, C., Schwane, K., Geerts, A., Wunder, F., Berns, M. W., Neuhaus, E. M., Zimmer, R. K., Spehr, M., Hatt, H. Chemosensory Ca2+ dynamics correlate with diverse behavioral phenotypes in human sperm. J. Biol. Chem. 286, 17311-17325 (2011).
- Tholl, N., Naqvi, S., McLaughlin, E., Boyles, S., Bieber, A. L., Chandler, D. E. Swimming of Xenopus laevis sperm exhibits multiple gears and its duration is extended by egg jelly constituents. Biol. Bull. 220, 174-185 (2011).
- Eisenbach, M. Sperm chemotaxis. Rev. Reprod. 4, 56-66 (1999).
- Riffell, J. A., Zimmer, R. K. Sex and flow: the consequences of fluid shear for sperm-egg interactions. J. Exp. Biol. 210, 3644-3660 (2007).
- Corkidi, G., Taboada, B., Wood, C. D., Guerrero, A., Darszon, A. Tracking sperm in three-dimensions. Biochem. Biophys. Res. Commun. 373, 125-129 (2008).
- Himes, J. E., Riffell, J. A., Zimmer, C. A., Zimmer, R. K. Sperm chemotaxis as revealed with live and synthetic eggs. Biol Bull. 220, 1-5 (2011).
- Sun, F., Giojolas, L. C., Rovasio, R. A., Tur-Kaspa, I., Sanchez, R., Eisenbach, M. Lack of species-specificity in mammalian sperm chemotaxis. Dev. Biol. 255, 423-427 (2003).
- Guidobaldi, H. A., Teves, M. E., Uñates, D. R., Anastasía, A., Giojalas, L. C. Progesterone from the cumulus cells is the sperm chemoattractant secreted by the rabbit oocyte cumulus complex. PLoS One. 3, e3040-e3040 (2008).
- Oren-Benaroya, R., Orvieto, R., Gakamsky, A., Pinchasov, M., Eisenbach, M. The sperm chemoattractant secreted from human cumulus cells is progesterone. Hum. Reprod. 23, 2339-2345 (2008).
- Teves, M. E., Guidobaldi, H. A., Uñates, D. R., Sanchez, R., Miska, W., Publicover, S. J., Morales Garcia, A. A., Giojalas, L. C. Molecular mechanism for human sperm chemotaxis mediated by progesterone. PLoS One. 4, 8211-82 (2009).
- Blengini, C. S., Teves, M. E., Uñates, D. R., Guidobaldi, H. A., Gatica, L. V., Giojalas, L. C. Human sperm pattern of movement during chemotactic re-orientation towards a progesterone source. Asian J. Androl. 13, 769-773 (2011).
- Strünker, T., Goodwin, N., Brenker, C., Kashikar, N. D., Weyand, I., Seifert, R., Kaupp, U. B. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. J. Exp. Med. 115, 453-465 (1962).
- Zigmond, S. H., Lauffenburger, D. A. Assays of leukocyte chemotaxis. Annu. Rev. Med. 37, 149-155 (1986).
- Villanueva-Diaz, C., Vadillo-Ortega, F., Kably-Ambe, A., Diaz-Pérez, M. A., Krivitzky, S. K. Evidence that human follicular fluid contains a chemoattractant for spermatozoa. Fertil. Steril. 54, 1180-1182 (1990).
- Villanueva-Diaz, C., Arizs-Martinez, J., Bermejo-Martinez, L., Vadillo-Ortega, F. Progesterone induces human sperm chemotaxis. Fertil. Steril. 64, 1183-1188 (1995).
- Olson, J., Xiang, X., Ziegert, T., Kittleson, A., Rawls, A., Bieber, A., Chandler, D. E. A. l. l. u. r. i. n. a 21 kD sperm chemoattractant from Xenopus egg jelly, is homologous to mammalian sperm-binding proteins. Proc. Natl. Acad. Sci. U.S.A. 98, 11205-11210 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten