Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Два типа Анализы для обнаружения Chemoattraction спермы лягушки
В этой статье
Резюме
Яйца и внеклеточной покрытия вокруг яйца часто релизе пептидов, белков и малых молекул, которые взаимодействуют со спермой, чтобы вести их к яйцеклетке тем самым способствуя оплодотворению. Использование спермы лягушки мы описать и сравнить два класса тесты используются для обнаружения спермы chemoattraction - сперма накопления анализы и анализы спермы слежения.
Аннотация
Sperm chemoattraction in invertebrates can be sufficiently robust that one can place a pipette containing the attractive peptide into a sperm suspension and microscopically visualize sperm accumulation around the pipette1. Sperm chemoattraction in vertebrates such as frogs, rodents and humans is more difficult to detect and requires quantitative assays. Such assays are of two major types - assays that quantitate sperm movement to a source of chemoattractant, so-called sperm accumulation assays, and assays that actually track the swimming trajectories of individual sperm.
Sperm accumulation assays are relatively rapid allowing tens or hundreds of assays to be done in a single day, thereby allowing dose response curves and time courses to be carried out relatively rapidly. These types of assays have been used extensively to characterize many well established chemoattraction systems - for example, neutrophil chemotaxis to bacterial peptides and sperm chemotaxis to follicular fluid. Sperm tracking assays can be more labor intensive but offer additional data on how chemoattractancts actually alter the swimming paths that sperm take. This type of assay is needed to demonstrate the orientation of sperm movement relative to the chemoattrractant gradient axis and to visualize characteristic turns or changes in orientation that bring the sperm closer to the egg.
Here we describe methods used for each of these two types of assays. The sperm accumulation assay utilized is called a "two-chamber" assay. Amphibian sperm are placed in a tissue culture plate insert with a polycarbonate filter floor having 12 μm diameter pores. Inserts with sperm are placed into tissue culture plate wells containing buffer and a chemoatttractant carefully pipetted into the bottom well where the floor meets the wall (see Fig. 1). After incubation, the top insert containing the sperm reservoir is carefully removed, and sperm in the bottom chamber that have passed through the membrane are removed, pelleted and then counted by hemocytometer or flow cytometer.
The sperm tracking assay utilizes a Zigmond chamber originally developed for observing neutrophil chemotaxis and modified for observation of sperm by Giojalas and coworkers2,3. The chamber consists of a thick glass slide into which two vertical troughs have been machined. These are separated by a 1 mm wide observation platform. After application of a cover glass, sperm are loaded into one trough, the chemoattractant agent into the other and movement of individual sperm visualized by video microscopy. Video footage is then analyzed using software to identify two-dimensional cell movements in the x-y plane as a function of time (xyt data sets) that form the trajectory of each sperm.
протокол
1. Материалы и буферов, используемых
- Буфер ооцитов Рингера (1,5 х а2) содержит 124 мМ NaCl, 3,75 мМ KCl, 1,5 мМ CaCl 2, 1,5 мМ MgCl 2, 1,5 мМ Na 2 HPO 4, 10 мМ HEPES, рН 7,8. Оплодотворение Buffer (F-1) содержит 41,25 мМ NaCl, 1,25 мМ KCl, 0,25 мМ CaCl 2, 0,06 мМ MgCl 2, 0,5 мМ Na 2 HPO 4, 2,5 мМ HEPES, рН 7,8.
- Xenopus laevis яйцо вода готовится по Сугияма и соавт. 4. Кратко описаны, только что породил заливной яйца лягушки кружились в небольшом объеме F-1 буфера в течение 30 минут и кондиционированной среды удалены микропипетки. Эта среда, называемая "яйцо вода", также могут быть использованы для подготовки очищенной allurin, первичной хемоаттрактант в этом экстракте желе. Сперма получаются из коммерчески разводили Xenopus laevis Xenopus tropicalis или.
- См. Таблица материалов для конкретных предметов, необходимых в тОн анализа.
2. Двухкамерный тест для хемотаксиса лягушки спермы
- Обезболить лягушки путем погружения в воду, содержащую 0,07% бензокаин, обезглавить с помощью пары карборунд краями ножницами, и дважды сердцевины для обеспечения эвтаназии. Срежьте кожу с живота на подвергать мышцы. Сделать средней линии и боковые разрезы в брюшной мышцы и убрать. Мягко убрать кишечника и жир выявить белый, бобовидные яичек. Trim от соединительной ткани с помощью тонкой ножницы будьте осторожны, чтобы избежать кровеносных сосудов. Удалить яичка, смыть любой крови с использованием 1,5 х or2 буфер, затем рулон яичка на фильтровальную бумагу, чтобы удалить излишки буфера и малых приверженцем кровеносных сосудов, а затем поместить яичко в пластиковом блюде Питр в 0,2 мл 1,5 х or2 буфера. Заполните 5 мл шприц с 2 мл 1,5 х or2 буфера, аккуратно тыкать 10-20 отверстий в яичке на большей части поверхности на одном конце, вставить иглу на противоположном конце и осторожно вводят буфера, чтобы избавиться от спермы. Кроме того, однаможет внедрить буфера в то время как тыкать выхода отверстия, чтобы избавиться от спермы. Передача спермы подвески использовании микропипетки с отсечения кончика (избегая стрижка спермы) для микроцентрифужных трубки и место на льду.
- Оцените число лягушки спермы получены путем разбавления спермы 1:100 в 1,5 х ОР-2 и с 20 мкл образца смешанную суспензию спермы и подсчет числа клеток с использованием гемоцитометра и больших 1 мм 2 площади. Использование считать гемоцитометра и коэффициент выборки вычислить плотность спермы и общее количество сперматозоидов собраны. Эта сумма, как правило, 2 - 6 х 10 7 сперматозоидов в объеме около 2 мл, когда оба яичка используются. Развести подвески фондовом сперматозоидов с 1,5 х or2 буфера для получения спермы плотностью 2 х 10 7 / мл. Использование спермы для анализа в пределах от 2 до 3 часов после его приготовления. Оценка подвижности сперматозоидов путем разбавления 5 мкл сперма 1:10 с F-1 буфер и визуализации перемещение с помощью оптики фазового контраста. По меньшей мере 40% до 50% сперматозоидовдолжны быть подвижны. Даже соответствующих средств будет содержать большое количество неподвижные сперматозоиды большинство из которых являются незрелыми.
- Подготовьте новый 24-луночных пластиковых пластин культуре ткани micropipetting 700 мкл F1 буфера в каждую лунку. Каждая скважина должна быть около 15 мм в диаметре у основания.
- Начало серии анализов путем разбавления 100 мкл сперма подвеска с 900 мкл F1 Храните при комнатной температуре (примерно 21 до 23 ° С) в микроцентрифужных трубку, чтобы активировать подвижность сперматозоидов осмотическим шоком. Каждый раз, когда свежая сперма активируется в этой манере, сперма должна быть использована в течение 1-2 минут.
- Место 12 мкм пористости вставки (12 мм OD) в буфер, заполненный хорошо, убедитесь, что вставить размещения смещен относительно центра кадра, оставляя пространство для одной стороны. Сразу передачи 400 мкл подвижность сперматозоидов в активированный хорошо микропипетки с отсечения кончика. Применить спермы подвески на стену фильтрующий элемент и позволить ему бежать вниз на фильтр в нижней части-йэлектронной вставки; спермы подвески не должно быть пипеткой прямо на фильтре.
- Тщательно микропипетки 50 мкл хемоаттрактант агента в скважину в пространстве между хорошо и не по центру фильтр вставки. Надо быть осторожным, чтобы месторождение, где падение стороны и снизу также встретиться и снять пипетки, не нарушения в системе. В частности, на поршень микропипетки следует подталкивать только первая остановка, чтобы полностью извлечь образец, но нет пузырьков воздуха.
- Повторите шаги 2.5 и 2.6, чтобы начать как многие анализы по мере необходимости, то инкубировать табличке до проведения первого анализа начали имеет инкубировали 50 минут. Как правило, можно начать анализ каждые 45 до 60 секунд. Обратите внимание, что анализ может быть упорядочены по опытный человек или два человека работают вместе. В этом случае, один или два ряда анализов может быть начато с большим запасом подвижных сперматозоидов и быстрее пипетирования при условии, что сперматозоиды всегда используются в пределах от 1 до 2 минутактивации.
- Стоп каждого анализа в последовательности началось. Во-первых, тщательно устойчивый фильтрующий элемент с одной стороны, и с другой осторожно удалить большую часть или всю сперму суспензии в верхней палате по микропипетки или всасывания с пастер пипетки. Сразу же, с помощью тонкой пинцет, вытащите фильтрующий элемент и выбросьте. Уход должен быть использован на этом этапе, как минимум оставшихся сперматозоидов быть прокатилась через фильтр artifactually повышение значения для спермы проход.
- Из каждой пластины хорошо, передача всей подвески спермы микроцентрифужных трубки. Важно, чтобы смесь спермы суспензии в задолго до снятия с спермы, как правило, оседают на дно. Добавить 15 мкл 25% формальдегид в конечной концентрации 0,5% об. / и поставить в холодильник, если сперматозоидов не делается в один день.
- Гранул спермы в каждой пробирке с использованием 10 второй спин кнопки на личном микроцентрифужных с максимальной скоростью 2000 х g. Удалите все, кроме 100 мкл supernatМуравей из каждой пробирки, а затем ресуспендируют гранул в этом объеме. Возьмите 20 мл спермы подвески, развести 1:10 с дистиллированной водой, а количество сперматозоидов на гемоцитометра использовании 40x цели по прямой микроскоп. Использование графов и разведения факторов для расчета общего количества сперматозоидов, которые прошли через фильтр в каждом анализе.
3. Лягушка спермы отслеживания методом с использованием камеры Зигмунда
- Подготовьте рабочее место перевернутый микроскоп для видеозаписи. Мы используем Nikon Elipse TE300 инвертированного микроскопа оснащены либо Sony DXC-390 3-чип цвета аналог видеокамеры или Hamamatsu ORCA-03G монохромный цифровой камеры. Слайд Зигмунд камера должна опираться на этапе до стороне вниз с достаточной открытия в стадии пластины для размещения 22x40 мм стеклянной крышкой. Эта мера продиктована тем, что лягушки спермы не могут плыть против силы тяжести. Фокус либо 4x или 10x объектив на смотровой площадке работает между двумяжелобов.
- Тест, чтобы убедиться, что камера фокусируется по центру на смотровой площадке. Если камера Sony используется, вывод направляется в видеомонитор и A / D конвертер (видеозахвата), способные оцифровки 7 кадров в секунду от видеосигнала. Цифровой поток обрабатывается с помощью компьютера на частоте 3 ГГц или более предпочтительно с 4 Гб или более оперативной памяти. Хотя мы используем Scion Image программное обеспечение (специальная версия Windows, из NIH Image) контроль Scion CG-7 видеозахвата, эти продукты больше не доступны. Текущее решение состоит в использовании программного обеспечения изображения J с VirtualDub плагина для аналогового захвата видео камер. Если камера Хамамацу, то на его цифровой выход обрабатывается программным обеспечением Olympus cellSens и отображаются на мониторе компьютера. В обоих случаях данные сохраняются на любой внутренний или внешний жесткий диск, как 8-битный стек TIFF. Использование программного обеспечения изображения Scion требует преобразования последовательности изображений Tiff в стек с помощью изображения J. микроскопическое поле должно включать все или почти все ширина платформы наблюдения. Использование фазового контраста или темно оптики поле для достижения наилучших результатов. Расстояние между поверхностью смотровой площадки и нижнюю часть крышки стекла должна составлять от 15 до 20 мкм, как определено дифференциальное упором на каждой поверхности.
- Подготовка хемоаттрактант при соответствующей концентрации в Формуле-1 буфере. Подготовка Xenopus laevis спермы, как описано выше и хранить в 1,5 х or2 буфера на льду до использования.
- Сборка камеры Зигмунд. Начнем с сухой чистой камере. Использование микропипетки месте линия силиконового масла (4 мкл) около 5 мм от и параллельно внешнему краю каждого желоба. Место 22x40 стеклянная крышка мм на камере позволяет силиконовое масло, чтобы равномерно распределить на внешнем крае каждого желоба. Если предварительные эксперименты показали, что сперма сцепления проблема, возможно, потребуется, чтобы покрыть защитным стеклом с нитроцеллюлозы как это было предложено Фабро и соавт. 3. Alternнительно, включение белка в буферы используются (например, 1% BSA) может также уменьшить спермы прилипания.
- Обратить камеру и поместить на круговой вырез в столик микроскопа быть осторожным, чтобы покровное стекло не вступать в контакт с этапа. Это перевернутая конфигурации, необходимые для доставки Xenopus спермы от корыта на платформу. В отличие от млекопитающих, сперма, сперма Xenopus не достаточно сильны, чтобы плыть против силы тяжести достичь платформы.
- Активировать 20 мкл Xenopus спермы в 1,5 х or2 буфера путем смешивания с 1:10 F1 буфера при комнатной температуре. Использование микропипетки с разрезом наконечник, немедленно передать 70 мкл моторики активированных сперматозоидов в корыто. Это достигается путем проведения микропипетки под небольшим углом и размещения чаевые в боковое отверстие кормушки. Суспензии клеток выбрасывается заполняет впадину и моста под действием капиллярных сил. Затем заполнить противоположный корыта в той же манере, используя chemoatttractant решение.
- Начало видеозаписи в течение 3 минут (Xenopus спермы имеют ограниченный срок службы, подвижность) и продолжаться в течение 5 минут. В конце видеозаписи, разбирать и мыть камеру желоба и смотровая площадка с давлением струю воды, а затем этанола из шприца бутылку. Удалить силиконовое масло из верхней поверхности с бумажными салфетками тем, чтобы не загрязнять смотровую площадку и впадины.
- При необходимости, конвертировать видео данных, полученных в последовательность изображений Tiff или стек с помощью программного обеспечения изображения J. Затем откройте файл изображения J и в первые 21 кадров (3 секунды) выбрать до 50 спермы, которые необходимо отслеживать. Чтобы избежать предвзятости, решили спермы из всех регионов полевых наблюдений и без знания их данные траектории. Захват двумерной траектории ячейки в плоскости XY, как функцию времени (xyt наборов данных) для каждого сперматозоида точкой и щелчком мыши, используя плагин MtrackJ модуль для изображения Дж. траектории Визуализируйте и рассчитать траекториюрасстояния, оси компонентов и скоростями в пределах MtrackJ. Кроме того, проведение этих операций и дальнейшего численного анализа (например, направленность, хемотаксис параметров и параметров гистограмм), импортируя xyt наборов данных в Microsoft Excel.
- Участок траектории для каждого сперматозоида в Excel для выявления общих закономерностей движения в том числе линейных, криволинейных, и круговые шаблоны, а также такие функции, как очереди. Использование xyt наборы данных для расчета средней скорости криволинейного, чистая путешествие по X (градиент) - и Y-оси и ориентацию таких параметров, как средний угол путешествия по отношению к оси градиента.
4. Представитель Результаты:
Важные технические параметры в две камеры анализа являются размер и форма камеры, пористость мембраны, а длина инкубации. Размер верхней палаты проведения спермы не должно быть настолько большим в диаметре, что потребуется большой объем спермы (предварительноferably 0,5 мл или менее) и не должно быть верхней палаты настолько глубоко, чтобы создать высокую колонку клеточной суспензии (<1 см). Объем буфера нижней палаты окружающих верхнюю вставку камера должна точно соответствовать уровню клеточной суспензии в вставить, чтобы не создавать давление трансмембранного гидростатического которые artifactually силу спермы через мембрану. Размещение пустой вставить в нижнюю также первым, а затем спермы загрузки результатов в начальной гидростатическое давление вверх, что предотвращает спермы происходит через мембрану во время загрузки. Выбор размера пор мембраны определяется размер сперму, а коммерческая доступность пористой вставки мембраны. Мы считаем, что тесты с лягушкой сперма может использовать либо 8 или 12 мкм в диаметре поры, хотя 12 мкм поры обеспечить прохождение большего числа сперматозоидов позволяет более точный подсчет. Поры размерами более 12 мкм, похоже, не быть в продаже. Альтернативой использованию тивставками СГУП культура использования Neuroprobe мембраны предназначены для хемотаксиса анализов в 96-луночных планшетах. Они предлагают потенциально более высокую пропускную способность и более широкий круг диаметром пор. Хотя больших млекопитающих спермы, казалось бы, требуют большего диаметра пор мы успешно анализировали мышь спермой хемотаксис использованием вставок с 12 мкм поры (Burnett, неопубликованные данные). Напротив, меньше размеры пор может быть достаточно для небольших спермы (например, морской еж), хотя мы еще не проверили эту возможность.
Одним из недостатков двухкамерный анализа, описанного в том, что сперматозоиды помещаются в верхней камере таким образом неизбежно приводит к некоторым спермы проход под действием силы тяжести, таким образом уменьшая сигнал фону. Это обусловлено тем, что Xenopus спермы не достаточно бодрым в их подвижность плыть против силы тяжести, как и у млекопитающих спермы. Еще одна трудность в опробования Xenopus спермы является тот факт, что их подвижность лIFE времени мало - от 5 до 15 минут после активации. Это ограничение является основанием для необходимости активировать новую порцию спермы каждые 2 до 3 минут при выполнении нескольких анализов. В результате исследования ход времени показали, что большинство сперматозоидов прохождение происходит в течение первых 20 минут после анализа 5. Хотя мы используем 50-минутный инкубационный период, этот период, вероятно, может быть замкнут на 20 или 30 минут. Напротив, для мыши сперматозоиды, которые остаются подвижными в течение нескольких часов, мы использовали до 2 часов период анализа с хорошими результатами (Burnett, неопубликованные данные).
В двухкамерных методом с использованием лягушка спермы, общее количество сперматозоидов, проходящего через пористую мембрану, как правило, от 10 до 20 тысяч или около 1 до 2% от спермы помещается в верхнюю вставку камеры. Наличие хемоаттрактант градиент в нижней палате может увеличить прохождение спермы столько, сколько от 4 до 10 раз. На рисунке 2 показана типичная кривая ответа дозы производится с этим анализом. Ех!акт Xenopus яйца желе ("яйцо вода"), содержащий известные allurin белка хемоаттрактант (красные кружки), был помещен в нижней камере на серию разведений. Общий белок яйца водой, содержащейся в каждом анализе приведены в мкг / проба - количество поставляется в оригинальной 50 мкл. Поскольку белок доставляется сформирует диффузии градиент, фактический диапазон концентрации белка, что сперма реагировать на не известно, но может быть оценена в 5 до 10 раз ниже, чем концентрация белка капли доставлено. По этой причине, мы обозначим количество белка введен, а не концентрация. Обычно мы выполняем дублировать или трех экземплярах анализы для каждой дозы и средний результат, мы потом повторить весь эксперимент 3 или 4 раза с использованием спермы от разных самцов в каждом эксперименте. Средняя и стандартная ошибка среднего рассчитывается для каждой дозы с стандартная ошибка среднего обычно составляет 5 до 10% от среднего значения. Обратите внимание, что белки без KNOшп хемоаттрактант деятельности, такие как бычий сывороточный альбумин (кружки, рис. 2) может привести к низком уровне, неспецифические увеличение спермы прохождения через мембрану. Интересное наблюдение, что кривая доза-эффект для яйце вода мультифазные - восходящая фаза и снижение фазы. Этот тип отношений мультифазные является общей для спермы хемоаттрактантов; реакция человеческой спермы в фолликулярной жидкости показывает подобный двухфазный 6 отношений, которые, как полагают быть полезны тем, что высокие концентрации хемоаттрактант найдены в непосредственной близости от яйца могут служить для уменьшения дальнейшего поиска ответов на часть спермы.
Иногда мы обнаруживаем, что контрольные значения для этого теста выше, чем обычно, тем самым уменьшая кратное увеличение производства хемоаттрактант. Как правило, это можно проследить на механические разрушения фильтрующего элемента во время теста. Таким образом, важно, чтобы вставки не нарушается при загрузке спермы или чеmoattractant, во время теста инкубации или при вставке будет удален. Особенно важным является то, что сперма водохранилища в вставить удаляется микропипетки или всасывания перед подъемом вставки из колодца. Это гарантирует, что сперма не прокатилась через пористую мембрану в нижней камере, как вставить удаляется.
Важные технические параметры в камере анализа Зигмунд включают расстояние между платформой покровного стекла и наблюдения, увеличение видеонаблюдения, тип оптики используется, и частоту кадров. Расстояние между смотровой площадки, как правило, от 10 до 15 мкм, хотя это расстояние может быть изменено количество силиконового масла используется для взаимодействия между стеклянной крышкой и камерой слайд - больше нефти, тем больше расстояние. Тонком плане жидкости увеличивается количество времени, необходимое для градиент к форме, а также долговечность градиент один раз формируется. Толще плоскости жидкости позволяет более быстрое гформирование radient но градиент имеет более короткий срок службы и меньше стабильности. Динамика градиент образования могут быть визуализированы с помощью флуоресцентного красителя или люминесцентные декстрана в хемоаттрактант хорошо, и с помощью флуоресцентной микроскопии, чтобы посмотреть в динамике. Тест Реагент должен быть согласован в молекулярной массой до хемоаттрактант используются и динамика определяется использовать, чтобы судить, сколько минут должно быть разрешено для формирования градиента и регистрация спермы движений.
Увеличение использоваться, должны быть низкими в целом (4x или 10x цель), если всей платформы наблюдения, чтобы представить себе как в анализе условий мы описали. С другой стороны, лупы с большим увеличением (40x или 63x цель) может быть полезным, если намеревается следить за относительно короткие сегменты траектории или желает разрешить жгутиковых движений. Отслеживание может осуществляться либо путем полу-ручных методов, как описано в этой статье или автоматического отслеживания как это практикуется в более подачкаhisticated программных пакетов, таких как Метаморф или Imaris Track. В любом случае, простота отслеживания сильно зависит от контрастности изображения, будь то оператором или программно-помощь распознавания объектов. Хотя яркие оптики поле может быть использовано в некоторых случаях, использование оптики фазового контраста или темного поля оптики обычно требуется. Наконец, частота кадров зависит от временного разрешения лучшего в слежения. Если полу-ручные методы используются как в нашей процедуре, один, вероятно, ограничено относительно низкой частотой кадров - от 4 до 8 кадров в секунду - из-за трудоемкого характера записи данных. С другой стороны, наблюдения видео, частоту которые могут потребоваться для принятия оперативных мер, таких как жгутиковые формы волны. Часто, экспериментальные цели лучше всего делать медленнее частота кадров экспериментов и быстрее экспериментов частоту кадров отдельно, поскольку один хотел бы также изменить другие параметры, такие как увеличение, оптика, или цифровой обработки изображений.
Типичные результаты Zigmвторых камеры слежения анализа состоят из множества траекторий, как тем, которые наблюдаются в течение пятидесяти лягушки спермы в видеоклип фильм 1. Против образ смотровую площадку, траекторий отдельных сперматозоидов прослеживаются в красный для контрольного эксперимента (без хемоаттрактант настоящее градиента). Двумерной клетки траекторий в плоскости х, как функция времени для каждого сперматозоида могут быть построены и зарегистрированы MtrackJ и импортированы в Microsoft Excel. Для траектории анализа, обозначить хемоаттрактант оси градиентом, как по оси Х и Y-оси, ортогональной оси, в соответствии с конвенцией, первоначально разработанная Фабро и соавт. 3. Как показано на диаграмме рисунка 3, фактической траектории принято состоит из шагов, сумма, длина которой равна расстоянию криволинейной траектории в (синий / золото стрелки). Чистая расстояние и направление поездки каждый сперматозоид вектор, соединяющий первую и последнюю точку траектории (красной диагональной стрелкой).Чистая путешествия могут быть разделены на своей оси Х компонент и Y-оси компонента (красный пунктирными стрелками; также называется чистой дельта X и чистой дельта Y, соответственно).
Потому что хемотаксис у позвоночных спермы может включать в себя сравнительно тонкие изменения в направлении движения, большое количество спермы (от 100 до 300), случайно выбранных, обычно анализируются для каждого условия часто требуют объединенных данных от 4 до 6 независимых экспериментов. Для иллюстрации, однако, мы будем использовать данные только пятьдесят лягушки спермы. В таблице 1 приведены общие параметры, используемые для обнаружения изменений в сперме путешествия. Средняя чистая путешествие по оси Х значительно возрастет, если в наличии хемоаттрактант, сперма населения в целом следует траектории, более тесно связывая с градиентом. В нашем примере, средняя чистая Х-ось увеличился более чем три раза в присутствии яйцо водой. Можно также участок гистограммы чистых X-ось для спермы населения, которая имеет преиму Tage, что небольшие субпопуляции реагировать сперматозоидов могут быть обнаружены. Два параметра разработан Фабро и соавт. 3 может помочь обнаружить таких групп населения. И процент сперматозоидов показывает положительную чистую X-ось (% Ах> 0) и процент сперматозоидов показывает чистый линейное перемещение не более 45 градусов от оси градиента (% Ах / | ΔY |> 1) может резко возрасти, если Все население спермы чувствителен к хемоаттрактант или меньше, но все еще значительные суммы, если субпопуляций спермы чувствительны. В нашем примере в таблице 1 показано увеличение обоих параметров в течение пятидесяти спермы лягушки подвергается градиент воды яйцо. Обратите внимание, что случайных неориентированных движения даст ненулевые значения для обоих этих параметров на 50% и 25% соответственно; контрольные значения выше этого (например, в таблице 1) представляют собой фон, связанный либо небольшое количество образца или для смещения в сперме ориентации частности, экспериментального проектирования.
Содержание "> Направленность спермы путешествия в ответ на хемоаттрактант агенты могут быть непосредственно оценена тета, угол между вектором чистого путешествия для каждого сперматозоида и градиент (X)-оси. В нашем примере в таблице 1 показано, что означает тета снизились для сперматозоидов плавать в воде яйца градиент о том, что сперма траектории, как население было лучше согласованы с градиентом. Подобно чистая Х-ось (см. выше), thetas для спермы населения может быть выражена как распределение, подход также чувствительны для субпопуляций реагировать спермы и тот, который был недавно изучен Gakamsky и др. 7.Наконец, криволинейные и мгновенной скорости для отдельных спермы также могут быть извлечены из данных, описывающих двумерные траектории ячейки в плоскости х, как функция времени. Можно было бы найти, что есть увеличение скорости, а также сдвиг в ориентации путешествия, тем самым предлагая chemokinetic реагирования, а такжехемотаксиса ответ.
Эти данные представляют собой отправную точку для анализа спермы траекторий. Дальнейший анализ может включать в себя измерение линейной траектории и кривизна на момент за моментом основе, осуществляется Бемер и соавт. Шиба 8 и соавт. 9, автоматического обнаружения оборотов, как осуществляется Burnett и соавт. 10, и нелинейность, как судить по фрактальный анализ 11,12. При условии, что сперма плаванию эти траектории мониторинг на большем увеличении, можно также изображение жгутиковых движения и в режиме реального времени кальция сигналов осуществляется в несколько лабораторий 8,9,13,14,15,16. Такие исследования показали, что оба беспозвоночных и млекопитающих спермы реагировать на хемоаттрактантов на резкие повороты спермы до градиент к хемоаттрактант источник. Эти повороты сопровождаются жгутиковых изгибы, которые изменяют ориентацию спермы, сколько бы руль, изгибы, которые, кажется инициирован определены, волны лике кальция сигналов, распространяющихся через жгутика. Таким образом, конечной целью спермы отслеживание соотнести сигнализации динамики с изменениями в движение жгутиков, которые служат основой спермы ориентации в хемотаксиса градиента. Эти цели еще не достигнуты в Xenopus спермы, которые двигаются в винтовое движение 17, проявляют низкую кривизны их траекторий в 10, и чьи кальция сигналы до сих пор не контролируется.
Хотя мы сосредоточились здесь на подробным анализ методов мы используем для спермы Xenopus laevis, как две камеры спермы анализ накопления и отслеживания Зигмунд камере анализа могут быть использованы для млекопитающих спермы, если некоторые изменения сделаны. И анализы можно проводить при температуре 37 ° C при желании, с использованием слайдов теплее, а в анализе Зигмунд камеры, столик микроскопа теплее. Как правило, сперма млекопитающих будут изолированы, capacitated и инкубировали с использованием соответствующих млекопитающих буферовг хемоаттрактантов, но анализ данных будет похож на то, что описано здесь для земноводных. Еще одно отличие состоит в том камеру Зигмунд, как правило, в вертикальном положении на сцене прямой микроскоп с млекопитающих спермы, в отличие от сперматозоидов Xenopus, могут плавать вверх на смотровую площадку. До сих пор не проверялось, эти два анализы могут видеть приложение спермой число видов в будущей работе.

Рисунок 1. Принципиальная схема двухкамерный анализа. Сперматозоиды помещаются в вставить дно которой поликарбонатный фильтр с порами 12 мкм. Хемоаттрактант решение тщательно пипеткой в колодец, чтобы инициировать образование градиента концентрации.
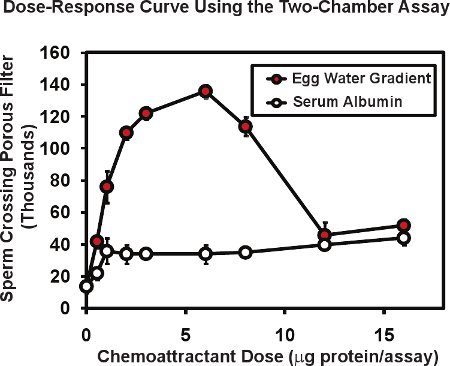
Рисунок 2. Представителю данных для лягушки спермы с помощью двух камер спермы chemotaxiс анализом. Яйцо воду готовят из X. laevis яйца экспонатов многофазных дозы деятельности кривой, характерной для спермы хемоаттрактантов. Бычий сывороточный альбумин спермы увеличивается проход лишь незначительно - неспецифическое действие белка. Рис изменение от Аль-Anzi & Chandler 5.
Фильм 1. Видеоклип показывает траектории лягушки спермы нанесены красным цветом на смотровой площадке камеры Зигмунд. Ширина платформы составляет 1 мм. Нажмите сюда, чтобы посмотреть видеоклип.
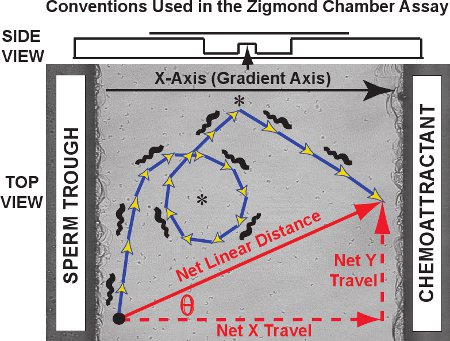
Рисунок 3. Оси конвенций, сперма криволинейной траектории и вектора чистого линейного путешествия будут выводиться на смотровую площадку камеры Зигмунд. Данные, полученные бывают трех типов. Во-первых, сперма траектории себя (синий / золото стрелки) может выявить конкретные модели суч в виде кругов и поворотов (звездочки). Криволинейные расстояние и криволинейных скорости могут быть измерены для траектории пути. Во-вторых, чистый линейное расстояние путешествовал по всей траектории, чистая X (градиент) оси компонентов путешествия, чистая оси Y компонентом путешествия и углом тета между осью X и вектором чистой путешествия могут быть рассчитаны для каждой траектории и по сравнению, как распределение по всем спермы отслеживаться. В-третьих, мгновенное изменение скорости и направления движения для сегментов в рамках отдельных траекторий могут быть изучены по отдельности или в качестве населения. Выше, вид сбоку камеры представлена на диаграмме.

Таблица 1. Параметры часто используемых в анализе данных из камеры Зигмунд.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Хемотаксис клеток движущихся либо амебоидных движения или жгутиков питание плавание содержится во многих биологических условий и изучение этого явления требует наличие практичного и надежного анализа. Некоторые примеры этого явления, такие как привлечение спермы яйца морского ежа ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим Bioimaging Кека лаборатории за использование их видео работы станции микроскопии. Это исследование было поддержано грантом NSF IBN-0615435.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название пункта | Компания | Номер по каталогу | Комментарии |
| 24-луночных планшетах | Бектон-Дикенсон | 35/1147 | |
| 12 мм наружный диаметр вставки с 12 мкм поры мембраны | Millipore | PIXP01250 | Мы использовали Costar-Corning transwell пластины # 3403-настоящее время прекращено |
| Зигмунд камеры | Neuroprobe | Z02 | |
| Силиконовое масло | General Electric | SF1154 | Эквивалент Dow Corning 550 Fluid |
| Изображение J программного обеспечения | Уэйн Rasband, исследовательских служб филиала Национального института психического здоровья | Бесплатно скачать на http://rsbweb.nih.gov/ij | Java-программа, которая работает на Windows, ЛинUX и Mac |
| MtrackJ программного обеспечения | Эрик Meijering / Imagescience / Биомедицинские Imaging Group , Erasmus MC - Университет Медицинского центра Роттердама | Бесплатно скачать на http://www.imagescience.org/meijering/software/mtrackj/ | Java-программа, которая работает на Windows, Linux и Mac |
| Virtual Dub программного обеспечения | GNU General Public Лицензированные программного обеспечения | Бесплатно скачать через http://www.virtualdub.org/index.html | Инструкциям программы установки на веб-сайте изображения J под плагины, а для Windows, только |
| cellSens программного обеспечения | Олимп | Смотрите сайт: http://www.olympusamerica.com/seg_section/product.asp? продукт = 1070 | Органы управления и получает изображения с различных камер. Также имеет возможность обработки изображений |
Ссылки
- Ward, G. E., Brokaw, C. J., Garbers, D. L., Vacquier, V. D. Chemotaxis of Arbacia punctulata spermatozoa to resact, a peptide from the egg jelly layer. J. Cell Biol. 101, 2324-2329 (1985).
- Olivera, R. G., Tomasi, L., Rovasio, R. A., Giojalas, L. C. Increased velocity and induction of chemotactic response in mouse spermatozoa by follicular and oviductal fluids. J. Reprod. Fertil. 115, 23-27 (1999).
- Fabro, G., Rovasio, R. A., Civalero, S., Frenkel, A., Caplan, S. R., Eisenbach, M., Giojalas, L. C. Chemotaxis of capacitated rabbit spermatozoa to follicular fluid revealed by a novel directionality-based assay. Biol. Reprod. 67, 1565-1571 (2002).
- Sugiyama, H., Burnett, L., Xiang, X., Olson, J., Willis, S., Miao, A., Akema, T., Bieber, A. L., Chandler, D. E. Purification and multimer formation of allurin, a sperm chemoattractant from Xenopus laevis egg jelly. Mol. Reprod. Dev. 76, 527-536 (2009).
- Al-Anzi, B., Chandler, D. Xenopus laevis egg jelly releases a sperm chemoattractant during spawning. Dev. Biol. 198, 366-375 (1998).
- Ralt, D., Goldenberg, M., Fetterolf, P., Thompson, D., Dor, J., Mashiach, S., Garbers, D. L., Eisenbach, M. Sperm attraction to a follicular factor(s) correlates with human egg fertilizability. Proc. Natl. Acad. Sci. U.S.A. 88, 2840-2844 (1991).
- Gakamsky, A., Schechtman, E., Caplan, S. R., Eisenbach, M. Analysis of chemotaxis when the fraction of responsive cells is small--application to mammalian sperm guidance. Int. J. Dev. Biol. 52, 481-487 (2008).
- Böhmer, M., Van, Q., Weyand, I., Hagen, V., Beyermann, M., Matsumoto, M., Hoshi, M., Hildebrand, E., Kaupp, U. B. Ca2+ spikes in the flagellum control chemotactic behavior of sperm. EMBO J. 24, 2741-2752 (2005).
- Shiba, K., Baba, S. A., Inoue, T., Yoshida, M. Ca2+ bursts occur around a local minimal concentration of attractant and trigger sperm chemotactic response. Proc. Natl. Acad. Sci. U.S.A. 105, 19312-19317 (2008).
- Burnett, L. A., Sugiyama, H., Bieber, A. L., Chandler, D. E. Egg jelly proteins stimulate directed motility in Xenopus laevis sperm. Mol. Reprod. Dev. 78, 450-462 (2011).
- Abaigar, T., Barbero, J., Holt, W. V. Trajectory variance and autocorrelations within single sperm tracks as population level descriptors of sperm track complexity, predictability and energy generating ability. J. Androl. , Forthcoming (2011).
- Mortimer, S. T., Swan, M. A., Mortimer, D. Fractal analysis of capacitating human spermatozoa. Hum. Reprod. 11, 1049-1054 (1996).
- Guerrero, A., Carneiro, J., Pimentel, A., Wood, C. D., Corkidi, G., Darszon, A. Strategies for locating the female gamete: the importance of measuring sperm trajectories in three spatial dimensions. Mol. Hum. Reprod. 17, 511-523 (2011).
- Yoshida, M., Yoshida, K. Sperm chemotaxis and regulation of flagellar movement by Ca2+. Mol. Hum. Reprod. 17, 457-465 (2011).
- Spehr, M., Schwane, K., Riffell, J. A., Zimmer, R. K., Hatt, H. Odorant receptors and olfactory-like signaling mechanisms in mammalian sperm.Mol. Cell. Endocrinol. 250, 128-136 (2006).
- Veitinger, T., Riffell, J. R., Veitinger, S., Nascimento, J. M., Triller, A., Chandsawangbhuwana, C., Schwane, K., Geerts, A., Wunder, F., Berns, M. W., Neuhaus, E. M., Zimmer, R. K., Spehr, M., Hatt, H. Chemosensory Ca2+ dynamics correlate with diverse behavioral phenotypes in human sperm. J. Biol. Chem. 286, 17311-17325 (2011).
- Tholl, N., Naqvi, S., McLaughlin, E., Boyles, S., Bieber, A. L., Chandler, D. E. Swimming of Xenopus laevis sperm exhibits multiple gears and its duration is extended by egg jelly constituents. Biol. Bull. 220, 174-185 (2011).
- Eisenbach, M. Sperm chemotaxis. Rev. Reprod. 4, 56-66 (1999).
- Riffell, J. A., Zimmer, R. K. Sex and flow: the consequences of fluid shear for sperm-egg interactions. J. Exp. Biol. 210, 3644-3660 (2007).
- Corkidi, G., Taboada, B., Wood, C. D., Guerrero, A., Darszon, A. Tracking sperm in three-dimensions. Biochem. Biophys. Res. Commun. 373, 125-129 (2008).
- Himes, J. E., Riffell, J. A., Zimmer, C. A., Zimmer, R. K. Sperm chemotaxis as revealed with live and synthetic eggs. Biol Bull. 220, 1-5 (2011).
- Sun, F., Giojolas, L. C., Rovasio, R. A., Tur-Kaspa, I., Sanchez, R., Eisenbach, M. Lack of species-specificity in mammalian sperm chemotaxis. Dev. Biol. 255, 423-427 (2003).
- Guidobaldi, H. A., Teves, M. E., Uñates, D. R., Anastasía, A., Giojalas, L. C. Progesterone from the cumulus cells is the sperm chemoattractant secreted by the rabbit oocyte cumulus complex. PLoS One. 3, e3040-e3040 (2008).
- Oren-Benaroya, R., Orvieto, R., Gakamsky, A., Pinchasov, M., Eisenbach, M. The sperm chemoattractant secreted from human cumulus cells is progesterone. Hum. Reprod. 23, 2339-2345 (2008).
- Teves, M. E., Guidobaldi, H. A., Uñates, D. R., Sanchez, R., Miska, W., Publicover, S. J., Morales Garcia, A. A., Giojalas, L. C. Molecular mechanism for human sperm chemotaxis mediated by progesterone. PLoS One. 4, 8211-82 (2009).
- Blengini, C. S., Teves, M. E., Uñates, D. R., Guidobaldi, H. A., Gatica, L. V., Giojalas, L. C. Human sperm pattern of movement during chemotactic re-orientation towards a progesterone source. Asian J. Androl. 13, 769-773 (2011).
- Strünker, T., Goodwin, N., Brenker, C., Kashikar, N. D., Weyand, I., Seifert, R., Kaupp, U. B. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. J. Exp. Med. 115, 453-465 (1962).
- Zigmond, S. H., Lauffenburger, D. A. Assays of leukocyte chemotaxis. Annu. Rev. Med. 37, 149-155 (1986).
- Villanueva-Diaz, C., Vadillo-Ortega, F., Kably-Ambe, A., Diaz-Pérez, M. A., Krivitzky, S. K. Evidence that human follicular fluid contains a chemoattractant for spermatozoa. Fertil. Steril. 54, 1180-1182 (1990).
- Villanueva-Diaz, C., Arizs-Martinez, J., Bermejo-Martinez, L., Vadillo-Ortega, F. Progesterone induces human sperm chemotaxis. Fertil. Steril. 64, 1183-1188 (1995).
- Olson, J., Xiang, X., Ziegert, T., Kittleson, A., Rawls, A., Bieber, A., Chandler, D. E. A. llurin a 21 kD sperm chemoattractant from Xenopus egg jelly, is homologous to mammalian sperm-binding proteins. Proc. Natl. Acad. Sci. U.S.A. 98, 11205-11210 (2001).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены