Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La construcción de un hidrogel de colágeno para la entrega de la madre microesferas cargadas con células quitosano
* Estos autores han contribuido por igual
En este artículo
Resumen
Un obstáculo importante en las actuales terapias con células madre es determinar el método más eficaz para proporcionar a estas células a los tejidos del huésped. A continuación, describimos un método de entrega basado en quitosano que sea eficiente y simple en el planteamiento, al tiempo que permite derivadas de tejido adiposo de células madre para mantener su multipotencia.
Resumen
Las células madre pluripotentes han demostrado ser extremadamente útil en el campo de la medicina regenerativa 1-3. Sin embargo, con el fin de utilizar eficazmente estas células para la regeneración de tejido, un número de variables deben ser tenidas en cuenta. Estas variables incluyen: el volumen total y el área superficial del sitio de implantación, las propiedades mecánicas de los tejidos y el microambiente del tejido, que incluye la cantidad de vascularización y los componentes de la matriz extracelular. Por lo tanto, los materiales que se utilizan para entregar estas células deben ser biocompatibles con una composición química definida mientras se mantiene una resistencia mecánica que imita el tejido huésped. Estos materiales también debe ser permeable al oxígeno y nutrientes para proporcionar un microambiente favorable para las células para sujetar y proliferar. El quitosano, un polisacárido catiónico con una excelente biocompatibilidad, puede ser fácilmente modificado químicamente y tiene una alta afinidad para unirse con in vivo macromolecules 4-5. El quitosano imita la porción glucosaminoglucano de la matriz extracelular, lo que le permite funcionar como un sustrato para la adhesión celular, la migración y proliferación. En este estudio se utilizan quitosano en forma de microesferas para entregar derivadas de tejido adiposo células madre (ASC) en una base de colágeno tridimensional andamio 6. Un ideal de célula a microesfera relación se determinó con respecto al tiempo de incubación y densidad de las células para alcanzar el número máximo de células que podrían ser cargados. Una vez ASC se siembran en las microesferas de quitosano (MCS), que están incorporados en un armazón de colágeno y pueden mantenerse en cultivo durante períodos prolongados. En resumen, este estudio proporciona un método para entregar, precisamente, las células madre dentro de un andamio de tres dimensiones biomaterial.
Protocolo
1. Aislamiento adiposo células madre derivadas de (ASC)
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Aislar adiposo perirrenal rata y epididimal y se lava con solución estéril de Hank sal tamponada (HBSS) que contenía 1% de suero fetal bovino (SFB) como se describió anteriormente 6.
- Picar el tejido y transferir 1-2 g en 25 ml de HBSS conteniendo FBS al 1% en un tubo de 50 ml y se centrifuga a 500 g durante 8 minutos a temperatura ambiente.
- Recoger la capa adiposa de libre flotación del tejido y la transferencia a 125 ml matraz Erlenmeyer y se trata con 25 ml de colagenasa tipo II (200 U / ml) en HBSS durante 45 min a 37 ° C en un agitador orbital (125 rpm).
- Retirar con cuidado la fracción líquida (por debajo de aceite y la capa de tejido adiposo) y filtrar secuencialmente a través de un filtro de nylon de malla 100-micras y 70 micras. Centrifugar el filtrado a 500 g durante 10 min a temperatura ambiente, aspirar el supernatant y lavar el precipitado dos veces con 25 ml de HBSS.
- Resuspender el sedimento celular en 50 ml de medio de crecimiento (Medio MesenPRO RS basal), complementado con Suplemento MesenPRO Crecimiento RS, antibiótico-antimicótico (100 U / ml de penicilina G, 100 ug / ml de sulfato de estreptomicina, y 0,25 g / ml de anfotericina B) , y 2 mM de L-glutamina y células pipeta en 2 matraces T75 (25 ml / matraz).
- Cultura de la ASC en un 5% de CO 2 humidificado incubadora a 37 ° C (Paso 4.2 ASC se utilizan para todos los experimentos).
2. Preparación de microesferas de quitosano (CSM)
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- CSM se preparan mediante un proceso de agua en aceite emulsificación junto con una técnica de coacervación iónico utilizando nuestra anterior protocolo 6. Emulsionar una solución acuosa de quitosano (6 ml de w / v 3% de quitosano en 0,5 M de ácido acético) en un 100 ml de una mezcla en fase de aceite consistente en sojapetróleo, n-octanol (01:02 v / v) y 5% de sorbitan mono-oleato (Span 80) emulsionante, utilizando sobrecarga (1700 rpm) y agitación magnética (1000 rpm) simultáneamente, en direcciones opuestas. Este método doble de mezclado asegura que las micelas formadas desde el principio antes de la reticulación se produce pueden permanecer en solución y no se depositan en el fondo. Además, la barra magnética agitadora ayudas en DE-agregación de quitosano durante la formación de micelas y la rigidización.
- La mezcla se agita continuamente durante aproximadamente 1 hora hasta una estable de agua-en-aceite que se obtiene. Reticulación iónica se inicia con la adición de 1,5 ml de 1% w / v de hidróxido de potasio en n-octanol cada 15 minutos durante 4 horas (24 ml en total).
- Después de la terminación de la reacción de reticulación, lentamente decantar la fase oleosa de la mezcla que contiene CSM y añadir inmediatamente las esferas a 100 ml de acetona. Se lavan las esferas con acetona hasta que la fase de aceite se elimina completamente.
- Secar los campos recuperados en un desecador de vacío y analyze sin más trámite. El tamaño medio de partícula CSM, área de superficie por miligramo y la unidad de volumen cúbico se determinó usando el analizador de tamaño de partícula.
- Para los experimentos subsiguientes, lavar CSM tres veces con agua estéril para eliminar las sales residuales y esterilizar con alcohol absoluto.
3. Determinación del número de grupos amino libres en CSM
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Determinar el número de grupos amino libres presentes en CSM después de la reticulación iónica mediante el trinitro bencenosulfónico (TNBS) ensayo del ácido de Bubins y Ofner 7. Incubar 5 mg de microesferas con 1 ml de solución al 0,5% TNBS en un tubo de vidrio de 50 ml durante 4 horas a 40 ° C y hidrolizar con la adición de 3 ml de HCl 6N a 60 ° C durante 2h.
- Enfriar las muestras a temperatura ambiente, y extraer los TNBS libres mediante la adición de 5 ml de agua desionizada y 10 ml de etiléter.
- Calentar una alícuota de 5 ml de la fase acuosa a 40 ° C en un baño de agua durante 15 minutos para evaporar cualquier éter residual, enfriar a temperatura ambiente, y se diluye con 15 ml de agua.
- Se mide la absorbancia a 345 nm con un espectrofotómetro utilizando la solución de TNBS sin quitosano como en blanco y quitosano el utilizado para la preparación CSM para determinar el número total de grupos amino. Estimación del número de grupos amino libres de la CSM en relación con quitosano.
4. Cargando ASC en CSM
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Equilibrar 5 mg de CSM esterilizados de la sección 2.5 en HBSS estériles durante la noche y agregar a un niño de 8 micras de tamaño de poro de inserción placa de la membrana de cultivo (placa de 24 pocillos).
- Después de la CSM se han asentado sobre la membrana, cuidadosamente aspire el HBSS y añadir 300 l de medio de crecimiento hacia el interior del inserto y 700 l de medio de crecimiento para ªe fuera del inserto.
- Resuspender ASC a la concentración apropiada (1 x 10 4 a 4 x 10 4) en 200 l de medio de crecimiento y las semillas sobre el CSM el interior del inserto placa de cultivo. El volumen final de medio de cultivo dentro de la inserción, después de la siembra, es de 500 l.
- Incubar el cabeza de serie ASC a CSM durante 24 horas en un 5% de CO 2 humidificado incubadora a 37 ° C.
5. La determinación del porcentaje de carga ASC y la viabilidad celular en el CSM
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Después de la incubación, recoger el CSM ASC-cargada en un tubo de microcentrífuga de 1,5 ml estéril sin alterar las células que han migrado a la membrana de inserción.
- Eliminar el medio residual y añadir 250 l de medio de cultivo fresco al tubo.
- A cada tubo se añaden 25 l de MTT [3 - (4,5-dimethylthiozole-2-il) -2,5-difeniltetrazolio]solución (5 mg / ml) y se incuba durante 4 horas en un 5% de CO 2 humidificado incubadora a 37 ° C.
- Después de la incubación, se elimina el medio, añadir 250 l de dimetilsulfóxido, y vórtice de la mezcla durante 2-5 minutos para solubilizar el complejo formazano.
- Centrifugar el CSM a 2700 x g durante 5 min, y determinar la absorbancia sobrenadante medido a 570 nm utilizando 630 nm como referencia.
- Determinar el número de células asociada con el CSM en relación con el valor de absorbancia obtenido a partir de un número conocido de viable ASC.
6. Caracterización de ASC-CSM-Embedded gel de colágeno
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Mezcla ASC-cargado CSM (5 mg contiene ≈ 2 x 10 4 células) con colágeno tipo 1 (7,5 mg / ml) extraído de tendón de cola de rata según el método de Bornstein 8 y fibrilar después de ajustar el pH a 6,8 usando NaOH 2 N.
- Agregue el fibrilada colágeno-ASC-CSM mezcla a una placa de 12 pocillos y se incuba durante 30 minutos a un 5% de CO 2 humidificado incubadora a 37 ° C.
- Después de la fibrilación completa, incubar los geles de colágeno-ASC-CSM para un máximo de 14 días en un 5% de CO 2 humidificado incubadora a 37 ° C.
- Lanzamiento y la migración de las células de CSM en el gel se observaron utilizando técnicas estándar de microscopía.
7. Los resultados representativos
En el presente estudio, hemos desarrollado una estrategia para entregar in vitro las células madre a partir de microesferas de quitosano (CSM) en un gel de colágeno andamio. CSM poroso de tamaño uniforme (175-225 micras de diámetro) y la composición se prepara y se usa como portadores de células (Figura 2). Tras incubar ASC con el CSM, las células unida a una concentración de 2 x 10 4 cells/5mg de CSM. Las células eran capaces de difundir sobre la microesfera, mientras que se extiende filopodiosen las grietas porosas de la microesfera (Figura 3). Una vez que el CSM cargadas con células se mezclaron con el gel de colágeno, las células inmediatamente comenzaron a emigrar en los geles (Figura 4).
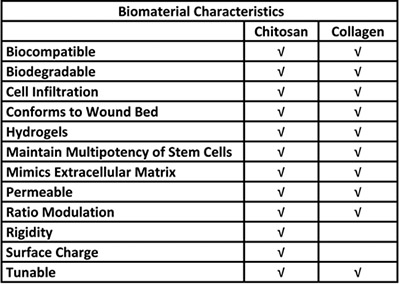
Tabla 1. Ventajas biológicas para el uso del quitosano y el colágeno en un sistema de entrega vástago célula.
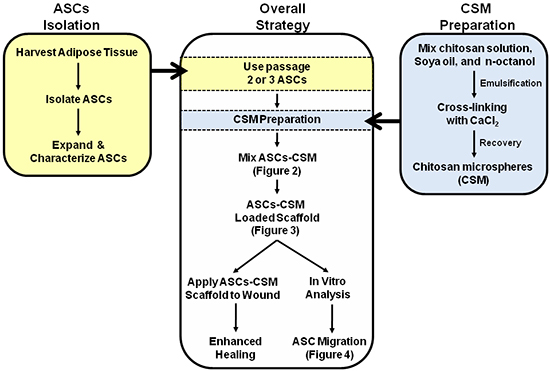
Figura 1. Esquema que representa la estrategia general para el uso dual de la ASC-CSM andamios de colágeno cargadas. Figuras 2, 3 y 4 se anotan en el esquema para ayudar con la interpretación de las imágenes.
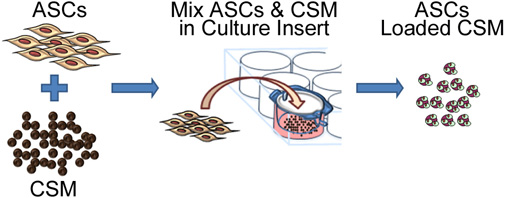
Figura 2. Representación esquemática que representa el proceso de siembra de células madre en quitosano microesferas. El procESS consiste en co-cultivo de ASC con el CSM en un 8 - tamaño de micras de poro la cultura inserción de la placa. Después de 24 horas, las microesferas son retirados de la inserción y están listos para incrustar en una matriz de biomaterial.
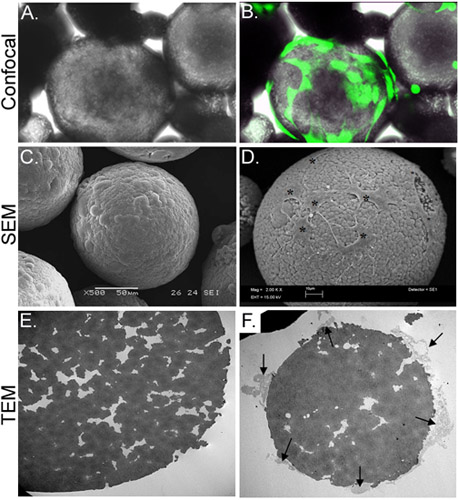
Figura 3. Caracterización morfológica de CSM-cargado con ASC. El panel A muestra una micrografía de luz de ASC-cargado CSM, mientras que el panel B muestra el mismo campo de visión superpuesta con una imagen obtenida por microscopía de fluorescencia confocal. ASC se precargado con calceína AM (verde). El panel C muestra una imagen de una imagen SEM de una microesfera sin carga, mientras que el panel D muestra las células cargadas en la microesfera (asteriscos). La imagen de TEM en panel E muestra una sección transversal de una microesfera descargada. Una multitud de poros y grietas se encuentran a lo largo de la microesfera. Panel F muestra una sección transversal de microesferas con células (flechas) unida y que se extiende filopodios en la CREvicios. Aumentos originales: A y B = 70X, C = 500x, D = 2.000 x, E y F = 2.500 x.

Figura 4. Migración de ASC desde el CSM en el armazón tridimensional de colágeno. Los paneles A y B representan el CSM con células migrando de microesferas y en la matriz de colágeno en el día 3 (A, las flechas). El panel B muestra una cultura similar después de 12 días. Microscopía electrónica de transmisión (TEM) se representan en las imágenes C, D y E. Los asteriscos en C y D muestran una microesfera que ha sido seccionada con células que migran fuera de la microesfera (flechas). Mayor aumento de panel D se representa en el panel E, y muestra filopodios de células asociadas a las fibrillas de colágeno (recuadro). Magnificación original: A y B = 100 veces; C y D = 6.000 x, E = 20.000 x, inserción = 150.000 x.
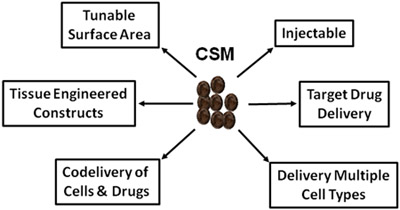
Figura 5.Esquema que muestra los usos grandes de CSM en la medicina regenerativa y la administración de fármacos.
Access restricted. Please log in or start a trial to view this content.
Discusión
Un obstáculo importante en las células madre basado en la terapia es el desarrollo de métodos eficientes para la entrega de las células de las regiones indicadas para su reparación. Debido a la variabilidad paciente a paciente, el tipo de tejido, el tamaño de la lesión y profundidad; la metodología de las células madre con envío debe determinarse sobre una base de caso por caso. A pesar de incorporar las células madre dentro de una matriz y su entrega a la zona de la herida que parece ser un enfoque más lóg...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de intereses financieros existen.
Aviso legal
Las opiniones o afirmaciones contenidas en este documento son las opiniones particulares de los autores y no deben interpretarse como oficial o que refleja las opiniones del Departamento de Defensa o el Gobierno de los EE.UU.. Los autores son empleados del gobierno de EE.UU., y este trabajo fue preparado como parte de sus funciones oficiales. Todo el trabajo fue apoyado por el Ejército de los EE.UU. de Investigación Médica y el Comando de Material. Este estudio se llevó a cabo en virtud de un protocolo revisado y aprobado por la Investigación Médica del Ejército de EE.UU. y de la Junta de Revisión Institucional de Material de comandos, y de acuerdo con el protocolo aprobado.
Agradecimientos
DOZ con el apoyo de una subvención concedida por La Fundación de Ginebra. SN fue apoyado por una beca Postdoctoral Fellowship de la Iniciativa de Ingeniería de Tejidos de Pittsburgh.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / equipo | Empresa | Número de catálogo | Comentarios |
| Hanks BalancedSalt solución (HBSS) | Gibco | 14175 | Consumible |
| Suero Bovino Fetal | Hyclone | SH30071.03 | Consumible |
| La colagenasa tipo II | Sigma-Aldrich | C6685 | Consumible |
| 70-m de nylon de malla de filtro | BD Biosciences | 352350 | Consumible |
| 100-m de nylon de malla de filtro | BD Biosciences | 352360 | Consumible |
| El crecimiento medio del sistema MesenPRO | Invitrogen | 12746-012 | Consumible |
| L-glutamina | Gibco | 25030 | Consumible |
| T75 frasco de cultivo de tejidos | BD Biosciences | 137787 | Consumible |
| El quitosano | Sigma-Aldrich | 448869 | Consumible |
| Ácido Acético | Sigma-Aldrich | 320099 | Consumible |
| N-octanol | Acros Organics | 150630025 | Consumible |
| Sorbitan mono-oleato | Sigma-Aldrich | S6760 | Consumible |
| Hidróxido de potasio | Sigma-Aldrich | P1767 | Consumible |
| Acetona | Fisher Scientific | L-4859 | Consumible |
| Etanol | Sigma-Aldrich | 270741 | Consumible |
| Trinitro bencenosulfónico | Sigma-Aldrich | P2297 | Consumible |
| Ácido clorhídrico | Sigma-Aldrich | 320331 | Consumible |
| Éter etílico | Sigma-Aldrich | 472-484 | Consumible |
| 8 micras de tejido Inserta cultivo en placa | BD Biosciences | 353097 | Consumible |
| 1,5 ml Tubos de microcentrífuga | Pescador | 05-408-129 | Consumible |
| Reactivo MTT | Invitrogen | M6494 | Consumible |
| Dimetilsulfóxido | Sigma-Aldrich | D8779 | Consumible |
| Qtracker célula Etiquetado Kit (Q seguimiento de 655) | Sondas moleculares | Q2502PMP | Consumible |
| Colágeno tipo 1 | Travigen | 3447-020-01 | Consumible |
| Hidróxido de sodio | Sigma-Aldrich | S8045 | Consumible |
| 12 placas de cultivo tisular | BD Biosciences | 353043 | Consumible |
| Centrifugar | Eppendorf | 5417R | Equipo |
| Agitador orbital | New Brunswick Scienctific | C24 | Equipo |
| Incubador humidificado con Air-5% de CO 2 | Thermo Scientific | Modelo 370 | Equipo |
| Agitador de varillas | IKA | Visc6000 | Equipo |
| Agitador magnético | Corning | PC-210 | Equipo |
| Desecador de vacío | - | - | Equipo |
| Analizador de Tamaño de Partículas | Malvern | STP2000 Spraytec | Equipo |
| Baño de agua | Fisher Scientific | Isotemp210 | Equipo |
| Espectrofotómetro | Beckman | Beckman Coulter DU800UV/Visible Espectrofotómetro | Equipo |
| Vórtice | Diagger | 3030a | Equipo |
| Lector de microplacas | Molecular Devices | SpectraMax M2 | Equipo |
| Luz / microscopio de fluorescencia | Olimpo | IX71 | Equipo |
| Microscopio Confocal | Olimpo | FV-500 microscopio confocal de barrido láser | Equipo |
| Microscopio Electrónico de Barrido | Carl Zeiss MicroImaging | Leo 435 VP | Equipo |
| Microscopio Electrónico de Transmisión | JEOL | JEOL 1230 | Equipo |
Referencias
- Krampera, M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair. Bone. 39, 678-683 (2006).
- Patrick, C. W. Tissue engineering strategies for adipose tissue repair. Anat. Rec. 263, 361-366 (2001).
- Pountos, I., Giannoudis, P. V. Biology of mesenchymal stem cells. Injury. 36, Suppl 3. S8-S12 (2005).
- Kim, I. Y. Chitosan and its derivatives for tissue engineering applications. Biotechnol. Adv. 26, 1-21 (2008).
- Shi, C. Therapeutic potential of chitosan and its derivatives in regenerative medicine. J. Surg. Res. 133, 185-192 (2006).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part. A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, C. M. 3rd The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J. Biomed. Mater. Res. A. 81, 259-268 (2007).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Shanmuganathan, S. Preparation and characterization of chitosan microspheres for doxycycline delivery. Carbohydr. Polym. 73, 201-211 (2008).
- Haque, T., Chen, H., Ouyang, W., Martoni, C., Lawuyi, B., Urbanska, A., Prakash, S. Investigation of a new microcapsule membrane combining alginate, chitosan, polyethylene glycol and poly-L-lysine for cell transplantation applications. Int. J. Artif. Organs. 28, 631-637 (2005).
- Goren, A., Dahan, N., Goren, E., Baruch, L., Machluf, M. Encapsulated human mesenchymal stem cells: a unique hypoimmunogenic platform for long-term cellular therapy. FASEB J. 24, 22-31 (2010).
- Zielinski, B. A., Aebischer, P. Chitosan as a matrix for mammalian cell encapsulation. Biomaterials. 15, 1049-1056 (1994).
- Girandon, L., Kregar-Velikonja, N., Božikov, K., Barliç, A. In vitro Models for Adipose Tissue Engineering with Adipose-Derived Stem Cells Using Different Scaffolds of Natural Origin. Folia Biol. (Praha). 57, 47-56 (2011).
- Baruch, L., Machluf, M. Alginate-chitosan complex coacervation for cell encapsulation: effect on mechanical properties and on long-term viability. Biopolymers. 82, 570-579 (2006).
- Wei, Y., Gong, K., Zheng, Z., Wang, A., Ao, Q., Gong, Y., Zhang, X. Chitosan/silk fibroin-based tissue-engineered graft seeded with adipose-derived stem cells enhances nerve regeneration in a rat model. J. Mater. Sci. Mater. Med. , (2011).
- Wang, Q., Jamal, S., Detamore, M. S., Berkland, C. PLGA-chitosan/PLGA-alginate nanoparticle blends as biodegradable colloidal gels for seeding human umbilical cord mesenchymal stem cells. J. Biomed. Mater. Res. A. 96, 520-527 (2011).
- Alves da Silva, M. L., Martins, A., Costa-Pinto, A. R., Correlo, V. M., Sol, P., Bhattacharya, M., Faria, S., Reis, R. L., Neves, N. M. Chondrogenic differentiation of human bone marrow mesenchymal stem cells in chitosan-based scaffolds using a flow-perfusion bioreactor. J. Tissue Eng. Regen. Med. , (2010).
- Kang, Y. M., Lee, B. N., Ko, J. H., Kim, G. H., Kang, K. N., Kim da, Y., Kim, J. H., Park, Y. H., Chun, H. J., Kim, C. H., Kim, M. S. In vivo biocompatibility study of electrospun chitosan microfiber for tissue engineering. Int. J. Mol. Sci. 11, 4140-4148 (2010).
- Bozkurt, G., Mothe, A. J., Zahir, T., Kim, H., Shoichet, M. S., Tator, C. H. Chitosan channels containing spinal cord-derived stem/progenitor cells for repair of subacute spinal cord injury in the rat. Neurosurgery. 67, 1733-1744 (2010).
- Leipzig, N. D., Wylie, R. G., Kim, H., Shoichet, M. S. Differentiation of neural stem cells in three-dimensional growth factor-immobilized chitosan hydrogel scaffolds. Biomaterials. 32, 57-64 (2011).
- Altman, A. M., Gupta, V., RÃos, C. N., Alt, E. U., Mathur, A. B. Adhesion, migration and mechanics of human adipose-tissue-derived stem cells on silk fibroin-chitosan matrix. Acta Biomater. 6, 1388-1397 (2010).
- Altman, A. M., Yan, Y., Matthias, N., Bai, X., Rios, C., Mathur, A. B., Song, Y. H., Alt, E. U. IFATS collection: Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model. Stem Cells. 27, 250-258 (2009).
- Machado, C. B., Ventura, J. M., Lemos, A. F., Ferreira, J. M., Leite, M. F., Goes, A. M. 3D chitosan-gelatin-chondroitin porous scaffold improves osteogenic differentiation of mesenchymal stem cells. Biomed. Mater. 2, 124-131 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados