A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בניית Hydrogel קולגן עבור משלוח של התא טעון גזע Chitosan microspheres
In This Article
Summary
המכשול העיקרי בתא טיפולים שוטפים גזע הוא לקבוע את השיטה היעילה ביותר, כדי לספק תאים אלה לרקמות המארחות. כאן אנו מתארים שיטה chitosan מבוסס משלוח יעיל ופשוט של הגישה, תוך מתן אפשרות השומן שמקורם בתאי גזע כדי לשמור על multipotency שלהם.
Abstract
בתאי גזע multipotent הוכחו להיות שימושי ביותר בתחום הרפואה משובי 1-3. עם זאת, כדי להשתמש ביעילות את התאים האלה לשחזור רקמות, מספר משתנים יש לקחת בחשבון. משתנים אלה כוללים: הנפח הכולל ושטח הפנים של אתר ההשתלה, תכונות מכניות של רקמות ואת microenvironment רקמות, הכוללת את כמות כלי הדם ועל מרכיבי מטריקס תאיים. לכן, חומרים בשימוש, כדי לספק את התאים האלה חייבים להיות ביולוגית עם הרכב כימי מוגדר, תוך שמירה על חוזק מכני המחקה רקמת המארח. חומרים אלה חייבים להיות גם החדיר את חמצן וחומרים מזינים לספק microenvironment חיובית על תאים לצרף מתרבים. Chitosan, פוליסכריד קטיוני עם biocompatibility מעולה, ניתן לשנות בקלות כימית ויש לו זיקה גבוהה להיקשר עם in vivo Macromolecules 4-5. Chitosan מחקה חלק glycosaminoglycan של מטריקס תאית, מה שמאפשר לו לתפקד כמו המצע של הגירה הידבקות, תאים ו ההפצה. במחקר זה אנו מנצלים chitosan בצורה של microspheres כדי לספק שומן שמקורם בתאי גזע (ASC) על בסיס קולגן תלת ממדי הפיגום 6. היחס האידיאלי התא אל microsphere נקבע ביחס לזמן הדגירה ואת צפיפות התאים כדי להשיג המספר המרבי של התאים ניתן לטעון. לאחר ASC הם זרע על microspheres chitosan (CSM), הם מוטבעים פיגום קולגן יכול להישמר בתרבות לתקופות ממושכות. לסיכום, מחקר זה מספק שיטה בדיוק לספק בתאי גזע בתוך 3 מימדי ביולוגי הפיגום.
Protocol
1. בידוד הנגזרות שומן גזע תאים (ASC)
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- לבודד את השומן עכברוש perirenal ו epididymal ולשטוף עם פתרון שנאגרו האנק של מלח סטרילית (HBSS) המכיל 1% בסרום שור עוברית (FBS) כפי שתואר קודם 6.
- לרכך את הרקמה ולהעביר 1-2 גרם בתוך 25 מ"ל של HBSS המכילים FBS 1% אל תוך צינור 50 מ"ל ו 500 גרם צנטריפוגות ב 8 דקות בטמפרטורת החדר.
- איסוף הספונטנית רקמת שומן שכבת והעברה בקבוק 125 מ"ל erlenmeyer ולטפל עם 25 מ"ל של collagenase מסוג II (200 יח' / מ"ל) ב HBSS 45 דקות ב 37 מעלות צלזיוס על שייקר מסלולית (125 סל"ד).
- מוציאים בזהירות את החלק היחסי נוזלי (להלן נפט שכבת השומן) ולסנן ברצף דרך מסנן של 100 מיקרומטר ו 70 מיקרומטר רשת ניילון. בצנטריפוגה תסנין ב 500 גרם 10 דקות בטמפרטורת החדר, לשאוב supernatanלא לשטוף גלולה פעמיים עם 25 HBSS מ"ל.
- Resuspend תא גלולה ב 50 מ"ל של מדיום הגידול (MesenPRO בינוני RS בסל) השלימו עם תוספת RS צמיחה MesenPRO, אנטיביוטיקה antimycotic (100 U / mL של פניצילין G, 100 מיקרוגרם / סטרפטומיצין סולפט מ"ל, ו -0.25 מיקרוגרם / מ"ל amphotericin B) , אל 2 T75 צלוחיות (25 מ"ל / בקבוק) 2 מ"מ L-גלוטמין ותאי pipet.
- תרבות ASC ב 5% CO 2 באינקובטור humidified ב 37 ° C (המעבר 2-4 ASC משמשים לניסויים בכלל).
2. הכנת Chitosan microspheres (CSM)
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- CSM מוכנים בתהליך תחליב מים בתוך שמן יחד עם הטכניקה coacervation יוניים באמצעות פרוטוקול הקודמת שלנו 6. Emulsify בתמיסה מימית של chitosan (6 מ"ל של chitosan 3% w / v בחומצה אצטית 0.5 מ ') 100 מ"ל של תערובת שמן השלב המורכב סויהשמן, N-octanol (01:02 v / v) ו 5% sorbitan-מונו oleate (פרק 80) מתחלב, באמצעות תקורה (1,700 סל"ד) ו בחישה מגנטי (1000 סל"ד) בו זמנית, בכיוונים מנוגדים. בשיטה הכפולה של ערבוב מבטיח כי micelles נוצרו בשלב מוקדם לפני cross-linking מתרחשת יכול להישאר פתרון ולא להסתפק לתחתית. יתר על כן, מערבבים המגנטי בר מסייע דה צבירה chitosan במהלך היווצרות micelle ו rigidization.
- התערובת היא עוררה ברציפות עד האמולסיה יציבה מים על שמן מתקבל במשך שעה בערך 1. Crosslinking יונית נשלחת עם תוספת של 1.5 מ"ל של הידרוקסיד 1% w / v אשלגן דקות N-octanol 15 עבור כל 4 שעות (24 מ"ל בסך הכל).
- לאחר השלמת התגובה crosslinking, למזוג לאט את השלב הנפט של CSM תערובת המכילה ומיד להוסיף את התחומים עד 100 מ"ל של אצטון. לשטוף את התחומים עם אצטון עד לשלב שמן נמחק לחלוטין.
- לייבש את התחומים התאוששה תא ייבוש ואקום אנאליyze ללא עיבוד נוסף. CSM הממוצע החלקיקים בגודל, שטח הפנים מיליגרם ו מעוקב יחידת נפח נקבע באמצעות גודל החלקיקים Analyzer.
- ניסויים שבאו לאחר מכן, לשטוף CSM שלוש פעמים עם מים סטריליים כדי להסיר שאריות מלחי ו לחטא עם אלכוהול מוחלט.
3. קביעת מספר קבוצות אמינו חופשיות ב CSM
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- לקבוע את מספר קבוצות אמינו חופשיות הנמצאים CSM לאחר crosslinking יוניים באמצעות benzenesulfonic trinitro (TNBS) assay של חומצה Bubins ו Ofner 7. דגירה של 5 מ"ג microspheres עם 1 מ"ל של תמיסת TNBS 0.5% בשנת צינור זכוכית 50 מ"ל במשך 4 שעות ב 40 מעלות צלזיוס, hydrolyze עם תוספת של 3 מ"ל של HCl 6N ב 60 ° C ל 2h.
- לקרר את דגימות לטמפרטורת החדר, ולחלץ את TNBS בחינם על ידי הוספת 5 מ"ל מים deionized ו 10 מ"ל של אתילהאתר.
- לחמם aliquot 5 מ"ל של שלב מימית עד 40 מעלות צלזיוס באמבט מים במשך 15 דקות להתאדות בכל האתר שיורית, מצננים לטמפרטורת החדר, לדלל עם 15 מ"ל מים.
- למדוד את ספיגת ב 345 ננומטר עם ספקטרופוטומטר באמצעות פתרון TNBS ללא chitosan כמו ריק chitosan משמש להכנת CSM כדי לקבוע את המספר הכולל של קבוצות אמינו. להעריך את מספר קבוצות אמינו חופשיות של CSM ביחס chitosan.
4. טוען ASC ב CSM
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- לאזן 5 מ"ג של CSM עיקור מסעיף 2.5 ב HBSS סטריליים לילה ולהוסיף 8-מיקרומטר גודל הנקבוביות להוסיף קרום צלחת תרבות (24 גם צלחת).
- לאחר CSM התיישבו על הממברנה, בזהירות לשאוב את HBSS ולהוסיף 300 μL של מדיום הגידול הפנימי של הכנס ו 700 μL של התקשורת הצמיחה ל הדואר מחוץ להוסיף.
- Resuspend ASC בריכוז המתאים (1 x 4-04 אוקטובר 10 x 4) 200 μL של המדיום צמיחה זרע על CSM בתוך להוסיף את הצלחת התרבות. היקף הסופי של המדיום תוך הוספה התרבות, לאחר זריעה, הוא 500 μL.
- דגירה seeded ASC על CSM עבור H 24 ב 5% CO 2 באינקובטור humidified ב 37 ° C.
5. קביעת אחוז טוען ASC ו כדאיות התא ב CSM
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- לאחר הדגירה, לאסוף CSM ASC-טעון צינור 1.5-מ"ל סטרילי microcentrifuge מבלי להפריע את התאים אשר היגרו אל קרום הוספה.
- להסיר את שאריות בינוני ומוסיפים 250 μL של מדיום הגידול טרי הצינור.
- אל צינור זה להוסיף 25 MTT μL [3 - (4,5-dimethylthiozole-2-י.ל.) -2,5-diphenyltetrazolium ברומיד]הפתרון (5 מ"ג / מ"ל) ו - דגירה של 4 שעות ב 5% CO 2 באינקובטור humidified ב 37 ° C.
- לאחר הדגירה, הסר בינוני, מוסיפים 250 μL של sulfoxide דימתיל, ואת המערבולת התערובת במשך 2-5 דקות כדי solubilize מורכבת formazan.
- בצנטריפוגה CSM ב 2700 x g 5 דקות, ולקבוע את ספיגת supernatant נמדד ב 570 ננומטר באמצעות 630 ננומטר כנקודת התייחסות.
- לקבוע את מספר הסלולרי קשור CSM יחסית לערך ספיגת לקבל מספרים הידועים של ASC בת קיימא.
6. אפיון ASC-CSM-Embedded קולגן ג'ל
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- מערבבים ASC-CSM טעון (5 מ"ג המכיל ≈ 2 x 10 4 תאים) עם קולגן סוג 1 (7.5 מ"ג / מ"ל) המופק גיד זנב עכברוש על פי השיטה של בורנשטיין 8 ו לרעוד לאחר התאמת נתוני pH 6.8 כדי שימוש 2 N NaOH.
- מוסיפים את תערובת פירפר קולגן-ASC-CSM לצלחת 12-טוב ו דגירה של 30 דקות בשעה של 5% CO 2 באינקובטור humidified ב 37 ° C.
- לאחר פרפור מלאה, דגירה של קולגן-ASC-CSM ג'ל של עד 14 יום ב 5% CO 2 באינקובטור humidified ב 37 ° C.
- שחרור והעברה של תאים CSM לתוך הג'ל נצפו באמצעות שיטות מיקרוסקופיה רגילות.
7. נציג תוצאות
במחקר הנוכחי, פיתחנו אסטרטגיה במבחנה כדי לספק לתאי גזע של chitosan microspheres (CSM) לתוך קולגן ג'ל הפיגום. CSM נקבובי בגודל אחיד (175-225 מיקרומטר קוטר) והרכב היו מוכנים ושימש ספקים סלולריים (איור 2). על דוגרים ASC עם CSM, התאים מחוברים בריכוז של 2 cells/5mg x 4 10 של CSM. התאים מסוגלים להתפשט על microsphere, תוך הארכת filopodiaלתוך הסדקים נקבוביים של microsphere (איור 3). לאחר CSM התא טעון היו מעורבים עם ג'ל קולגן, התאים החלו מיד נודדות אל ג 'ל (איור 4).
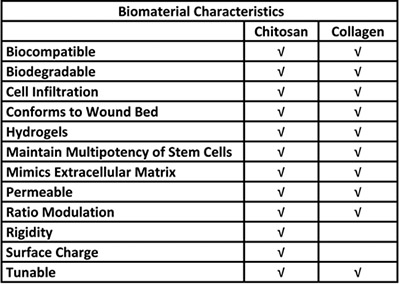
טבלה 1. יתרונות ביולוגיים לשימוש של chitosan ו הקולגן מערכת תא גזע הלידה.
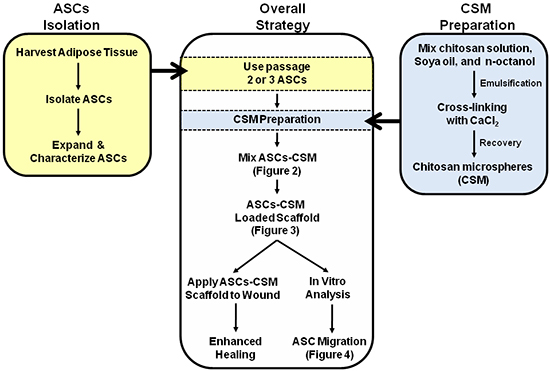
באיור 1. סכמטי המתאר את האסטרטגיה הכוללת לשימוש כפול של ASC-CSM פיגומים טעון קולגן. איורים 2, 3 ו -4 הם המבואר בתוך סכמטי לסייע בפרשנות של התמונות.
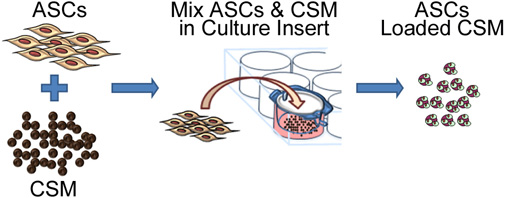
איור 2. ייצוג סכמטי המתאר את תהליך זריעת בתאי גזע על chitosan microspheres. ProcESS כוללת שיתוף culturing ASC עם CSM ב 8 - נקבוביות מיקרומטר בגודל הממברנה התרבות להוסיף צלחת. לאחר 24 שעות, microspheres יוסרו להוסיף והם מוכנים להטבעת לתוך המטריצה בחומר ביולוגי.
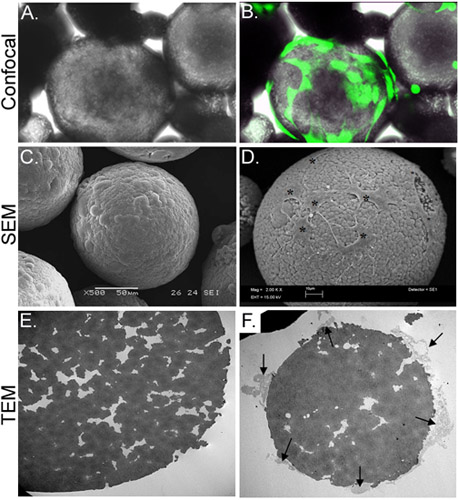
איור 3. אפיון מורפולוגי של CSM-עמוסה ASC. לוח מתאר מיקרוסקופ אור של CSM ASC טעונים, בעוד לוח ב 'מראה את אותו שדה הראייה גבי בתמונה מתקבל על ידי מיקרוסקופ פלואורסצנטי confocal. ASC היו מראש עם calcein בבוקר (ירוק). לוח ג מתאר תמונה של תמונה SEM של microsphere פרקו, בעוד לוח ד ניתן לראות תאים הועמסו על microsphere (כוכביות). תמונת TEM ב E לוח מראה חתך של microsphere טעון. מספר רב של נקבוביות הסדקים נמצאים ברחבי microsphere. לוח F מראה microsphere בחתך רוחב עם תאים (חיצים) מחובר הארכת filopodia אל creהמידות הרעות. בהגדלה מקור: & B = 70x, C = 500X, D = 2000 x, E & F = 2,500 x.

איור 4. הגירה של ASC מ CSM לתוך תלת מימדי קולגן הפיגום. לוחות א 'וב' מתארים CSM עם תאים נודדות הרחק microsphere לתוך המטריצה קולגן ביום 3 (א ', חיצים). לוח ב 'מציג את התרבות דומה לאחר 12 יום. מיקרוסקופ אלקטרונים הילוכים (TEM) תמונות מתוארים ג', ד ', וא' כוכביות ב-C ו-D להראות microsphere כי כבר בחתך רוחב עם תאים נודדות הרחק microsphere (חיצים). ההגדלה גבוה יותר של לוח ד מתואר E לוח, ומראה filopodia התא מחוברת את סיבי הקולגן (השיבוץ). ההגדלה המקורי: A ו-B = 100x: C & D = 6000 x, E = 20,000 X, הבלעה = 150000 x.
איור 5.סכמה המתארת את השימושים עצומות של CSM ברפואה רגנרטיבית משלוח סמים.
Access restricted. Please log in or start a trial to view this content.
Discussion
המכשול העיקרי בטיפול בתאי גזע מבוסס מפתחת שיטות יעילות עבור משלוח של תאים לאזורים המפורטים לתיקון. בשל השתנות החולה המטופל, סוג הרקמה, גודל ועומק הפציעה, המתודולוגיה של בתאי גזע אספקת צריכה להיקבע על בסיס כל מקרה לגופו. למרות הטבעה בתאי גזע בתוך מטריקס ושולחים אותם ל?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין אינטרסים כלכליים מתחרים קיימים.
הבהרה
חוות הדעת או וטיעונים הכלולות במסמך זה הן את הדעות הפרטיות של הכותבים ואינם להתפרש הרשמי או משקף את הדעות של משרד הביטחון או ממשלת ארה"ב. הכותבים הם עובדי ממשלת ארה"ב, ואת העבודה הזאת הוכנה במסגרת תפקידיהם הרשמיים. כל עבודה נתמך על ידי הצבא האמריקני למחקר רפואי ו פיקוד אמצעי. המחקר נערך תחת פרוטוקול נבדקה ואושרה על ידי הצבא האמריקני למחקר רפואי ו פיקוד אמצעי ביקורת מוסדי עמוד, ועל פי פרוטוקול שאושר.
Acknowledgements
Doz נתמך על ידי מענק הוענק מטעם קרן ז'נבה. SN נתמך על ידי מענק מלגה דוקטורים מן היוזמה הנדסת רקמות פיטסבורג.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב / ציוד | חברה | מספר קטלוגי | תגובות |
| הנקס BalancedSalt פתרון (HBSS) | Gibco | 14175 | מתכלים |
| בסרום שור עוברית | Hyclone | SH30071.03 | מתכלים |
| Collagenase Type II | Sigma-Aldrich | C6685 | מתכלים |
| 70 מיקרומטר רשת ניילון המסנן | BD Biosciences | 352350 | מתכלים |
| 100 מיקרומטר רשת ניילון המסנן | BD Biosciences | 352360 | מתכלים |
| בינוני MesenPRO צמיחה מערכת | Invitrogen | 12746-012 | מתכלים |
| L-גלוטמין | Gibco | 25030 | מתכלים |
| T75 בתרבית רקמה Flask | BD Biosciences | 137787 | מתכלים |
| Chitosan | Sigma-Aldrich | 448869 | מתכלים |
| חומצה אצטית | Sigma-Aldrich | 320099 | מתכלים |
| N-Octanol | Acros Organics | 150630025 | מתכלים |
| Sorbitan-Mono-oleate | Sigma-Aldrich | S6760 | מתכלים |
| אשלגן הידרוקסיד | Sigma-Aldrich | P1767 | מתכלים |
| אצטון | פישר סיינטיפיק | L-4859 | מתכלים |
| אתנול | Sigma-Aldrich | 270741 | מתכלים |
| Trinitro Benzenesulfonic חומצה | Sigma-Aldrich | P2297 | מתכלים |
| מימן כלורי | Sigma-Aldrich | 320331 | מתכלים |
| אתיל Ether | Sigma-Aldrich | 472-484 | מתכלים |
| 8-מיקרומטר בתרבית רקמה הוספת פלייט | BD Biosciences | 353097 | מתכלים |
| 1.5-מ"ל Microcentrifuge צינורות | דיג | 05-408-129 | מתכלים |
| MTT מגיב | Invitrogen | M6494 | מתכלים |
| דימתיל Sulfoxide | Sigma-Aldrich | D8779 | מתכלים |
| תא Qtracker סימון Kit (ש גשש 655) | בדיקות מולקולריות | Q2502PMP | מתכלים |
| הקלד 1 קולגן | Travigen | 3447-020-01 | מתכלים |
| סודיום הידרוקסיד | Sigma-Aldrich | S8045 | מתכלים |
| 12 ובכן בתרבית רקמה צלחות | BD Biosciences | 353043 | מתכלים |
| סרכזת | Eppendorf | 5417R | ציוד |
| Orbital שאכר | ניו ברונסוויק Scienctific | C24 | ציוד |
| החממה Humidified עם האוויר CO-5% 2 | Thermo Scientific | דגם 370 | ציוד |
| תקורה stirrer | איקא | Visc6000 | ציוד |
| מגנטית stirrer | קורנינג | PC-210 | ציוד |
| אבק תא ייבוש | - | - | ציוד |
| גודל החלקיקים Analyzer | Malvern | STP2000 Spraytec | ציוד |
| מי האמבט | פישר סיינטיפיק | Isotemp210 | ציוד |
| ספקטרופוטומטר | Beckman | Beckman Coulter DU800UV/Visible ספקטרופוטומטר | ציוד |
| מערבולת | Diagger | 3030a | ציוד |
| Microplate Reader | התקנים מולקולריים | SpectraMax M2 | ציוד |
| אור / מיקרוסקופ פלואורסצנטי | אולימפוס | IX71 | ציוד |
| Confocal מיקרוסקופ | אולימפוס | FV-500 סריקת לייזר מיקרוסקופ Confocal | ציוד |
| סריקת מיקרוסקופ אלקטרונים | Carl Zeiss מיקרופוןroImaging | ליאו 435 סמנכ"ל | ציוד |
| מיקרוסקופ אלקטרונים הילוכים | JEOL | JEOL 1230 | ציוד |
References
- Krampera, M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair. Bone. 39, 678-683 (2006).
- Patrick, C. W. Tissue engineering strategies for adipose tissue repair. Anat. Rec. 263, 361-366 (2001).
- Pountos, I., Giannoudis, P. V. Biology of mesenchymal stem cells. Injury. 36, Suppl 3. S8-S12 (2005).
- Kim, I. Y. Chitosan and its derivatives for tissue engineering applications. Biotechnol. Adv. 26, 1-21 (2008).
- Shi, C. Therapeutic potential of chitosan and its derivatives in regenerative medicine. J. Surg. Res. 133, 185-192 (2006).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part. A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, C. M. 3rd The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J. Biomed. Mater. Res. A. 81, 259-268 (2007).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Shanmuganathan, S. Preparation and characterization of chitosan microspheres for doxycycline delivery. Carbohydr. Polym. 73, 201-211 (2008).
- Haque, T., Chen, H., Ouyang, W., Martoni, C., Lawuyi, B., Urbanska, A., Prakash, S. Investigation of a new microcapsule membrane combining alginate, chitosan, polyethylene glycol and poly-L-lysine for cell transplantation applications. Int. J. Artif. Organs. 28, 631-637 (2005).
- Goren, A., Dahan, N., Goren, E., Baruch, L., Machluf, M. Encapsulated human mesenchymal stem cells: a unique hypoimmunogenic platform for long-term cellular therapy. FASEB J. 24, 22-31 (2010).
- Zielinski, B. A., Aebischer, P. Chitosan as a matrix for mammalian cell encapsulation. Biomaterials. 15, 1049-1056 (1994).
- Girandon, L., Kregar-Velikonja, N., Božikov, K., Barliç, A. In vitro Models for Adipose Tissue Engineering with Adipose-Derived Stem Cells Using Different Scaffolds of Natural Origin. Folia Biol. (Praha). 57, 47-56 (2011).
- Baruch, L., Machluf, M. Alginate-chitosan complex coacervation for cell encapsulation: effect on mechanical properties and on long-term viability. Biopolymers. 82, 570-579 (2006).
- Wei, Y., Gong, K., Zheng, Z., Wang, A., Ao, Q., Gong, Y., Zhang, X. Chitosan/silk fibroin-based tissue-engineered graft seeded with adipose-derived stem cells enhances nerve regeneration in a rat model. J. Mater. Sci. Mater. Med. , (2011).
- Wang, Q., Jamal, S., Detamore, M. S., Berkland, C. PLGA-chitosan/PLGA-alginate nanoparticle blends as biodegradable colloidal gels for seeding human umbilical cord mesenchymal stem cells. J. Biomed. Mater. Res. A. 96, 520-527 (2011).
- Alves da Silva, M. L., Martins, A., Costa-Pinto, A. R., Correlo, V. M., Sol, P., Bhattacharya, M., Faria, S., Reis, R. L., Neves, N. M. Chondrogenic differentiation of human bone marrow mesenchymal stem cells in chitosan-based scaffolds using a flow-perfusion bioreactor. J. Tissue Eng. Regen. Med. , (2010).
- Kang, Y. M., Lee, B. N., Ko, J. H., Kim, G. H., Kang, K. N., Kim da, Y., Kim, J. H., Park, Y. H., Chun, H. J., Kim, C. H., Kim, M. S. In vivo biocompatibility study of electrospun chitosan microfiber for tissue engineering. Int. J. Mol. Sci. 11, 4140-4148 (2010).
- Bozkurt, G., Mothe, A. J., Zahir, T., Kim, H., Shoichet, M. S., Tator, C. H. Chitosan channels containing spinal cord-derived stem/progenitor cells for repair of subacute spinal cord injury in the rat. Neurosurgery. 67, 1733-1744 (2010).
- Leipzig, N. D., Wylie, R. G., Kim, H., Shoichet, M. S. Differentiation of neural stem cells in three-dimensional growth factor-immobilized chitosan hydrogel scaffolds. Biomaterials. 32, 57-64 (2011).
- Altman, A. M., Gupta, V., RÃos, C. N., Alt, E. U., Mathur, A. B. Adhesion, migration and mechanics of human adipose-tissue-derived stem cells on silk fibroin-chitosan matrix. Acta Biomater. 6, 1388-1397 (2010).
- Altman, A. M., Yan, Y., Matthias, N., Bai, X., Rios, C., Mathur, A. B., Song, Y. H., Alt, E. U. IFATS collection: Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model. Stem Cells. 27, 250-258 (2009).
- Machado, C. B., Ventura, J. M., Lemos, A. F., Ferreira, J. M., Leite, M. F., Goes, A. M. 3D chitosan-gelatin-chondroitin porous scaffold improves osteogenic differentiation of mesenchymal stem cells. Biomed. Mater. 2, 124-131 (2007).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved