Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Der Bau einer Kollagen-Hydrogel für die Lieferung von Stem Cell-beladenen Chitosan-Mikrokügelchen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Eine große Hürde in der aktuellen Stammzelltherapien ist die Bestimmung der effektivste Methode, diese Zellen zu Wirtsgewebe zu liefern. Hier beschreiben wir eine Chitosan-basierte Methode, die Lieferung effizienter und einfacher in Ansatz ist, während es aus Fettgewebe gewonnenen Stammzellen, ihre Multipotenz aufrecht zu erhalten.
Zusammenfassung
Multipotente Stammzellen hat sich gezeigt, extrem nützlich sein auf dem Gebiet der regenerativen Medizin 3.1. Um jedoch diese Zellen effektiv zu nutzen für die Geweberegeneration, müssen eine Reihe von Variablen berücksichtigen. Diese Variablen umfassen: das Gesamtvolumen und die Oberfläche der Implantationsstelle, die mechanischen Eigenschaften des Gewebes und das Gewebe Mikroumgebung, die die Menge an Vaskularisierung und die Komponenten der extrazellulären Matrix umfasst. Daher müssen die Materialien verwendet, um diese Zellen zu liefern biokompatibel mit einer definierten chemischen Zusammensetzung während eine mechanische Festigkeit, die den Host Gewebe nachahmt. Diese Materialien müssen auch durchlässig für Sauerstoff und Nährstoffe, um einen günstigen Mikroumgebung für Zellen zu befestigen und vermehren können. Chitosan, ein kationisches Polysaccharid mit hervorragender Biokompatibilität, leicht chemisch modifiziert sein und hat eine hohe Affinität mit in vivo binden mackromoleküle 4-5. Chitosan imitiert das Glycosaminoglycan Teil der extrazellulären Matrix, so dass es als Substrat für die Zelladhäsion, Migration und Proliferation funktionieren zu können. In dieser Studie verwenden wir Chitosan in Form von Mikrokügelchen, um Fettgewebe gewonnene Stammzellen (ASC) in eine Basis von Kollagen dreidimensionales Gerüst 6 zu liefern. Eine ideale Zelle-zu-Mikrokügelchen-Verhältnis wurde in Bezug auf die Inkubationszeit und-Zelldichte, zu maximale Anzahl der Zellen, die geladen werden erreichen konnte bestimmt. Sobald ASC auf die Chitosan-Mikrokügelchen (CSM) ausgesät werden, werden sie in einer Kollagenmatrix eingebettet und können in Kultur für ausgedehnte Zeiträume beibehalten werden. Zusammenfassend liefert diese Studie eine Methode, um genau zu liefern Stammzellen innerhalb eines dreidimensionalen Gerüst Biomaterial.
Protokoll
1. Isolieren von aus Fettgewebe gewonnenen Stammzellen (ASC)
Hinweis: Alle Verfahren wurden bei Raumtemperatur durchgeführt, wenn nichts anderes angegeben ist.
- Isolieren Ratte perirenalen und Nebenhoden Fettgewebe und wäscht mit sterilen gepufferten Salzlösung Hanks-Lösung (HBSS) mit 1% fötalem Rinderserum (FBS), wie zuvor 6 beschrieben.
- Hackfleisch und das Gewebe zu übertragen 1-2 g in 25 ml HBSS, enthaltend 1% FBS in einen 50 ml-Röhrchen und zentrifugiert bei 500 g für 8 Minuten bei Raumtemperatur.
- Sammeln der frei schwebenden Fettgewebe Schicht und Übertragung in 125 ml Erlenmeyer-Kolben und Behandlung mit 25 ml Collagenase Typ II (200 U / ml) in HBSS für 45 min bei 37 ° C auf einem Schüttler (125 rpm).
- Entfernen Sie vorsichtig die flüssige Fraktion (unten Öl-und Fett-Schicht) und der Filter nacheinander durch eine 100-um und um 70-Nylon-Mesh-Filter. Zentrifuge das Filtrat bei 500 g für 10 min bei Raumtemperatur, saugen Sie den supernatant und waschen Sie das Pellet zweimal mit 25 ml HBSS.
- Zellpellet in 50 ml Wachstumsmedium (MesenPRO RS Basal Medium) mit MesenPRO RS Growth Supplement, Antibiotika-Antimykotika (100 U / ml Penicillin G, 100 ug / ml Streptomycin-Sulfat, und 0,25 ug / ml Amphotericin B) ergänzt und 2 mM L-Glutamin und Pipette Zellen in 2 T75-Flaschen (25 ml / Flasche).
- Kultur der ASC in einem 5% CO 2 befeuchteten Inkubator bei 37 ° C (Passage 2-4 ASC für alle Experimente verwendet werden).
2. Herstellung von Chitosan Mikrokügelchen (CSM)
Hinweis: Alle Verfahren wurden bei Raumtemperatur durchgeführt, wenn nichts anderes angegeben ist.
- CSM werden von einer Wasser-in-Öl-Emulsion Prozess zusammen mit einem ionischen Koazervation Technik mit unserer vorherigen Protokolls 6 hergestellt. Emulgieren einer wässrigen Lösung von Chitosan (6 ml 3% w / v Chitosan in 0,5 M Essigsäure) in einem 100 ml einer Ölphase bestehend aus SojaÖl, n-Octanol (1:2 v / v) und 5% Sorbitan-Mono-Oleat (Span 80) Emulgator an Overhead (1700 rpm) und magnetischem Rühren (1000 rpm) gleichzeitig in entgegengesetzten Richtungen. Dieser duale Verfahren zum Mischen sorgt dafür, dass Micellen früh vor dem Vernetzen tritt in Lösung bleiben kann und nicht am Boden absetzen. Darüber hinaus der magnetische Rührstab hilft bei de-Aggregation Chitosan während Mizellenbildung und rigidization.
- Die Mischung wird kontinuierlich für ungefähr 1 Stunde, bis eine stabile Wasser-in-Öl-Emulsion erhalten wird gerührt. Ionische Vernetzung wird durch die Zugabe von 1,5 ml von 1% w / v Kaliumhydroxid in n-Octanol alle 15 min für 4 h (24 ml Gesamtvolumen) eingeleitet.
- Nach Beendigung der Vernetzungsreaktion, langsam dekantieren die Ölphase der Mischung, die CSM und sofort die Kugeln 100 ml Aceton. Waschen der Kugeln mit Aceton, bis die Ölphase vollständig entfernt wird.
- Trocknen Sie die wiederhergestellten Sphären in einem Vakuumexsikkator und analYZE ohne weitere Verarbeitung. Die durchschnittliche CSM Partikelgröße, Oberfläche pro Milligramm und die Einheit Kubikmeter Volumen wurde mit Partikelgrößenanalyse.
- Für die folgenden Experimente, waschen Sie CSM dreimal mit sterilem Wasser, um restliche Salze zu entfernen und zu sterilisieren mit absolutem Alkohol.
3. Bestimmen der Anzahl der freien Aminogruppen in CSM
Hinweis: Alle Verfahren wurden bei Raumtemperatur durchgeführt, wenn nichts anderes angegeben ist.
- Bestimmen der Anzahl von freien Aminogruppen in CSM nach ionische Vernetzung unter Verwendung des Trinitro Benzolsulfonsäure (TNBS)-Assay der Bubins und Ofner 7. Inkubiere 5 mg Mikrosphären mit 1 ml 0,5% TNBS-Lösung in einem 50 ml Glasröhrchen für 4 h bei 40 ° C und Hydrolyse unter Zusatz von 3 ml 6 N HCl bei 60 ° C für 2 Stunden.
- Kühlung der Proben auf Raumtemperatur, und Extrahieren der freien TNBS durch Zugabe von 5 ml entionisiertem Wasser und 10 ml EthylacetatÄther.
- Warm eine 5-ml-Aliquot der wässrigen Phase auf 40 ° C in einem Wasserbad für 15 min, um das restliche Ether, auf Raumtemperatur abkühlen, verdampft und verdünnt mit 15 ml Wasser.
- Die Absorption bei 345 nm mit einem Spektrophotometer unter Verwendung TNBS-Lösung ohne Chitosan als leer und die Chitosan zur Herstellung CSM verwendet, um die Gesamtzahl der Aminogruppen zu bestimmen. Schätzen Sie die Anzahl der freien Aminogruppen des CSM in Bezug auf Chitosan.
4. Lädt ASC in CSM
Hinweis: Alle Verfahren wurden bei Raumtemperatur durchgeführt, wenn nichts anderes angegeben ist.
- Äquilibrieren 5 mg sterilisiert CSM aus Abschnitt 2.5 in sterilem HBSS über Nacht, und fügen Sie in ein 8-um Porengröße Membran Kulturplatte Einsatz (24-Well-Platte).
- Nachdem die CSM auf die Membran niedergelassen haben, sorgfältig absaugen HBSS und 300 ul von Wachstumsmedium auf die Innenseite des Einsatzes und 700 ul des Wachstums Medien zu the Außenseite des Einsatzes.
- Resuspendieren ASC in der entsprechenden Konzentration (1 x 10 4 bis 4 x 10 4) in 200 ul Wachstumsmedium und Saatgut über den CSM in der Kulturschale Einsatz. Das Endvolumen des Mediums innerhalb der Kultur Einsatz, nach dem Aussäen von 500 ul.
- Inkubieren Sie die ASC seeded auf CSM für 24 h in einem 5% CO 2 befeuchteten Inkubator bei 37 ° C.
5. Bestimmung des Prozentsatzes ASC Loading und Zelllebensfähigkeit in CSM
Hinweis: Alle Verfahren wurden bei Raumtemperatur durchgeführt, wenn nichts anderes angegeben ist.
- Nach der Inkubation, sammeln die ASC-beladenen CSM in ein steriles 1,5 ml Mikrozentrifugenröhrchen, ohne die Zellen, die in den Einsatz Membran gewandert sind.
- Entfernen Sie die Reste des Mediums und 250 ml frisches Wachstumsmedium in das Röhrchen.
- In jedes Röhrchen hinzufügen 25 ul MTT [3 - (4,5-dimethylthiozole-2-yl) -2,5-diphenyltetrazoliumbromid]Lösung (5 mg / ml) und Inkubation für 4 h in einem 5% CO 2 befeuchteten Inkubator bei 37 ° C
- Nach der Inkubation des Mediums zu entfernen, mit 250 ul Dimethylsulfoxid und Wirbel der Mischung für 2-5 min, um die Formazan-Komplex aufzulösen.
- Zentrifugieren Sie die CSM bei 2700 x g für 5 min, und bestimmen Sie den Überstand Absorption bei 570 nm mit 630 nm als Referenz gemessen.
- Bestimmen Sie die Zellzahl mit dem CSM gegenüber dem Extinktionswert von bekannten Anzahl lebensfähiger ASC erhalten assoziiert.
6. Charakterisierung von ASC-CSM-Embedded Kollagen-Gel
Hinweis: Alle Verfahren wurden bei Raumtemperatur durchgeführt, wenn nichts anderes angegeben ist.
- ASC-Mix geladene CSM (5 mg enthält ≈ 2 x 10 4 Zellen) mit Typ 1-Kollagen (7,5 mg / ml) aus Rattenschwanzsehnen nach der Methode der Bornstein 8 und fibrillieren extrahiert nach Einstellen des pH auf 6,8 mit 2 N NaOH.
- In der fibrillierten Kollagen-ASC-CSM Mischung auf eine 12-Well-Platte und Inkubation für 30 min bei einer 5% CO 2 befeuchteten Inkubator bei 37 ° C
- Nach der vollständigen Kammerflimmern, bebrüten die Kollagen-ASC-CSM-Gele für bis zu 14 Tage in einem 5% CO 2 befeuchteten Inkubator bei 37 ° C.
- Veröffentlichung und Migration von Zellen von CSM in das Gel wurden mittels Standard-Mikroskopie-Techniken.
7. Repräsentative Ergebnisse
In der vorliegenden Studie haben wir ein in vitro-Strategie zur Stammzellen aus Chitosan-Mikrokügelchen (CSM) in ein Kollagengel Gerüst liefern entwickelt. Poröse CSM von einheitlicher Größe (175-225 um Durchmesser) und Zusammensetzung wurden hergestellt und wie Zellträger (2) verwendet. Nach Inkubation mit dem ASC CSM, die Zellen bei einer Konzentration von 2 x 10 4 cells/5mg der CSM befestigt. Die Zellen waren in der Lage sich über den Mikrokügelchen, während sich Filopodienin die Spalten der porösen Mikrokügelchen (3). Sobald die Zelle beladenen CSM mit dem Kollagen-Gel gemischt wurden, begann die Zellen sofort wandern in den Gelen (Abbildung 4).
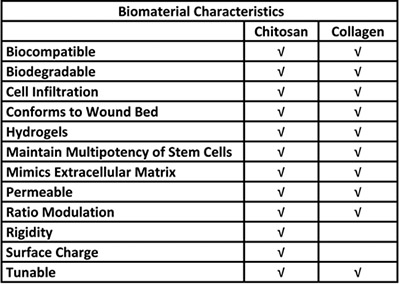
Tabelle 1. Biologische Vorteile für die Verwendung von Chitosan und Kollagen in einer Stammzelle Abgabesystem.
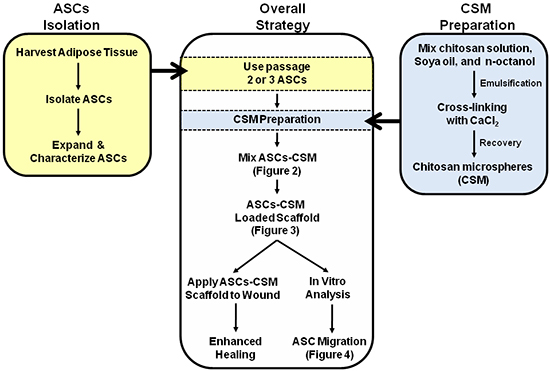
Abbildung 1. Schematische Darstellung der Gesamtstrategie für die zweifache Nutzung von ASC-CSM geladenen Kollagenträger. Abbildungen 2, 3 und 4 sind mit Anmerkungen in der schematischen um bei der Interpretation der Bilder zu unterstützen.
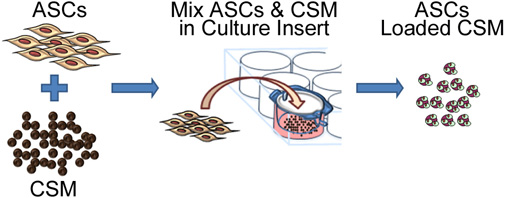
Abbildung 2. Schematische Darstellung, den Prozess der Aussaat Stammzellen auf Chitosan-Mikrokügelchen. Das procESS beinhaltet Co-Kultivierung mit ASC CSM in einem 8 - um Porengröße Membran Kulturplatte Einsatz. Nach 24 Stunden werden die Mikrokügelchen aus dem Einsatz entfernt und sind für die Einbettung in eine Matrix Biomaterial.
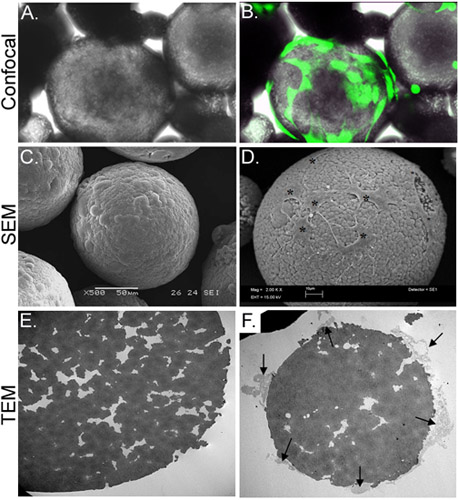
Abbildung 3. Morphologische Charakterisierung von CSM mit ASC-geladen. Panel A zeigt eine lichtmikroskopische Aufnahme von ASC-beladenen CSM, während Panel B zeigt die gleichen Sichtfeld mit einem Bild durch konfokale Fluoreszenzmikroskopie erhalten überlagert. ASC wurden mit Calcein AM (grün) vorinstalliert. Tafel C zeigt ein Bild eines SEM-Bildes eines unbelasteten Mikrokügelchen, während Tafel D zeigt Zellen auf die Mikrokügelchen (Sternchen) geladen. TEM-Bild Tafel E zeigt einen Querschnitt eines unbelasteten Mikrokügelchen. Eine Vielzahl von Poren und Risse werden in der Mikrokügelchen angeordnet. Tafel F zeigt eine Querschnitt Mikrokügelchen mit Zellen (Pfeile) befestigt ist und sich in die cre FilopodienLaster. Original-Vergrößerungen: A & B = 70X, C = 500x, D = 2.000 x; E & F = 2.500 x.

Abbildung 4. Migration der ASC von der CSM in den dreidimensionalen Kollagen-Gerüst. Felder A und B zeigen die CSM mit Zellen Migration von Mikrokügelchen und in die Kollagenmatrix am Tag 3 (A, Pfeile). Tafel B zeigt eine ähnliche Kultur nach 12 Tagen. Transmissionselektronenmikroskopie (TEM) in C-, D und E. Sternchen in C und D dargestellt zeigen eine Mikrokugel, die bereits im Querschnitt hat mit Zellen Migration vom Mikrokugel (Pfeile). Höhere Vergrößerung Panel D wird im Panel E dargestellt und zeigt Zelle Filopodien an den Kollagenfibrillen (kleines Bild). Original-Vergrößerung: A & B = 100x; C & D = 6.000 x; E = 20.000 x, x Einsatz = 150.000.
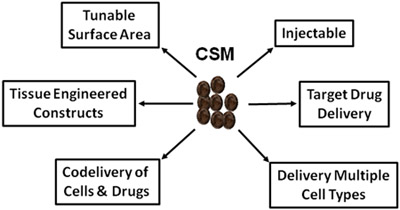
Abbildung 5.Schematische Darstellung der überwiegende Verwendung von CSM in der regenerativen Medizin und Drug Delivery.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Eine große Hürde in der Stammzell-basierten Therapie ist die Entwicklung effizienter Methoden für die Lieferung von Zellen zu den angegebenen Regionen zur Reparatur. Aufgrund der Patient zu Patient Variabilität, die Gewebe-Typ, Größe und Tiefe Verletzungen, muss die Methodik der Bereitstellung von Stammzellen auf einer Fall-zu-Fall-Basis bestimmt werden. Obwohl die Einbettung Stammzellen in einer Matrix und liefert sie an der Wundstelle scheint ein nächster logischer Ansatz für das Tissue Engineering werden, ble...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine konkurrierenden finanziellen Interessen bestehen.
Lizenzbestimmungen
Die Meinungen oder Aussagen in diesem Dokument sind die privaten Ansichten der Autoren und sind nicht als offizielle oder die Sichtweise des Department of Defense oder die US-Regierung ausgelegt werden. Die Autoren sind Mitarbeiter der US-Regierung, und diese Arbeit wurde im Rahmen ihrer dienstlichen Aufgaben vorbereitet. Alle Arbeiten wurden von der US Army Medical Research und Materiel Command unterstützt. Diese Studie wurde im Rahmen eines Protokolls überprüft und von der US Army Medical Research und Materiel Command Institutional Review Board, und in Übereinstimmung mit dem genehmigten Protokoll genehmigt durchgeführt.
Danksagungen
DOZ wird durch einen Zuschuss aus der Genfer Stiftung unterstützt. SN wurde von einem Postdoctoral Fellowship Grant von der Pittsburgh Tissue Engineering Initiative unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz / Ausrüstung | Firma | Katalog-Nummer | Kommentare |
| Hanks BalancedSalt Lösung (HBSS) | Gibco | 14175 | Verbrauchsmaterial |
| Fötalem Rinderserum | Hyclone | SH30071.03 | Verbrauchsmaterial |
| Kollagenase vom Typ II | Sigma-Aldrich | C6685 | Verbrauchsmaterial |
| 70-um Nylonmaschenfilter | BD Biosciences | 352350 | Verbrauchsmaterial |
| 100-um Nylonmaschenfilter | BD Biosciences | 352360 | Verbrauchsmaterial |
| MesenPRO Growth Medium-System | Invitrogen | 12746-012 | Verbrauchsmaterial |
| L-Glutamin | Gibco | 25030 | Verbrauchsmaterial |
| T75 Zellkulturflasche | BD Biosciences | 137787 | Verbrauchsmaterial |
| Chitosan | Sigma-Aldrich | 448869 | Verbrauchsmaterial |
| Essigsäure | Sigma-Aldrich | 320099 | Verbrauchsmaterial |
| N-Octanol | Acros Organics | 150630025 | Verbrauchsmaterial |
| Sorbitan-Mono-Oleat | Sigma-Aldrich | S6760 | Verbrauchsmaterial |
| Kaliumhydroxid | Sigma-Aldrich | P1767 | Verbrauchsmaterial |
| Aceton | Fisher Scientific | L-4859 | Verbrauchsmaterial |
| Ethanol | Sigma-Aldrich | 270741 | Verbrauchsmaterial |
| Trinitro Benzolsulfonsäure | Sigma-Aldrich | P2297 | Verbrauchsmaterial |
| Salzsäure | Sigma-Aldrich | 320331 | Verbrauchsmaterial |
| Ethyl Ether | Sigma-Aldrich | 472-484 | Verbrauchsmaterial |
| 8-um Gewebekulturplatte Einsätze | BD Biosciences | 353097 | Verbrauchsmaterial |
| 1,5-ml Reaktionsgefäße | Fischer | 05-408-129 | Verbrauchsmaterial |
| MTT-Reagenz | Invitrogen | M6494 | Verbrauchsmaterial |
| Dimethylsulfoxid | Sigma-Aldrich | D8779 | Verbrauchsmaterial |
| Qtracker Zelle Labeling Kit (Q-Tracker 655) | Molecular Probes | Q2502PMP | Verbrauchsmaterial |
| Typ 1-Kollagen | Travigen | 3447-020-01 | Verbrauchsmaterial |
| Natriumhydroxid | Sigma-Aldrich | S8045 | Verbrauchsmaterial |
| 12-well-Zellkulturplatten | BD Biosciences | 353043 | Verbrauchsmaterial |
| Zentrifugieren | Eppendorf | 5417R | Ausrüstung |
| Orbitalschüttler | New Brunswick einem wissenschaftlichen | C24 | Ausrüstung |
| Befeuchteten Inkubator mit Air-5% CO 2 | Thermo Scientific | Modell 370 | Ausrüstung |
| Kopfrührer | IKA | Visc6000 | Ausrüstung |
| Magnetrührer | Corning | PC-210 | Ausrüstung |
| Vakuumexsikkator | - | - | Ausrüstung |
| Particle Size Analyzer | Malvern | STP2000 Spraytec | Ausrüstung |
| Wasserbad | Fisher Scientific | Isotemp210 | Ausrüstung |
| Spektrophotometer | Beckman | Beckman Coulter DU800UV/Visible Spektralphotometer | Ausrüstung |
| Wirbel | Diagger | 3030A | Ausrüstung |
| Mikroplatten-Reader | Molecular Devices | SpectraMax M2 | Ausrüstung |
| Licht / Fluoreszenz-Mikroskop | Olymp | IX71 | Ausrüstung |
| Konfokalmikroskop | Olymp | FV-500 Laser-konfokalen | Ausrüstung |
| Rasterelektronenmikroskop | Carl Zeiss MicroImaging | Leo 435 VP | Ausrüstung |
| Transmissions-Elektronenmikroskop | JEOL | JEOL 1230 | Ausrüstung |
Referenzen
- Krampera, M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair. Bone. 39, 678-683 (2006).
- Patrick, C. W. Tissue engineering strategies for adipose tissue repair. Anat. Rec. 263, 361-366 (2001).
- Pountos, I., Giannoudis, P. V. Biology of mesenchymal stem cells. Injury. 36, Suppl 3. S8-S12 (2005).
- Kim, I. Y. Chitosan and its derivatives for tissue engineering applications. Biotechnol. Adv. 26, 1-21 (2008).
- Shi, C. Therapeutic potential of chitosan and its derivatives in regenerative medicine. J. Surg. Res. 133, 185-192 (2006).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part. A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, C. M. 3rd The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J. Biomed. Mater. Res. A. 81, 259-268 (2007).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Shanmuganathan, S. Preparation and characterization of chitosan microspheres for doxycycline delivery. Carbohydr. Polym. 73, 201-211 (2008).
- Haque, T., Chen, H., Ouyang, W., Martoni, C., Lawuyi, B., Urbanska, A., Prakash, S. Investigation of a new microcapsule membrane combining alginate, chitosan, polyethylene glycol and poly-L-lysine for cell transplantation applications. Int. J. Artif. Organs. 28, 631-637 (2005).
- Goren, A., Dahan, N., Goren, E., Baruch, L., Machluf, M. Encapsulated human mesenchymal stem cells: a unique hypoimmunogenic platform for long-term cellular therapy. FASEB J. 24, 22-31 (2010).
- Zielinski, B. A., Aebischer, P. Chitosan as a matrix for mammalian cell encapsulation. Biomaterials. 15, 1049-1056 (1994).
- Girandon, L., Kregar-Velikonja, N., Božikov, K., Barliç, A. In vitro Models for Adipose Tissue Engineering with Adipose-Derived Stem Cells Using Different Scaffolds of Natural Origin. Folia Biol. (Praha). 57, 47-56 (2011).
- Baruch, L., Machluf, M. Alginate-chitosan complex coacervation for cell encapsulation: effect on mechanical properties and on long-term viability. Biopolymers. 82, 570-579 (2006).
- Wei, Y., Gong, K., Zheng, Z., Wang, A., Ao, Q., Gong, Y., Zhang, X. Chitosan/silk fibroin-based tissue-engineered graft seeded with adipose-derived stem cells enhances nerve regeneration in a rat model. J. Mater. Sci. Mater. Med. , (2011).
- Wang, Q., Jamal, S., Detamore, M. S., Berkland, C. PLGA-chitosan/PLGA-alginate nanoparticle blends as biodegradable colloidal gels for seeding human umbilical cord mesenchymal stem cells. J. Biomed. Mater. Res. A. 96, 520-527 (2011).
- Alves da Silva, M. L., Martins, A., Costa-Pinto, A. R., Correlo, V. M., Sol, P., Bhattacharya, M., Faria, S., Reis, R. L., Neves, N. M. Chondrogenic differentiation of human bone marrow mesenchymal stem cells in chitosan-based scaffolds using a flow-perfusion bioreactor. J. Tissue Eng. Regen. Med. , (2010).
- Kang, Y. M., Lee, B. N., Ko, J. H., Kim, G. H., Kang, K. N., Kim da, Y., Kim, J. H., Park, Y. H., Chun, H. J., Kim, C. H., Kim, M. S. In vivo biocompatibility study of electrospun chitosan microfiber for tissue engineering. Int. J. Mol. Sci. 11, 4140-4148 (2010).
- Bozkurt, G., Mothe, A. J., Zahir, T., Kim, H., Shoichet, M. S., Tator, C. H. Chitosan channels containing spinal cord-derived stem/progenitor cells for repair of subacute spinal cord injury in the rat. Neurosurgery. 67, 1733-1744 (2010).
- Leipzig, N. D., Wylie, R. G., Kim, H., Shoichet, M. S. Differentiation of neural stem cells in three-dimensional growth factor-immobilized chitosan hydrogel scaffolds. Biomaterials. 32, 57-64 (2011).
- Altman, A. M., Gupta, V., RÃos, C. N., Alt, E. U., Mathur, A. B. Adhesion, migration and mechanics of human adipose-tissue-derived stem cells on silk fibroin-chitosan matrix. Acta Biomater. 6, 1388-1397 (2010).
- Altman, A. M., Yan, Y., Matthias, N., Bai, X., Rios, C., Mathur, A. B., Song, Y. H., Alt, E. U. IFATS collection: Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model. Stem Cells. 27, 250-258 (2009).
- Machado, C. B., Ventura, J. M., Lemos, A. F., Ferreira, J. M., Leite, M. F., Goes, A. M. 3D chitosan-gelatin-chondroitin porous scaffold improves osteogenic differentiation of mesenchymal stem cells. Biomed. Mater. 2, 124-131 (2007).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten