JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
줄기 세포 - 로드된 키토산 Microspheres의 배달을 위해 콜라겐 히드로겔을 구축
요약
현재 줄기 세포 치료에서 주요 장애물은 호스트 조직으로 이들 세포를 전달하는 가장 효과적인 방법을 결정합니다. 지방 파생 줄기 세포들이 multipotency을 유지할 수 있도록하면서 여기에서, 우리는 효과적이고 접근 간단 키토산 기반의 전달 방법을 설명합니다.
초록
Multipotent 줄기 세포는 재생 의료 1-3 분야에서 매우 유용한 것으로 표시되었습니다. 그러나, 조직 재생을 위해 효과적으로 이들 세포를 사용하기 위해서는 변수의 수를 고려되어야한다. 이러한 변수는 다음과 같습니다 : 총 볼륨 및 주입 사이트의 표면적, 조직의 기계적 성질과 vascularization의 금액 및 세포외 기질의 구성 요소를 포함하는 조직 microenvironment를. 호스트 조직을 모방한 것이었 기계적 강도를 유지하면서 따라서 이러한 세포를 전달하기 위해 사용되는 자료는 정의된 화학 성분과 biocompatible이어야합니다. 이 자료는 또한 산소와 영양소를 세포 부착 및 분아 따위에 의해 번식하는 데 유리한 microenvironment를 제공하기 위해 대한 투과이어야합니다. 키토산, 우수한 biocompatibility과 양이온 다당류, 쉽게 화학적으로 바뀌었 및 생체내 맥에서 함께 바인딩 높은 친화력을 가지고 있습니다romolecules 4-5. 키토산은 세포 접착, 마이 그 레이션 및 확산을위한 기판으로 작동할 수 있도록, 세포외 기질의 glycosaminoglycan 부분을 모방한 것이었 지요. 본 연구에서는 입체 비계 6 기반의 콜라겐으로 지방 파생 줄기 세포 (ASC)를 제공하는 microspheres의 형태로 키토산을 활용. 이상적인 휴대 microsphere 비율은 배양 시간 및 로드할 수있는 세포의 최대 개수를 달성하기위한 세포 밀도에 대하여 산출된 것입니다. ASC는 키토산 microspheres (CSM)에 놓는되면, 그들은 콜라겐 발판에 포함된 및 확장 기간 동안 문화를 유지하실 수 있습니다. 요약이 연구는 정확하게 입체 biomaterial 발판 내에서 줄기 세포를 제공하는 방법을 제공합니다.
프로토콜
1. 격리 지방 파생 줄기 세포 (ASC)
주의 : 별도로 명시하지 않는 한 모든 절차를 상온에서 수행되었다.
- 쥐 perirenal 및 epididymal 지방을 분리하고 이전 6 설명된대로 1퍼센트 태아 소 혈청 (FBS)을 포함하는 무균 행크의 버퍼 소금 용액 (HBSS)으로 씻는다.
- 조직을 말하다하고 실온에서 8 분 500g에서 50 ML 튜브 및 원심 분리기로 1퍼센트 FBS가 포함된 HBSS의 25 ML에 1-2그램을 전송.
- 자유 부동 지방 조직 계층과 125 ML erlenmeyer 플라스크에 송금을 모아서 37시 45 분 대한 HBSS에서 collagenase 2 형 (200 U / ML)의 25 ML과 치료 ° 궤도 흔드는 (125 RPM)에서 C #.
- 조심스럽게 액체 분획을 (오일과 지방 레이어 아래)을 제거하고 100 μm의 및 70 μm의 나일론 메쉬 필터를 통해 순차적으로 필터링합니다. 상온에서 10 분 동안 500g에 여과물을 원심 분리기, supernatan을 기음t 및 25 ML의 HBSS로 두 번 펠릿 씻는다.
- MesenPRO RS 형성제 (100 U / 페니실린 G, 100 μg / ML의 스트렙토 마이신 황산과 0.25 μg / ML Amphotericin B의 ML) 항생제 - antimycotic으로 보충 성장 매체 (MesenPRO RS 자연적으로 흐르는 것과, 반사적으로 흐르는 중간)의 50 ML에 세포 펠렛을 Resuspend , 2 T75 flasks (25 ML / 플라스크)에 2 밀리미터 L-글루타민과 pipet 세포.
- 문화 37 ° C (ASC가 모든 실험에 사용되는 항로 2-4)에서 5 % CO 2 humidified 인큐베이터에서 ASC.
2. 키토산 Microspheres (CSM)을 준비
주의 : 별도로 명시하지 않는 한 모든 절차를 상온에서 수행되었다.
- CSM은 우리의 이전 프로토콜 6을 사용 이온 coacervation 기법과 함께 워터 인 오일 유화 과정에서 준비가되어 있습니다. 콩으로 구성된 오일 위상 혼합물의 100 ML에 키토산의 수용액 (0.5 M 아세트산의 산성에서 3퍼센트 W / V 키토산 6 ML)를 유상으로 만들다석유, N-octanol (1시 2분 V / V) 5 % 솔비 탄 모노-oleate (폭 80) 유화제, 반대 방향으로, 오버헤드 (1700 RPM)과 동시에 자성 저어 (1000 RPM)를 사용. 초기 가교가 발생하기 전에에서 형성 micelles이 용액에 남아하고 아래로 정착 수없는 혼합 보장이 이중 방식입니다. 또한,의 자석 볶음 바 AIDS 마이셀 형성 및 rigidization 동안 키토산을 취소 수렴.
- 혼합물은 지속적으로 안정적인 물 인 석유 유제를 얻을 때까지 약 1 시간 동안 흔들 수 있습니다. 이오니아 crosslinking은 4 H (24 ML 합계)에 대한 N-octanol 매 15 분 안에 1퍼센트 W / V 수산화 칼륨 1.5 ML의 추가와 함께 시작됩니다.
- crosslinking 반응 완료 후, 천천히 혼합물이 포함된 CSM의 석유 단계를 가만히 따르다 즉시 아세톤 100 ML에 분야를 추가합니다. 오일 위상이 완전히 제거될 때까지 아세톤과 분야 씻으십시오.
- 진공 건조기와 항문에서 복구된 분야 말리추가 처리없이 yze. 평균 CSM 입자 크기, 밀리그램 당 면적과 단위 입방 볼륨이 입자 크기 분석기를 사용하여 결정되었다.
- 후속 실험의 경우 잔류 염분을 제거하고 절대 알코올로 소독하는 살균 물로 CSM 세 번 씻는다.
3. CSM에서의 자유 아미노 그룹의 개수를 결정
주의 : 별도로 명시하지 않는 한 모든 절차를 상온에서 수행되었다.
- Bubins 및 Ofner 7 trinitro benzenesulfonic (TNBS) 산성 분석을 사용하여 이온 crosslinking 후 CSM에있는 무료 아미노 그룹의 개수를 결정합니다. 40 ° C 4 H에 대한 50 ML 유리관의 0.5 % TNBS 용액 1 ML과 microspheres의 5 밀리그램을 부화하고 2 시간 동안 60 ° C에서 6N HCL 3 ML의 추가와 함께 hydrolyze.
- 실내 온도에 샘플을 냉각하고, 탈이온수 5 ML과 에틸 10 ML을 추가하여 무료 TNBS를 추출에테르.
- ° C 물 목욕 15 분 실온에 시원한 잔여 마취제, 증발 및 물 15 ML로 희석하기 위해 40 수성 단계의 5 ML의 나누어지는을 따뜻하게.
- 빈과 키토산은 아미노 그룹의 총 수를 결정하기 위해 CSM 준비에 사용으로 키토산없이 TNBS 솔루션을 사용하여 분광 광도계로 345 nm의 흡광도에서 측정. 키토산에 상대적인 CSM 무료 아미노 그룹의 수를 예상됩니다.
4. CSM의 로딩 ASC
주의 : 별도로 명시하지 않는 한 모든 절차를 상온에서 수행되었다.
- 하룻밤 무균 HBSS의 섹션 2.5에서 소독 CSM의 5 밀리그램을 평형과 8 μm의 기공 크기의 멤브레인 문화 플레이트 인서트 (24 - 웰 플레이트)에 추가합니다.
- CSM은 멤브레인에 정착한 후, 조심스럽게 HBSS를 기음과 세기에 성장 미디어 삽입 700 μL의 내부에 성장 배지 300 μL를 추가할삽입 이외의 전자.
- 문화 플레이트 인서트 내부 CSM 이상 성장 매체와 종자 200 μL의 적절한 농도에서 Resuspend ASC (1 X 10월 4일에서 4일까지 × 10 4). 문화 삽입 내에서 매체의 최종 부피는 시딩 후, 500 μL입니다.
- 37시 5 % CO 2 humidified 배양기에서 24 H 위해 CSM에 대한 ASC 씨앗을 품어 ° C.
5. CSM에 ASC로드 및 세포 생존 능력의 비율을 결정
주의 : 별도로 명시하지 않는 한 모든 절차를 상온에서 수행되었다.
- 부화 후 삽입 막으로 마이그레이션한 세포를 방해하지 않고 멸균 1.5 ML의 microcentrifuge 튜브의 ASC-로드된 CSM를 수집합니다.
- 잔여 매체를 제거하고 튜브에 신선한 성장 매체 250 μL를 추가합니다.
- 각각의 튜브는 25 μL MTT에게 [3 - (4,5-dimethylthiozole-2-yl) -2,5-diphenyltetrazolium의 브로마이드] 추가하려면용액 (5 밀리그램 / ML) 37시 5 % CO 2 humidified 인큐베이터에서 4 H 동안 품어 ° C.
- 부화 후, 매체를 제거 디메틸 sulfoxide 250 μL를 추가하고 formazan 복잡한 solubilize 위해 2-5 분 와동 혼합.
- 5 분 동안 2,700 X g에서 CSM을 원심 분리기, 그리고 참고로 630 nm의를 사용하여 570 nm의에서 측정 뜨는 흡광도를 결정한다.
- 가능한 ASC의 알려진 숫자에서 얻은 흡광도 값에 상대적 CSM과 관련된 휴대폰 번호를 확인합니다.
6. ASC-CSM-임베디드 콜라겐 젤 특성화
주의 : 별도로 명시하지 않는 한 모든 절차를 상온에서 수행되었다.
- 2 N NaOH를 사용하여 6.8로 산도를 조정 후 Bornstein 8 fibrillate의 방법에 따라 쥐의 꼬리 힘줄에서 추출한 제 1 형 콜라겐 (7.5 밀리그램 / ML)와 믹스 ASC-로드된 CSM (5 MG는 ≈ 2 X 10 4 세포를 포함).
- 12 잘 판에 fibrillated 콜라겐-ASC-CSM 혼합물을 추가하고 37에서 5 % CO 2 humidified 배양기에서 30 분 동안 품어 ° C.
- 전체 세동 후, 37 ° C.에 최대 5 % CO 2 humidified 인큐베이터에 14 일 동안 콜라겐-ASC-CSM의 젤을 품어
- 겔에 CSM에서 세포의 출시 및 마이 그 레이션은 표준 현미경 기술을 이용하여 관찰되었다.
7. 대표 결과
현재 연구에서 우리는 콜라겐 젤 발판으로 키토산 microspheres (CSM)에서 줄기 세포를 전달에서 체외 전략을 개발했습니다. 균일한 크기 (직경 175-225 μm의)와 구성 다공성 CSM은 휴대 캐리어 (그림 2)로 준비하고 사용되었습니다. CSM으로 ASC를 잠복기되면 세포는 CSM 2 X 10 4 cells/5mg의 농도에 첨부. filopodia을 확장하는 동안 세포가 microsphere를 통해 확산이 가능했다microsphere의 다공성 틈새 (그림 3)에. 휴대 로드된 CSM은 콜라겐 젤과 혼합되었다되면, 세포는 즉시 젤류 (그림 4)로 이주하기 시작했다.
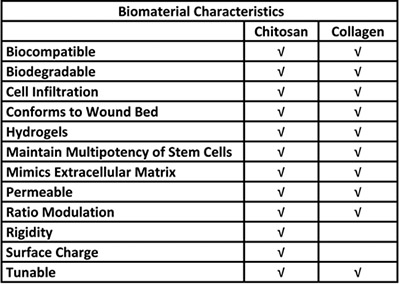
표 1. 줄기 세포 전달 시스템의 키토산과 콜라겐의 사용에 대한 생물 학적 장점.
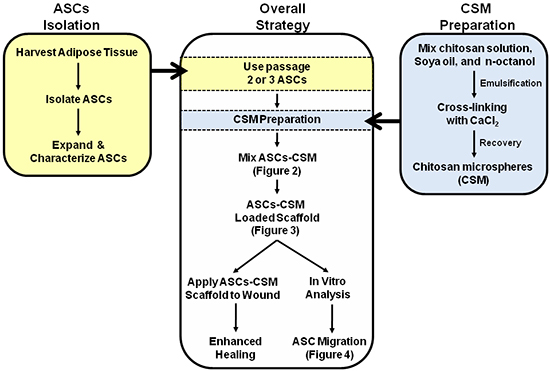
그림 1. 도식은 ASC-CSM 로드된의 콜라겐 공사장 공중 발판의 이중 사용을위한 전반적인 전략을 묘사. 그림 2, 3 및 4는 이미지의 해석에 도움을 도식 내에 주석이 있습니다.
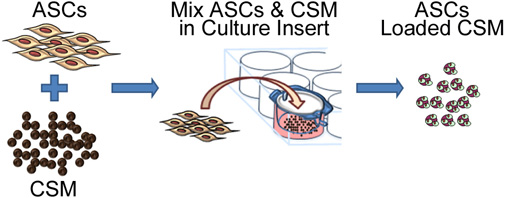
그림 2. 도식 표현은 키토산 microspheres에 줄기 세포를 퍼뜨리고하는 과정을 묘사. PROCμm의 기공 크기의 멤브레인 문화 플레이트 인서트 - ESS는 8 CSM과 함께 공동 culturing ASC 관련이 있습니다. 24 시간 이내에, microspheres는 삽입에서 제거 및 biomaterial 행렬에 포함되어있는 준비가됩니다.
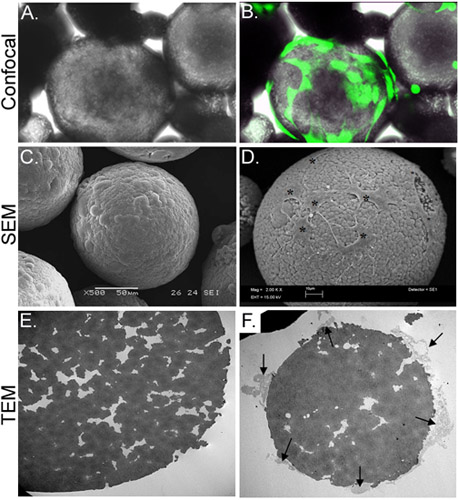
그림 3. ASC와 CSM-로드의 형태학의 특성. 패널 B는 공촛점 형광 현미경으로 얻은 이미지로 겹쳐보기의 같은 필드를 표시하는 동안 패널, ASC-로드된의 CSM의 가벼운 현미경을 묘사. ASC는 calcein AM (녹색)가 미리로드되었습니다. 패널 D는 microsphere (별표)에 싣게되는 세포를 보여주면서 패널 C는, 신이 microsphere의 SEM 이미지의 이미지를 묘사. 패널 전자의 TEM 이미지는 신이 microsphere의 단면을 보여줍니다. 모공과 틈새의 무리가 microsphere에 걸쳐 위치하고 있습니다. 패널 F는 세포와 교차 sectioned microsphere (화살표)를 첨부하고 cre로 filopodia을 확장 보여줍니다나쁜. 원래 배율 : & B = 70X; C = 500x, D = 2,000 X, E & F = 2,500 X.

그림 4. 입체 콜라겐 발판으로 CSM에서 ASC의 마이 그 레이션. 패널은 A와 B는 세포가 떨어져 microsphere의 이주와 함께 일 3 콜라겐 매트릭스 (, 화살표)으로 CSM을 묘사. 패널 B는 12 일 후에 유사한 문화를 보여줍니다. 전송 전자 현미경은 (TEM) 이미지가 C, D, 및 C와 D에서 E가 별표에 묘사된하고는 세포가 microsphere (화살표)에서 떨어져 마이 그 레이션과 함께 교차 sectioned되었습니다 microsphere를 보여줍니다. 패널 D의 높은 배율은 패널 전자에 묘사된, 그리고 콜라겐 원섬유 (삽입된 페이지)에 부착된 세포 filopodia를 보여줍니다. 원래 배율 : & B = 100x, C & D = 6,000 X; E = 20,000 X, 삽입된 페이지 = 150,000 X.
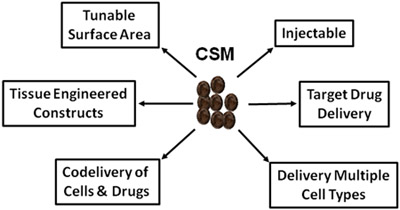
그림 5.도식은 재생 의료 및 약물 전달에 CSM의 광대한 사용을 묘사.
Access restricted. Please log in or start a trial to view this content.
토론
줄기 세포 기반 요법의 주요 장애물은 수리를 위해 지정된 지역에 세포의 전달을위한 효율적인 방법을 개발하고있다. 환자의 다양성에 대한 환자로 인해 조직 유형, 부상 크기와 깊이, 전달하는 줄기 세포의 방법론은 사례별로 결정되어야합니다. 매트릭스 내에서 줄기 세포를 내장하고 상처 사이트에 배달하는 것은 조직 공학을위한 다음 논리적인 접근 방식 것으로 보이지만 몇 가지 기술적인 ?...
Access restricted. Please log in or start a trial to view this content.
공개
어떤 경쟁하는 금융 이익은 존재하지.
유의 사항
여기에 포함된 의견이나 주장은 저자의 개인 의견이며 공식이나 국방 또는 미국 정부 부서의 의견을 반영 해석할 수 없습니다. 저자는 미국 정부의 직원이며,이 작품들은 공무의 일환으로 준비되었다. 모든 작품은 미국 육군 의학 연구 및 Materiel 명령에 의해 지원되었다. 이 연구는 미국 육군 의학 연구 및 Materiel 명령 기관 검토위원회 및 승인 절차에 따라의 검토 및 승인 절차하에 실시되었다.
감사의 말
DOZ는 제네바 재단에서 수여 교부금에 의해 지원됩니다. SN은 피츠버그 조직 공학 이니셔티브에서 박사 과정 이수 화목 그랜트에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 시약 / 장비의 명칭 | 회사 | 카탈로그 번호 | 댓글 |
| 행크스 BalancedSalt 솔루션 (HBSS) | Gibco | 14,175 | 소모품 |
| 태아 소 혈청 | Hyclone | SH30071.03 | 소모품 |
| Collagenase 타입 II | 시그마 - 올드 리치 | C6685 | 소모품 |
| 70 μm의 나일론 메쉬 필터 | BD Biosciences | 352,350 | 소모품 |
| 100 μm의 나일론 메쉬 필터 | BD Biosciences | 352,360 | 소모품 |
| MesenPRO 성장 매체 시스템 | Invitrogen | 12746-012 | 소모품 |
| L-글루타민 | Gibco | 25,030 | 소모품 |
| T75 조직 배양 플라스크 | BD Biosciences | 137,787 | 소모품 |
| 키토산 | 시그마 - 올드 리치 | 448,869 | 소모품 |
| 초산 | 시그마 - 올드 리치 | 320,099 | 소모품 |
| N-Octanol | Acros의 생명체 | 150,630,025 | 소모품 |
| 솔비 - 모노-oleate | 시그마 - 올드 리치 | S6760 | 소모품 |
| 수산화 칼륨 | 시그마 - 올드 리치 | P1767 | 소모품 |
| 아세톤 | 피셔 과학 | L-4859 | 소모품 |
| 에탄올 | 시그마 - 올드 리치 | 270,741 | 소모품 |
| Trinitro Benzenesulfonic 산성 | 시그마 - 올드 리치 | P2297 | 소모품 |
| 염산 | 시그마 - 올드 리치 | 320,331 | 소모품 |
| 에틸 에테르 | 시그마 - 올드 리치 | 472-484 | 소모품 |
| 8 μm의 조직 문화 플레이트 삽입물 | BD Biosciences | 353,097 | 소모품 |
| 1.5 ML의 Microcentrifuge 튜브 | 어부 | 05-408-129 | 소모품 |
| MTT 시약 | Invitrogen | M6494 | 소모품 |
| 디메틸 Sulfoxide | 시그마 - 올드 리치 | D8779 | 소모품 |
| Qtracker 셀 라벨 키트 (Q 추적기 655) | 분자 프로브 | Q2502PMP | 소모품 |
| 한 콜라겐을 입력 | Travigen | 3447-020-01 | 소모품 |
| 수산화 나트륨 | 시그마 - 올드 리치 | S8045 | 소모품 |
| 12 음 조직 배양 플레이트 | BD Biosciences | 353,043 | 소모품 |
| 원심 분리기 | Eppendorf | 5417R | 장비 |
| 궤도 흔드는 | 뉴 브 런 즈윅 Scienctific | C24 | 장비 |
| 에어 5 % CO 2와 Humidified 인큐베이터 | 써모 과학 | 모델 370 | 장비 |
| 오버헤드 활동가 | 이카 | Visc6000 | 장비 |
| 마그네틱 활동가 | 코닝 | PC-210 | 장비 |
| 진공 건조기 | - | - | 장비 |
| 입자 크기 분석기 | Malvern | STP2000 Spraytec | 장비 |
| 열탕 목욕 | 피셔 과학 | Isotemp210 | 장비 |
| 분광 | Beckman | Beckman 보습 바로 앞에 달린 풀베는 날 DU800UV/Visible 분광 | 장비 |
| 와동 | Diagger | 3030a | 장비 |
| Microplate Reader를 | 분자 장치 | SpectraMax M2 | 장비 |
| 형광 / 라이트 현미경 | 올림포스 산 | IX71 | 장비 |
| 공촛점 현미경 | 올림포스 산 | 공촛점 현미경 스캐닝 FV-500 레이저 | 장비 |
| 전자 현미경 검사 | 칼 자이스 혈구 마이크roImaging | 레오 435 부사장 | 장비 |
| 전송 전자 현미경 | JEOL | JEOL 1230 | 장비 |
참고문헌
- Krampera, M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair. Bone. 39, 678-683 (2006).
- Patrick, C. W. Tissue engineering strategies for adipose tissue repair. Anat. Rec. 263, 361-366 (2001).
- Pountos, I., Giannoudis, P. V. Biology of mesenchymal stem cells. Injury. 36, Suppl 3. S8-S12 (2005).
- Kim, I. Y. Chitosan and its derivatives for tissue engineering applications. Biotechnol. Adv. 26, 1-21 (2008).
- Shi, C. Therapeutic potential of chitosan and its derivatives in regenerative medicine. J. Surg. Res. 133, 185-192 (2006).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part. A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, C. M. 3rd The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J. Biomed. Mater. Res. A. 81, 259-268 (2007).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Shanmuganathan, S. Preparation and characterization of chitosan microspheres for doxycycline delivery. Carbohydr. Polym. 73, 201-211 (2008).
- Haque, T., Chen, H., Ouyang, W., Martoni, C., Lawuyi, B., Urbanska, A., Prakash, S. Investigation of a new microcapsule membrane combining alginate, chitosan, polyethylene glycol and poly-L-lysine for cell transplantation applications. Int. J. Artif. Organs. 28, 631-637 (2005).
- Goren, A., Dahan, N., Goren, E., Baruch, L., Machluf, M. Encapsulated human mesenchymal stem cells: a unique hypoimmunogenic platform for long-term cellular therapy. FASEB J. 24, 22-31 (2010).
- Zielinski, B. A., Aebischer, P. Chitosan as a matrix for mammalian cell encapsulation. Biomaterials. 15, 1049-1056 (1994).
- Girandon, L., Kregar-Velikonja, N., Božikov, K., Barliç, A. In vitro Models for Adipose Tissue Engineering with Adipose-Derived Stem Cells Using Different Scaffolds of Natural Origin. Folia Biol. (Praha). 57, 47-56 (2011).
- Baruch, L., Machluf, M. Alginate-chitosan complex coacervation for cell encapsulation: effect on mechanical properties and on long-term viability. Biopolymers. 82, 570-579 (2006).
- Wei, Y., Gong, K., Zheng, Z., Wang, A., Ao, Q., Gong, Y., Zhang, X. Chitosan/silk fibroin-based tissue-engineered graft seeded with adipose-derived stem cells enhances nerve regeneration in a rat model. J. Mater. Sci. Mater. Med. , (2011).
- Wang, Q., Jamal, S., Detamore, M. S., Berkland, C. PLGA-chitosan/PLGA-alginate nanoparticle blends as biodegradable colloidal gels for seeding human umbilical cord mesenchymal stem cells. J. Biomed. Mater. Res. A. 96, 520-527 (2011).
- Alves da Silva, M. L., Martins, A., Costa-Pinto, A. R., Correlo, V. M., Sol, P., Bhattacharya, M., Faria, S., Reis, R. L., Neves, N. M. Chondrogenic differentiation of human bone marrow mesenchymal stem cells in chitosan-based scaffolds using a flow-perfusion bioreactor. J. Tissue Eng. Regen. Med. , (2010).
- Kang, Y. M., Lee, B. N., Ko, J. H., Kim, G. H., Kang, K. N., Kim da, Y., Kim, J. H., Park, Y. H., Chun, H. J., Kim, C. H., Kim, M. S. In vivo biocompatibility study of electrospun chitosan microfiber for tissue engineering. Int. J. Mol. Sci. 11, 4140-4148 (2010).
- Bozkurt, G., Mothe, A. J., Zahir, T., Kim, H., Shoichet, M. S., Tator, C. H. Chitosan channels containing spinal cord-derived stem/progenitor cells for repair of subacute spinal cord injury in the rat. Neurosurgery. 67, 1733-1744 (2010).
- Leipzig, N. D., Wylie, R. G., Kim, H., Shoichet, M. S. Differentiation of neural stem cells in three-dimensional growth factor-immobilized chitosan hydrogel scaffolds. Biomaterials. 32, 57-64 (2011).
- Altman, A. M., Gupta, V., RÃos, C. N., Alt, E. U., Mathur, A. B. Adhesion, migration and mechanics of human adipose-tissue-derived stem cells on silk fibroin-chitosan matrix. Acta Biomater. 6, 1388-1397 (2010).
- Altman, A. M., Yan, Y., Matthias, N., Bai, X., Rios, C., Mathur, A. B., Song, Y. H., Alt, E. U. IFATS collection: Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model. Stem Cells. 27, 250-258 (2009).
- Machado, C. B., Ventura, J. M., Lemos, A. F., Ferreira, J. M., Leite, M. F., Goes, A. M. 3D chitosan-gelatin-chondroitin porous scaffold improves osteogenic differentiation of mesenchymal stem cells. Biomed. Mater. 2, 124-131 (2007).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유