Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Construction d'un hydrogel de collagène pour la prestation de souches microsphères Cell-chargé Chitosan
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Un obstacle majeur dans actuelles thérapies par cellules souches est de déterminer la méthode la plus efficace de fournir à ces cellules de tissus de l'hôte. Ici, nous décrivons une méthode de livraison à base de chitosan qui est efficace et simple dans l'approche, tout en permettant aux cellules souches adipeuses pour maintenir leur multipotence.
Résumé
Les cellules souches multipotentes ont été révélées extrêmement utiles dans le domaine de la médecine régénérative 1-3. Cependant, afin d'utiliser efficacement ces cellules pour la régénération tissulaire, un certain nombre de variables doivent être prises en compte. Ces variables comprennent: le volume total et de la surface du site d'implantation, les propriétés mécaniques du tissu et le micro-tissu, qui comprend le montant de la vascularisation et les composants de la matrice extracellulaire. Par conséquent, les matériaux utilisés pour la prestation de ces cellules doit être biocompatible avec une composition chimique définie tout en conservant une résistance mécanique qui imite le tissu hôte. Ces matériaux doivent aussi être perméable à l'oxygène et de nutriments pour fournir un microenvironnement favorable à cellules de se fixer et de proliférer. Chitosan, un polysaccharide cationique avec une excellente biocompatibilité, peut être facilement modifiée chimiquement et a une forte affinité pour se lier avec in vivo macromolecules 4-5. Chitosane imite la partie glycosaminoglycane de la matrice extracellulaire, lui permettant de fonctionner en tant que substrat pour l'adhérence cellulaire, la migration et la prolifération. Dans cette étude, nous utilisons le chitosane sous forme de microsphères de produire des cellules souches adipeuses (ASC) dans un collagène en fonction échafaudage tridimensionnel 6. Un idéal de cellule à microsphère rapport a été déterminée par rapport au temps d'incubation et la densité cellulaire de réaliser nombre maximum de cellules qui peuvent être chargés. Une fois l'ASC sont ensemencées sur les microsphères de chitosan (CSM), ils sont intégrés dans un échafaudage de collagène et peut être maintenue en culture pendant de longues périodes. En résumé, cette étude fournit une méthode pour justement offrir des cellules souches au sein d'un échafaudage tridimensionnel biomatériau.
Protocole
1. Isoler des cellules souches dérivées du tissu adipeux (ASC)
Remarque: Toutes les procédures ont été réalisées à température ambiante, sauf indication contraire.
- Isoler adipeux périrénal chez le rat et de l'épididyme et laver avec une solution stérile de Hank saline tamponnée (HBSS) contenant 1% de sérum de veau fœtal (FBS), comme décrit précédemment 6.
- Émincer le tissu et le transfert 1-2 g dans 25 ml de HBSS contenant 1% de FBS dans un tube de 50 ml et centrifuger à 500 g pendant 8 min à température ambiante.
- Recueillir la couche flottante du tissu adipeux et le transfert de 125 ml Erlenmeyer et traiter avec 25 ml de collagénase de type II (200 U / ml) dans du HBSS pendant 45 min à 37 ° C sur un agitateur orbital (125 rpm).
- Retirer soigneusement la fraction liquide (ci-dessous d'huile et de la couche adipeux) et filtrer séquentiellement à travers un filtre de maille en nylon 100-um et 70-um. Centrifuger le filtrat à 500 g pendant 10 min à température ambiante, aspirer le supernatant et laver le culot deux fois avec HBSS mL 25.
- Remettre en suspension le culot cellulaire dans 50 ml de milieu de croissance (MesenPRO RS moyen basal) supplémenté avec supplément MesenPRO croissance RS, antibiotiques antimycosiques (100 U / ml de pénicilline G, 100 ug / ml de sulfate de streptomycine, et 0,25 pg / ml d'amphotéricine B) , et 2 mM de L-glutamine et les cellules de pipette en 2 flacons T75 (25 ml / flacon).
- Culture de l'ASC dans un 5% de CO 2 incubateur humidifié à 37 ° C (Passage 2-4 ASC sont utilisés pour toutes les expériences).
2. Préparation Chitosan microsphères (CSM)
Remarque: Toutes les procédures ont été réalisées à température ambiante, sauf indication contraire.
- CSM sont préparés par un procédé de l'eau dans l'huile d'émulsification avec une technique de coacervation ionique à l'aide de notre précédente protocole n ° 6. Émulsionner une solution aqueuse de chitosane (6 ml de 3% p / v chitosane dans 0,5 M d'acide acétique) dans une 100 mL de mélange une phase huileuse comprenant de sojal'huile, le n-octanol (1:2 en volume / volume) et de 5% de sorbitan mono-oléate (travée 80) émulsifiant, en utilisant de tête (1700 tpm) et agitation magnétique (1000 tpm) simultanément, dans des directions opposées. Cette double méthode de mélange assure que les micelles formées très tôt, avant la réticulation se produit peut rester en solution et non pas se déposent au fond. En outre, l'agitation magnétique bar aides en de-agrégation chitosane lors de la formation de micelles et rigidification.
- Le mélange est agité en continu pendant environ 1 heure jusqu'à ce qu'une stable eau-dans-huile est obtenue. Réticulation ionique est initiée par l'ajout de 1,5 ml à 1% p / v d'hydroxyde de potassium dans du n-octanol toutes les 15 minutes pendant 4 h (24 totale ml).
- Après l'achèvement de la réaction de réticulation, lentement décanter la phase huileuse de la CSM mélange contenant et ajouter immédiatement les sphères à 100 ml d'acétone. Laver les sphères avec de l'acétone jusqu'à ce que la phase huileuse est complètement enlevé.
- Sécher les sphères récupérés dans un dessiccateur à vide et de l'anusYZE sans autre traitement. La taille moyenne des particules de CSM, la surface par milligramme et l'unité de volume cubique a été déterminée en utilisant un analyseur de taille de particules.
- Pour les expériences ultérieures, se laver trois fois avec du CSM de l'eau stérile pour éliminer les sels résiduels et stériliser à l'alcool absolu.
3. Détermination du nombre de groupes amino libres dans CSM
Remarque: Toutes les procédures ont été réalisées à température ambiante, sauf indication contraire.
- Déterminer le nombre de groupes amino libres présents dans CSM après réticulation ionique en utilisant le test trinitro benzènesulfonique (TNBS) de Bubins et Ofner 7. Incuber 5 mg de microsphères avec 1 ml de solution TNBS 0,5% dans un tube de 50 ml en verre pendant 4 h à 40 ° C et hydrolyser avec l'ajout de 3 ml de HCl 6N à 60 ° C pendant 2h.
- Refroidir les échantillons à température ambiante, et d'extraire les TNBS libres en ajoutant 5 ml d'eau déminéralisée et 10 ml d'éthyléther.
- Chauffer une partie aliquote de 5 ml de la phase aqueuse à 40 ° C dans un bain-marie pendant 15 min à s'évaporer toute l'éther résiduel, refroidir à température ambiante, et diluer avec 15 ml d'eau.
- Mesurer l'absorbance à 345 nm avec un spectrophotomètre utilisant une solution de chitosane TNBS sans que l'ébauche et le chitosane utilisé pour la préparation CSM pour déterminer le nombre total de groupes amino. Estimer le nombre de groupes amino libres du CSM par rapport au chitosane.
4. Chargement en ASC CSM
Remarque: Toutes les procédures ont été réalisées à température ambiante, sauf indication contraire.
- Equilibrer 5 mg de CSM stérilisés de l'article 2.5 dans HBSS stériles nuit et ajouter à un 8-um taille des pores membranaires insert plaque de culture (24-puits).
- Après le CSM se sont installés sur la membrane, aspirer délicatement les HBSS et ajouter 300 ul de milieu de croissance à l'intérieur de l'insert et 700 ul de milieu de croissance pour ee extérieur de l'insert.
- Resuspendre ASC à la concentration appropriée (1 x 10 4 à 4 x 10 4) dans 200 pi de milieu de croissance et de semences au cours de la CSM intérieur de l'insert plaque de culture. Le volume final du milieu au sein de l'insert de culture, après le semis, est de 500 pi.
- Incuber la tête de série ASC sur CSM pendant 24 h dans un 5% de CO 2 incubateur humidifié à 37 ° C.
5. Déterminer le pourcentage de chargement ASC et la viabilité cellulaire en CSM
Remarque: Toutes les procédures ont été réalisées à température ambiante, sauf indication contraire.
- Après incubation, la collecte du CSM ASC-chargée dans un microtube de 1,5 ml stérile sans perturber les cellules qui ont migré dans la membrane d'insertion.
- Retirez le milieu résiduel et ajouter 250 ul de milieu de croissance frais dans le tube.
- Pour chaque tube ajouter 25 ul MTT [3 - (4,5-dimethylthiozole-2-yl) -2,5-diphényltétrazolium]solution (5 mg / ml) et incuber pendant 4 h dans un 5% de CO 2 incubateur humidifié à 37 ° C.
- Après incubation, éliminer le milieu, ajouter 250 ul de diméthylsulfoxyde, et le vortex le mélange pendant 2-5 min pour solubiliser le complexe de formazan.
- Centrifuger le CSM à 2700 x g pendant 5 min, et de déterminer l'absorbance surnageant mesurée à 570 nm en utilisant 630 nm comme référence.
- Déterminer le nombre de cellules associée avec le CSM par rapport à la valeur d'absorbance obtenue à partir des numéros connus de l'ASC viable.
6. Caractériser ASC-CSM-Embedded gel de collagène
Remarque: Toutes les procédures ont été réalisées à température ambiante, sauf indication contraire.
- Mélange ASC-chargé CSM (5 mg contenant ≈ 2 x 10 4 cellules) avec collagène de type 1 (7,5 mg / ml) extrait à partir du tendon de queue de rat selon la méthode de Bornstein 8 et la fibrillation, après ajustement du pH à 6,8 à l'aide de NaOH 2 N.
- Ajouter la fibrille collagène-ASC-CSM mélange sur une plaque de 12 puits et incuber pendant 30 min à une 5% de CO 2 incubateur humidifié à 37 ° C.
- Après la fibrillation complète, incuber les gels de collagène-ASC-CSM pour un maximum de 14 jours dans un 5% de CO 2 incubateur humidifié à 37 ° C.
- Libération et migration de cellules de CSM dans le gel ont été observés en utilisant des techniques de microscopie standard.
7. Les résultats représentatifs
Dans la présente étude, nous avons développé une stratégie in vitro pour produire des cellules souches à partir de chitosane microsphères (CSM) dans un gel de collagène échafaud. CSM poreuse de taille uniforme (175-225 m de diamètre) et la composition ont été préparée et utilisée en tant que supports de cellules (figure 2). Sur incubation ASC avec le CSM, les cellules attaché à une concentration de 2 x 10 4 cells/5mg du CSM. Les cellules étaient capables de se propager au cours de la microsphère, tout en étendant filopodesdans les interstices de la microsphère poreux (figure 3). Une fois que le CSM cellule-chargé ont été mélangées avec le gel de collagène, les cellules immédiatement commencé migrer dans les gels (figure 4).
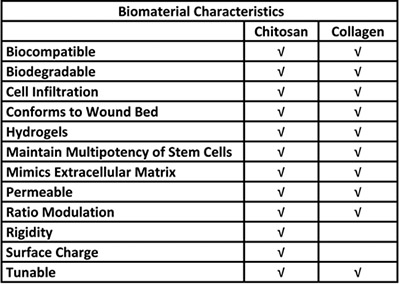
Tableau 1. Avantages biologiques pour l'utilisation de chitosane et de collagène dans un système de délivrance de cellules souches.
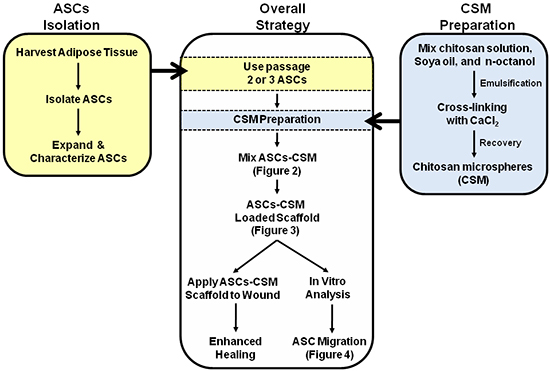
Figure 1. Schéma illustrant la stratégie globale de la double utilisation des ASC-CSM échafaudages de collagène chargés. Les figures 2, 3, et 4 sont annotés dans le schéma pour aider à l'interprétation des images.
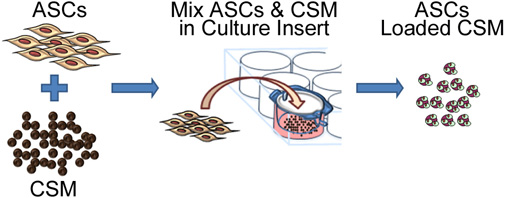
Figure 2. Représentation schématique illustrant le processus d'ensemencement des cellules souches sur le chitosane microsphères. Le process implique la co-culture avec ASC CSM dans un 8 - um taille des pores de membrane plaque d'insertion de la culture. Après 24 heures, les microsphères sont retirés de l'insert et sont prêts pour l'enrobage dans une matrice biomatériau.
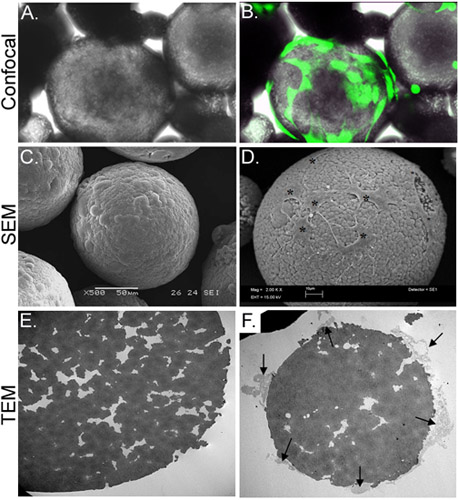
Figure 3. La caractérisation morphologique des CSM-chargé avec ASC. Groupe A représente la microscopie optique de ASC-chargé CSM, tandis que le panneau B montre le même champ de vision superposée à une image obtenue par microscopie confocale de fluorescence. ASC ont été préchargé avec calcéine AM (vert). Groupe C représente une image d'une image MEB d'une microsphère vide, tandis que le panneau D montre des cellules chargées sur la microsphère (astérisques). L'image TEM dans E panneau montre une section transversale d'un microsphère déchargé. Une multitude de pores et les fissures sont situées tout au long de la microsphère. Groupe F montre une microsphère coupe transversale avec des cellules (flèches) attaché et l'extension des filopodes dans le CREvices. Grossissements originales: A & B = 70X; C = 500x, D = 2.000 x; E & F = 2.500 x.

Figure 4. Migration des ASC du CSM dans l'échafaudage de collagène en trois dimensions. Les panneaux A et B représentent le CSM avec des cellules migrent d'microsphères et dans la matrice de collagène, le jour 3 (A flèches,). Le panneau B montre une culture similaire, après 12 jours. Microscopie électronique à transmission (TEM) des images sont représentées en C, D et E. Les astérisques en C et D montrent une microsphère qui a été coupe transversale avec des cellules migrent de la microsphère (flèches). Un plus fort grossissement du panneau D est représenté dans panneau E, et montre filopodes cellule attachée aux fibrilles de collagène (en médaillon). Le grossissement est de: A & B = 100x; C & D = 6.000 x; E = 20.000 x, encart = 150000 x.
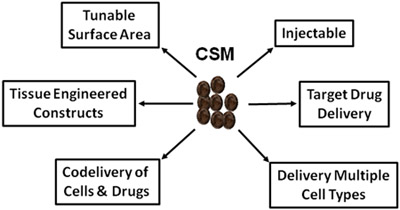
Figure 5.Schéma illustrant les utilisations de vastes CSM en médecine régénérative et la livraison de drogue.
Access restricted. Please log in or start a trial to view this content.
Discussion
Un obstacle majeur à base de cellules souches est un traitement au point des méthodes efficaces pour la livraison des cellules dans les régions spécifiées pour la réparation. En raison de la variabilité patient à patient, le type de tissu, la taille et la profondeur des blessures, la méthodologie de cellules souches offrant doit être déterminée au cas par cas. Bien que l'incorporation des cellules souches au sein d'une matrice et de les livrer à l'endroit de la plaie semble être une approche lo...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Aucun des intérêts concurrents financiers existent.
Avertissements
Les opinions ou affirmations contenues dans ce document sont les opinions personnelles des auteurs et ne doivent pas être interprétées comme officielle ou reflétant les vues du ministère de la Défense ou le gouvernement des États-Unis. Les auteurs sont des employés du gouvernement des États-Unis, et ce travail a été préparé dans le cadre de leurs fonctions officielles. Tous les travaux ont été soutenus par le US Army Medical Research et le Commandement du matériel. Cette étude a été menée selon un protocole révisé et approuvé par le US Army Medical Research et le Commandement du matériel Conseil d'examen du institutionnelle, et en conformité avec le protocole approuvé.
Remerciements
DOZ est soutenu par une subvention accordée par la Fondation Genève. SN a été soutenu par une subvention de bourses postdoctorales de l'Initiative de Pittsburgh du génie tissulaire.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif / équipements | Entreprise | Numéro de catalogue | Commentaires |
| Hanks BalancedSalt Solution (HBSS) | Gibco | 14175 | Consommables |
| Sérum fœtal bovin | Hyclone | SH30071.03 | Consommables |
| Collagénase de type II | Sigma-Aldrich | C6685 | Consommables |
| 70-um filet de nylon filtre | BD Biosciences | 352350 | Consommables |
| 100 um en filet de nylon filtre | BD Biosciences | 352360 | Consommables |
| Système MesenPRO moyen de croissance | Invitrogen | 12746-012 | Consommables |
| L-glutamine | Gibco | 25030 | Consommables |
| T75 flacon de culture tissulaire | BD Biosciences | 137787 | Consommables |
| Chitosan | Sigma-Aldrich | 448869 | Consommables |
| Acide acétique | Sigma-Aldrich | 320099 | Consommables |
| N-octanol | Acros Organics | 150630025 | Consommables |
| Sorbitan-Mono-oléate | Sigma-Aldrich | S6760 | Consommables |
| Hydroxyde de potassium | Sigma-Aldrich | P1767 | Consommables |
| Acétone | Fisher Scientific | L-4859 | Consommables |
| L'éthanol | Sigma-Aldrich | 270741 | Consommables |
| Trinitro benzènesulfonique | Sigma-Aldrich | P2297 | Consommables |
| Acide chlorhydrique | Sigma-Aldrich | 320331 | Consommables |
| Ether éthylique | Sigma-Aldrich | 472-484 | Consommables |
| 8-um Insère tissus plaque de culture | BD Biosciences | 353097 | Consommables |
| Tubes à centrifuger de 1,5 ml | Pêcheur | 05-408-129 | Consommables |
| Réactif MTT | Invitrogen | M6494 | Consommables |
| Diméthylsulfoxyde | Sigma-Aldrich | D8779 | Consommables |
| Qtracker portable kit de marquage (Q Tracker 655) | Sondes moléculaires | Q2502PMP | Consommables |
| Collagène de type 1 | Travigen | 3447-020-01 | Consommables |
| Hydroxyde de sodium | Sigma-Aldrich | S8045 | Consommables |
| Plaques à 12 puits de culture de tissus | BD Biosciences | 353043 | Consommables |
| Centrifuger | Eppendorf | 5417R | Équipement |
| Orbital Shaker | Nouveau-Brunswick Scienctific | C24 | Équipement |
| Incubateur humidifié avec du CO de l'air-5% 2 | Thermo Scientific | Modèle 370 | Équipement |
| Agitateur à hélice | IKA | Visc6000 | Équipement |
| Agitateur magnétique | Corning | PC-210 | Équipement |
| Dessiccateur à vide | - | - | Équipement |
| Analyseur granulométrique | Malvern | STP2000 Spraytec | Équipement |
| Bain d'eau | Fisher Scientific | Isotemp210 | Équipement |
| Spectrophotomètre | Beckman | Beckman Coulter Spectrophotomètre DU800UV/Visible | Équipement |
| Vortex | Diagger | 3030a | Équipement |
| Lecteur de microplaques | Molecular Devices | SpectraMax M2 | Équipement |
| Lumière / microscope à fluorescence | Olympe | IX71 | Équipement |
| Microscope confocal | Olympe | FV-500 microscope confocal à balayage laser | Équipement |
| Microscope Electronique à Balayage | Carl Zeiss MicroImaging | Leo 435 VP | Équipement |
| Microscope électronique à transmission | JEOL | JEOL 1230 | Équipement |
Références
- Krampera, M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair. Bone. 39, 678-683 (2006).
- Patrick, C. W. Tissue engineering strategies for adipose tissue repair. Anat. Rec. 263, 361-366 (2001).
- Pountos, I., Giannoudis, P. V. Biology of mesenchymal stem cells. Injury. 36, Suppl 3. S8-S12 (2005).
- Kim, I. Y. Chitosan and its derivatives for tissue engineering applications. Biotechnol. Adv. 26, 1-21 (2008).
- Shi, C. Therapeutic potential of chitosan and its derivatives in regenerative medicine. J. Surg. Res. 133, 185-192 (2006).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part. A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, C. M. 3rd The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J. Biomed. Mater. Res. A. 81, 259-268 (2007).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Shanmuganathan, S. Preparation and characterization of chitosan microspheres for doxycycline delivery. Carbohydr. Polym. 73, 201-211 (2008).
- Haque, T., Chen, H., Ouyang, W., Martoni, C., Lawuyi, B., Urbanska, A., Prakash, S. Investigation of a new microcapsule membrane combining alginate, chitosan, polyethylene glycol and poly-L-lysine for cell transplantation applications. Int. J. Artif. Organs. 28, 631-637 (2005).
- Goren, A., Dahan, N., Goren, E., Baruch, L., Machluf, M. Encapsulated human mesenchymal stem cells: a unique hypoimmunogenic platform for long-term cellular therapy. FASEB J. 24, 22-31 (2010).
- Zielinski, B. A., Aebischer, P. Chitosan as a matrix for mammalian cell encapsulation. Biomaterials. 15, 1049-1056 (1994).
- Girandon, L., Kregar-Velikonja, N., Božikov, K., Barliç, A. In vitro Models for Adipose Tissue Engineering with Adipose-Derived Stem Cells Using Different Scaffolds of Natural Origin. Folia Biol. (Praha). 57, 47-56 (2011).
- Baruch, L., Machluf, M. Alginate-chitosan complex coacervation for cell encapsulation: effect on mechanical properties and on long-term viability. Biopolymers. 82, 570-579 (2006).
- Wei, Y., Gong, K., Zheng, Z., Wang, A., Ao, Q., Gong, Y., Zhang, X. Chitosan/silk fibroin-based tissue-engineered graft seeded with adipose-derived stem cells enhances nerve regeneration in a rat model. J. Mater. Sci. Mater. Med. , (2011).
- Wang, Q., Jamal, S., Detamore, M. S., Berkland, C. PLGA-chitosan/PLGA-alginate nanoparticle blends as biodegradable colloidal gels for seeding human umbilical cord mesenchymal stem cells. J. Biomed. Mater. Res. A. 96, 520-527 (2011).
- Alves da Silva, M. L., Martins, A., Costa-Pinto, A. R., Correlo, V. M., Sol, P., Bhattacharya, M., Faria, S., Reis, R. L., Neves, N. M. Chondrogenic differentiation of human bone marrow mesenchymal stem cells in chitosan-based scaffolds using a flow-perfusion bioreactor. J. Tissue Eng. Regen. Med. , (2010).
- Kang, Y. M., Lee, B. N., Ko, J. H., Kim, G. H., Kang, K. N., Kim da, Y., Kim, J. H., Park, Y. H., Chun, H. J., Kim, C. H., Kim, M. S. In vivo biocompatibility study of electrospun chitosan microfiber for tissue engineering. Int. J. Mol. Sci. 11, 4140-4148 (2010).
- Bozkurt, G., Mothe, A. J., Zahir, T., Kim, H., Shoichet, M. S., Tator, C. H. Chitosan channels containing spinal cord-derived stem/progenitor cells for repair of subacute spinal cord injury in the rat. Neurosurgery. 67, 1733-1744 (2010).
- Leipzig, N. D., Wylie, R. G., Kim, H., Shoichet, M. S. Differentiation of neural stem cells in three-dimensional growth factor-immobilized chitosan hydrogel scaffolds. Biomaterials. 32, 57-64 (2011).
- Altman, A. M., Gupta, V., RÃos, C. N., Alt, E. U., Mathur, A. B. Adhesion, migration and mechanics of human adipose-tissue-derived stem cells on silk fibroin-chitosan matrix. Acta Biomater. 6, 1388-1397 (2010).
- Altman, A. M., Yan, Y., Matthias, N., Bai, X., Rios, C., Mathur, A. B., Song, Y. H., Alt, E. U. IFATS collection: Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model. Stem Cells. 27, 250-258 (2009).
- Machado, C. B., Ventura, J. M., Lemos, A. F., Ferreira, J. M., Leite, M. F., Goes, A. M. 3D chitosan-gelatin-chondroitin porous scaffold improves osteogenic differentiation of mesenchymal stem cells. Biomed. Mater. 2, 124-131 (2007).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon