Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La expansión de los linfocitos T citotóxicos sangre del cordón umbilical que Citomegalovirus Target, Virus de Epstein-Barr, adenovirus y
En este artículo
Resumen
Aquí se describe la primera práctica de fabricación (GMP)-cumple método de producción de virus específicos de los linfocitos T citotóxicos (CTL) de la sangre del cordón umbilical, una fuente de células T predominantemente ingenuo.
Resumen
Las infecciones de virus después de un trasplante de células madre se encuentran entre las causas más comunes de muerte, sobre todo después de la sangre del cordón (CB) trasplante (CBT), donde el CB no contiene cantidades apreciables de células T del virus con experiencia que pueden proteger al destinatario de la infección 1. - 4 Nosotros y otros han demostrado que el virus de CTL específico generado a partir de donantes seropositivos y se infunde al destinatario son seguros y protectores. 5-8 Sin embargo, hasta hace poco, virus específicos de las células T no podría ser generado a partir de sangre de cordón, probablemente debido a la ausencia de virus específicos de las células T de memoria.
En un esfuerzo para imitar mejor las condiciones en el cebado in vivo de las células T vírgenes, se estableció un método que utiliza CB-derivados de las células dendríticas (DC) transducidas con un vector adenoviral (Ad5f35pp65) que contiene el antígeno inmunodominante CMV pp65, por lo tanto, conducir especificidad de las células T hacia CMV y adenovirus. 9 Al inicio, utilizamos estas máquinasDCs estructurados, así como CB derivados de células T en la presencia de las citoquinas IL-7, IL-12 e IL-15. 10 En la segunda estimulación se utilizó el EBV de células B transformadas, o EBV-LCL, que expresan tanto latente y antígenos para el VEB lítico. Ad5f35pp65-EBV-LCL transducidas se utilizan para estimular las células T en presencia de IL-15 en la segunda estimulación. Estimulaciones posteriores utilizar Ad5f35pp65-EBV-LCL transducidas y IL-2.
De 50x10 6 células mononucleares CB somos capaces de generar más de 150 x 10 6 virus específicos de las células T que lisan los impulsos de antígeno-objetivos y liberación de citoquinas en respuesta a la estimulación antigénica. 11 Estas células se fabrican de una manera GMP usando sólo la fracción de 20% de una unidad de sangre de cordón se fraccionó y se han traducido para el uso clínico.
Protocolo
1. Aislamiento de células mononucleares (día 0)
- Insertar espiga de adaptador luer hembra en el puerto de salida de la fracción de 20% de la unidad de sangre del cordón umbilical, conecte la jeringa y retirar la sangre. Transferir sangre descongeladas a 20 ml de RPMI calentó en tubo de centrífuga 50 mL. Enjuague la bolsa de sangre de cordón con 5 ml de RPMI y transferir al tubo de centrífuga mismo.
- Centrifugar las células durante 10 minutos a 400 x g. Aspirar el sobrenadante.
- Resuspender las células en 20 ml de RPMI caliente. Células de capa en 15 ml de Lymphoprep en 50 ml tubo de centrífuga. Centrifugar 40 minutos a 400 x g.
- Cosechar la interfaz que contiene las células mononucleares y se lava en 20 ml de RPMI. Centrifugar durante 10 minutos @ 450 x g.
- Aspirar el sobrenadante y lavar con 20 ml de RPMI. Contar las células y centrifugar durante 5 minutos a 400 x g.
- Aspirar el sobrenadante y volver a suspender las células a 5 x 10 6 células mononucleares / mL de CellGenix DC medios de comunicación (sin suero). Retirar 1 mL para EBV-LCL generación y puesta en 15 ml centrifuge tubo.
2. Generación de células dendríticas (comenzando en el día 0)
- Placa de 2 ml de células (ya se encuentran en 5 x 10 6 células / ml de medios de comunicación DC) por pocillo en una placa de 6-así. Dejar en incubación durante 1-2 horas.
- Después de 1-2 horas, se lavan las células no adherentes por lavado 3-4 veces con PBS. Recoger las células no adherentes y congelar. Añadir 2 ml / pocillo de medio de DC que contienen 1000 U / ml de IL-4 y 800 U / ml de GM-CSF.
- 3-4 días después de la iniciación DC, reponer la IL-4 y GM-CSF mediante la adición de 100 l / pocillo de medio que contenía una concentración final de 1000U/mL IL-4 y 800 U / ml de GM-CSF.
- En el día 5-6, la cosecha DC raspando el pocillo con una pipeta de transferencia. Contar las células grandes y centrifugar durante 5 minutos @ 400 x g. Aspirar los medios de comunicación y DC resuspender en 2x10 6 células / ml de los medios de comunicación de CC. Añadir 0,5 ml / pocillo de una placa de 24 pocillos.
- Transducir la DC usando el vector Ad5f35pp65 en una celda por MOI de 10 unidades infecciosas. Añadir vector a cada pocillo en una placa de 24 pocillos. Se incuban las células durante 1,5 horas. Después de 1,5 horas, agregar 1,5 ml / pocillo de medio que contiene DC: 1000 U / ml de IL-4, 800 U / ml de GM-CSF, 10 ng / ml de TNF-alfa, 1 mg / ml de PGE-1, 100 ng / mL IL-6, y 10 ng / ml de IL-1beta. Estas citoquinas madurar los países en desarrollo.
3. Generación de EBV-LCL (a partir del día 0)
- Centrifugar el tubo que contiene las 5 x 10 6 células mononucleares. Añadir 200 l de concentrado EBV B95.8 sobrenadante y 1,8 ml de medio completo (RPMI + 10% de FBS + 2 mM L-glutamina) que contiene ciclosporina (1 ug / ml).
- Alícuota de 100 l de células en 10 pocillos de una placa de 96 pocillos y 200 mu l en 5 pozos. Añadir 100 l de medios de comunicación completa ciclosporina + a los pocillos que contienen sólo 100 l de células. Llenar los pocillos restantes con agua estéril.
- Alimente el semanario LCL y ampliar de una placa de 96 pocillos a una placa de 24 pocillos después de 2 semanas. Después de otra semana, transferir a un matraz T25 y en la transferencia de semana posteriorun matraz T75. En esta etapa se recomienda congelar las alícuotas de LCL. Por lo general se toma 1 mes para generar un número suficiente de LCL.
4. CTL Iniciación - 7 días después del inicio de los DC
- Los países en desarrollo Harvest e irradiar a los 30 Gy. Lave 4 x y el recuento. Resuspender DC en los medios de células T que contienen suero humano (45% de RPMI, 45% CLICK, 10% de suero humano, 2 mM de L-glutamina) @ 1 x 10 5 DCS / ml.
- Descongelar las células no adherentes de la etapa 2.2. Lavar las células, y contar. Resuspender en 2 x 10 6 células no adherentes / mL en medio de células T que contienen suero humano. Añadir 10 ng / ml de IL-7 e IL-12-, y 5 ng / ml de IL-15. Añadir 1 ml de células por pocillo en una placa de 24 pocillos. Añadir 1 ml de DC por pocillo. Llenar los pocillos vacíos de 24-así placa con agua estéril.
- 7 días después de la iniciación de células T, la alimentación y / o dividir las células con medio de células T que contienen suero humano.
- 9-12 días después de la iniciación de células T, las células T congelar hasta que la LCL están listos.
- ONCE LCL se han expandido y se pasan en matraces T75, la transducción de la LCL por centrifugación durante 5 minutos a 400 x g. Añadir el vector al sedimento de células en una MOI de 100 unidades infecciosas por célula. Incubar durante 1,5 horas. Después de 1,5 horas, resuspender en medio completo a 5 x 10 5 LCL / ml y añadir 2 ml por pocillo en una placa de 24 pocillos. 12
- Después de 2 días, la cosecha de la LCL e irradiar a los 40 Gy. Lave 4 x y el recuento. Resuspender el LCL en los medios de comunicación de células T que contienen suero humano a 2,5 x 10 5 células / ml. Añadir 1 ml de LCL por pocillo de una placa de 24 pocillos. Además, añadir 5 x 10 6 LCL a un dispositivo de cultivo Grex40 así como 5 ng / ml de IL-15. 13
- Recoger las células T. Centrifugar durante 5 minutos a 400 x g, aspirar el sobrenadante y se resuspenden en medios de células T que contienen suero humano a 1 x 10 6 células T / mL. Añadir 5 ng / ml de IL-15 y se añade 1 ml / pocillo de células T (un total de 1 x 10 6 células T) para el LCL que ya están en la placa de 24 pocillos. En el Grex40, llevarel volumen total de medios de hasta 30 ml.
- En días 3-4 después de la estimulación, si las células son confluentes después dividir (en la placa) 1:1 y añadir medio fresco que contenía 50 U / ml de IL-2. Si ellos no son confluentes después simplemente aspirar ½ los medios de comunicación y sustituir con medio que contenía 50 U / ml de IL-2. En la Grex40, aspirar el medio de los medios de comunicación, reemplazar con medio fresco, y se añaden 50 U / ml de IL-2.
- En el día 7, repetir como en el paso 4,6 pero el uso de IL-2 en el día de la estimulación no, IL-15.
5. Los resultados representativos
Un esquema del protocolo de fabricación GMP aprobado por la FDA se representa en la figura 1. El proceso dura unos 50 días. Los métodos típicos de la generación de virus específicos de las células T expandir pre-existentes de células T de memoria, sin embargo, carece de experiencia en la sangre del cordón virus de las células T y por lo tanto necesitamos vivo prime ingenuo células T ex. Para ello, se utilizan células dendríticas, así como las citoquinas IL-7, IL-12 e IL-15,necesario para la generación de especificidad viral.
Después de 3 estimulaciones, el rendimiento debería ser más de 100x10 6 células. Si las células no hay suficientes, estimulaciones adicionales se puede realizar hasta que el número deseado de CTLs están disponibles. La mayoría de estas células debe ser CD3 + con una mezcla de CD4 + y CD8 + células T. No debe ser menos de 15% de células NK (CD3-/CD56 +) y menos de 1% células B CD19 + (Figura 2).
El CTL expandido debe reconocer el antígeno pp65 de CMV, hexón y pentón de adenovirus, así como numerosos antígenos de EBV que se expresan en EBV-LCL. Cuando se probó en un ensayo ELISPOT, CTL debería secretar más IFN-? en respuesta a estos antígenos que los antígenos irrelevantes (Figura 3).
El CTL también debe lisar virales pulsadas con péptidos tales objetivos blastos PHA. En un ensayo de liberación de 51Cr, CTL lyse debe LCL, CMVpp65 de pulso y Adenovirus hexón y /o objetivos pentón de pulso pero no objetivos pulsadas con péptidos irrelevantes (Figura 4).
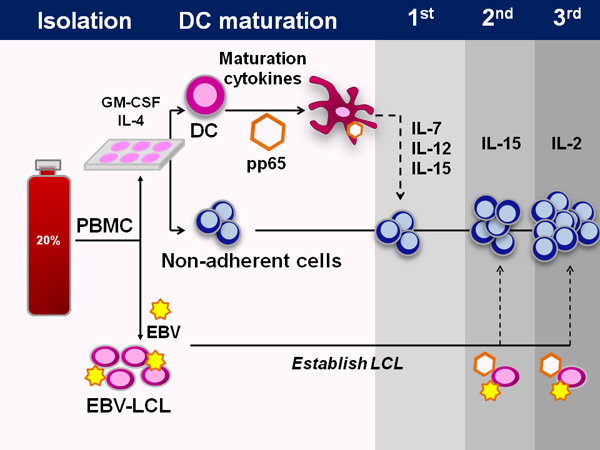
Figura 1. Generación de múltiples virus CTL específicos de sangre del cordón umbilical. Esquemática que muestra todo el proceso de fabricación de CTL a partir de sangre del cordón umbilical. En primer lugar las células mononucleares de sangre de cordón umbilical se aíslan de la fracción de 20% de la unidad de sangre de cordón umbilical fraccionado. Con la excepción de 5x10 6 células que se guardan para la generación de LCL, todas las células se colocaron en placas en medio de células dendríticas durante 1-2 horas, momento en el cual las células no adherentes se recogieron y congelaron. La DC se alimenta entonces DC de medios que contiene IL-4 y GM-CSF. Después de 5 días de cultivo, la DC se maduran y transducidas con un vector adenoviral que contiene el antígeno inmunodominante CMV pp65. En la iniciación, estas DC se combinan con las células no adherentes, así como las citoquinas IL-7, IL-12,y IL-15. En estimulaciones posteriores, el vector adenoviral se utiliza el mismo para transducir EBV-LCL, que se utilizan como células presentadoras de antígeno. IL-15 se utiliza en la segunda estimulación y la IL-2 a partir de entonces.
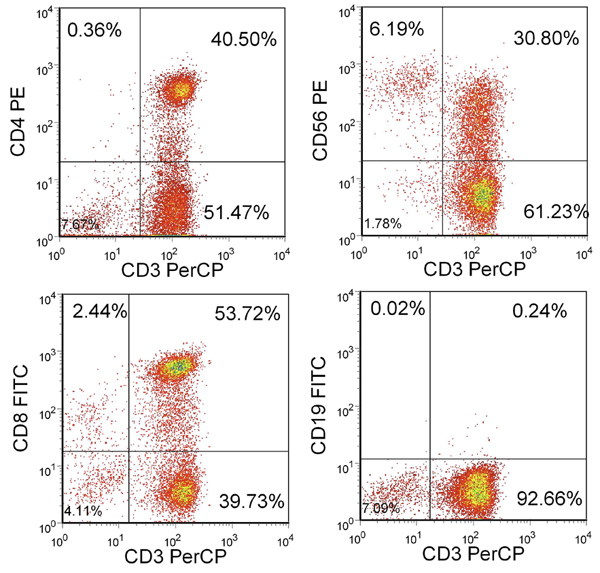
Figura 2. Fenotipo de las células T resultante. Se muestra el porcentaje de células vivas incluidas en la puerta de linfocitos. CTL son CD3 + y CD4 + o CD8 +, pero en gran parte CD3-/CD56- y CD19-.
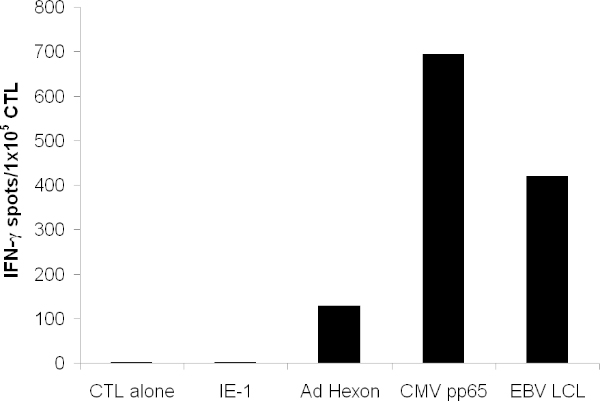
Figura 3. Funcionalidad de células T. Especificidad de las células T se ensayó por el IFN-γELISPOT. Las células T fueron pulsadas con péptidos solapantes que abarcan toda la proteína de hexón, pentón, pp65, y el antígeno irrelevante 1-IE. CTL solo indica los medios de comunicación solo. LCL autólogas fueron irradiadas y se añadió a 1x10 5 / pocillo. Se muestra el punto medio de la formación de células count de pocillos por triplicado.
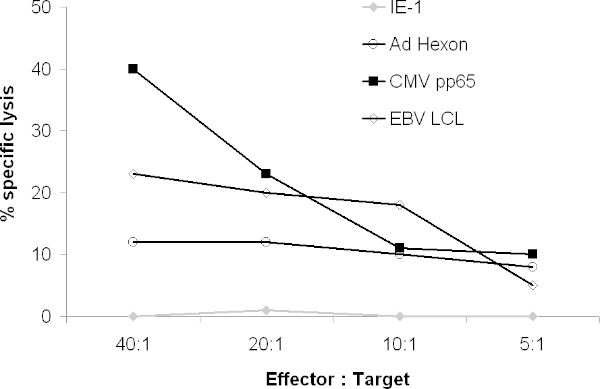
Figura 4. Actividad citolítica de CTL. La capacidad de los CTL resultante para lisar dianas que expresan antígenos virales fue probado en un ensayo de 51 Cr. 51 Cr-autólogas marcadas blastos PHA fueron pulsadas con péptidos solapantes que abarcan el antígeno completo o 51 Cr-LCL autólogas marcadas se cocultivaron con CTL. Después de 4 horas, la liberación gamma se contaron en un contador gamma.
Access restricted. Please log in or start a trial to view this content.
Discusión
Las actuales estrategias encaminadas a controlar las infecciones virales después de la TCC puede ser eficaz, pero están asociados con toxicidades significativas, son caros, y no confieren protección a largo plazo contra la infección posterior. De hecho, el uso de algunos fármacos antivirales pueden limitar la expansión de las células T específicas de virus que de otro modo serían de protección. 14 Otra opción es la infusión de las células derivadas del donante T específicos para el virus. ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por un Dan L. Duncan beca de investigación colaborativa (CMB y EJS), el Instituto Nacional del Corazón Pulmón, y Sangre (US4HL081007), una Sociedad de Leucemia y Linfoma Investigación Clínica premio Scholar (CMB), y el Instituto Nacional del Cáncer (RO1 CA06150816; EJS).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre de reactivo | Empresa | Número de catálogo | |
| RPMI 1640 | Invitrogen | 21870-076 | |
| DC medios de comunicación | CellGenix | 20801-0500 | |
| EHAA (Medio de Click) | Irvine Scientific | 9195 | |
| Suero Humano | Gemini Bio Products | 100-110 | |
| Gas Permeable Cultureware 18 | Wilson-Wolf | 80040S | |
| IL-2 | Chiron (TCH Farmacia) | ||
| IL-12 | NCI / CTEP | ||
| IL-15 | CellGenix | 1013-050 | |
| IL-7 | De I + D | AFL207 | |
| IL-1 beta | De I + D | AFL201 | |
| IL-6 | CélulaGenix | 1004-050 | |
| GM-CSF | TCH Farmacia | ||
| IL-4 | De I + D | AFL204 | |
| TNF-alfa | De I + D | AFL210 | |
| Ad5f35pp65 | BCM Vector CAGT Instalaciones de Producción | ||
| Transferencia de plasma con adaptador luer hembra | Carta Médica | 89-550-66J | |
| Lymphoprep | Nycomed | 1114550 |
Referencias
- Kennedy-Nasser, A. A. Comparable outcome of alternative donor and matched sibling donor hematopoietic stem cell transplant for children with acute lymphoblastic leukemia in first or second remission using alemtuzumab in a myeloablative conditioning regimen. Biol. Blood Marrow Transplant. 14, 1245-1245 (2008).
- Hanley, P. J. Improving clinical outcomes using adoptively transferred immune cells from umbilical cord blood. Cytotherapy. 12, 713(2010).
- Szabolcs, P., Cairo, M. S. Unrelated umbilical cord blood transplantation and immune reconstitution. Semin. Hematol. 47, 22(2010).
- Canto, E., Rodriguez-Sanchez, J. L., Vidal, S. Distinctive response of naive lymphocytes from cord blood to primary activation via TCR. J. Leukoc. Biol. 74, 998-998 (2003).
- Leen, A. M. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1160 (2006).
- Riddell, S. R. Restoration of viral immunity in immunodeficient humans by the adoptive transfer of T cell clones. Science. 257, 238(1992).
- O'Reilly, R. J. Adoptive transfer of antigen-specific T-cells of donor type for immunotherapy of viral infections following allogeneic hematopoietic cell transplants. Immunol. Res. 38, 237-237 (2007).
- Peggs, K. S. Adoptive cellular therapy for early cytomegalovirus infection after allogeneic stem-cell transplantation with virus-specific T-cell lines. Lancet. 362, 1375-1375 (2003).
- Sili, U. Large-scale expansion of dendritic cell-primed polyclonal human cytotoxic T-lymphocyte lines using lymphoblastoid cell lines for adoptive immunotherapy. J. Immunother. 26, 241(2003).
- Bollard, C. M. Good manufacturing practice-grade cytotoxic T lymphocytes specific for latent membrane proteins (LMP)-1 and LMP2 for patients with Epstein-Barr virus-associated lymphoma. Cytotherapy. 13, 518(2011).
- Hanley, P. J. Functionally active virus-specific T cells that target CMV, adenovirus, and EBV can be expanded from naive T-cell populations in cord blood and will target a range of viral epitopes. Blood. 114, 1958(1958).
- Hanley, P. J. Expansion of T cells targeting multiple antigens of cytomegalovirus, Epstein-Barr virus and adenovirus to provide broad antiviral specificity after stem cell transplantation. Cytotherapy. , (2011).
- Gerdemann, U. Generation of Multivirus-specific T Cells to Prevent/treat Viral Infections after Allogeneic Hematopoietic Stem Cell Transplant. J. Vis. Exp. (51), e2736(2011).
- Mori, T., Kato, J. Cytomegalovirus infection/disease after hematopoietic stem cell transplantation. Int. J. Hematol. 91, 588(2010).
- Einsele, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916(2002).
- Bao, L. Expansion of cytomegalovirus pp65 and IE-1 specific cytotoxic T lymphocytes for cytomegalovirus-specific immunotherapy following allogeneic stem cell transplantation. Biol. Blood Marrow Transplant. 14, 1156(2008).
- Shpall, E. J., Bollard, C. M., Brunstein, C. Novel cord blood transplant therapies. Biol. Blood Marrow Transplant. 17, Suppl 1. S39-S45 (2011).
- Vera, J. F. Accelerated production of antigen-specific T cells for preclinical and clinical applications using gas-permeable rapid expansion cultureware (G-Rex. J. Immunother. 33, 305(2010).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados