É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Expandindo linfócitos T citotóxicos do sangue do cordão umbilical que citomegalovírus Target, vírus de Epstein-Barr, e Adenovirus
Neste Artigo
Resumo
Aqui descrevemos a prática de fabricação primeiro (BPF) compatível com método de produção de vírus específicos linfócitos T citotóxicos (CTL) de sangue de cordão umbilical, fonte de células T predominantemente ingênua.
Resumo
Infecções por vírus após o transplante de células-tronco estão entre as causas mais comuns de morte, especialmente depois do sangue de cordão umbilical (CB) transplante (CBT), onde o BC não contém números apreciáveis de células T-vírus experientes que podem proteger o destinatário da infecção 1. - 4 Nós e outros autores mostraram que o vírus-specific CTL gerados a partir de dadores seropositivos e injectada para o receptor são seguras e de protecção. 5-8 No entanto, até há pouco tempo, as células T específicas para o vírus não pode ser gerado a partir de sangue do cordão umbilical, provavelmente devido ao ausência de vírus específicos de células T de memória.
Num esforço para melhor imitar a condições de estímulo in vivo de células T naive, foi estabelecido um método que utilizou células CB-derivadas dendríticas (DC) transduzida com um vector adenoviral (Ad5f35pp65) contendo o antigénio imunodominante CMV pp65, portanto dirigir a especificidade de células T para CMV e adenovírus. 9 No início, nós usamos estes maDCs estruturadas, bem como derivados de CB células T na presença das citocinas IL-7, IL-12 e IL-15. 10 Na segunda estimulação foi utilizado EBV-células B transformadas, ou EBV-LCL, que expressam tanto latente e antígenos líticos EBV. Ad5f35pp65-EBV-LCL transduzidas são usados para estimular as células T na presença de IL-15 na segunda estimulação. Estimulações subsequentes usam Ad5f35pp65-EBV-LCL transduzidas e IL-2.
De 50x10 6 CB células mononucleares que são capazes de gerar mais de 150 x 10 6 de vírus específicos de células T que lisam alvos pulsados antigénio e libertação de citocinas em resposta a estimulação antigénica. 11 Estas células foram fabricadas de um modo compatível com GMP utilizando somente a fracção de 20% de uma unidade de fraccionamento de sangue do cordão e foram traduzidos para o uso clínico.
Protocolo
1. Isolamento de células mononucleares (dia 0)
- Insira espiga de adaptador luer fêmea no orifício de saída da fracção de 20% da unidade de sangue do cordão umbilical, anexar e remover a seringa do sangue. Transferir sangue descongeladas a 20 mL de RPMI aquecido no tubo de centrífuga de 50 mL. Enxaguar saco de sangue do cordão umbilical com 5 mL de meio RPMI e transferir para o tubo de centrífuga mesmo.
- Centrifugar as células durante 10 minutos a 400 x g. Aspirar o sobrenadante.
- Ressuspender as células em 20 ml de RPMI morno. As células da camada em 15 mL de Lymphoprep em 50 ml de tubo de centrífuga. Centrifugar 40 minutos @ 400 x g.
- Colher a interface contendo as células mononucleares e lava-se em 20 mL de RPMI. Centrifugar durante 10 minutos @ 450 x g.
- Aspirar o sobrenadante e lava-se em 20 mL de RPMI. Contar as células e centrifugação durante 5 minutos a 400 x g.
- Aspirar células sobrenadante e ressuspender a 5 x 10 6 células mononucleares / mL de Cellgenix DC mídia (sem soro). Retirar 1 mL de EBV-LCL geração e colocados em 15 ml centrifuge tubo.
2. Geração de células dendríticas (a partir de dia 0)
- Placa 2 mL de células (já estão a 5 x 10 6 células / mL de meio DC) por poço numa placa de 6 poços. Deixe na incubadora por 1-2 horas.
- Após 1-2 horas, lavar as células não aderentes por lavagem 3-4 vezes com PBS. Recolher as células não aderentes e congelar. Adicionar 2 mL / poço de meio DC contendo 1000 U / ml de IL-4 e 800 U / mL de GM-CSF.
- 3-4 dias após a iniciação DC, encher a IL-4 e GM-CSF por adição de 100 uL / poço de meio contendo uma concentração final de 1000U/mL IL-4 e 800 U / mL de GM-CSF.
- No dia 5-6, colheita da DC por raspagem do poço com uma pipeta de transferência. Contar as células grandes e centrifugar durante 5 minutos @ 400 x g. Aspirado de mídia e ressuspender DC em 2x10 6 células / ml de DC mídia. Adicionar 0,5 mL / poço de uma placa de 24 poços.
- Transduzir a DC utilizando o vector numa célula Ad5f35pp65 por MOI de 10 unidades infecciosas. Adicionar vector para cada poço de uma placa de 24 poços. Incubar as células durante 1,5 horas. Após 1,5 horas, adicionar 1,5 ml / poço de meio DC contendo: 1000 U / mL de IL-4, 800 U / mL de GM-CSF, 10 ng / mL de TNF-alfa, 1 ug / mL de PGE-1, de 100 ng / mL IL-6, e 10 ng / mL de IL-1beta. Estas citocinas amadurecer os DCs.
3. Geração de EBV-LCL (começando no dia 0)
- Centrifuga-se o tubo contendo os 5 x 10 6 células mononucleares. Adicionar 200 uL de sobrenadante concentrado EBV B95.8 e 1,8 mL de meio completo (RPMI + 10% de FBS + 2 mM de L-glutamina) contendo ciclosporina (1 ug / mL).
- Alíquota de 100 uL de células em 10 cavidades de uma placa de 96 poços e 200 ul para 5 poços. Adicionam-se 100 ul de meio completo + ciclosporina aos poços contendo apenas 100 ul de células. Encher os poços restantes com água estéril.
- Alimentar o semanal LCL e expandir a partir de uma placa de 96 poços para uma placa de 24 poços depois de aproximadamente 2 semanas. Depois de mais uma semana, transferir para um balão T25 e na transferência de semana subsequenteum frasco T75. Nesta fase, é recomendado que você congelar alíquotas de LCL. Ele normalmente leva um mês para gerar um número suficiente de LCL.
4. CTL Initiation - 7 dias após o início da DCs
- DCs de colheita e irradiar a 30 Gy. Lavar 4 x e contagem. Ressuspender DC em meios de células T que contêm soro humano (45% de RPMI, 45% CLICK, 10% de soro humano, L-glutamina 2mM) @ 1 x 10 5 DCs / mL.
- Descongelar as células não aderentes a partir do passo 2.2. Lave as células, e contar. Ressuspender a 2 x 10 6 células não aderentes / mL em meio de células T contendo soro humano. Adicionam-se 10 ng / mL de IL-7 e IL-12, e 5 ng / mL de IL-15. Adicionar 1 mL de células por poço numa placa de 24 poços. Adicionar 1 mL de DC por poço. Preencher cavidades vazias de 24 poços da placa com água estéril.
- 7 dias após a iniciação das células T, de alimentação e / ou separar as células com meio contendo soro de células T humanas.
- 9-12 dias após o início da célula T, congelar as células T até que a LCL estão prontos.
- Once LCL expandiram e são passadas em frascos T75, transduzir a LCL por centrifugação durante 5 minutos a 400 x g. Adicionar o vector para a pelete de células a um MOI de 100 unidades infecciosas por célula. Incubar durante 1,5 horas. Após 1,5 horas, ressuspender em meio completo a 5 x 10 5 LCL / mL e adicionar 2 ml por poço numa placa de 24 cavidades 12.
- Após 2 dias, colher o LCL e irradiam a 40 Gy. Lavar 4 x e contagem. Ressuspender o LCL em meio de células T contendo soro humano a 2,5 x 10 5 células / mL. Adicionar 1 mL de LCL por poço de uma placa de 24 poços. Além disso, adicionam-se 5 x 10 6 LCL para um dispositivo de cultura, bem como Grex40 5 ng / mL de IL-15 13.
- Colheita das células T. Centrifugar durante 5 minutos @ xg 400, aspirar o sobrenadante e ressuspender em meio de células T contendo soro humano a 1 x 10 6 células T / mL. Adicionam-se 5 ng / mL de IL-15 e adicionar 1 mL / poço de células T (total de 1 x 10 6 células T) para o LCL que já estão na placa de 24 poços. No Grex40, trazero volume total do material até 30 mL.
- No dia 3-4 de pós-estimulação, se as células confluentes são dividir (na placa) 1:1 e adicionar meio fresco contendo 50 U / mL de IL-2. Se eles não são, em seguida, simplesmente confluente ½ aspirar os meios de comunicação e substitua com meio contendo 50 U / mL de IL-2. No Grex40, aspirar a metade dos meios de comunicação, substituir com novas mídias, e adicionar 50 U / mL de IL-2.
- No dia 7, repetir como no passo 4,6, mas utilização de IL-2 no dia da estimulação, e não a IL-15.
5. Resultados representativos
Um esquema do protocolo de fabricação GMP conforme aprovado pelo FDA é apresentada na Figura 1. O processo leva cerca de 50 dias. Métodos típicos de gerar células específicas do vírus T expandir pré-existentes células T de memória, no entanto, carece de sangue do cordão umbilical células T-vírus experientes e, portanto, precisamos nobre ingênuo ex vivo de células T. Para fazer isso, utilizamos células dendríticas assim como as citocinas IL-7, IL-12 e IL-15,necessária para a geração de especificidade viral.
Depois de 3 estímulos, o rendimento deverá ser superior a 100x10 6 células. Se as células não estiverem disponíveis, os estímulos adicionais podem ser realizados até que o número desejado de CTLs estão disponíveis. A maioria destas células deve ser CD3 + com uma mistura de células CD4 + e CD8 +. Deverá haver menos de 15% de células NK (CD3-/CD56 +) e menos de 1% de células B CD19 + (Figura 2).
O CTL expandido deve reconhecer o antigénio de pp65 de CMV, hexon e penton de adenovirus, bem como numerosos antigénios de EBV, que são expressos em EBV-LCL. Quando testados num ensaio ELISPOT, CTL deve segregar mais IFN-? em resposta a estes antigénios do que os antigénios irrelevantes (Figura 3).
O CTL deve também lisar virais peptídeo-pulsados alvos de blastos PHA tais. Num ensaio de libertação de 51Cr, de CTL deve lisar LCL, CMVpp65 pulsado e Adenovirus hexon e /penton ou pulsado alvos, mas não alvos pulsados com peptídeos irrelevantes (Figura 4).
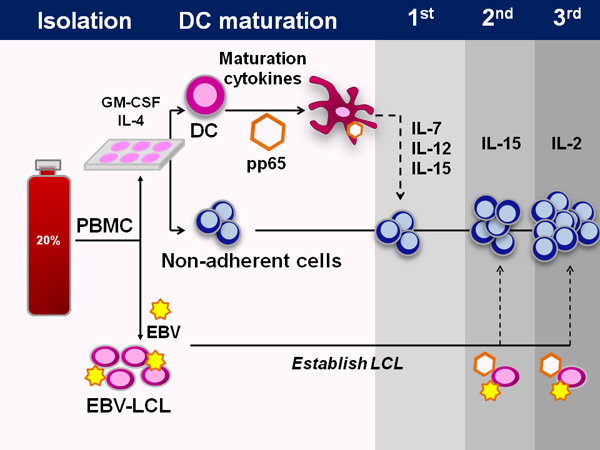
Figura 1. Geração de multi-virus-specific CTL a partir do sangue do cordão umbilical. Esquemática, que mostra todo o processo de fabrico de CTL a partir do sangue do cordão umbilical. Primeiro, as células mononucleares do sangue do cordão são isolados a partir da fracção de 20% da unidade de fraccionamento de sangue de cordão umbilical. Com a excepção de 5x10 6 células que são guardados para a geração de LCL, todas as células são em seguida incubadas em meio de células dendriticas, durante 1-2 horas, altura em que as células não-aderentes foram colhidas e congeladas. A DC são então alimentados DC media contendo IL-4 e GM-CSF. Após 5 dias de cultura, o DC são amadurecidas e transduzidas com um vector adenoviral contendo o antigénio imunodominante CMV pp65. Na iniciação, estas DC são combinadas com as células não-aderentes, bem como as citocinas IL-7, IL-12,e IL-15. No estimulações subsequentes, o vector adenoviral mesmo é utilizado para transduzir EBV-LCL, que são utilizadas como as células apresentadoras de antigénio. IL-15 é utilizado para a segunda estimulação de IL-2 e em seguida.
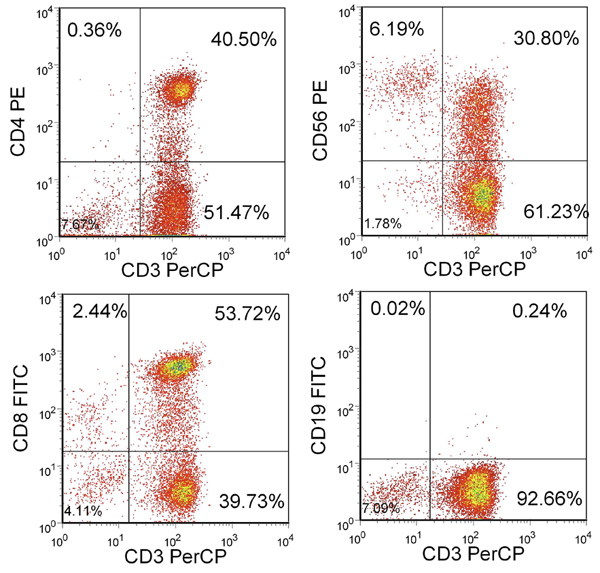
Figura 2. Fenótipo de células T resultante. Mostrada a percentagem de células vivas incluídos na barreira linfocitária. CTL são CD3 + e CD4 + ou CD8 +, mas em grande parte CD3-/CD56- e CD19-.
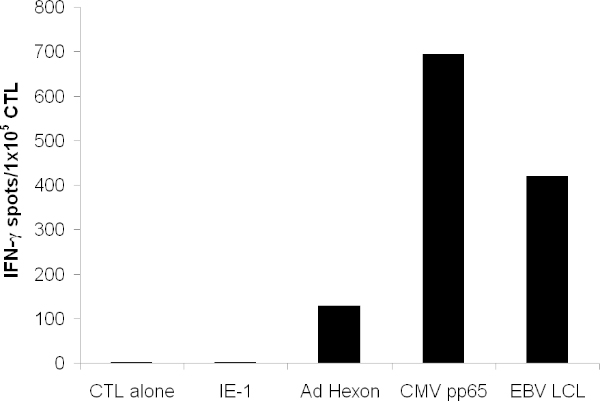
Figura 3. T funcionalidade celular. Especificidade das células T foi testada por IFN-γELISPOT. As células T foram pulsadas com peptídeos sobrepostos abrangendo toda a proteína de hexon, penton, pp65 e o antigénio irrelevante IE-1. CTL sozinho indica meio sozinho. LCL autólogas foram irradiadas e adicionado a 1x10 5 / poço. É mostrado o ponto médio formando celular count de poços em triplicado.
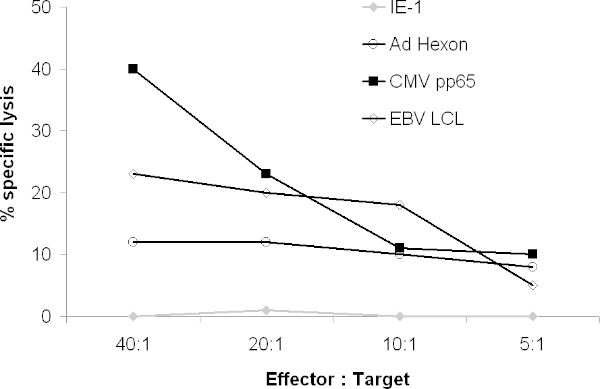
Figura 4. A actividade citolítica de CTL. A capacidade do CTL resultante para lisar alvos que expressam antigénios virais foi testado num ensaio de Cr 51. 51 Cr-blastos autólogos marcados com PHA foram pulsadas com peptídeos sobrepostos abrangendo o antigénio inteiro ou 51Cr-marcado LCL autólogas foram co-cultivadas com CTL. Depois de 4 horas, a libertação de gama foi contada num contador gama.
Access restricted. Please log in or start a trial to view this content.
Discussão
As estratégias actuais no sentido de controlar as infecções virais após TCC pode ser eficaz, mas estão associadas com toxicidade significativa, são caros, e não conferem protecção a longo prazo contra a infecção posterior. Na verdade, o uso de algumas drogas antivirais podem limitar a expansão de células T específicas de vírus que de outra forma seria protectora 14. Outra opção é a infusão de doador derivados de vírus-células T específicas. Nós e outros autores mostraram que essas...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado por uma L. Dan Duncan colaborativo bolsa de investigação (CMB e EJS), o Instituto Nacional do Coração, Pulmão e Sangue (US4HL081007), uma Leucemia e Linfoma Sociedade prêmio Acadêmico de Pesquisa Clínica (CMB), e do Instituto Nacional do Câncer (RO1 CA06150816; EJS).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| RPMI 1640 | Invitrogen | 21870-076 | |
| DC mídia | CellGenix | 20801-0500 | |
| EHAA (meio de Click) | Irvine Scientific | 9195 | |
| Soro Humano | Gémeos Bio Products | 100-110 | |
| Gás Permeável Cultureware 18 | Wilson-Wolf | 80040S | |
| IL-2 | Chiron (TCH Farmácia) | ||
| IL-12 | NCI / CTEP | ||
| IL-15 | CellGenix | 1013-050 | |
| IL-7 | R & D | AFL207 | |
| IL-1beta | R & D | AFL201 | |
| IL-6 | CélulaGenix | 1004-050 | |
| GM-CSF | TCH Farmácia | ||
| IL-4 | R & D | AFL204 | |
| TNF-alfa | R & D | AFL210 | |
| Ad5f35pp65 | BCM CAGT Facilidade de Produção Vector | ||
| Transferência de plasma conjunto com adaptador luer fêmea | Carta de Medicina | 89-550-66J | |
| Lymphoprep | Nycomed | 1114550 |
Referências
- Kennedy-Nasser, A. A. Comparable outcome of alternative donor and matched sibling donor hematopoietic stem cell transplant for children with acute lymphoblastic leukemia in first or second remission using alemtuzumab in a myeloablative conditioning regimen. Biol. Blood Marrow Transplant. 14, 1245-1245 (2008).
- Hanley, P. J. Improving clinical outcomes using adoptively transferred immune cells from umbilical cord blood. Cytotherapy. 12, 713(2010).
- Szabolcs, P., Cairo, M. S. Unrelated umbilical cord blood transplantation and immune reconstitution. Semin. Hematol. 47, 22(2010).
- Canto, E., Rodriguez-Sanchez, J. L., Vidal, S. Distinctive response of naive lymphocytes from cord blood to primary activation via TCR. J. Leukoc. Biol. 74, 998-998 (2003).
- Leen, A. M. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1160 (2006).
- Riddell, S. R. Restoration of viral immunity in immunodeficient humans by the adoptive transfer of T cell clones. Science. 257, 238(1992).
- O'Reilly, R. J. Adoptive transfer of antigen-specific T-cells of donor type for immunotherapy of viral infections following allogeneic hematopoietic cell transplants. Immunol. Res. 38, 237-237 (2007).
- Peggs, K. S. Adoptive cellular therapy for early cytomegalovirus infection after allogeneic stem-cell transplantation with virus-specific T-cell lines. Lancet. 362, 1375-1375 (2003).
- Sili, U. Large-scale expansion of dendritic cell-primed polyclonal human cytotoxic T-lymphocyte lines using lymphoblastoid cell lines for adoptive immunotherapy. J. Immunother. 26, 241(2003).
- Bollard, C. M. Good manufacturing practice-grade cytotoxic T lymphocytes specific for latent membrane proteins (LMP)-1 and LMP2 for patients with Epstein-Barr virus-associated lymphoma. Cytotherapy. 13, 518(2011).
- Hanley, P. J. Functionally active virus-specific T cells that target CMV, adenovirus, and EBV can be expanded from naive T-cell populations in cord blood and will target a range of viral epitopes. Blood. 114, 1958(1958).
- Hanley, P. J. Expansion of T cells targeting multiple antigens of cytomegalovirus, Epstein-Barr virus and adenovirus to provide broad antiviral specificity after stem cell transplantation. Cytotherapy. , (2011).
- Gerdemann, U. Generation of Multivirus-specific T Cells to Prevent/treat Viral Infections after Allogeneic Hematopoietic Stem Cell Transplant. J. Vis. Exp. (51), e2736(2011).
- Mori, T., Kato, J. Cytomegalovirus infection/disease after hematopoietic stem cell transplantation. Int. J. Hematol. 91, 588(2010).
- Einsele, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916(2002).
- Bao, L. Expansion of cytomegalovirus pp65 and IE-1 specific cytotoxic T lymphocytes for cytomegalovirus-specific immunotherapy following allogeneic stem cell transplantation. Biol. Blood Marrow Transplant. 14, 1156(2008).
- Shpall, E. J., Bollard, C. M., Brunstein, C. Novel cord blood transplant therapies. Biol. Blood Marrow Transplant. 17, Suppl 1. S39-S45 (2011).
- Vera, J. F. Accelerated production of antigen-specific T cells for preclinical and clinical applications using gas-permeable rapid expansion cultureware (G-Rex. J. Immunother. 33, 305(2010).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados