Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'expansion des lymphocytes T cytotoxiques à partir de sang de cordon ombilical qui cytomégalovirus cible, le virus Epstein-Barr Virus et Adénovirus
Dans cet article
Résumé
Nous décrivons ici la première bonne pratique de fabrication (BPF) conforme à la méthode de production spécifiques du virus de lymphocytes T cytotoxiques (CTL) à partir de sang de cordon ombilical, source de cellules T naïves principalement.
Résumé
Les infections virales après transplantation de cellules souches sont parmi les causes les plus fréquentes de décès, en particulier après le sang du cordon (CB) transplantation (TCC) où le CB ne contient pas un nombre appréciable de cellules T du virus expérimentés qui peuvent protéger le destinataire de l'infection 1. - 4 Nous et d'autres ont montré que le virus de CTL spécifique généré à partir de donneurs séropositifs et infusé au bénéficiaire sont en sécurité et de protection. 8.5 Cependant, jusqu'à récemment, le virus de cellules T spécifiques ne pouvaient pas être générée à partir de sang de cordon, probablement en raison de la absence de virus-cellules T spécifiques de la mémoire.
Dans un effort pour mieux imiter les conditions d'amorçage in vivo des cellules T naïves, nous avons établi une méthode qui a utilisé des cellules dendritiques dérivées de CB (DC) transduites avec un vecteur adénoviral (Ad5f35pp65) contenant l'antigène pp65 CMV immunodominant, par conséquent, de conduire la spécificité des lymphocytes T vers le CMV et l'adénovirus. 9 Au début, nous utilisons ces machinesPED structurés, ainsi que CB dérivées des cellules T en présence des cytokines IL-7, IL-12 et IL-15. Au 10 secondes, nous avons utilisé la stimulation transformées par EBV des cellules B, ou EBV-LCL, qui expriment à la fois latente et lytiques antigènes d'EBV. Ad5f35pp65-transduites EBV-LCL sont utilisés pour stimuler les cellules T en présence d'IL-15 à la seconde stimulation. Stimulations ultérieures utilisent Ad5f35pp65 transduites par EBV-LCL et de l'IL-2.
De 6 CB 50x10 cellules mononucléaires nous sommes en mesure de générer plus de 150 x 10 6 virus de cellules T spécifiques de l'antigène qui lysent des cibles pulsées et des cytokines libération en réponse à une stimulation antigénique. 11 Ces cellules ont été fabriqués d'une manière conforme aux BPF en utilisant seulement la fraction 20% d'une unité de fractionnement de sang de cordon et qui ont été convertis pour un usage clinique.
Protocole
1. Isolement de cellules mononucléaires (jour 0)
- Insérer pointe de raccord luer femelle au port de sortie de la fraction de 20% de l'unité de sang de cordon, fixer une seringue et retirer le sang. Transférer le sang décongelé à 20 mL de RPMI réchauffé dans 50 ml tube à centrifuger. Rincer sac de sang de cordon ombilical avec 5 ml de RPMI et transférer dans le tube à centrifugation.
- Centrifuger les cellules pendant 10 minutes à 400 x g. Aspirer le surnageant.
- Remettre en suspension les cellules dans 20 ml de RPMI chaud. Cellules couche sur 15 ml de Lymphoprep dans 50 ml tube à centrifuger. Centrifuger 40 minutes à 400 x g.
- Récolter l'interface contenant les cellules mononucléaires et laver dans 20 ml de RPMI. Centrifuger pendant 10 minutes à 450 x g.
- Aspirer le surnageant et laver dans 20 ml de RPMI. Compter les cellules et faire tourner pendant 5 minutes à 400 x g.
- Aspirer le surnageant et remettre en suspension les cellules à 5 x 10 6 cellules mononucléées / mL de CellGenix DC médias (sans sérum). Prélever 1 mL pour l'EBV-LCL génération et la mise en CE 15 mlntrifuge tube.
2. Génération des cellules dendritiques (à partir du jour 0)
- Planche 2 ml de cellules (sont déjà à 5 x 10 6 cellules / ml de DC médias) par puits dans une plaque à 6 puits. Laisser dans l'incubateur pendant 1-2 heures.
- Après 1-2 heures, laver les cellules non adhérentes par lavage 3-4 fois avec du PBS. Recueillir les cellules non adhérentes et les congeler. Ajouter 2 ml / puits de médias DC contenant 1000 U / ml d'IL-4 et 800 U / ml de GM-CSF.
- 3-4 jours après l'initiation DC, reconstituer l'IL-4 et de GM-CSF par addition de 100 pl / puits de milieu contenant une concentration finale de 1000U/mL IL-4 et 800 U / ml de GM-CSF.
- Le jour de 5-6, la récolte de la DC en grattant le puits avec une pipette de transfert. Compter les cellules grandes et centrifuger pendant 5 min à 400 x g. Aspirer les médias et remettre en suspension DC à 2x10 6 cellules / ml de DC médias. Ajouter 0,5 mL / puits d'une plaque de 24 puits.
- Transduire le courant continu en utilisant le vecteur Ad5f35pp65 à une cellule par MOI de 10 unités infectieuses. Ajouter vector à chaque puits dans une plaque de 24 puits. Incuber les cellules pendant 1,5 heures. Au bout de 1,5 heures, ajouter 1,5 ml / puits de DC médias contenant: 1000 U / ml d'IL-4, 800 U / ml de GM-CSF, 10 ng / ml de TNF-alpha, 1 ug / ml de PGE-1, 100 ng / mL IL-6, et 10 ng / ml d'IL-1beta. Ces cytokines mûrir les pays en développement.
3. Génération de l'EBV LCL (à partir du jour 0)
- Centrifuger le tube contenant les 5 x 10 6 cellules mononucléaires. Ajouter 200 ul de surnageant concentré EBV B95.8 et 1,8 ml de milieu complet (RPMI + 10% FBS + 2 mM de L-glutamine) contenant la cyclosporine (1 pg / ml).
- Aliquote de 100 ul de cellules dans 10 puits d'une plaque de 96 puits et 200 ul dans 5 puits. Ajouter 100 ul de médias complet + cyclosporine dans les puits ne contenant que 100 ul de cellules. Remplir les puits restants avec de l'eau stérile.
- Nourrir l'hebdomadaire LCL et développer à partir d'une plaque de 96 puits dans une plaque de 24 puits après ~ 2 semaines. Après une autre semaine, transférer dans un flacon T25 et dans le transfert de semaine suivante àun flacon T75. A ce stade, il est recommandé que vous gelez aliquotes de LCL. Il prend généralement de 1 mois à générer un nombre suffisant de LCL.
4. CTL Initiation - 7 jours après le début des PED
- PED récolte et irradier à 30 Gy. Lavez 4 x et le nombre. Remettre en suspension dans un milieu continu de cellules T contenant le sérum humain (45% de RPMI, 45% de Click, 10% de sérum humain, 2 mM de L-glutamine) @ 1 x 10 5 DC / ml.
- Décongeler les cellules non adhérentes de l'étape 2,2. Laver les cellules, et à compter. Remettre en suspension à 2 x 10 6 cellules non-adhérentes / mL dans les médias lymphocytes T contenant le sérum humain. Ajouter 10 ng / ml d'IL-7 et IL-12, et 5 ng / ml d'IL-15. Ajouter 1 mL de cellules par puits dans une plaque de 24 puits. Ajouter 1 ml de DC par puits. Remplir les puits vides de plaque de 24 puits avec de l'eau stérile.
- 7 jours après le début de cellule T, d'alimentation et / ou de diviser des cellules de lymphocytes T avec des milieux contenant du sérum humain.
- 9-12 jours après le début des lymphocytes T, les lymphocytes T geler jusqu'à ce que la LCL sont prêts.
- Once LCL ont augmenté et sont passés dans des flacons T75, la transduction du LCL par centrifugation pendant 5 min à 400 x g. Ajouter le vecteur de la pastille de cellules à une MOI de 100 unités infectieuses par cellule. Incuber pendant 1,5 heures. Au bout de 1,5 heures, remettre en suspension dans un milieu complet à 5 x 10 5 LCL / ml et ajouter 2 ml par puits dans une plaque de 24 puits. 12
- Après 2 jours, la récolte du LCL et irradier à 40 Gy. Lavez 4 x et le nombre. Reprendre le LCL dans les médias lymphocytes T contenant du sérum humain à 2,5 x 10 5 cellules / ml. Ajouter 1 mL de LCL par puits d'une plaque de 24 puits. En outre, ajouter 5 x 10 6 LCL à un dispositif de culture Grex40 ainsi que 5 ng / ml d'IL-15 13.
- Récolter les cellules T. Centrifuger pendant 5 minutes à 400 xg, aspirer le surnageant et remettre en suspension dans un milieu contenant du sérum de cellules T humaines à 1 x 10 6 cellules T / mL. Ajouter 5 ng / ml d'IL-15 et ajouter 1 mL / puits de cellules T (total de 1 x 10 cellules T 6) au LCL qui sont déjà dans la plaque de 24 puits. Dans le Grex40, apportezle volume total des supports jusqu'à 30 ml.
- Le jour post-stimulation 3-4, si les cellules sont confluentes, puis les séparer (de la plaque) 1:1 et ajouter du milieu frais contenant 50 U / ml d'IL-2. Si elles ne sont pas confluentes alors simplement aspirer ½ les médias et le remplacer par un milieu contenant 50 U / ml d'IL-2. Dans le Grex40, aspirer la moitié des médias, remplacez-le par du milieu frais, et ajouter 50 U / ml d'IL-2.
- Au jour 7, répétez comme à l'étape 4.6 mais l'utilisation d'IL-2 le jour de la stimulation, et non l'IL-15.
5. Les résultats représentatifs
Un schéma du protocole de fabrication BPF approuvé par la FDA est représenté dans la figure 1. Le processus prend environ 50 jours. Les méthodes typiques de générer des virus de cellules T spécifiques de développer préexistantes cellules T mémoires, mais manque de sang de cordon ombilical des cellules T du virus expérimentés et donc nous avons besoin pour amorcer vivo T naïfs ex cellules. Pour ce faire, nous utilisons des cellules dendritiques ainsi que les cytokines IL-7, IL-12 et IL-15,nécessaire pour générer une spécificité virale.
Après 3 stimulations, le rendement doit être supérieur à 100x10 6 cellules. Si les cellules ne sont pas suffisantes, les stimulations supplémentaires peuvent être effectuées jusqu'à ce que le nombre souhaité de CTL sont disponibles. La majorité de ces cellules devrait être CD3 + avec un mélange de lymphocytes CD4 + et CD8 +. Il devrait y avoir moins de 15% de cellules NK (CD3-/CD56 +) et moins de 1% des cellules CD19 + B (figure 2).
Le CTL élargie devrait reconnaître l'antigène pp65 du CMV, hexon et du penton de l'adénovirus, ainsi que de nombreux antigènes d'EBV qui sont exprimés sur LCL EBV. Lors d'un essai dans un test ELISPOT, CTL doit sécréter plus d'IFN-? en réponse à ces antigènes que les antigènes non pertinents (figure 3).
Le CTL devraient également lyse virale peptide-pulsés tels objectifs explosions de PHA. Dans un essai de libération de 51Cr, CTL devraient lyser LCL, CMVpp65-Adenovirus hexon pulsé et-et /ou penton-pulsé objectifs, mais pas les cibles puisées avec des peptides non pertinents (figure 4).
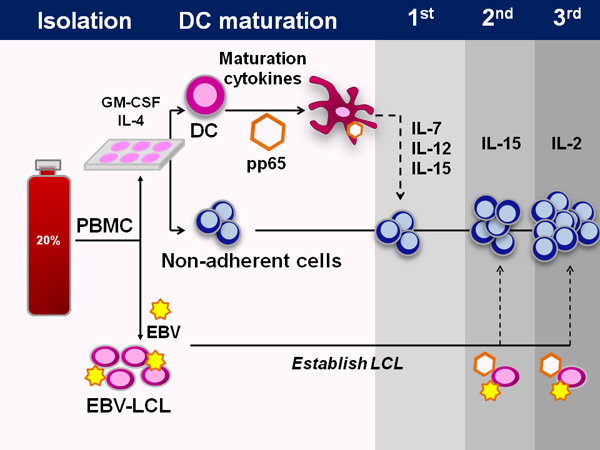
Figure 1. Génération de multi-virus CTL spécifiques du sang de cordon. Schéma montrant l'ensemble du processus de fabrication CTL à partir de sang de cordon. Première des cellules mononucléées de sang de cordon sont isolés à partir de la fraction 20% de l'unité de fractionnement du sang de cordon ombilical. À l'exception de 5x10 6 cellules qui sont enregistrés pour la génération de LCL, toutes les cellules sont ensuite étalées dans les médias de cellules dendritiques pendant 1-2 heures, après quoi les cellules non adhérentes sont récoltés et congelés. Le DC sont ensuite introduits DC médias contenant de l'IL-4 et GM-CSF. Après 5 jours de culture, le DC sont élevés et transduites avec un vecteur adénoviral contenant l'antigène pp65 CMV immunodominant. Lors de l'initiation, les DC sont combinées avec les cellules non-adhérentes ainsi que des cytokines IL-7, IL-12,et IL-15. À des stimulations suivantes, le vecteur adénoviral est même utilisé pour transduire des EBV-LCL, qui sont utilisées comme cellules présentatrices d'antigène. IL-15 est utilisé à la deuxième stimulation et d'IL-2 par la suite.
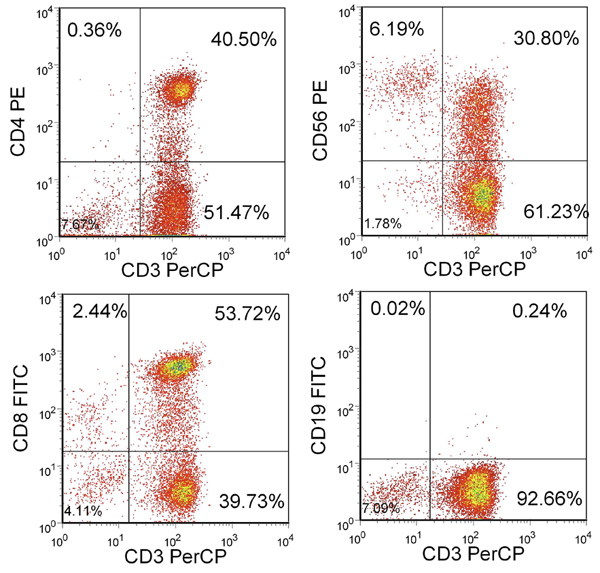
Figure 2. Phénotype des cellules T en résulte. Représenté est le pourcentage de cellules vivantes inclus dans la grille des lymphocytes. CTL sont CD3 + CD4 + et CD8 + ou en grande partie, mais CD3-/CD56- et CD19-.
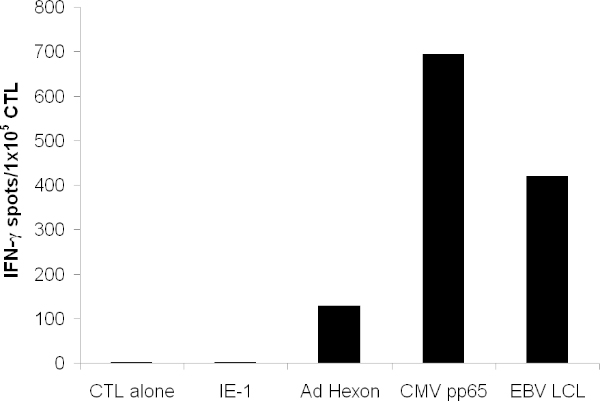
Figure 3. Fonctionnalité des cellules T. La spécificité des lymphocytes T a été testé par l'IFN-γELISPOT. Les cellules T ont été marquées avec des peptides se chevauchant couvrant la totalité de la protéine hexon, penton, pp65, et l'antigène sans rapport IE-1. CTL seul indique médias seul. LCL autologues ont été irradiés et ajoutés à 1x10 5 / puits. Montré est l'endroit moyen formant cellule contant de trois puits.
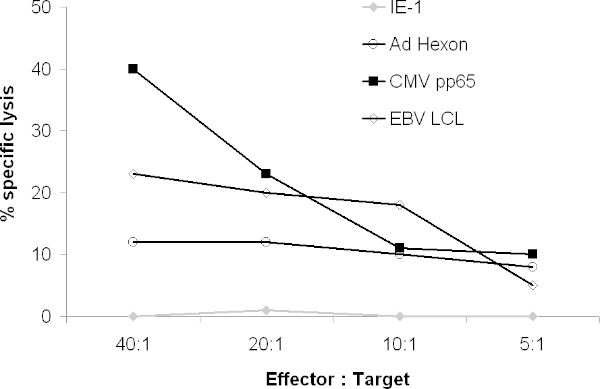
La figure 4. Activité cytolytique des CTL. La capacité du CTL résultant de lyser des cibles exprimant des antigènes viraux a été testé dans un essai de 51 Cr 51. Cr-étiquetés autologues explosions PHA ont été puisées avec des peptides chevauchant couvrant l'antigène entier ou 51 Cr marqué autologue LCL ont été co-cultivées avec des CTL. Après 4 heures, la libération gamma a été comptée sur un compteur gamma.
Access restricted. Please log in or start a trial to view this content.
Discussion
Les stratégies actuelles visant à lutter contre les infections virales après CBT peuvent être efficaces, mais ils sont associés à des toxicités importantes, sont coûteux, et ne confèrent pas une protection à long terme contre l'infection plus tard. En fait, l'utilisation de certains médicaments antiviraux peuvent limiter l'expansion des cellules T spécifiques du virus qui seraient autrement protection. 14 Une autre option est l'infusion de cellules virales spécifiques des ba...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu par un Dan L. Duncan subvention de recherche concertée (CMB et EJS), le National Heart, Lung, and Blood Institute (US4HL081007), une Société de leucémie et lymphome prix de recherche clinique Scholar (CMB) et le National Cancer Institute (RO1 CA06150816; EJS).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| RPMI 1640 | Invitrogen | 21870-076 | |
| DC médias | CellGenix | 20801-0500 | |
| EHAA (Moyen cliquable) | Irvine Scientific | 9195 | |
| Sérum humain | Gémeaux Produits Bio | 100-110 | |
| Perméables aux gaz Cultureware 18 | Wilson-Loup | 80040S | |
| IL-2 | Chiron (TCH pharmacie) | ||
| IL-12 | NCI / CTEP | ||
| IL-15 | CellGenix | 1013-050 | |
| IL-7 | R & D | AFL207 | |
| IL-1beta | R & D | AFL201 | |
| IL-6 | CelluleGenix | 1004-050 | |
| GM-CSF | TCH pharmacie | ||
| IL-4 | R & D | AFL204 | |
| TNF-alpha | R & D | AFL210 | |
| Ad5f35pp65 | BCM CAGT installation de production de vecteur | ||
| Transfert au plasma avec adaptateur Luer femelle | Charte médical | 89-550-66j | |
| Lymphoprep | Nycomed | 1114550 |
Références
- Kennedy-Nasser, A. A. Comparable outcome of alternative donor and matched sibling donor hematopoietic stem cell transplant for children with acute lymphoblastic leukemia in first or second remission using alemtuzumab in a myeloablative conditioning regimen. Biol. Blood Marrow Transplant. 14, 1245-1245 (2008).
- Hanley, P. J. Improving clinical outcomes using adoptively transferred immune cells from umbilical cord blood. Cytotherapy. 12, 713(2010).
- Szabolcs, P., Cairo, M. S. Unrelated umbilical cord blood transplantation and immune reconstitution. Semin. Hematol. 47, 22(2010).
- Canto, E., Rodriguez-Sanchez, J. L., Vidal, S. Distinctive response of naive lymphocytes from cord blood to primary activation via TCR. J. Leukoc. Biol. 74, 998-998 (2003).
- Leen, A. M. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1160 (2006).
- Riddell, S. R. Restoration of viral immunity in immunodeficient humans by the adoptive transfer of T cell clones. Science. 257, 238(1992).
- O'Reilly, R. J. Adoptive transfer of antigen-specific T-cells of donor type for immunotherapy of viral infections following allogeneic hematopoietic cell transplants. Immunol. Res. 38, 237-237 (2007).
- Peggs, K. S. Adoptive cellular therapy for early cytomegalovirus infection after allogeneic stem-cell transplantation with virus-specific T-cell lines. Lancet. 362, 1375-1375 (2003).
- Sili, U. Large-scale expansion of dendritic cell-primed polyclonal human cytotoxic T-lymphocyte lines using lymphoblastoid cell lines for adoptive immunotherapy. J. Immunother. 26, 241(2003).
- Bollard, C. M. Good manufacturing practice-grade cytotoxic T lymphocytes specific for latent membrane proteins (LMP)-1 and LMP2 for patients with Epstein-Barr virus-associated lymphoma. Cytotherapy. 13, 518(2011).
- Hanley, P. J. Functionally active virus-specific T cells that target CMV, adenovirus, and EBV can be expanded from naive T-cell populations in cord blood and will target a range of viral epitopes. Blood. 114, 1958(1958).
- Hanley, P. J. Expansion of T cells targeting multiple antigens of cytomegalovirus, Epstein-Barr virus and adenovirus to provide broad antiviral specificity after stem cell transplantation. Cytotherapy. , (2011).
- Gerdemann, U. Generation of Multivirus-specific T Cells to Prevent/treat Viral Infections after Allogeneic Hematopoietic Stem Cell Transplant. J. Vis. Exp. (51), e2736(2011).
- Mori, T., Kato, J. Cytomegalovirus infection/disease after hematopoietic stem cell transplantation. Int. J. Hematol. 91, 588(2010).
- Einsele, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916(2002).
- Bao, L. Expansion of cytomegalovirus pp65 and IE-1 specific cytotoxic T lymphocytes for cytomegalovirus-specific immunotherapy following allogeneic stem cell transplantation. Biol. Blood Marrow Transplant. 14, 1156(2008).
- Shpall, E. J., Bollard, C. M., Brunstein, C. Novel cord blood transplant therapies. Biol. Blood Marrow Transplant. 17, Suppl 1. S39-S45 (2011).
- Vera, J. F. Accelerated production of antigen-specific T cells for preclinical and clinical applications using gas-permeable rapid expansion cultureware (G-Rex. J. Immunother. 33, 305(2010).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon