Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ausbau zytotoxische T-Lymphozyten aus Nabelschnurblut, dass Target Cytomegalovirus, Epstein-Barr-Virus und Adenovirus
In diesem Artikel
Zusammenfassung
Hier beschreiben wir die erste Good Manufacturing Practice (GMP)-kompatiblen Verfahren zur Herstellung virus-spezifische zytotoxische T-Lymphozyten (CTL) aus Nabelschnurblut, eine Quelle von überwiegend naiven T-Zellen.
Zusammenfassung
Virus-Infektionen nach einer Stammzelltransplantation gehören zu den häufigsten Todesursachen, besonders nach Nabelschnurblut (CB) Transplantation (CBT), wo die CB enthält keine nennenswerte Zahl von Virus-erfahrenen T-Zellen, die den Empfänger vor einer Infektion schützen können 1. - Wir und andere 4 gezeigt, dass Virus-spezifische CTL von seropositiven Spendern erzeugt und an den Empfänger infundiert haben sind sicher und schützend. 5-8 jedoch bis vor kurzem Virus-spezifischen T-Zellen nicht aus Nabelschnurblut erzeugt werden, was wahrscheinlich auf die Abwesenheit von virus-spezifischen Gedächtnis-T-Zellen.
In dem Bemühen, besser zu imitieren die in vivo Bedingungen Priming von naiven T-Zellen haben wir ein Verfahren, CB-abgeleitete dendritische Zellen (DC) transduziert mit einem adenoviralen Vektor (Ad5f35pp65), enthaltend die CMV immundominanten pp65 verwendet, daher T-Zell-Spezifität Antreiben Richtung CMV und Adenovirus. 9 Bei der Initiierung, verwenden wir diese marierte DCs sowie CB-abgeleiteten T-Zellen in Gegenwart der Cytokine IL-7, IL-12 und IL-15. 10 In der zweiten Stimulation verwendeten wir EBV-transformierten B-Zellen oder EBV-LCL, die sowohl exprimieren latente und lytische EBV-Antigene. Ad5f35pp65-transduzierten EBV-LCL werden verwendet, um die T-Zellen in Gegenwart von IL-15 bei der zweiten Stimulation zu stimulieren. Nachfolgende Reize verwenden Ad5f35pp65-transduzierten EBV-LCL und IL-2.
Von 50x10 6 CB mononukleären Zellen können wir nach oben von 150 x 10 6 Virus-spezifischen T-Zellen, Antigen-gepulste Freisetzung Targets und Zytokinen in Reaktion auf Antigenstimulation lysieren erzeugen. 11. Diese Zellen wurden in einer GMP-gerechte Weise hergestellt unter Verwendung nur die 20%-Anteil an einer fraktionierten Nabelschnurblut Einheit und haben für den klinischen Einsatz übersetzt worden.
Protokoll
Ein. Mononukleären Zellen Isolation (Tag 0)
- Legen Spitze von weiblichen Luer-Adapter in die Steckdose Port des 20% Anteil an der Nabelschnurblut-Einheit legen Spritze und entfernen Sie das Blut. Die aufgetauten Blut 20 ml RPMI erwärmt in 50 ml Zentrifugenröhrchen. Spülen Nabelschnurblut Beutel mit 5 ml RPMI und Transfer zum gleichen Zentrifugenröhrchen.
- Zentrifuge Zellen für 10 Minuten bei 400 x g beträgt. Absaugen des Überstandes.
- Resuspendieren Zellen in 20 ml warmem RPMI. Schicht von Zellen auf 15 ml Lymphoprep in 50 ml Zentrifugenröhrchen. Zentrifuge 40 Minuten bei 400 x g.
- Ernten die Schnittstelle mit den mononukleären Zellen und waschen in 20 ml RPMI. Zentrifuge für 10 Minuten bei 450 x g.
- Absaugen des Überstandes und waschen in 20 ml RPMI. Zählen von Zellen und Spin für 5 Minuten bei 400 x g.
- Absaugen des Überstandes und resuspendieren Zellen bei 5 x 10 6 mononukleären Zellen / ml CellGenix DC Medien (Serum-frei). Entfernen 1 mL für EBV-LCL-Generation und in 15 mL centrifuge Röhre.
2. Dendritische Zelle Generation (beginnend am Tag 0)
- Platte 2 ml Zellen (bereits bei 5 x 10 6 Zellen / ml Medium DC) pro Vertiefung in eine Platte mit 6 Vertiefungen. Lassen Sie im Inkubator für 1-2 Stunden.
- Nach 1-2 Stunden, Auswaschen der nicht-adhärenten Zellen durch Waschen 3-4 mal mit PBS. Sammeln Sie die nicht-adhärenten Zellen und einfrieren. 2 ml / Vertiefung des DC Medien mit 1000 U / ml IL-4 und 800 U / ml GM-CSF.
- 3-4 Tage nach DC Initiierung, füllt die IL-4 und GM-CSF durch Zugabe von 100 ul / Vertiefung von Medien mit einer Endkonzentration von 1000U/mL IL-4 und 800 U / ml GM-CSF.
- Am Tag 5-6, Ernte der DC durch Abkratzen der gut mit einer Pipette. Zählen Sie die großen Zellen und Zentrifuge für 5 Minuten bei 400 x g. Aspirate Medien und resuspendieren DC bei 2x10 6 Zellen / ml DC Medien. 0,5 mL / Well einer 24-Well-Platte.
- Transduzieren die DC mit dem Ad5f35pp65 Vektor bei einer MOI pro Zelle von 10 infektiösen Einheiten. Fügen vector zu jedem Well in einer 24-Well-Platte. Inkubieren Zellen für 1,5 Stunden. Nach 1,5 Stunden, 1,5 mL / Well DC Medien mit: 1000 U / mL IL-4, 800 U / ml GM-CSF, 10 ng / mL TNF-alpha, 1 ug / mL PGE-1, 100 ng / mL IL-6, und 10 ng / ml IL-1beta. Diese Zytokine reifen die DCs.
3. Erzeugung von EBV-LCL (beginnend am Tag 0)
- Zentrifugieren enthaltend die 5 x 10 6 mononukleären Zellen. Fügen Sie 200 ul konzentrierter EBV B95.8 Überstand und 1,8 ml komplettem Medium (RPMI + 10% FBS + 2mM L-Glutamin) enthält Cyclosporin (1 pg / mL).
- Aliquot 100 ul Zellen in 10 Wells einer 96-Well-Platte und in 200 ul 5 Vertiefungen. 100 ul von kompletten media + Cyclosporin zu den Vertiefungen, die nur 100 ul der Zellen. Füllen restlichen Vertiefungen mit sterilem Wasser.
- Führen Sie das LCL wöchentlich und erweitern von einer 96-Well-Platte auf eine 24-Well-Platte nach ~ 2 Wochen. Nach einer weiteren Woche zu einer T25-Flasche übertragen und in der anschließenden Woche Transfer zuma T75-Flasche. In diesem Stadium ist es empfehlenswert, dass Sie Aliquots von LCL einfrieren. Es dauert in der Regel 1 Monat bis eine ausreichende Anzahl von LCL generieren.
4. CTL Initiation - 7 Tage nach Beginn der DCs
- Ernte DCs und strahlen bei 30 Gy. Waschen Sie 4 x und zählen. Resuspendieren DC in T-Zell-Medium mit humanem Serum (45% RPMI, 45% der CLICK, 10% humanem Serum, 2 mM L-Glutamin) bei 1 x 10 5 DCs / ml.
- Auftauen nichtadhärenten Zellen aus Schritt 2.2. Waschen der Zellen und zu zählen. Resuspendieren bei 2 x 10 6 nicht-adhärenten Zellen / ml in T-Zell-Medium, das humanes Serum. Fügen Sie 10 ng / ml IL-7 und IL-12 und 5 ng / ml IL-15. 1 mL Zellen pro Well in einer 24-Well-Platte. 1 mL DC pro Vertiefung. Füllen Sie leere Vertiefungen von 24-Well-Platte mit sterilem Wasser.
- 7 Tage nach der T-Zell-Initiierung, aufgeteilt Futter und / oder die Zellen mit T-Zellen-enthaltenden Medien Humanserum.
- 9-12 Tage nach T-Zell-Initiation, frieren die T-Zellen, bis die LCL bereit sind.
- Once LCL ausgebaut wurden und in T75-Flaschen passagiert, transduzieren das LCL durch Zentrifugation für 5 Minuten bei 400 x g beträgt. Hinzufügen des Vektors zu dem Zellpellet bei einer MOI von 100 infektiösen Einheiten pro Zelle. Inkubieren für 1,5 Stunden. Nach 1,5 Stunden, in komplettem Medium auf 5 x 10 5 LCL / mL resuspendieren und 2 mL pro Vertiefung einer 24-Well-Platte. 12
- Nach 2 Tagen ernten die LCL und strahlen bei 40 Gy. Waschen Sie 4 x und zählen. Resuspendieren des LCL in T-Zell-Medien mit menschlichem Serum bei 2,5 x 10 5 Zellen / ml. 1 mL LCL pro Vertiefung einer 24-Well-Platte. Fügen Sie außerdem 5 x 10 6 LCL einer Grex40 Kultur Gerätes sowie 5 ng / mL IL-15. 13
- Ernten Sie die T-Zellen. Zentrifuge für 5 Minuten bei 400 xg, den Überstand aspirieren und resuspendieren in T-Zell-Medien mit menschlichem Serum bei 1 x 10 6 T-Zellen / mL. Add 5 ng / mL IL-15 und geben Sie 1 ml / Vertiefung von T-Zellen (insgesamt 1 x 10 6 T-Zellen) der LCL, die bereits in den 24-Well-Platte. In der Grex40 bringendas Gesamtvolumen der Medien bis 30 mL.
- Am Tag 3-4 nach der Stimulation, wenn die Zellen konfluent sind dann teilen (in der Platte) 1:1 und frisches Medium mit 50 U / ml IL-2. Wenn sie nicht konfluent sind dann einfach absaugen ½ die Medien und ersetzen mit Medien, die 50 U / ml IL-2. In der Grex40 absaugen die Hälfte der Medien, ersetzen Sie sie durch frische Medien, und 50 U / ml IL-2.
- Am Tag 7, wie in Schritt 4,6 wiederholen, sondern verwenden IL-2 am Tag der Stimulation, nicht IL-15.
5. Repräsentative Ergebnisse
Eine schematische Darstellung der GMP-konformen FDA-zertifizierten Fertigungsstätte Protokoll ist in Abbildung 1 dargestellt. Der Vorgang dauert etwa 50 Tage. Typische Methoden zur Erzeugung von virus-spezifischen T-Zellen zu erweitern bereits vorhandene Gedächtnis-T-Zellen, jedoch fehlt Nabelschnurblut Virus-erfahrenen T-Zellen und deshalb müssen wir prime naiven T-Zellen ex vivo. Hierzu verwenden wir dendritischen Zellen als auch die Zytokine IL-7, IL-12 und IL-15,die zum Erzeugen viralen Spezifität.
Nach 3 Stimulationen, sollte die Ausbeute über 100x10 6-Zellen sein. Wenn genügend Zellen zur Verfügung stehen, können zusätzliche Stimulationen durchgeführt, bis die gewünschte Anzahl von CTLs zur Verfügung stehen. Die Mehrheit dieser Zellen sollten CD3 + mit einem Gemisch aus CD4 + und CD8 + T-Zellen sein. Es sollte weniger als 15% NK-Zellen (CD3-/CD56 +) und weniger als 1% CD19 + B-Zellen (Abb. 2).
Das expandierte CTL sollte das pp65 von CMV, Hexon und Penton erkennt aus Adenovirus, sowie zahlreiche EBV-Antigene, die auf EBV-LCL exprimiert werden. Wenn in einem ELISPOT-Assay getestet, CTL sollte sezernieren mehr IFN-? in Reaktion auf diese Antigene als irrelevant Antigene (Abbildung 3).
Die CTL sollte auch lysieren virale Peptid-gepulsten Ziele wie PHA-Blasten. In einem 51 Cr-Release-Assay sollte CTL lysieren LCL, CMVpp65-gepulste und Adenovirus Hexon-und /oder Penton-gepulste Ziele, aber keine Ziele mit irrelevanten Peptide (Abbildung 4) gepulst.
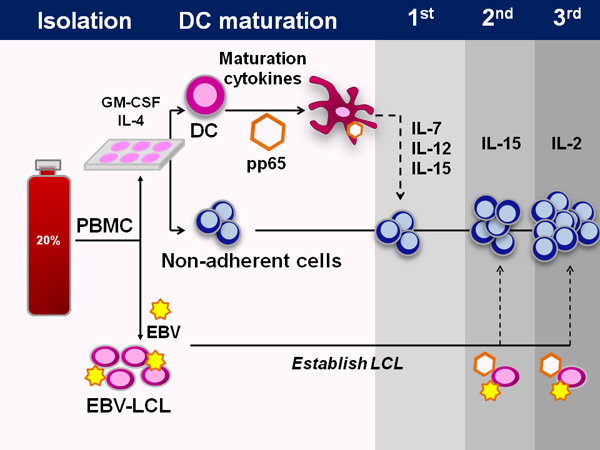
Abbildung 1. Generation von Multi-virus-spezifischen CTL aus Nabelschnurblut. Schematische Darstellung des gesamten Prozesses der CTL Herstellung aus Nabelschnurblut. Zuerst werden die Nabelschnurblut mononukleäre Zellen aus dem 20%-igem Anteil des fraktionierten Nabelschnurblut Gehäuse isoliert. Mit Ausnahme von 5x10 6 Zellen, die für LCL Generation gespeichert werden, werden alle Zellen dann in dendritische Zelle Medien für 1-2 Stunden ausplattiert, an welchem Punkt die nicht-adhärenten Zellen geerntet und eingefroren. Die DC werden dann zugeführt DC Medien mit IL-4 und GM-CSF. Nach 5 Tagen Kultur werden die DC gereift und transduziert mit einem adenoviralen Vektor, der das immundominante CMV pp65. Bei der Initiierung werden diese DC mit den nicht haftenden Zellen sowie den Zytokinen IL-7, IL-12 in Kombination,und IL-15. Bei nachfolgenden Stimulationen wird derselbe adenovirale Vektor verwendet, die EBV-LCL, die als Antigen-präsentierende Zellen verwendet werden transduzieren. IL-15 ist an der zweiten Stimulation und IL-2 danach verwendet.
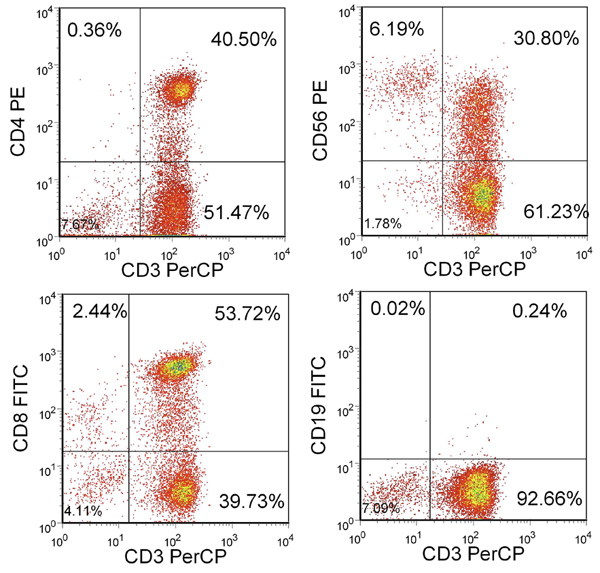
Abbildung 2. Phänotyp der resultierenden T-Zellen. Gezeigt ist der Prozentsatz an lebenden Zellen in der Lymphozyten-Gate enthalten. CTL sind CD3 + und CD4 + oder CD8 + aber weitgehend CD3-/CD56- und CD19-.
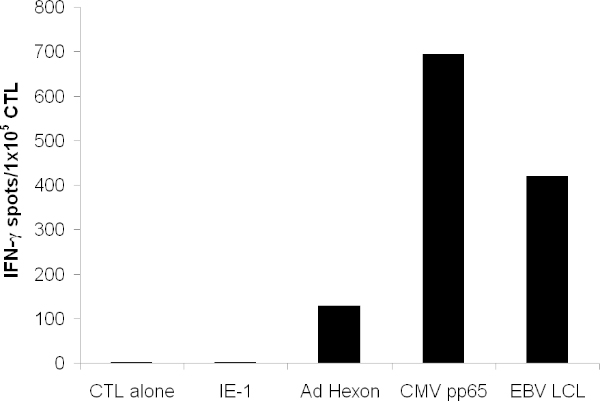
Abbildung 3. T-Zell-Funktionalität. T-Zell-Spezifität wurde durch IFN-γELISPOT getestet. T-Zellen wurden mit überlappenden Peptiden, die die gesamte Protein von Hexon, Pentonbasis, pp65 gepulst und das irrelevante IE-1 Antigens. CTL allein zeigt Medien allein. Autologen LCL bestrahlt wurden und fügte bei 1x10 5 / well. Dargestellt ist die Kassamittelkurs bildende Zelle count der dreifachen Wells.
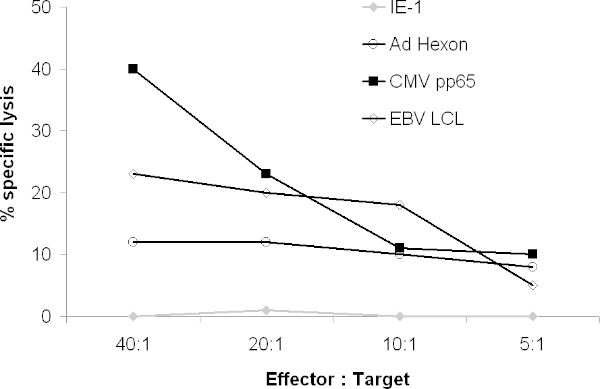
Abbildung 4. Cytolytische Aktivität von CTL. Die Fähigkeit der resultierenden CTL-Ziele zu exprimierenden viralen Antigenen lysieren wurde in einem 51 Cr-Assay getestet. 51 Cr-markierten autologen PHA-Blasten mit überlappenden Peptide, die die gesamte Antigen oder 51 Cr-markierten autologen LCL wurden kokultiviert mit CTL wurden gepulst. Nach 4 Stunden wurde Gamma-Release auf einem Gamma-Zähler gezählt.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Aktuelle Strategien zur Steuerung virale Infektionen nach CBT soll wirksam sein kann, aber sie sind mit erheblicher Toxizität verbunden sind, sind teuer und nicht verleihen langfristigen Schutz gegen spätere Infektionen. In der Tat kann die Verwendung einiger antiviralen Medikamenten begrenzen die Expansion des Virus-spezifischen T-Zellen, die sonst Schutzschicht. 14 weitere Option ist die Infusion von Donor-derived Virus-spezifischen T-Zellen. Wir und andere haben gezeigt, dass solche T-Zellen sicher...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde durch einen Dan L. Duncan kollaborative Forschungsstipendium (CMB und EJS), der National Heart, Lung, and Blood Institute (US4HL081007), ein Leukemia and Lymphoma Society Clinical Research Scholar Award (CMB), und dem National Cancer Institute unterstützt (RO1 CA06150816; EJS).
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Namen Reagenz | Firma | Katalog-Nummer | |
| RPMI 1640 | Invitrogen | 21870-076 | |
| DC Medien | CellGenix | 20801-0500 | |
| EHAA (Anweisungen-Medium) | Irvine Scientific | 9195 | |
| Human Serum | Gemini Bio Produkte | 100-110 | |
| Gasdurchlässige Cultureware 18 | Wilson-Wolf | 80040S | |
| IL-2 | Chiron (TCH Pharmacy) | ||
| IL-12 | NCI / CTEP | ||
| IL-15 | CellGenix | 1013-050 | |
| IL-7 | R & D | AFL207 | |
| IL-1beta | R & D | AFL201 | |
| IL-6 | ZelleGenix | 1004-050 | |
| GM-CSF | TCH Pharmacy | ||
| IL-4 | R & D | AFL204 | |
| TNF-alpha | R & D | AFL210 | |
| Ad5f35pp65 | BCM CAGT Vector Production Facility | ||
| Plasma Transfer mit Luer-Adapter-Set | Charter Medical | 89-550 66j | |
| Lymphoprep | Nycomed | 1114550 |
Referenzen
- Kennedy-Nasser, A. A. Comparable outcome of alternative donor and matched sibling donor hematopoietic stem cell transplant for children with acute lymphoblastic leukemia in first or second remission using alemtuzumab in a myeloablative conditioning regimen. Biol. Blood Marrow Transplant. 14, 1245-1245 (2008).
- Hanley, P. J. Improving clinical outcomes using adoptively transferred immune cells from umbilical cord blood. Cytotherapy. 12, 713(2010).
- Szabolcs, P., Cairo, M. S. Unrelated umbilical cord blood transplantation and immune reconstitution. Semin. Hematol. 47, 22(2010).
- Canto, E., Rodriguez-Sanchez, J. L., Vidal, S. Distinctive response of naive lymphocytes from cord blood to primary activation via TCR. J. Leukoc. Biol. 74, 998-998 (2003).
- Leen, A. M. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1160 (2006).
- Riddell, S. R. Restoration of viral immunity in immunodeficient humans by the adoptive transfer of T cell clones. Science. 257, 238(1992).
- O'Reilly, R. J. Adoptive transfer of antigen-specific T-cells of donor type for immunotherapy of viral infections following allogeneic hematopoietic cell transplants. Immunol. Res. 38, 237-237 (2007).
- Peggs, K. S. Adoptive cellular therapy for early cytomegalovirus infection after allogeneic stem-cell transplantation with virus-specific T-cell lines. Lancet. 362, 1375-1375 (2003).
- Sili, U. Large-scale expansion of dendritic cell-primed polyclonal human cytotoxic T-lymphocyte lines using lymphoblastoid cell lines for adoptive immunotherapy. J. Immunother. 26, 241(2003).
- Bollard, C. M. Good manufacturing practice-grade cytotoxic T lymphocytes specific for latent membrane proteins (LMP)-1 and LMP2 for patients with Epstein-Barr virus-associated lymphoma. Cytotherapy. 13, 518(2011).
- Hanley, P. J. Functionally active virus-specific T cells that target CMV, adenovirus, and EBV can be expanded from naive T-cell populations in cord blood and will target a range of viral epitopes. Blood. 114, 1958(1958).
- Hanley, P. J. Expansion of T cells targeting multiple antigens of cytomegalovirus, Epstein-Barr virus and adenovirus to provide broad antiviral specificity after stem cell transplantation. Cytotherapy. , (2011).
- Gerdemann, U. Generation of Multivirus-specific T Cells to Prevent/treat Viral Infections after Allogeneic Hematopoietic Stem Cell Transplant. J. Vis. Exp. (51), e2736(2011).
- Mori, T., Kato, J. Cytomegalovirus infection/disease after hematopoietic stem cell transplantation. Int. J. Hematol. 91, 588(2010).
- Einsele, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916(2002).
- Bao, L. Expansion of cytomegalovirus pp65 and IE-1 specific cytotoxic T lymphocytes for cytomegalovirus-specific immunotherapy following allogeneic stem cell transplantation. Biol. Blood Marrow Transplant. 14, 1156(2008).
- Shpall, E. J., Bollard, C. M., Brunstein, C. Novel cord blood transplant therapies. Biol. Blood Marrow Transplant. 17, Suppl 1. S39-S45 (2011).
- Vera, J. F. Accelerated production of antigen-specific T cells for preclinical and clinical applications using gas-permeable rapid expansion cultureware (G-Rex. J. Immunother. 33, 305(2010).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten