このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
臍帯血から細胞傷害性Tリンパ球の拡大をそのターゲットサイトメガロウイルス、エプスタイン - バーウイルス、およびアデノウイルス
要約
ここでは、最初の良い製造基準(GMP)に準拠した臍帯血、主にナイーブT細胞のソースからウイルス特異的細胞傷害性Tリンパ球(CTL)を製造する方法を説明します。
要約
幹細胞移植後のウイルス感染は、特にCBは感染から受信者を保護することができ、ウイルス経験豊富なT細胞のかなりの数字を含まない臍帯血(CB)移植(CBT)の後に、死の最も一般的な原因の一つである1 -我々や他のウイルス特異的CTL抗体陽性ドナーから生成され、受信者に注入が安全かつ保護的であることが示されている。5-8しかし、最近まで、ウイルス特異的T細胞が臍帯血から生成することができませんでした、おそらくのために4ウイルス特異的メモリーT細胞が存在しない。
良いナイーブT細胞の in vivoでのプライミング条件で模倣するための努力で、我々は、したがってT細胞特異性を駆動する、CB由来樹状細胞(DC)は免疫CMV抗原pp65抗原を含むアデノウイルスベクター(Ad5f35pp65)で形質導入に使用する方法を確立し開始時9。CMV、およびアデノウイルスに向かって、我々はこれらのmaを使うtured樹と同様に、CB由来T細胞サイトカインの存在下で、IL-7、IL-12およびIL-15 10我々は両方を発現するEBV形質転換B細胞、またはEBV-LCLを、使用される第二の刺激で潜伏と溶解EBV抗原。 Ad5f35pp65形質のEBV-LCLは第2の刺激でのIL-15の存在下でT細胞を刺激するために使用されます。後続の刺激は、EBV-LCLおよびIL-2 Ad5f35pp65形質を使用しています。
50x10 6、CB単核細胞から、我々は抗原刺激に応答して、抗原をパルス目標とリリースサイトカインを溶解さ150×10 6のウイルス特異的T細胞の上方に生成することができます。11これらの細胞は、使用して、GMPに準拠した方法で製造されただけ画し臍帯血ユニットの20%画分および臨床使用のために翻訳されています。
プロトコル
1。単核細胞分離(0日目)
- 臍帯血ユニットの20%分の出口ポートにメスルアーアダプタのスパイクを挿入し、シリンジを接続して、血液を除去する。 50 mLの遠心分離管中で温めたRPMI 20mLに解凍した血液を転送します。 RPMI 5mLで臍帯血袋を洗浄し、同じ遠心チューブに移す。
- 400 x gで10分間細胞を遠心分離します。上清を吸引します。
- 暖かいRPMI 20mlに細胞を再懸濁する。 50 mLの遠心分離管でLymphoprep 15mLの上に層細胞。 40分@ 400×gで遠心分離します。
- 単核細胞を含むインターフェイスを収穫し、RPMI 20mlに洗う。 10分@ 450×gで遠心します。
- 上清を吸引し、RPMI 20mlに洗う。 5分@ 400×gでのための細胞とスピンを数える。
- Cellgenix直流メディア(無血清)/ mlの5×10 6個の単核細胞上清に再懸濁した細胞を吸引します。 EBV-LCLの世代のために1 mLを削除し、15 mLのCEに入れチューブをntrifuge。
2。樹状細胞の生成(day0から)
- 6ウェルプレートにウェルあたり細胞(DCメディアの/ mLを5×10 6個の細胞に既にある)のプレートを2mL。 1-2時間インキュベーター内にしておきます。
- 1-2時間後、PBSで3〜4回洗浄することにより、非接着細胞を洗い流してください。非接着細胞と凍結を収集します。を2mL /ウェルの1000 U / mlのIL-4のと800 U / mLのGM-CSFを含む直流メディアを追加します。
- DCの開始後3〜4日、1000U/mL IL-4および800 U / mLのGM-CSFの最終濃度を含有する培地を100μL/ウェルを添加することにより、IL-4およびGM-CSFを補給してください。
- 日5-6、収穫ホールピペットでよくを削ってDC上。 5分@ 400×gでの大きな細胞や遠心分離機を数える。 2×10 6細胞/ DCのメディアのmLの吸引メディアを再懸濁し、DC。 24ウェルプレートの0.5mL /ウェルを追加します。
- 10感染単位のMOIで細胞あたりでAd5f35pp65ベクトルを使用してDCを伝達する。 vectoを追加24ウェルプレートの各ウェルにR。 1.5時間細胞をインキュベートします。 1.5時間後、含むDCメディアの1.5mL /ウェルを追加します:1000 U / mlのIL-4、800 U / mLのGM-CSFを、10 ng / mLで、TNF-α、1μg/ mLのPGE-1、100 ng / mLのIL-6、および10 ng / mlのIL-1β。これらのサイトカインは、樹状細胞を成熟させる。
3。 EBV-LCLの生成(day0から)
- 5×10 6個の単核細胞の入ったチューブを遠心します。濃縮されたEBV B95.8清との完全培地1.8 mLの培地(RPMI +10%FBS + 2mM L-グルタミン)を含有するシクロスポリン(1μg/ ml)を200μLを加える。
- 96ウェルプレートと5のウェルに200μLの10ウェルに細胞のアリコートを100μL添加します。完全培地+細胞の唯一の100μLを含むウェルにシクロスポリンの100μLを加える。滅菌水で残りのウェルを埋める。
- LCL毎週を養うために、約2週間後、24ウェルプレートに96ウェルプレートから展開します。もう一週間後に、T25フラスコに乗り換え、後に週に転送でT75フラスコ。この段階では、それはあなたがLCLのアリコートを凍結することをお勧めします。それは一般的にLCLの十分な数を生成するために1ヶ月位かかります。
4。 CTLを開始 - 7日DCの開始後
- 30 Gyで収穫DCおよび照射。 4×、カウントを洗ってください。ヒト血清を含むT細胞培地に再懸濁し、DC(45%RPMI、45%のCLICK、10%ヒト血清、2mM L-グルタミン)@ 1×10 5個のDC / mLであった。
- ステップ2.2から非接着細胞を解凍します。細胞を洗浄し、カウント。ヒト血清を含むT細胞培地で2×10 6個の非接着細胞/ mLで再懸濁する。 10 ng / mLのIL-7およびIL-12、および5 ng / mLのIL-15を追加します。 24ウェルプレートのウェルあたりの細胞の1 mLを加える。ウェルあたりのDCの1 mLを加える。滅菌水で24ウェルプレートの空のウェルを埋める。
- 7日T細胞開始後、飼料および/またはヒト血清を含むT細胞培地で細胞を分割します。
- LCLは準備が整うまで、9から12日T細胞開始後、T細胞を凍結します。
- OLCLが拡大し、T75フラスコに継代されるNCE、5分@ 400×gで遠心分離することにより、LCLを伝達する。 MOIのセル当たり100感染単位ので細胞ペレットにベクトルを追加します。 1.5時間インキュベートします。 1.5時間後、5×10 5 LCL / mLの完全培地で再懸濁し、24ウェルプレートにウェル当たり2 mLを加え12
- 2日後、40 GyでLCLおよび照射を収穫。 4×、カウントを洗ってください。 2.5×10 5細胞/ mLでヒト血清を含むT細胞の培地中でLCLを再懸濁します。 LCLの1 mL当たり24ウェルプレートを追加します。また、Grex40培養装置だけでなく、5 ng / mLのIL-15から5×10 6 LCLを追加します13
- T細胞を収穫します。 @ 400×gで5分間遠心し、上清を吸引し、1×10 6のT細胞/ mLのヒト血清を含むT細胞培地に再懸濁します。 5 ng / mLのIL-15を追加し、24ウェルプレートに既に登録されているLCLに1ml /ウェルのT細胞(1×10 6 T細胞の合計)を追加します。 Grex40では、持参最大30 mLにメディアの総容量。
- 細胞がコンフルエントにある場合刺激後3-4日で、その後、(プレートの)1:1それらを分割し、50 U / mLのIL-2を含む新鮮な培地を追加します。コンフルエントにない場合は、単に半培地を吸引し、50 U / mLのIL-2を含む培地と交換してください。 Grex40では、ハーフメディアを吸引し、新鮮な培地と交換し、50 U / mLのIL-2を追加します。
- 7日目に、ステップ4.6のように繰り返したが、IL-15は、刺激の日にIL-2を使用しない。
5。代表的な結果
GMP準拠のFDAの承認を受けた製造プロトコルの概略図を図1に描かれている。プロセスは約50日かかります。しかし、臍帯血は、ウイルス経験豊富なT細胞を欠いており、したがって、私たちはプライムナイーブT細胞をex vivoで移動する必要があります。ウイルス特異的T細胞が既存のメモリーT細胞を増殖生成する典型的な方法。そうするために、我々は、IL-12、IL-15、樹状細胞ならびにサイトカインIL-7を使用するウイルスの特異性を発生させるために必要。
3刺激した後、収量は100×6セルの上でなければなりません。十分な細胞が利用できない場合は、CTLの希望数が利用可能になるまで、追加の刺激を行うことができます。これらの細胞の大部分は、CD4 +およびCD8 + T細胞の混合物と、CD3 +である必要があります。 15%未満のNK細胞(CD3-/CD56 +)と1%未満のCD19 + B細胞( 図2)があるはずです。
拡大CTLは、アデノウイルスから、CMV、ヘキソンとペントンから抗原pp65抗原を認識するだけでなく、EBV-LCLに発現している多数のEBV抗原があります。 ELISPOTアッセイで試験した場合、CTLが分泌しなければなら以上のIFN-?これらの抗原に反応して無関係な抗原( 図3)より。
CTLはまた、ウイルスペプチドパルス目標などPHA芽を溶解する必要があります。 51 Cr放出アッセイでは、CTLはCMVpp65·パルスおよびアデノウイルス、LCLを溶解させる必要がありますヘキソンおよび/ペントンパルスしたターゲットが、無関係のペプチド( 図4)をパルスしていないターゲットや。
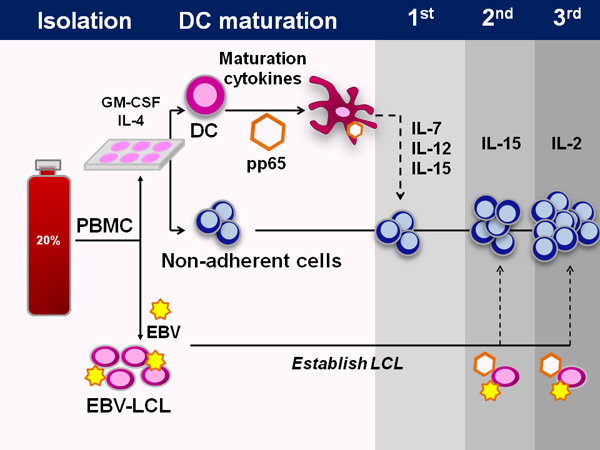
図1臍帯血から多ウイルス特異的CTLの生成 。臍帯血からCTL製造の全過程を模式的に示す。最初の臍帯血単核球を分画した臍帯血ユニットの20%画分から分離されています。 LCLの世代のために保存されている5×10 6個の細胞を除いて、全ての細胞は、その後、非接着細胞を回収し、凍結された時点で、1〜2時間、樹状細胞の培地に播種されています。 DCはその後、IL-4およびGM-CSFを含む供給のDCメディアです。培養5日後に、DCが熟成されており、免疫CMV抗原pp65抗原を含むアデノウイルスベクターを用いて形質導入。開始時に、これらのDCは、非付着細胞ならびにサイトカインIL-7、IL-12と結合されおよびIL-15。後続の刺激で、同じアデノウイルスベクターは、抗原提示細胞として使用され、EBV-LCLを形質導入するために使用されます。 IL-15は、その後、第2の刺激とIL-2で使用されています。
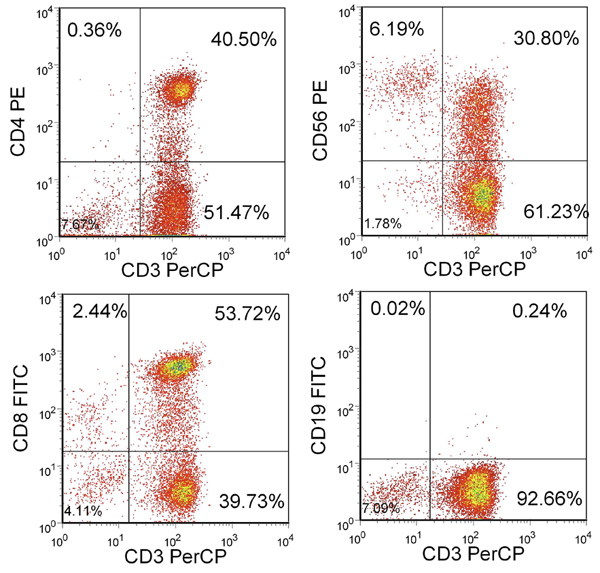
図2に得られたT細胞の表現型 。リンパ球ゲートに含まれる生細胞の割合が示されている。 CTLは、CD3 +およびCD4 +またはCD8 +が、大部分はCD3-/CD56-とアールCD19-。
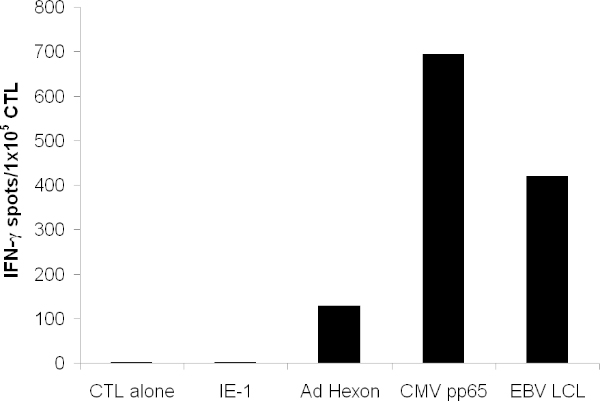
図3:T細胞の機能を提供します 。 T細胞の特異性は、IFN-γELISPOTにより試験した。 T細胞は、ヘキソン、ペントン、pp65を、そして無関係の抗原のIE-1のタンパク質全体にまたがる重複ペプチドをパルスした。単独でCTLが単独でメディアを示します。自家LCLは照射して1×10 5 /ウェルで添加した。セルCを形成し、平均点が示されている3ウェルのount。
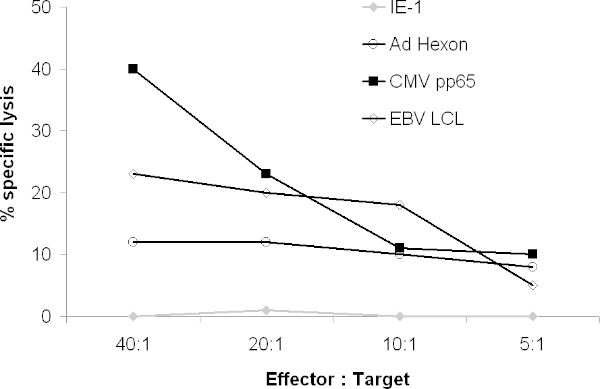
図4 CTLの細胞傷害活性 。ウイルス抗原を発現している標的を溶解する結果、CTLの能力を51 Crアッセイで試験した51 Cr標識自家PHA芽がLCLの自家Cr標識全体抗原にまたがる重複ペプチドをパルスしたり51したCTLの共培養を行った。 4時間後、ガンマリリースをガンマカウンターで計数した。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
CBTの後にウイルス感染を制御することを目的と現在の戦略が効果的ですが、彼らはかなりの毒性に関連付けられている、高価なもので、その後の感染症に対する長期の保護を与えない。実際には、いくつかの抗ウイルス薬の使用は、他の方法で保護されるであろうウイルス特異的T細胞の増殖を制限することがあります。14もう一つのオプションは、ドナー由来のウイルス特異的T...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、開示することは何もない。
謝辞
この作品は、ダン·L·ダンカン共同研究助成金(CMBとEJS)、国立心肺血液研究所(US4HL081007)、白血病とリンパ腫協会臨床研究奨学生賞(CMB)、および国立癌研究所によってサポートされていました(RO1 CA06150816; EJS)。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | |
| RPMI 1640 | インビトロジェン | 21870-076 | |
| DCのメディア | CellGenix | 20801-0500 | |
| EHAA(クリックのミディアム) | アーバイン·サイエンティフィック | 9195 | |
| ヒト血清 | ジェミニバイオ製品 | 100から110 | |
| ガス透過性Cultureware 18 | ウィルソン - ウルフ | 80040S | |
| IL-2の | カイロン(TCH薬局) | ||
| IL-12の | NCI / CTEP | ||
| IL-15の | CellGenix | 1013-050 | |
| IL-7の | 研究開発 | AFL207 | |
| IL-1βの | 研究開発 | AFL201 | |
| IL-6の | セルGenix | 1004-050 | |
| GM-CSF | TCH薬局 | ||
| IL-4 | 研究開発 | AFL204 | |
| TNF-α | 研究開発 | AFL210 | |
| Ad5f35pp65 | BCM CAGTベクトル製造施設 | ||
| プラズマ転送が雌型ルアーアダプターを使用して設定 | チャーターメディカル | 89から550-66j | |
| Lymphoprep | ナイコメッド | 1114550 |
参考文献
- Kennedy-Nasser, A. A. Comparable outcome of alternative donor and matched sibling donor hematopoietic stem cell transplant for children with acute lymphoblastic leukemia in first or second remission using alemtuzumab in a myeloablative conditioning regimen. Biol. Blood Marrow Transplant. 14, 1245-1245 (2008).
- Hanley, P. J. Improving clinical outcomes using adoptively transferred immune cells from umbilical cord blood. Cytotherapy. 12, 713(2010).
- Szabolcs, P., Cairo, M. S. Unrelated umbilical cord blood transplantation and immune reconstitution. Semin. Hematol. 47, 22(2010).
- Canto, E., Rodriguez-Sanchez, J. L., Vidal, S. Distinctive response of naive lymphocytes from cord blood to primary activation via TCR. J. Leukoc. Biol. 74, 998-998 (2003).
- Leen, A. M. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1160 (2006).
- Riddell, S. R. Restoration of viral immunity in immunodeficient humans by the adoptive transfer of T cell clones. Science. 257, 238(1992).
- O'Reilly, R. J. Adoptive transfer of antigen-specific T-cells of donor type for immunotherapy of viral infections following allogeneic hematopoietic cell transplants. Immunol. Res. 38, 237-237 (2007).
- Peggs, K. S. Adoptive cellular therapy for early cytomegalovirus infection after allogeneic stem-cell transplantation with virus-specific T-cell lines. Lancet. 362, 1375-1375 (2003).
- Sili, U. Large-scale expansion of dendritic cell-primed polyclonal human cytotoxic T-lymphocyte lines using lymphoblastoid cell lines for adoptive immunotherapy. J. Immunother. 26, 241(2003).
- Bollard, C. M. Good manufacturing practice-grade cytotoxic T lymphocytes specific for latent membrane proteins (LMP)-1 and LMP2 for patients with Epstein-Barr virus-associated lymphoma. Cytotherapy. 13, 518(2011).
- Hanley, P. J. Functionally active virus-specific T cells that target CMV, adenovirus, and EBV can be expanded from naive T-cell populations in cord blood and will target a range of viral epitopes. Blood. 114, 1958(1958).
- Hanley, P. J. Expansion of T cells targeting multiple antigens of cytomegalovirus, Epstein-Barr virus and adenovirus to provide broad antiviral specificity after stem cell transplantation. Cytotherapy. , (2011).
- Gerdemann, U. Generation of Multivirus-specific T Cells to Prevent/treat Viral Infections after Allogeneic Hematopoietic Stem Cell Transplant. J. Vis. Exp. (51), e2736(2011).
- Mori, T., Kato, J. Cytomegalovirus infection/disease after hematopoietic stem cell transplantation. Int. J. Hematol. 91, 588(2010).
- Einsele, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916(2002).
- Bao, L. Expansion of cytomegalovirus pp65 and IE-1 specific cytotoxic T lymphocytes for cytomegalovirus-specific immunotherapy following allogeneic stem cell transplantation. Biol. Blood Marrow Transplant. 14, 1156(2008).
- Shpall, E. J., Bollard, C. M., Brunstein, C. Novel cord blood transplant therapies. Biol. Blood Marrow Transplant. 17, Suppl 1. S39-S45 (2011).
- Vera, J. F. Accelerated production of antigen-specific T cells for preclinical and clinical applications using gas-permeable rapid expansion cultureware (G-Rex. J. Immunother. 33, 305(2010).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved