Method Article
Hibridación
En este artículo
Resumen
Análisis de genes temporales y espaciales de expresión tiene un papel crucial en la genómica funcional. Todo el montaje hibridación In situ Es útil para determinar la localización de las transcripciones dentro de los tejidos y los compartimentos subcelulares. Aquí describimos una hibridación In situ Protocolo con las modificaciones de los tejidos diana específicos en los mosquitos.
Resumen
Los mosquitos son vectores de un conjunto diverso de agentes patógenos como los arbovirus, parásitos protozoarios y nematodos. Investigación de las transcripciones y los reguladores de genes que se expresan en tejidos en los que el anfitrión de mosquitos e interactuar patógeno, y en los órganos implicados en la reproducción son de gran interés para las estrategias para reducir la transmitida por el mosquito transmisión de la enfermedad e interrumpir el desarrollo del óvulo. Un número de herramientas se han empleado para estudiar y validar la regulación temporal y tejidos específicos de la expresión génica. A continuación, describimos los protocolos que han sido desarrollados para obtener la información espacial, lo que aumenta nuestra comprensión de los genes específicos en donde se expresan y acumulan sus productos. El protocolo descrito se ha utilizado para validar la expresión y de determinar los patrones de acumulación de expedientes en los tejidos relacionados con la transmitida por el mosquito transmisión de patógenos, tales como las mujeres las glándulas salivales, así como los compartimentos subcelulares de los ovarios y los embriones, que vuelva atarde para la reproducción de mosquitos y el desarrollo.
Los procedimientos siguientes representan una metodología optimizada que mejora la eficiencia de varios pasos en el protocolo sin pérdida de las señales de hibridación específicos diana. Directrices para la preparación de la sonda de ARN, la disección de los tejidos blandos y el procedimiento general para la fijación y la hibridación se describen en la Parte A, mientras que los pasos específicos para la recogida, grabación, pre-hibridación y la hibridación de embriones de mosquitos se detallan en la Parte B.
Protocolo
A. Hibridación in situ para los tejidos blandos: glándulas salivales del mosquito y de los ovarios
Recetas para las soluciones y tampones necesarios para los procedimientos siguientes se describen en la Tabla 1.
1. Sonda de ARN Preparación y Análisis de la Calidad
- Cartillas de diseño para amplificar por PCR el objetivo de la transcripción de su interés. Se recomienda que la amplificación es ≥ 600 nucleótidos de longitud y que es más importante que la secuencia de amplificación es exclusivo de la transcripción de destino. Las secuencias que son no-única se evita, para eliminar la posibilidad de generar reacción cruzada sondas de ARN.
- Clonar el producto de PCR en el vector pCR4 TOPO-, o vector de clonación similares. El vector de clonación TOPO-pCR4 contiene T7 y T3 RNA polimerasa sitios de cebado que permiten la producción de sentido y antisentido de escorrentía productos de transcripción de un único clon.
- Secuencia del amplicón clonado para comprobar la secuencia fidelity y orientación dentro del plásmido vector.
- Realizar una reacción digestión de restricción con una enzima adecuada para producir un producto en antisentido transcripción in vitro. Linealización del plásmido se realiza en forma directa al seleccionar un sitio de restricción localizado en la región de clonación múltiple del vector pCR4-TOPO como Spe I, Pst I o No I. Asegurarse de que el sitio de restricción seleccionada no está presente en el fragmento clonado. El clon mismo puede ser utilizado para generar una sonda sentido-hebra de ARN, que sirve como un control de fondo. La hibridación in situ con una sonda sentido debe dar señal de poca o ninguna, cuando se compara con la de la sonda antisentido complementario.
- Verificar mediante electroforesis en gel que el clon pCR4-TOPO es completamente lineal.
- Se purifica el ADN de plásmido linealizado mediante la realización de una extracción con fenol-cloroformo, seguido por precipitación con etanol. Cuando precipitar el ADN del plásmido se recomienda utilizar una concent definitivaración de 2 M de acetato de amonio con 2.5 volúmenes de etanol para reducir el arrastre de sal residual en la reacción de transcripción in vitro.
- Preparar la digoxigenina (DIG)-cadena simple marcado con sonda de ARN mediante la realización de una segunda vuelta en la reacción de transcripción in vitro, usando 1 g del ADN plásmido linealizado como una plantilla. Preparar la reacción con polimerasa de ARN, tampón de transcripción y DIG ARN mezcla de etiquetado como se describe por las instrucciones del fabricante.
- Se purifica el DIG-etiquetados, en productos de transcripción in vitro por precipitación con etanol y resuspender el ARN sedimentadas en agua tratada con DEPC destilada.
- Verificar la calidad y el peso molecular esperado de la purificada DIG sonda marcada con ARN mediante electroforesis en gel de formaldehído. La sonda de RNA preparado se puede dividir en partes alícuotas y se almacenó a -80 ° C hasta su uso.
2. La disección de las glándulas salivales del mosquito y de los ovarios
- Diseccionar la saliva del mosquito glands utilizando una sonda y pinzas como se ha descrito anteriormente para Ae. aegypti. 1,2 para un archivo. las glándulas salivales gambiae, se puede disecar como se describe para el Ae. aegypti, o, alternativamente, como se describe en los Métodos para MR4 Anopheles Investigación manual. 3
- Diseccionar los ovarios de mosquitos usando unas pinzas como se ha descrito anteriormente para el Ae. aegypti. 4 En pocas palabras, usar un par de pinzas para agarrar el tórax, mientras que otro par de pinzas quita el penúltimo segmento abdominal para liberar a los ovarios.
- Recoger disecadas las glándulas salivales o de los ovarios en Ambion RNasa libre de 1,5 ml que contienen tubos de microcentrífuga 50 l de PBS.
- Mantener las muestras en hielo hasta que la fijación.
3. Fijación
- Fijar los tejidos disecados en recién preparada solución suave fijación del tejido (Tabla 1) a temperatura ambiente con nutación durante 30 min a 1 hora. La solución de fijación es preparada para prevenir oxidatión del fijador formaldehído. Fijación de 1 a 1,5 horas, se recomienda para las glándulas salivales. Un volumen mínimo de 1 ml se recomienda para la fijación de los tejidos en un tubo de microcentrífuga de 1,5 ml.
- Permitir que los tejidos se depositan en el fondo del tubo de microcentrífuga. Este es un paso importante, que sigue todos los cambios de las soluciones en el protocolo y minimizar la pérdida de muestra significativa.
- Decantar la solución de fijación mediante pipeteo cuidado, dejando a 50-100 l de volumen en el tubo de microcentrífuga y lavar 3 veces, 5 minutos cada uno con PBT.
- Pasos opcionales equilibración durante el almacenamiento de tejidos. Por pasos enjuagar PBT con etanol o metanol. Realice el paso de sabios lavados con PBT / alcohol (3:1, 1:1 y 1:3, 5 minutos cada uno). Tienda en el 100% (200) de alcohol a -20 ° C. Los tejidos se pueden almacenar durante varios meses sin degradación de la ultraestructura del tejido. Antes de realizar los pasos subsiguientes del protocolo, los tejidos deben ser devueltos al PBT por equilibración escalonada con alcohol / PBT (3:1, 1:1,1:3, 5 min cada uno).
- Realizar PBT se lava 3 veces, 5 minutos cada uno.
- Realizar la digestión de proteínas con 0,01 mg / ml de proteinasa K / PBT, 5 min a temperatura ambiente. Alternativamente, si tanto inmunolocalización de dianas proteicas y la hibridación in situ de ARN se desea, los ovarios pueden ser incubadas con 80% de acetona / H 2 O a -20 ° C durante 10 minutos en lugar de tratar con proteinasa K.
Proteinasa K se omite el tratamiento para la preparación de las glándulas salivales. Vaya directamente al paso 3.10. - Inmediatamente decantar la solución de digestión por pipeteado cuidadoso. Lavar 2 veces, 5 minutos cada uno con helado de PBT para detener la digestión.
- Realizar adicional PBT lava 2 x, 5 minutos cada uno a temperatura ambiente.
- Post-fijar en solución suave fijación del tejido a temperatura ambiente con nutación durante 30 min. Pasos posteriores a la fijación no se realizan de las glándulas salivales.
- Realizar PBT lava 5 ×, 5 minutos cada uno.
4. Hibridación
- Equilibre tejidos en solución de hibridación (hibridación) mediante la incubación a temperatura ambiente con 1 ml de hibridación / PBT (1:1) durante 30 minutos con nutación.
- Decantar tanto hibrid / PBT como sea posible. Añadir 1 ml de hibridación en cada tubo de muestra.
- Envuelva el tubo de muestra en el sellado de aire embalaje de protección (plástico de burbujas) y el lugar dentro de una botella de hibridación. Sella la botella con una tapa de botella de la hibridación.
- Pasos de hibridación de pre-hibridación y se puede realizar fácilmente en un horno de hibridación. Realizar pre-hibridación a 55 ° C durante 30 minutos con rotación.
- Transcurrido el tiempo suficiente para que los tejidos se depositan en el fondo del tubo de microcentrífuga, como la hibridación es más denso que el PBT. Con cuidado, decante la solución pre-hibridación. Los tejidos pueden llegar a ser transparente y difícil de visualizar. Pérdida de muestra se puede reducir dejando 50-100 l de volumen de la solución en cada tubo de muestra.
- Añadir un volumen de 50 l de hibridación en el tubo de muestra y mantener en un bloque de calor a 55 ° C.
- Desnaturalizar la sonda de RNA a 85 ° C durante 5-10 minutos. Inmediatamente, coloque la sonda desnaturalizada en hielo durante 5 min.
- Pipeta de la sonda de ARN en el tubo de muestra. La sonda de RNA flotarán en la superficie de la hibridación. Mezclar con un movimiento rápido el tubo suavemente.
- Realizar la hibridación en un volumen total de 50-100 l de hibridación por muestra. Se incuban las muestras en un bastidor de microfuga fijo dentro de un horno de hibridación, o en un bastidor de microfuga tubo flotante en un baño de agua, a 55 ° C durante 16-24 h.
5. RNasa A Tratamiento
- Retire la hibridación que contiene la sonda. Es importante para mantener las muestras a 55 ° C durante los pasos de lavado para reducir la unión no específica de la sonda no unida residual. Si varias muestras se hibridan, se recomienda mantener los tubos de muestra en un bloque de calor fijado en 55 ° C para mantener la temperatura de hibridación a lo largo de las etapas de lavado.
- Realizar un lavado rápido con hibrid pipeteando 1 ml de solución en la tina de microfugae invirtiendo el tubo y la muestra 5-6 veces.
Todos los lavados posteriores rápidos en el protocolo se realizó de forma similar mediante la adición de la solución requerida y los tiempos invirtiendo el tubo varias muestras. - Realizar dos lavados adicionales con hibridación a 55 ° C, 30 min cada uno con rotación en el horno de hibridación.
- Equilibrar en PBT mediante la incubación a temperatura ambiente con hibrid / PBT (1:1) durante 15 minutos con nutación.
- Realizar PBT lava 5 ×, 5 minutos cada uno.
- Preparar fresca RNAsa A tampón. Realizar RNAsa Un tratamiento por incubación en 20 mg / ml de RNAsa A / PBT a 37 ° C, durante 30 min. RNasa A escinde ARN de cadena sencilla y se traducirá en la degradación de la sonda de RNA no hibridada.
- Decantar RNAsa A búfer y realizar un lavado rápido con PBT.
- Realizar PBT se lava 3 veces, 5 minutos cada uno.
6. Incubación de anticuerpos
- Prepare una solución fresca de bloqueo (5% suero de pollo / 1% de occidentales reactivo de bloqueo / PBT), las muestras y el bloque de incubaciónTing en 1 ml de solución durante 30 minutos a temperatura ambiente con nutación.
- Añadir 200 l de una dilución 1:1000 de anti-DIG-fosfatasa alcalina (AP)-conjugado anticuerpo en solución de bloqueo. Incubar a 4 ° C, durante la noche con nutación.
7. Tinción de fosfatasa alcalina
- Quitar el anticuerpo y la solución de bloqueo.
- Realizar un lavado rápido con PBT.
- Realizar adicional PBT lava 5 ×, 10 minutos cada uno. Alternativamente, las muestras se pueden lavar 3x, 10 minutos cada uno seguido por un lavado prolongado a 4 ° C, durante la noche con nutación.
- Prepare una solución tampón fresca tinción AP.
- Realizar lavado rápido con el tampón de tinción AP.
- Realizar lavados adicionales con tampón de tinción 3 x AP, 5 minutos cada uno con nutación.
- Preparar, de acuerdo con las instrucciones del fabricante, la solución fresca tinción AP que contiene el sustrato NBT AP / BCIP.
- Incubar cada muestra con 500 l de solución de tinción de AP en temperatur ambientee con nutación, en la oscuridad. Las muestras se pueden incubar cubriendo los tubos con un recipiente opaco o papel de aluminio. Progresión de reacción debe controlarse cada 1-2 minutos para la formación de un precipitado púrpura. Dependiendo de la concentración de la sonda, la concentración de ARN diana y la presencia de no-objetivos específicos, la tinción puede proceder durante varios minutos a varias horas.
- Eliminar la mayor cantidad de la solución de tinción como sea posible. Los resultados insatisfactorios de decantación en la formación de un precipitado floculento blanco durante los pasos de lavado posteriores.
- La tinción se detiene por completo mediante la realización de dos lavados rápidos con PBT.
- Realizar adicional PBT se lava 3 veces, 5 minutos cada uno.
8. El glicerol de montaje
- El uso de un gran calibre 200 l punta de la pipeta, las muestras de transferencia de tubos de microcentrífuga en individuales de fondo redondo pocillos de una placa de punto de Pyrex.
- Retirar con cuidado de la muestra como la mayor parte del PBT como sea posible.
- Pipeta en la parte superior de la muestra glicerol 70% / H 2 O. Permita que el glicerol a impregnar el tejido de la muestra a 4 ° C, durante la noche. El tratamiento con glicerol evita la deshidratación de los tejidos durante el montaje de diapositivas.
- Preparar portaobjetos limpiando la superficie de deslizamiento limpiar con Kimwipes. Aplicar sobre el portaobjetos dos piezas de cinta invisible paralelo entre sí de manera que formen un canal estrecho (Figura 2).
- Usando un cepillo artístico, recoger muestras uno por uno y colocarlos a lo largo de la longitud del canal, posicionando cada muestra con la misma orientación, con respecto a las alineaciones anterior / posterior y dorsal / ventral.
- Después de posicionar cada muestra, utilice una torunda Kimwipe para absorber el exceso de solución de glicerol que rodea a los tejidos (Figura 3). La eliminación del exceso de glicerol es importante para prevenir la formación de burbujas, cuando el sellado de las muestras montadas en el portaobjetos bajo un cubreobjetos.
- Centro de cuidado y lugar de corriente alternamás de deslizamiento sobre el canal que contiene las muestras alineadas. Coloque la tapa deslizan semipermanente en la diapositiva taponando las esquinas de la hoja de la cubierta con esmalte de uñas transparente.
- Utilizando una pipeta 200 l, dispensar lentamente en un extremo del canal 70% de glicerol suficiente para llenar por acción capilar todo el espacio del canal y el área bajo el cubreobjetos.
- Sellar permanentemente las muestras montadas mediante la aplicación de esmalte de uñas a lo largo de los cuatro lados de la hoja de cubierta. Deje que el esmalte de uñas se seque lo suficiente antes de fotografiar de los híbridos de todo el montaje de los tejidos. Se recomienda para fotografiar imágenes de las muestras inmediatamente después del montaje.
B. Hibridación in situ para los embriones de mosquitos
Soluciones y tampones necesarios para la hibridación in situ para los embriones de mosquitos se ha descrito (Tabla 1). Los procedimientos de fijación y la hibridación que aquí se presentan se han modificado a partir de those informó por primera vez para el Anopheles gambiae, 5,6 Aedes aegypti y Culex quinquefasciatus 7 8.
1. Colector de Embriones
- Los embriones se obtuvieron de 300 acoplados, los mosquitos hembra adultos (pueden aparearse con los machos durante 48 horas, 3 días de post-emergencia) 72 horas después de comer sangre. Los mosquitos se mantienen en solución 3 M de sacarosa, a fin de evitar la oviposición antes del período de recogida previsto.
- Preparar los contenedores de recogida de embriones por el forro una de 16 onzas. vaso de papel con Saatilene Hitech malla de modo que la superficie interior de la taza se cubre completamente. La malla se puede fijar mediante el uso de una sola grapa. El uso de este malla reduce en gran medida los contaminantes fibrosos que están presentes si papel de filtro Whatman, o toallas de papel se utilizan.
- Llene el recipiente medio lleno con agua destilada.
- Los embriones se recogieron durante 1 hora colocando el recipiente de recogida en la jaula, que posteriormente se cubriópor una tela oscura para estimular la oviposición.
- Embriones recogidos se dejan madurar a etapas de desarrollo deseados fuera de la jaula en condiciones de cultivo estándar (85% de humedad relativa / 26 ° C). La maduración de los embriones de varias etapas puede ser correlacionada con el tiempo (horas después de la oviposición) siguiendo el curso del desarrollo hora aproximada de los acontecimientos descritos embrionarias (Tabla 2). Esta tabla resume los eventos más importantes en el desarrollo embrionario de Aedes aegypti, informó Raminani y Cupp, 9,10 Anopheles gambiae se describe por primera vez por Ivanova-Kazas 11 y ampliar ulteriormente Goltsev y sus colegas, 12,13 y Culex quinquefasciatus reportado por Davis. 14 El cursos de tiempo que se describen están destinadas a servir como estimaciones iniciales, en lugar de puntos en el tiempo absolutos, para la recolección de los embriones en etapas específicas de desarrollo.
2. Dechorionation, fijación y EndochoriLa interrupción en la
- Transferencia de embriones a partir del recipiente de recogida en un tubo de malla de captura Saatilene dechorionation (Figura 3).
Para los embriones Aedes, colocar el tubo de captura en un vaso que se llena con agua destilada suficiente para que el volumen del tubo de captura es un medio-completo. Un cepillo artístico puede ser utilizado para desalojar los embriones de la malla Saatilene y transferirlos al agua-tubo lleno de captura.
Para los embriones de Anopheles, retire la malla Saatilene del recipiente de colección y doblar la malla con cuidado para formar un embudo. Sosteniendo el embudo de malla con una mano, con la otra mano para dispensar agua destilada a través de una botella con atomizador de polietileno a lo largo de los lados del embudo para lavar los embriones en el tubo de captura. Este método se puede aplicar a los embriones Anopheles porque carecen de la sustancia adhesiva en la superficie de embriones Aedes, que permite a los huevos a pegarse a los sustratos de oviposición. - Prepare 40 ml de solución dechorionation (1 volumen 5,25% de hipoclorito de sodio: 3 volúmenes de agua destilada). Verter la solución en un plato de Petri de 100 mm.
- Preparar un vaso de precipitados de 100 ml que contiene 50 ml de agua destilada y se anule. El paso dechorionation es el tratamiento de hipoclorito de sodio sensible al tiempo e inmediatamente después los embriones se verá inmerso en esta agua, para diluir la solución dechorionation.
- Dechorionate los embriones en la malla captura tubo colocando el tubo en la placa de Petri llena con solución dechorionation. Utilice un dispositivo desechable de polietileno pipeta o una pipeta Pasteur para lavar los embriones, mientras se agita el frasco de captura para que los embriones permanecen sumergidas y se agita en la solución dechorionation.
Un máximo de 35 segundos se requiere para dechorionation de embriones Aedes, mientras que 75 segundos es suficiente para Anopheles y Culex embriones (Tabla 3). Dechorionation es uno de los pasos más delicados de la protOcol y la sobre-extensión del tratamiento de hipoclorito de sodio, especialmente para los embriones de Aedes evitará grietas propias del corion. - Inmediatamente sumerja la captura vial en el vaso que contiene agua.
- Lavar la solución dechorionation restante de los embriones mediante la eliminación de la sonda de captura del vaso lleno de agua y enjuagar las paredes interior y exterior del tubo de captura con agua destilada a partir de una botella de chorro o grifo equipado con un tubo.
- Dechorionation puede ser verificada mediante la visualización de los embriones con un microscopio de disección a bajo aumento. Embriones Aedes dechorionated carecen de la red exochorion-like y sólo la superficie lisa, pulida del endochorion negro es aparente para dechorionated embriones Anopheles, los flotadores exochorionic y estructuras cresta están ausentes (Figura 4).
- Usando un cepillo artístico, transferir los embriones dechorionated en un vial de centelleo con 5 ml de agua destilada water (Figura 5-1). Si las muestras múltiples se están preparando, mantener los tubos de captura en el agua para evitar la desecación de los embriones.
- Que los embriones se depositan en la base del vial de centelleo y eliminar la mayor cantidad de agua del vial como sea posible.
- Añadir 5 ml de heptano en el vial de centelleo (Figura 5-2). Eliminar el agua residual que permanece en el vial de centelleo.
- Añadir en el vial de centelleo 5 ml de solución recién preparada fijación embrión (Tabla 1).
- Fijar los embriones durante 30 minutos con la inversión de modo que las fases orgánica y acuosa mezclar a fondo, pero no vigorosamente.
- Retire la solución de fijación con una pipeta Pasteur de vidrio, teniendo cuidado de no molestar a la interfase, que contiene los embriones (Figura 5-3).
- Lavar la solución de fijación residual llenando el vial de centelleo con agua destilada tanto como sea posible. Invertir el vial de 5 veces ya continuación, retire toda el agua destilada.
- Llenar el vial de centelleo con 20 ml de agua destilada y mezclar invirtiendo el vial durante 30 min.
- Eliminar toda el agua del vial de centelleo.
- Añadir suficiente agua destilada hirviendo en el vial de centelleo de modo que la fase de heptano inorgánico alcanza la parte superior del vial.
- Incubar durante 30 segundos y luego eliminar todo el agua hirviendo.
- Añadir hielo de agua destilada fría hasta que la fase inorgánica alcanza la parte superior del vial. Incubar el vial en hielo durante 10 minutos.
- Eliminar primero las fases orgánicas acuosas y, a continuación. El heptano aparecerá opaco en esta etapa (Figura 5-4).
- Añadir 5 ml de heptano nueva en el vial. Elimine toda el agua que quede en el vial.
- Añadir 5 ml de metanol en el vial. Hacer girar el vial 1-2 veces con energía, sin agitación (Figura 6). Si las fases de metanol heptano inorgánicos y orgánicos se agita vigorosamente los embriones wiva a ser destruido durante la rotura endochorion. Vale la pena mencionar que se ha observado variación en la eficiencia de la interrupción endochorion de diferentes cepas de Aedes aegypti embriones.
- Incubar a temperatura ambiente durante 15-20 minutos. Durante esta etapa, las fases se convertirá turbia debido a la liberación de componentes de yema (Figura 5-5).
- Eliminar ambas fases orgánicas e inorgánicas y se lava con metanol 3 veces para eliminar todo residuo heptano.
- Los embriones se pueden almacenar en metanol a -20 ° C hasta varios meses.
3. Descamación
- Colocar un trozo de cinta de doble cara tupé en el centro de un 3 cm de placa de Petri. Toupee cinta se utiliza porque el adhesivo es estable en presencia de metanol y etanol.
- Usando un taladro grande (aproximadamente 3 mm de diámetro) 200 l punta de la pipeta, los embriones de transferencia a partir de metanol en la cinta de doble cara.
- Permita 1-2 minutos para que los embriones se asiente y adhantes de que la superficie de la cinta.
- Se decanta el exceso de metanol y permitir que la superficie se seque ligeramente durante 1-2 minutos.
- Añadir 4 ml de 95% (190 pruebas) etanol en la placa de Petri.
- Pipetear 600 l de agua destilada en el etanol y agitar para mezclar. La cinta se vuelven opacas en color. La adición de agua destilada hará que la cinta se ponga pegajosa e inmovilizar los embriones durante el pelado. Este paso se puede omitir si se desea.
- Utilice una aguja de calibre 27,5 conectado a una jeringa de 1 ml de quitar el endochorion agrietada (Figura 7). Después de soltar el embrión blanco a partir de los restos endochorion negros, transferir los embriones de la cinta para el depósito de etanol de la placa de Petri con un pincel de punta fina artístico. Con una punta de 3 mm de diámetro pipeta, transferir los embriones en un tubo de microcentrífuga Ambion 1,5 ml que contiene 500 l de etanol de prueba 200.
Los embriones pelados no debe permanecer en la cinta durante un período prolongado de tiempo, ya que pueden adherirse porpermanentemente a la cinta. - Realizar 2-3 lavados rápidos con un 100% (200) de etanol y almacenar los embriones en etanol puntillosa a -20 ° C. Embriones peladas se pueden almacenar a -20 ° C durante unos pocos meses, sin afectar la morfología o la señal de hibridación posterior.
4. Aclaración de la yema
- Realizar un lavado rápido con el etanol de prueba 200. Etanol puntilloso debe ser utilizado para todas las etapas de lavado subsiguientes y para la preparación de la solución de clarificación p-xileno yema.
- Realizar un lavado con etanol, 5 min con la nutación.
- Incubar en P-xylene/ethanol (9:1) a temperatura ambiente durante 1-1.5 h con nutación. El paso xileno permite la clarificación de la masa de yema para mejorar la relación señal a ruido.
- Eliminar la solución de xileno-etanol y realizar dos lavados rápidos con etanol.
- Realizar un lavado con etanol, 5 min con la nutación.
- Realizar dos lavados rápidos con metanol, seguido por lavado con metanol uno, 5 min connutación.
- Equilibrar en solución de formaldehído al 4% de fijación por lavado una vez con solución de fijación metanol / formaldehído (1:1).
5. La fijación y la hibridación in situ
La fijación y la hibridación in situ en los procedimientos son idénticos a los descritos en el protocolo de la sección A.
C. Representante de los resultados
La hibridación in situ en el protocolo descrito aquí, se traduce en patrones de tinción de colores que indican la presencia y localización del ARNm objetivo. Es importante destacar que los niveles relativos de abundancia de transcripción no puede determinarse por hibridación in situ. Resultados de hibridación son dependientes de la sonda de ARNm específico utilizado para el procedimiento de hibridación, la abundancia del ARNm diana en el tejido hibridada, así como la concentración de la sonda y la temperatura de hibridación. Comparación de los tejidos se hibridó con antisentido y las correspondientes sondas de ARNm de sentido hacer posible la interpretación precisa de los patrones de coloración.
La hibridación in situ de todo el montaje de las glándulas salivales hembra de Aedes aegypti con sondas de ARNm que amylase1 objetivo (AAEL006719), D7s2 (AAEL006423), y D7L2 (AAEL006424) indican que la acumulación de estas transcripciones en proximal-lateral, distal-lateral y distal lóbulos laterales / medial, respectivamente (Figura 8). 1-Todo el montaje ovarios de tres especies de mosquitos se hibridó con sondas de ARNm que se dirigen específicamente a las transcripciones respectivos ortólogos de Oskar (Figura 9). 7,8 hibridación in situ de todo el montaje embriones de Ae. aegypti, Un. gambiae y Cx. quinquefasciatus se realizó con sondas de ARN antisentido dirigidos a las transcripciones de mosquitos oskar respectivos ortólogos (Figura 10) 7,8.
igura 1 "src =" / files/ftp_upload/3709/3709fig1.jpg "/>
Figura 1. Esquema de post-hibridación de montaje puesta en marcha.
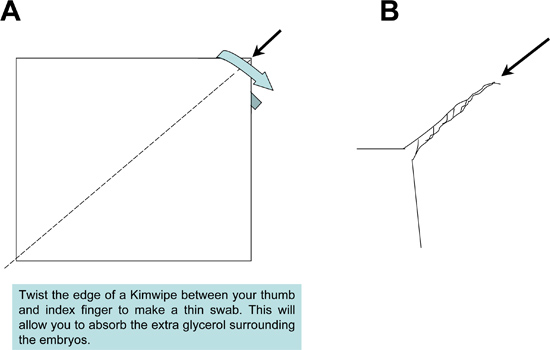
Figura 2. Preparación de Kimwipe fregona utilizado durante montaje de las muestras. Un tejido Kimwipe se tuerce fuertemente para producir una fregona de punta fina para absorber el exceso de medio de montaje de las muestras y diapositivas.
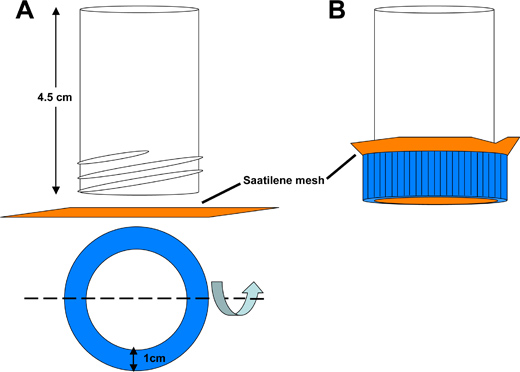
Figura 3. Esquema de Saatilene tubo de malla de captura dechorionation. A) La parte inferior de un tubo cónico de 50 ml de poliestireno se corta para producir un tubo hueco de 4,5 cm de longitud, abierto en ambos extremos. Una abertura circular se corta de la tapa del tubo cónico para permitir que el líquido a ser lavado a través de un 6,5 cm 2 pieza cuadrada de malla Saatilene. Los 330 hilos por pulgada, 34 micras de diámetro hilo tamiz de malla retiene los embriones de mosquitos. B) Del culoembled coger el tubo.

Figura 4. Aedes aegypti y Anopheles gambiae huevos, antes y después dechorionation. A) Aedes aegypti los huevos antes de la dechorionation. El exochorion similar a una malla se encuentra por encima de la endochorion negro y le da al huevo una apariencia de textura (la ampliación del recuadro). Después de la eliminación de la exochorion, sólo el endochorion lisa y pulida permanece (ampliación B y recuadro). C) Los huevos de Anopheles gambiae antes de dechorionation. Estructuras Exochorion tales como flotadores son visibles (flechas). D) La superficie lisa y pulida de la endochorion es visible después de dechorionation. Bar = 100 micras.

Figura 5. Una serie de pasos secuenciales para la fijación y la interrupción endochorion de Ae. los huevos de Aedes aegypti. A) oblicuo-vista frontaly B) lateral vista de viales de centelleo que contienen Ae. aegypti huevos durante la secuencia de pasos de fijación y de la interrupción endochorion. 1) Los embriones en agua destilada. 2) Los embriones flotan en la interfase entre la fase superior heptano y la fase acuosa inferior. 3) Después de la fijación de los embriones empaquetarse en una masa redonda. Los embriones permanecen en la interfase entre las fases solución de heptano y fijador. 4) Después del tratamiento con agua hirviendo y la incubación en hielo, la fase de heptano se vuelve ligeramente opaca. 5) Los embriones con endochorions interrumpidas se muestran en la interfase entre una fase opaca heptano y metanol en fase transparente.

Figura 6. Endochorion interrupción de Ae fijo. aegypti huevos. A) Inmediatamente después de enérgica agitación de heptano y fases de metanol, la formación de burbujas y la interrupción de la endochorion puede ser visualizada. B) following cinco minutos de incubación, a temperatura ambiente.
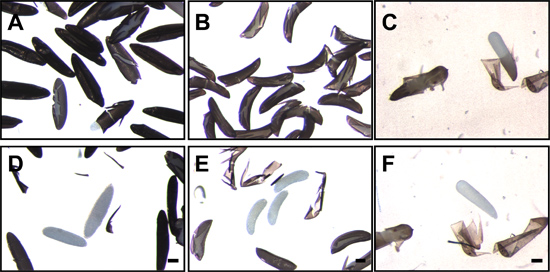
Figura 7. Los huevos de mosquito después de la interrupción y la eliminación de la endochorion Los huevos de Ae. aegypti (a), una. gambiae (B) y Cx. quinquefasciatus (C) posterior a la fijación y la interrupción de la endochorion. Embriones traslúcidos de color blanco se puede ver en el endochorion agrietada. Tras la eliminación del endochorion, los embriones translúcidos de Ae. aegypti (D), Una. gambiae (E) y Cx. quinquefasciatus (F) son claramente visibles. Bar = 100 micras.
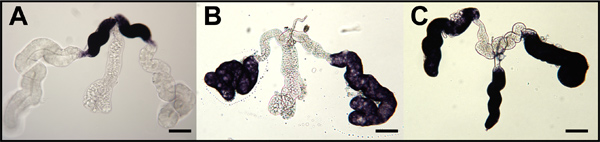
Figura 8. Hibridaciones in situ durante tres genes expresados en diferentes lóbulos de todo el montaje, hembra de Ae. aegypti glándulas salivales. La tinción es indicativo de la localización y la acumulación de amylase1 (AAE L006719) (A), D7s2 (AAEL006423) (B) y D7L2 (AAEL006424) (B). Bar = 100 micras.
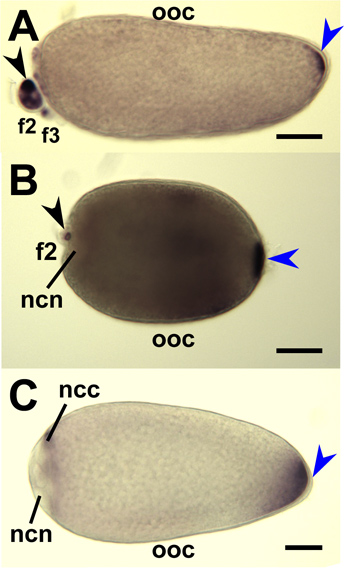
Figura 9. La hibridación in situ por los mosquitos oskar sondas de ARN antisentido a los ovocitos de mosquitos todo el montaje y las células de la enfermera. Etapa IV ovocitos (OOC) disecado de los ovarios de una. gambiae (A), Ae. aegypti (B) y Cx. quinquefasciatus (C) y se hibridó con sondas de ARN dirigidas respectivos mRNAs oskar mosquitos. Folículos primarios están orientados con anterior a la izquierda. La tinción en el polo posterior (azul punta de flecha) indican acumulada ARNm Oskar. Secundarias (f2) y terciario (F3) se muestran los folículos y la tinción (negro punta de flecha) indican una acumulación de mRNA de oskar en el citoplasma de la célula enfermera (NCC). La tinción se excluye de los núcleos celulares enfermera (NCN). Bar = 50 micras.
ad/3709/3709fig10.jpg "/>
Figura 10. La hibridación in situ por los mosquitos oskar sondas de ARN antisentido a los embriones de mosquitos todo el montaje. Los embriones están orientados con anterior a la izquierda. Celulares de embriones Blastodermo etapa de una. gambiae (A) y Cx. quinquefasciatus (C) se hibridó con sondas de mosquitos respectivas especies específicas oskar ARN. B) Un blastodermo sincitial Ae etapa. embrión aegypti se hibridó con sondas de ARN dirigidas a Ae. aegypti oskar transcripción. La tinción es evidente en las células polo posterior de todos los embriones, lo que indica la localización y la acumulación de mRNA oskar mosquitos en estas células. Bar = 50 micras.

Tabla 1. Soluciones y tampones para electroforesis en gel de formaldehído, la fijación y la hibridación in situ.
ftp_upload/3709/3709table2.jpg "/>
Tabla 2. Eventos de desarrollo y observaciones morfológicas correspondientes a etapas consecutivas durante la embriogénesis del mosquito.

Tabla 3. Resumen de las diferencias principales en los pasos de pre-hibridación para diversos tipos de tejidos.
Discusión
La hibridación in situ y el protocolo de tinción colorimétrica que aquí se presenta para los tejidos de mosquitos todo el montaje y los embriones es una técnica útil para la localización de las transcripciones en órganos específicos y tipos de células. Estos procedimientos son una mejora con respecto a los métodos ya se ha informado, tanto en la racionalización de amplias medidas de lavado y de proporcionar más detalles técnicos y las fuentes de reactivos.
En nuestra experiencia, la detección colorimétrica de las señales de hibridación es superior en sensibilidad y la claridad de la señal de hibridación en comparación con esquemas de detección basadas en fluorescencia. Por otra parte la detección colorimétrica elude las cuestiones relacionadas con la discriminación de la señal en los embriones, que son inherentemente auto-fluorescente. Las limitaciones en la detección de señales de hibridación ocurre, cuando baja abundancia transcripciones están dirigidos y tinción de fondo es evidente. El aumento de la temperatura de hibridación a 65 ° C se ha encontrado para reducir de nuevoseñales de hibridación de tierra, pero no es un sustituto sugerido para el diseño único objetivo sondas específicas de ARN.
Este protocolo se ha utilizado para llevar a cabo la hibridación in situ de todo el montaje las glándulas salivales del mosquito Aedes aegypti y los ovarios y los embriones de Anopheles gambiae, el Anopheles stephensi, Ae. aegypti y Culex quinquefasciatus. Este método también es aplicable a los tejidos de mosquitos otros, y presumiblemente los de otros insectos. Además, se compiló para las pautas de la primera vez comparativas para la puesta en escena del desarrollo embrionario de cada tres mosquitos vectores, Ae. aegypti, Un. gambiae y Cx. fatigans. Las observaciones se han reportado para cepas específicas de estas tres especies, bajo condiciones de cría discretos. Es importante señalar que el curso de tiempo de desarrollo puede variar para diferentes cepas de especies de mosquitos y bajo condiciones de cría diferentes. Hibridaciones en el suplemento in situ los esfuerzos en curso a analisar los transcriptomes de mosquitos y otros artrópodos, y puede ofrecer una mejor imagen de la regulación de la expresión génica en estos organismos.
Divulgaciones
Los autores no tienen revelaciones.
Agradecimientos
Los autores desean agradecer a Marika Walters para el asesoramiento en el desarrollo de la hibridación in situ en los métodos de los tejidos blandos y Goltsev Yury para la discusión de los protocolos para la hibridación in situ de Anopheles gambiae embriones, que fueron adaptados y modificados posteriormente para desarrollar el protocolo descrito aquí para la hibridación en in situ de Aedes y Culex embriones. Reconocemos también recomendaciones útiles dados por Adam Paré y Kosman David. Damos las gracias a Osvaldo Marinotti para la discusión científica y la edición del texto del protocolo.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| EDTA 0,5 M | Ambion | AM9261 | |
| Tris-HCl 1M | Ambion | AM9855G | pH 8,0 |
| PBS 10 veces | Ambion | AM9625 | |
| SSC 20X | Ambion | AM9763 | |
| 1,5 ml tubos de microfuga | Ambion | AM12400 | Menos opaco que los tubos estándar, ayuda a visualizar las muestras |
| Formamida desionizada | Ambion | AM9342 | El almacenamiento a 4 ° C |
| DEPC agua | Ambion | AM9932 | |
| Proteinasa K | Ambion | AM2546 | |
| 5,25% de hipoclorito de sodio | Austin | A-1 Marca | |
| T3 ARN polimerasa-Plus | Ambion | AM2733 | El almacenamiento a -20 ° C |
| T7 ARN polimerasa | Ambion | AM2082 | El almacenamiento a -20 ° C |
| 95% de etanol | Fisher Scientific | AC61511-0040 | |
| Fisherbrand pipetas desechables de polietileno de transferencia | Fisher Scientific | 13-711-7M | |
| 37% de formaldehído | Fisher Scientific | F79-500 | |
| HPLC-grado de metanol | Fisher Scientific | A452-1 | |
| Cloruro de magnesio | Fisher Scientific | M87-500 | |
| Microscopio cubierta de vidrio | Fisher Scientific | 12-542A | 18 x 18 mm |
| N-heptano | Fisher Scientific | H350-1 | |
| P-xileno | Fisher Scientific | O5082-500 | |
| Pyrex de 9 y Punto Plate | Fisher Scientific | 13-748B | 100x85 mm |
| Cloruro de sodio | Fisher Scientific | AC32730-0025 | |
| Hidróxido de sodio | Fisher Scientific | SS255-1 | |
| Superfrost / Plus portaobjetos | Fisher Scientific | 12-550-15 | 25x75x1.0 mm |
| Davlyn Red Clear-liner Toupee cinta | Cabello directo | RED-75R12 | Poli / material de la piel base de 0,75 cm x 12 m rollo de cinta |
| Kit de Clonación de TOPOTA Sequening con un disparo Top10 químicamente competente E. E. | Invitrogen | K457501 K457540 | 20 reacciones 40 reacciones |
| De salmón sonicado ADN de los espermatozoides | Invitrogen | 15632-011 | El almacenamiento a -20 ° C |
| Anti-digoxigenina-AP Fab | Roche Ciencias Aplicadas | 1093274 | El almacenamiento a 4 ° C |
| DIG RNA etiquetado mezcla | Roche Ciencias Aplicadas | 1277073 | El almacenamiento a -20 ° C |
| NBT / BCIP de la solución madre | Roche Ciencias Aplicadas | 1681451 | El almacenamiento a 4 ° C |
| Reactivo de bloqueo occidental | Roche Ciencias Aplicadas | 11921673001 | El almacenamiento a 4 ° C |
| Saatilene Hitech malla de poliéster (330.130) | Saati Imprimir | 330,34 UO PW | 330 hilos por pulgada, de 34 micras de diámetro de la rosca, color naranja |
| Glicerol | Sigma | G6279-1 | 70% en PBT |
| Sal de sodio de heparina | Sigma | H3393 | |
| Tween 20 | Sigma | P1379-500 | |
| 37% de formaldehído | Ted Pella | 18508 | Alícuotas de 10 ml en ampollas ámbar |
| 16 oz Recipientes con tapas de papel solitario | El Paper Company | SOLOKH16AJ8000 | |
| Vidrio borosilicato scintillatión vial con tapón de rosca sin ataduras | VWR International | 66022-128 | 20 ml caso de 500 |
| Sealed Air Bubble Wrap o via un material de relleno | VWR International | 500018-081 | De 10 pies / rollo 0.188 pulgadas de espesor |
| Suero de pollo | Toda la sangre se recoge ya sea desde la vena del ala, o por punción cardiaca de un pollo de menores. La sangre se incubó a 37 ° C durante 1 h hasta coagulada y luego se coloca en hielo durante 30 min. El suero se recogió y se centrifugó a 3000 xg durante 10 min. El sobrenadante resultante (aclarado suero) se recogió y se almacenó a -20 ° C hasta su uso. |
Tabla 4. Tabla de los reactivos específicos y equipos para la hibridación in situ.
Referencias
- Juhn, J. Spatial mapping of gene expression in the salivary glands of the dengue vector mosquito, Aedes aegypti. Parasit. Vectors. 4, 1(2011).
- Coleman, J., Juhn, J., James, A. A. Dissection of midgut and salivary glands from Ae. aegypti mosquitoes. J. Vis. Exp. (5), e228(2007).
- Benedict, M. Q. Dissecting Plasmodium-infected Mosquitoes: Salivary Glands, Chapter. 5.4.2. Methods in Anopheles Research. , Malaria Research and Reference Reagent Resource Center (MR4). (2007).
- Sappington, T. W., Brown, M. R., Raikhel, A. S. Culture and analysis of insect ovaries, Chapter. 42.3. The Molecular Biology of Insect Disease Vectors: A methods manual. , Chapman & Hall. London. (1997).
- Goltsev, Y., Hsiong, W., Lanzaro, G., Levine, M. Different combinations of gap repressors for common stripes in Anopheles and Drosophila embryos. Dev. Biol. 275, 435-446 (2004).
- Benedict, M. Q. Anopheles Embryo Fixation, Chapter. 3.7. Methods in Anopheles Research. Malaria Research and Reference Reagent Resource Center (MR4). , (2007).
- Juhn, J., James, A. A. oskar gene expression in the vector mosquitoes, Anopheles gambiae and Aedes aegypti. Insect Mol. Biol. 15, 363-372 (2006).
- Juhn, J., Marinotti, O., Calvo, E., James, A. A. Gene structure and expression of nanos (nos) and oskar (osk) orthologues of the vector mosquito, Culex quinquefasciatus. Insect Mol. Biol. 17, 545-552 (2008).
- Raminani, L. N., Cupp, E. W. Early Embryology of Aedes aegypti (L.) (Diptera: Culicidae). Int. J. Insect Morphol. & Embryol. 4, 517-528 (1975).
- Raminani, L. N., Cupp, E. W. Embryology of Aedes aegypti (L.) (Diptera: Culicidae): Organogenesis. Int. J. Insect morphol. & Embryol. 7, 273-296 (1978).
- Ivanova-Kazas, O. M. Embryonic development of Anopheles maculipennis Mg. Izv. Akad. Nauk SSSR ser. Biol. 2, 140-170 (1949).
- Goltsev, Y. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Dev. Biol. 330, 462-470 (2009).
- Papatsenko, D., Levine, M., Goltsev, Y. Clusters of temporal discordances reveal distinct embryonic patterning mechanisms in Drosophila and Anopheles. PLoS Biol. 9, e1000584(2011).
- Davis, C. W. C. A comparative study of larval embryogenesis in the mosquito Culex fatigans Wiedemann (Diptera: Culicidae) and the sheep-fly Lucilla seriata Meigen (Diptera: Calliphoridae) I. Description of embryonic development. Aust. J. Zool. 15, 547-579 (1967).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados