Method Article
Hybridisierung
In diesem Artikel
Zusammenfassung
Zeitliche und räumliche Genexpressionsanalysen spielen eine entscheidende Rolle in der funktionellen Genomik. Whole-mount-Hybridisierung In-situ- Ist nützlich für die Bestimmung der Lokalisierung von Transkripten in Geweben und subzellulären Kompartimenten. Hier beschreiben wir eine Hybridisierung In-situ- Protokoll mit Modifikationen für spezifische Zielgewebe in Mücken.
Zusammenfassung
Insektenstiche können für eine vielfältige Reihe von Erregern einschließlich Arboviren, Protozoen und Nematoden. Untersuchung der Transkripte und Genregulatoren, die in Geweben, in denen die Mücke Wirt und Pathogen zu interagieren und in Organen der Fortpflanzung beteiligt sind von großem Interesse für Strategien, um durch Moskitos übertragene Krankheit Übertragung zu verringern und zu stören Ei Entwicklung zum Ausdruck kommen. Eine Reihe von Tools wurden eingesetzt, um Untersuchung und Bestätigung der zeitliche und Gewebe-spezifische Regulation der Genexpression. Hier beschreiben wir Protokolle, die entwickelt wurden, um räumliche Informationen, die unser Verständnis von denen spezifische Gene exprimiert werden und reichern ihre Produkte verstärkt zu erhalten. Die beschriebenen Protokoll wurde verwendet, um die Expression zu verifizieren und festzustellen Akkumulation Muster der Expression in Geweben im Zusammenhang mit Mücken übertragene Erregerübertragung, wie weibliche Speicheldrüsen sowie subzellulären Kompartimenten der Ovarien und Embryonen, die neuspät, um Moskito Fortpflanzung und Entwicklung.
Die folgenden Verfahren stellen eine optimierte Methodik, die die Effizienz der verschiedenen Schritte in dem Protokoll verbessert, ohne Verlust der Ziel-spezifischen Hybridisierungssignale. Richtlinien für die RNA-Sonde der Aufbereitung werden die Dissektion der Weichteile und der allgemeinen Vorschrift zur Fixierung und Hybridisierung in Teil A beschrieben, während die spezifischen Schritte für die Gewinnung, Fixierung, Pre-Hybridisierung und Hybridisierung von Embryonen Mücke in Teil B sind detailliert
Protokoll
A. in situ Hybridisierung für Weichteilgewebe: die Speicheldrüse der Mücke und der Eierstöcke
Rezepte für Lösungen und Puffer für die folgende Arbeitsschritte erforderlich sind in Tabelle 1 dargestellt.
1. RNA-Sonde Vorbereitung und Qualitätsanalyse
- Design-Primer zur PCR-Amplifikation der Ziel-Transkript von Interesse. Es wird empfohlen, dass das Amplicon ≥ 600 Nukleotide lang und noch wichtiger, dass das Amplicon-Sequenz einzigartig für die Ziel-Transkript ist. Sequenzen, die nicht eindeutig sind, vermieden werden, um die Möglichkeit der Erzeugung kreuzreaktiv RNA-Sonden zu entfernen.
- Klonen Sie das PCR-Produkt in den pCR4-TOPO-Vektor oder ähnliche Klonierungsvektor. Die pCR4-TOPO Klonierungsvektor enthält T7 und T3 RNA-Polymerase Grundierung Websites, die die Produktion von sowohl Sense-und Antisense Run-off-Transkription aus einem einzigen Klon zu ermöglichen.
- Sequence das geklonte Amplikon zu sequenzieren fid überprüfenelity und Orientierung in der Vektor-Plasmid.
- Führen Sie eine Restriktionsverdau Reaktion mit einem geeigneten Enzym, ein Antisense-Transkription in vitro herzustellen. Plasmide Linearisierung wird einfach durch die eine Restriktionsstelle in der multiplen Klonierungsstelle Bereich des pCR4-TOPO-Vektor wie Spe I, Pst I befindet oder nicht I. Stellen Sie sicher, dass die ausgewählte Restriktionsstelle nicht in der klonierten Fragments. Die gleichen Klon kann ein Sense-Strang-RNA-Sonde, die als Hintergrund Steuerung dient zu erzeugen. Die Hybridisierung in situ mit einem Sense-Sonde sollte wenig oder kein Signal, wenn man sie mit der komplementären Antisense-Sonde verglichen.
- Stellen Sie sicher durch Gel-Elektrophorese, dass die pCR4-TOPO-Klon vollständig linearisiert.
- Reinigen des linearisierten Plasmid-DNA durch Durchführen einer Phenol-Chloroform-Extraktion, mit anschließender Ethanolfällung. Wenn Ausfällen des Plasmid-DNA wird empfohlen, um eine endgültige concent verwendenRation von 2 M Ammoniumacetat mit 2,5 Volumina Ethanol zur Verringerung der Verschleppung von restlichem Salz in die In-vitro-Transkriptions-Reaktion.
- Bereiten Sie die Digoxigenin (DIG)-markierte einzelsträngige RNA-Sonde durch Durchführen einer Run-off in vitro-Transkriptions-Reaktion, unter Verwendung von 1 ug des linearisierten Plasmid-DNA als Matrize. Bereiten Sie die Reaktion mit RNA-Polymerase, Puffer Transkription und DIG RNA Labeling Mix wie von den Anweisungen des Herstellers beschrieben.
- Reinigen des DIG-markierten, in vitro Transkription durch Ethanolfällung und resuspendieren pelletiert RNA in DEPC-behandeltem destilliertem Wasser.
- Überprüfen der Qualität und erwarteten Molekulargewicht des gereinigten DIG-markierten RNA-Sonde durch Formaldehyd-Gelelektrophorese. Die hergestellte RNA-Sonde kann in Aliquots aufgeteilt und bei -80 ° C bis zur Verwendung.
2. Dissektion der Speicheldrüse der Mücke und der Eierstöcke
- Sezieren Mücke Speichel-Glands mit einer Sonde und Pinzette, wie zuvor für Ae beschrieben. aegypti. 1,2 für eine. gambiae, Speicheldrüsen können seziert wie für Ae beschrieben werden. aegypti, oder alternativ, wie in den MR4 Methoden zur Anopheles Forschung Handbuch beschrieben. 3
- Sezieren Moskito Eierstöcke mit einer Pinzette, wie zuvor für Ae beschrieben. aegypti. 4 kurz, verwenden Sie eine Zange, um den Brustkorb zu fassen, während eine andere Zange zieht das vorletzte Abdominalsegment, um die Eierstöcke zu lösen.
- Sammeln Sie seziert Speicheldrüsen oder der Eierstöcke in Ambion RNase-freies 1,5 ml-Mikrozentrifugenröhrchen mit 50 ul PBS.
- Pflegen Sie Proben auf Eis bis zur Fixierung.
3. Fixierung
- Befestigen seziert Geweben in frisch hergestellten Fixierung von Gewebe-Lösung (Tabelle 1) bei Raumtemperatur mit Nutation für 30 Minuten bis 1 Stunde. Die Fixierung Lösung wird frisch zubereitet, um zu verhindern oxidatIon der Formaldehyd-Fixativ. Fixierung für 1-1,5 h ist für Speicheldrüsen empfohlen. Ein Minimum von 1 ml wird zur Befestigung Geweben in einem 1,5 ml Mikrozentrifugenröhrchen empfohlen.
- Willkommen sind die Gewebe auf den Grund des Mikrozentrifugenröhrchens zu regeln. Dies ist ein wichtiger Schritt, der alle Änderungen von Lösungen im Protokoll folgt und wird signifikante Stichprobe zu minimieren.
- Man dekantiert die Fixierung Lösung durch vorsichtiges Pipettieren, so dass 50 bis 100 ul Volumen in der Mikrozentrifugenröhrchen und dann waschen 3 ×, jeweils 5 min mit PBT.
- Optional Äquilibrierung Schritte für Gewebe Lagerung. Schrittweise ausspülen PBT entweder mit Ethanol oder Methanol. Führen stufenweise Waschen mit PBT / Alkohol (3:1, 1:1 und 1:3, jeweils 5 min). Shop in 100% (200 Proof) Alkohol bei -20 ° C Gewebe können für mehrere Monate ohne Veränderung der Gewebeultrastruktur gespeichert werden. Vor der Durchführung nachfolgenden Schritte des Protokolls muss das Gewebe zu PBT durch stufenweise Äquilibrierung mit Alkohol / PBT (3:1, 1:1 zurückgegeben,1:3, jeweils 5 min).
- Führen PBT wäscht 3 ×, jeweils 5 min.
- Führen Proteinverdauung mit 0,01 mg / ml Proteinase K / PBT, 5 min bei Raumtemperatur. Alternativ, wenn die beiden Immunlokalisation von Protein-Targets und in situ Hybridisierung von RNA gewünscht sind, kann Eierstöcke mit 80% Aceton / H 2 O bei -20 ° C für 10 min anstelle der Behandlung mit Proteinase K inkubiert
Proteinase K-Behandlung ist für die Vorbereitung der Speicheldrüsen weggelassen. Direkt in die 3,10 fort. - Unmittelbar dekantieren die Verdauung Lösung durch vorsichtiges Pipettieren. Waschen 2 ×, jeweils 5 min mit eiskaltem PBT, um die Verdauung zu stoppen.
- Führen Sie die zusätzlichen PBT wäscht 2 ×, jeweils 5 min bei Raumtemperatur.
- Fixierung von Gewebe in Lösung Post-fix bei Raumtemperatur mit Nutation für 30 min. Postfixierung Schritte sind nicht für den Speicheldrüsen durchgeführt.
- Führen Sie wäscht PBT 5 ×, jeweils 5 min.
4. Hybridisierung
- Äquilibrieren Gewebe in Hybridisierungslösung (Hyb) durch Inkubation bei Raumtemperatur mit 1 ml der Hybridisierungs / PBT (1:1) 30 min lang mit Nutation.
- Dekantieren so viel Hyb / PBT wie möglich. 1 ml Hyb in jedes Probenröhrchen.
- Wickeln Sie das Probenröhrchen in versiegelten-Air-schützenden Verpackung (Luftpolsterfolie) und im Inneren einer Hybridisierung Flasche. Verschließen Sie die Flasche mit einem Kronkorken-Hybridisierung.
- Prähybridisierung und Hybridisierung Schritte können leicht in einem Hybridisierungsofen durchgeführt werden. Führen Vorhybridisierung bei 55 ° C für 30 min mit der Drehung.
- Lassen Sie genügend Zeit für die Gewebe auf den Grund des Mikrozentrifugenröhrchens begleichen, da die Hyb ist dichter als PBT. Vorsichtig dekantieren Vorhybridisierungslösung. Gewebe können sich durchscheinend und schwierig zu visualisieren. Probenverlust kann, indem man 50 bis 100 ul Lösungsvolumen bei jedem Probenröhrchen reduziert werden.
- Dann werden 50 ul Volumen von Hyb in das Probenröhrchen und in einem Heizblock halten bei 55 ° C
- Denaturierung des RNA-Sonde bei 85 ° C für 5-10 min. Unmittelbar, legen Sie die denaturierte Sonde auf Eis für 5 min.
- Pipettieren Sie die RNA-Sonde in das Probenröhrchen. Die RNA-Sonde an der Oberfläche des Hyb schweben. Mischen Sie den Schlauch durch flicking sanft.
- Führen Sie die Hybridisierung in einem Gesamtvolumen von 50-100 ul Hyb pro Probe. Inkubieren der Proben in einer festen Zahnstange in einer Mikrozentrifuge Hybridisierungsofen, oder in einem schwebenden Mikrozentrifugenröhrchen Gestell in einem Wasserbad bei 55 ° C für 16-24 Stunden.
5. RNAse A-Behandlung
- Entfernen Sie die Hyb mit der Sonde. Es ist wichtig, um die Proben bei 55 ° C zu halten während der Waschschritte, um nicht-spezifische Bindung von restlichem ungebundene Sonde zu reduzieren. Wenn mehrere Proben hybridisiert sind, ist es empfehlenswert, Probenröhrchen in einem Heizblock eingestellt halten bei 55 ° C, um die Hybridisierungstemperatur in der Waschschritte zu halten.
- Führen Sie eine schnelle Wäsche mit Hyb durch Pipettieren von 1 ml Lösung in die Wanne MikrofugeE und Invertieren der Probenröhrchen 5-6 mal.
Alle nachfolgenden praktischen Waschungen in dem Protokoll sind in ähnlicher Weise durch Zugabe der erforderlichen Lösung und das Probenröhrchen-invertierenden mehrere Male durchgeführt. - Es können zwei zusätzliche Waschungen mit Hyb bei 55 ° C, 30 min jeweils mit Drehung in der Hybridisierungsofen.
- Äquilibrieren in PBT durch Inkubation bei Raumtemperatur mit Hyb / PBT (1:1) 15 min lang mit Nutation.
- Führen Sie wäscht PBT 5 ×, jeweils 5 min.
- Bereiten Sie frische RNAse einen Puffer. Führen RNAse-A-Behandlung durch Inkubation in 20 ug / ml RNAse A / PBT bei 37 ° C, 30 min. RNAse A spaltet einzelsträngige RNA und beim Abbau von nicht-hybridisierten RNA-Sonde führen.
- Dekantieren RNAse A Puffer und führen Sie eine schnelle Wäsche mit PBT.
- Führen PBT wäscht 3 ×, jeweils 5 min.
6. Antikörperinkubation
- Bereiten Sie frische Blockierungslösung (5% Serum vom Huhn / 1% Western Blocking Reagent / PBT) und Block-Proben durch InkubationTing in 1 ml Lösung für 30 min bei Raumtemperatur mit Nutation.
- Zugabe von 200 ul einer 1:1000-Verdünnung von Anti-DIG-alkalische Phosphatase (AP)-konjugierten Antikörper in Blocking-Lösung. Inkubation bei 4 ° C, über Nacht mit Nutation.
7. Alkalische Phosphatase Färbung
- Entfernen Sie die Antikörper-und Blocking-Lösung.
- Führen Sie einen kurzen Waschung mit PBT.
- Führen Sie die zusätzlichen PBT wäscht 5 ×, jeweils 10 Minuten. Alternativ können die Proben gewaschen 3x, jeweils 10 Minuten durch einen verlängerten Waschen bei 4 ° C, über Nacht mit Nutation folgen.
- Bereiten Sie frische AP Färbepuffer.
- Führen Sie schnelle Wäsche mit AP Färbepuffer.
- Führen Sie die zusätzlichen Waschungen mit AP Färbepuffer 3 ×, jeweils 5 min mit Nutation.
- Bereiten Sie nach den Anweisungen des Herstellers, frischen AP-Färbelösung mit der AP-Substrat NBT / BCIP.
- Inkubieren Sie jede Probe mit 500 ul AP-Färbelösung bei Raumtemperatur Längee mit Nutation, in der Dunkelheit. Die Proben können durch Abdecken der Rohre mit einem opaken Behälter oder Aluminiumfolie inkubiert werden. Reaktionsverlauf sollte alle 1-2 Minuten zur Bildung einer purpurroten Niederschlag beobachtet werden. In Abhängigkeit von der Konzentration der Sonde, die Konzentration von Ziel-RNA und das Vorhandensein von nicht-spezifischen Ziele, kann die Färbung für einige Minuten bis einige Stunden lang ablaufen.
- Entfernen Sie so viel der Färbelösung wie möglich. Unzureichende Dekantieren führt zur Bildung eines weißen flockigen Niederschlag während der nachfolgenden Waschschritte.
- Die Färbung wird vollständig durch die Durchführung von zwei schnellen Waschen mit PBT gestoppt.
- Führen Sie die zusätzlichen PBT wäscht 3 ×, jeweils 5 min.
8. Glycerin Montage
- Mit einer großen Bohrung 200 pl Pipettenspitze, Transfer Proben aus Mikrozentrifugenröhrchen in einzelne Rundboden-Vertiefungen einer Pyrex Tüpfelplatte.
- Vorsichtig aus der Probe zu entfernen, da ein großer Teil der PBT wie möglich.
- Pipette auf der Oberseite der Probe 70% Glycerin / H 2 O. Willkommen sind Glycerin, um die Gewebeprobe bei 4 ° C Permeat, über Nacht. Glycerin Behandlung verhindert Austrocknung der Gewebe während der Schienenführung.
- Bereiten Objektträger durch Abwischen der Gleitfläche mit Kimwipes reinigen. Anwenden auf die Folie zwei Stücke unsichtbare Band parallel zueinander, so dass sie einen engen Kanal (2) zu bilden.
- Mit einem künstlerischen Pinsel, abholen Proben ein-by-one und legen Sie sie entlang der Länge des Kanals, die Positionierung jeder Probe mit der gleichen Ausrichtung in Bezug auf anterior / posterior und dorsal / ventral Ausrichtungen.
- Nach der Positionierung jeder Probe, mit einem Tupfer Kimwipe, um überschüssige Glycerin-Lösung rund um das Gewebe (Abbildung 3) zu absorbieren. Entfernung des überschüssigen Glycerin ist wichtig, um die Bildung von Blasen zu verhindern, beim Abdichten der eingebettete Proben auf dem Objektträger unter einem Deckglas.
- Zentrum und Ort sorgfältig acüber Slip über den Kanal mit den Proben ausgerichtet. Befestigen Sie die Abdeckung semipermanent rutschen auf den Objektträger durch Tupfen Sie die Ecken des Deckglases mit transparentem Nagellack.
- Unter Verwendung eines 200 ul Pipette langsam verzichtet in ein Ende des Kanals 70% Glycerin genug, um durch Kapillarwirkung füllen den gesamten Raum des Kanals und die Fläche unter dem Deckglas.
- Dauerhaft versiegeln die eingebettete Proben unter Anwendung Nagellack entlang aller vier Seiten des Deckglases. Lassen Sie den Nagellack ausreichend trocknen, bevor Fotografieren der hybridisierten whole-mount Gewebe. Es wird empfohlen, um Bilder der Proben unmittelbar nach der Montage zu fotografieren.
B. in situ Hybridisierung für Mosquito Embryonen
Lösungen und Puffer für die Hybridisierung in situ für Moskito Embryonen benötigt werden beschrieben (Tabelle 1). Fixierung und Hybridisierung hier vorgestellten Verfahren wurden von thos geändert wordene erste bekannt für Anopheles gambiae, 5,6 Aedes aegypti und Culex quinquefasciatus 7. 8
1. Embryo-Entnahme
- Die Embryonen werden aus 300 zusammengesteckt, weiblichen, erwachsenen Mücken (erlaubt, mit Männern über 48 h, 3 Tage nach dem Auflaufen paaren) 72 Stunden nach der Fütterung Blut gesammelt. Die Mücken sind auf 3 M Saccharose-Lösung erhalten, um die Eiablage vor der beabsichtigten Sammlung Zeitraum zu verhindern.
- Bereiten Embryo Sammelbehälter durch Auskleiden eines 16 Unzen Pappbecher mit Saatilene Hitech Maschen, so daß die Innenfläche der Schale vollständig bedeckt ist. Das Netz kann durch eine einzelne Klammer angebracht werden. Mit diesem Gitter reduziert faserigen Verunreinigungen, die vorhanden sind, wenn Whatman-Filterpapier oder Papiertücher verwendet werden.
- Füllen Sie den Behälter halb voll mit destilliertem Wasser.
- Die Embryonen werden für 1 Stunde, indem die Sammelbehälter in dem Käfig, die anschließend abgedeckt wird gesammeltvon einem dunklen Tuch zu stimulieren Eiablage.
- Gesammelte Embryonen dürfen zu wünschen Entwicklungsstadien außerhalb des Käfigs in Standard Haltungsbedingungen (85% relative Feuchte / 26 ° C) zu reifen. Die Reifung der Embryonen zu verschiedenen Stufen kann die Zeit (Stunden nach der Eiablage-) nach dem ungefähren Entwicklungszeit Laufe der embryonalen beschriebenen Ereignisse (Tabelle 2) korreliert werden. Diese Tabelle fasst wichtige Ereignisse in der embryonalen Entwicklung für Aedes aegypti, durch Raminani und Cupp berichtete, beschrieb 9,10 Anopheles gambiae zuerst von Ivanova-Kazas 11 und weiter durch Goltsev und Kollegen, 12,13 und Culex quinquefasciatus berichtet von Davis erarbeitet. Die 14 Zeit-Verläufe beschrieben sind, sollen als erste Schätzungen, anstatt absolute Zeitpunkte für die Sammlung von Embryonen in bestimmten Phasen der Entwicklung dienen.
2. Dechorionation, Fixierung und Endochoriauf Störung
- -Embryonen aus dem Sammelbehälter in eine Saatilene Mesh dechorionation Fang Röhre (Abbildung 3).
Für Aedes Embryonen, ein Fang Rohr in ein Becherglas, das mit ausreichend destilliertem Wasser gefüllt wird, so daß das Volumen der Klinke Rohr ein halb voll ist. Eine künstlerische Pinsel kann verwendet werden, um die Embryonen aus dem Netz zu verdrängen Saatilene und übertragen Sie sie in den mit Wasser gefüllten Röhre Fang werden.
Für Anopheles-Embryonen, nehmen Sie den Saatilene Mesh aus dem Sammelbehälter und falten Sie das Gitter vorsichtig auf einen Trichter bilden. Halten Sie das Mesh Trichter mit einer Hand, mit der anderen Hand zu destilliertem Wasser durch eine Polyethylen Spritzflasche verzichten entlang der Seiten des Trichters, um die Embryonen in die Fang-Rohr zu waschen. Dieses Verfahren kann auf Anopheles Embryonen angewendet werden, da sie den Klebstoff auf der Oberfläche von Aedes Embryonen, die Eier ermöglicht, der Eiablage Substraten haften fehlt. - Prepare 40 ml dechorionation-Lösung (1 Volumen 5,25% Natriumhypochlorit: 3 Volumen destilliertes Wasser). Füllen Sie die Lösung in eine 100 mm Petrischale.
- Bereiten Sie ein 100 ml Becherglas mit 50 ml destilliertem Wasser und beiseite stellen. Die dechorionation Schritt zeitempfindliche und unmittelbar nach der Natriumhydrochloridbehandlung die Embryonen in diesem Wasser getaucht werden, um die Lösung zu verdünnen dechorionation.
- Dechorionate die Embryonen im Netz fangen Rohr, indem das Röhrchen in der Petrischale mit dechorionation-Lösung gefüllt. Verwenden Sie einen Einweg-Polyethylen Transferpipette oder Pasteurpipette, um die Embryonen zu waschen, während wirbelnde den Fang Fläschchen, so dass die Embryonen unter Wasser bleiben und in der dechorionation Lösung geschüttelt.
Ein Maximum von 35 Sek. für dechorionation von Aedes Embryonen erforderlich ist, während 75 Sekunden reicht für Anopheles und Culex Embryonen (Tabelle 3). Dechorionation ist eines der empfindlichsten Schritte des Protocol und Überdehnung der Natriumhypochlorit-Behandlung, die speziell für Aedes Embryonen verhindern eine ordnungsgemäße Cracken des Chorion. - Sofort tauchen die Fänge Fläschchen in den Becher mit Wasser.
- Spülen Sie die verbleibenden dechorionation Lösung von den Embryonen durch Entfernen der Haken Rohr aus dem mit Wasser gefüllten Becher und Abspülen der Innen und Außenwände des Fangs Schlauch mit destilliertem Wasser aus einer Spritzflasche oder Hahn mit Schlauch versehen.
- Dechorionation kann durch Sichtbarmachen der Embryonen mit einem Präpariermikroskop bei geringer Vergrößerung nachgewiesen werden. Dechorionated Aedes Embryonen fehlt die Netting-like exochorion und nur die glatte, polierte Oberfläche des schwarzen endochorion ist offensichtlich für dechorionated Anopheles-Embryonen, die Schwimmer und exochorionic Grat Strukturen nicht vorhanden sind (Abbildung 4).
- Mit einem künstlerischen Pinsel, übertragen Sie die dechorionated Embryonen in ein Szintillationsfläschchen mit 5 ml destilliertem Wasserter (Abbildung 5-1). Wenn mehrere Proben hergestellt werden, dann sind die Fang Röhrchen in Wasser, um ein Austrocknen der Embryonen zu verhindern.
- Lassen Sie die Embryonen auf der Basis des Szintillations-Fläschchen absetzen und so viel Wasser zu entfernen, aus dem Fläschchen wie möglich.
- 5 ml Heptan in die Szintillationsfläschchen (Abbildung 5-2). Entfernen Sie das restliche Wasser, das im Szintillationsfläschchen bleibt.
- Fügen Sie in das Szintillationsfläschchen 5 ml frisch zubereitete Embryo Fixierung Lösung (Tabelle 1).
- Befestigen Embryonen für 30 min unter Inversion, so daß die organischen und wässrigen Phasen gründlich zu mischen, aber nicht zu stark.
- Entfernen Sie die Fixierung Lösung mit einer Pasteurpipette aus Glas, man aufpassen, nicht um die Interphase, welche die Embryonen enthält (Abbildung 5-3) zu stören.
- Waschen Sie die restliche Fixierung Lösung durch Befüllen des Szintillationsfläschchen mit soviel destilliertem Wasser wie möglich. Drehen Sie die Durchstechflasche und 5-malentfernen Sie dann alle des destillierten Wassers.
- Füllen Sie den Szintillationsfläschchen mit 20 ml destilliertem Wasser und mischen durch Umdrehen der Flasche für 30 min.
- Entfernen Sie das gesamte Wasser aus dem Szintillationsfläschchen.
- Fügen Sie genug kochendes destilliertes Wasser in den Szintillationsfläschchen so dass die anorganischen Heptan-Phase erreicht die Spitze des Fläschchens.
- Inkubieren Sie für 30 Sekunden und entfernen dann alle das kochende Wasser.
- In eiskaltem destilliertem Wasser, bis der anorganischen Phase erreicht die Spitze des Fläschchens. Inkubation der Flasche in Eis für 10 min.
- Entfernen Sie zunächst die wässrigen und organischen Phasen anschließend. Das Heptan erscheint bei diesem Schritt (Abbildung 5-4) undurchsichtig.
- 5 ml Heptan neue in das Fläschchen. Entfernen Sie das gesamte restliche Wasser aus dem Fläschchen.
- 5 ml Methanol in das Fläschchen. Schwenken Sie die Durchstechflasche 1-2 mal energisch, ohne Schütteln (Abbildung 6). Wenn die anorganischen und organischen Heptan Methanol Phasen geschüttelt werden kräftig die Embryonen wiwerde während endochorion Bruch zerstört werden. Es ist erwähnenswert, dass wir Variation in der Effizienz der endochorion Störung beobachtet für verschiedene Stämme von Aedes aegypti Embryonen.
- Inkubieren bei Raumtemperatur für 15-20 min. Während dieser Phase werden die Phasen trüb durch die Freisetzung von Dotter-Komponenten (Abbildung 5-5).
- Entfernen Sie beide organischen und anorganischen Phasen und wäscht mit Methanol 3 mal, um alle restlichen Heptan zu entfernen.
- Embryonen können in Methanol bei -20 ° C für bis zu mehrere Monate gelagert.
3. Peeling
- Legen Sie ein Stück doppelseitiges Klebeband Toupet in der Mitte eines 3 cm Petrischale. Toupee Band verwendet wird, weil der Klebstoff in Gegenwart von Methanol und Ethanol stabil.
- Wenn eine große Bohrung (etwa 3 mm Durchmesser) 200 ul Pipettenspitze-Embryonen aus Methanol auf die doppelseitige Klebeband.
- Erlauben Sie 1-2 min für die Embryonen, sich niederzulassen und adhere auf das Band Oberfläche.
- Dekantieren überschüssige Methanol und lassen Sie die Oberfläche leicht angetrocknet für 1-2 min.
- 4 ml 95% (190 Proof) Ethanol in die Petrischale.
- Pipettieren Sie 600 ul destilliertes Wasser in den Ethanol und Schwenken vermischen. Das Band wird trüb in der Farbe. Zugabe von destilliertem Wasser führt dazu, das Band zu klebrig und zu immobilisieren die Embryonen beim Schälen. Dieser Schritt kann weggelassen werden, falls gewünscht.
- Verwenden Sie ein 27,5-Gauge-Nadel, die an einer 1 ml Spritze Fass zum Ablösen der rissige endochorion (Abbildung 7). Nach dem Loslassen der Embryo weißen von den schwarzen endochorion Reste, übertragen Sie die Embryonen aus der Band auf den Ethanol-Reservoir der Petrischale mit einem feinen Pinsel-Spitze künstlerisch. Mit einem 3-mm-Bohrung Pipettenspitze, übertragen Sie die Embryonen in eine Ambion 1,5 ml Mikrozentrifugenröhrchen mit 500 von 200 ul Ethanol Beweis.
Die geschälten Embryonen sollten nicht auf dem Band bleiben für eine längere Zeit, weil sie pro möglicherweise haftendauerhaft auf das Band. - Führen Sie 2-3 schnelle Waschungen mit 100% (200 Proof) Ethanol und speichern die Embryonen in punctilious Ethanol bei -20 ° C Geschälte Embryonen können bei -20 ° C für ein paar Monate werden, ohne die Morphologie oder die anschließende Hybridisierung Signal gespeichert.
4. Klärung von Yolk
- Führen Sie eine schnelle Wäsche mit 200 proof Ethanol. Korrekte Ethanol sollte für alle nachfolgenden Waschschritte und zur Herstellung der P-Xylol Eigelb Klärung Lösung verwendet werden.
- Führen Sie eine Ethanol waschen, 5 min mit Nutation.
- Inkubieren P-xylene/ethanol (9:1) bei Raumtemperatur für 1-1,5 h bei Nutation. Die Xylol-Schritt kann Klärung der Dottermasse, um das Signal-Rausch-Verhältnis zu verbessern.
- Entfernen Sie den Xylol-Ethanol-Lösung und führen zwei schnellen Waschen mit Ethanol.
- Führen Sie eine Ethanol waschen, 5 min mit Nutation.
- Führen Sie zwei schnelle Waschungen mit Methanol, um eine Methanolwäsche gefolgt, 5 min mitNutation.
- Äquilibrieren in 4% Formaldehyd-Fixierung Lösung von einmaligem Waschen mit Methanol / Formaldehyd-Fixierung Lösung (1:1).
5. Fixierung und Hybridisierung in situ
Fixierung und Hybridisierung in situ Verfahren sind identisch mit denen in Abschnitt A beschriebenen Protokoll
C. repräsentative Ergebnisse
Die Hybridisierung in situ hier beschriebene Protokoll, führt farbigen Färbungsmuster, die Anwesenheit und Lokalisierung des gezielten mRNA zeigt. Es ist wichtig zu betonen, dass das relative Niveau der Transkriptanreicherung nicht durch Hybridisierung in situ zu bestimmen. Hybridisierung Ergebnisse sind abhängig von der spezifischen mRNA-Sonde für die Hybridisierung verwendet Verfahren, die Häufigkeit der Ziel-mRNA in der hybridisierten Gewebe, wie auch durch die Konzentration und Hybridisierungstemperatur. Vergleich von Geweben mit Antisense-hybridisiert und entsprechenden Sense-mRNA-Sonden ermöglichen die genaue Interpretation der Färbungsmuster.
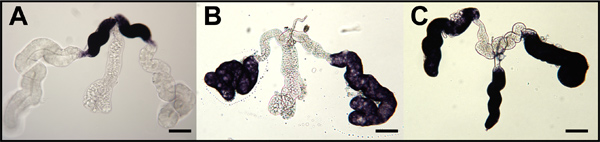
Hybridisierung in situ von whole-mount Speicheldrüsen der weiblichen Aedes aegypti mit mRNA-Sonden, dass Ziel amylase1 (AAEL006719), D7s2 (AAEL006423) und D7L2 (AAEL006424) Akkumulation dieser Transkripte in proximal-lateral, distal-lateral zeigen, und distal- lateralen / medialen Lappen (Abbildung 8). 1 whole-mount Eierstöcke von drei Mückenarten wurden mit mRNA-Sonden, die spezifisch auf die jeweiligen orthologen Transkripte von Oskar (Abbildung 9) hybridisiert. 7,8 Hybridisierung in situ von whole-mount Embryonen von Ae. aegypti, ein. gambiae und Cx. quinquefasciatus wurde unter Verwendung von Antisense-RNA-Sonden gezielt die jeweiligen Moskito Oskar orthologen Transkripte (Abbildung 10). 7,8
bbildung 1 "src =" / files/ftp_upload/3709/3709fig1.jpg "/>
Abbildung 1. Schematische Darstellung der Post-Hybridisierung Montage-Set-up.
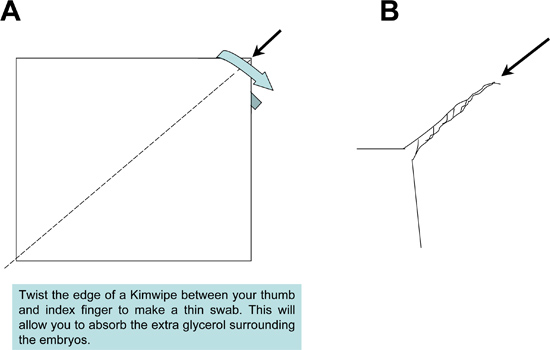
Abbildung 2. Vorbereitung der Probe während Kimwipe Mopp verwendet Montage. Ein Kimwipe Gewebe fest mit einem spitzen Mopp, um überschüssiges Eindeckmedium aus den Proben und Rutsche absorbieren produzieren verdreht.
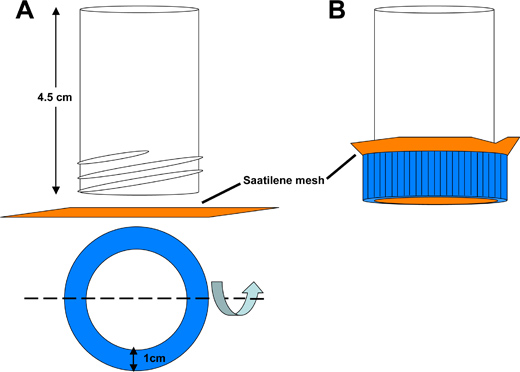
Abbildung 3. Schematische Darstellung der Saatilene Mesh dechorionation Klinke Rohr. A) Der Boden eines 50 ml konischen Röhrchen Polystyrol wird eine hohle Röhre 4,5 cm in der Länge, an beiden Enden offen zu ergeben geschnitten. Eine kreisförmige Öffnung aus dem konischen Rohr Deckel zu ermöglichen, dass Flüssigkeit durch eine 6,5 cm 2 quadratischen Stück Saatilene Mesh gewaschen werden geschnitten. Die 330 Fäden pro Zoll, behält 34 Mikron Durchmesser Gewinde Maschensieb die Mücke Embryonen. B) Assembled fangen Rohr.

4. Aedes aegypti und Anopheles gambiae Eier, vor und nach dechorionation. A) Aedes aegypti Eier vor dechorionation. Die netzartige exochorion liegt oberhalb des schwarzen endochorion und gibt dem Ei eine strukturierte Aussehen (Einschub Erweiterung). Nach dem Entfernen des exochorion, bleibt nur der glatte und polierte endochorion (B-und Einschub-Erweiterung). C) Eier von Anopheles gambiae vor dechorionation. Exochorion Strukturen wie Schwimmer sind sichtbar (Pfeile). D) Die glatte und polierte Oberfläche des endochorion ist sichtbar nach dechorionation. Bar = 100 um.

Abbildung 5. Eine Reihe von aufeinander folgenden Schritten zur Fixierung und endochorion Unterbrechung der Ae. aegypti Eier. A) Slanted-Frontalansichtund B) lateral-Blick auf Szintillationsgefäße mit Ae. aegypti Eier während der aufeinanderfolgenden Schritte Fixierung und endochorion Störung. 1) Die Embryonen in destilliertem Wasser. 2) Die Embryonen schweben in der Interphase zwischen der oberen Heptan-Phase und die untere wässrige Phase. 3) Nach der Fixierung die Embryonen packen zusammen in einer runden Masse. Embryonen bleiben in der Interphase zwischen Heptan und Fixierlösung Phasen. 4) Nach der Behandlung mit kochendem Wasser und Inkubation auf Eis, wird die Heptan-Phase leicht trübe. 5) Die Embryonen mit einer gestörten endochorions sind in der Interphase zwischen einem opaken und transparenten Heptanphase Methanol-Phase gezeigt.

Abbildung 6. Endochorion Unterbrechung der festen Ae. aegypti Eier. A) unmittelbar nach energetischer Verwirbelung Heptan und Methanol Phasen kann die Bildung von Blasen und die Störung des endochorion visualisiert werden. B) following fünf Minuten Inkubation bei Raumtemperatur.
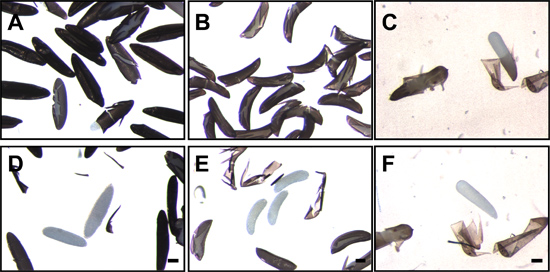
Abbildung 7. Mosquito Eier nach Unterbrechung und Entfernung des endochorion. Eier von Ae. aegypti (A), ein. gambiae (B) und Cx. quinquefasciatus (C) folgende Fixierung und Störung des endochorion. Weiß, durchscheinend Embryonen können innerhalb des gerissenen endochorion gesehen werden. Nach dem Entfernen des endochorion die transluzenten Embryonen von Ae. aegypti (D), ein. gambiae (E) und Cx. quinquefasciatus (F) sind deutlich sichtbar. Bar = 100 um.
8. In situ Hybridisierungen für drei Gene in verschiedenen Lappen der whole-mount, weiblich Ae ausgedrückt. aegypti Speicheldrüsen. Die Färbung ist ein Hinweis auf Lokalisation und Akkumulation von amylase1 (AAE L006719) (A), D7s2 (AAEL006423) (B) und D7L2 (AAEL006424) (B). Bar = 100 um.
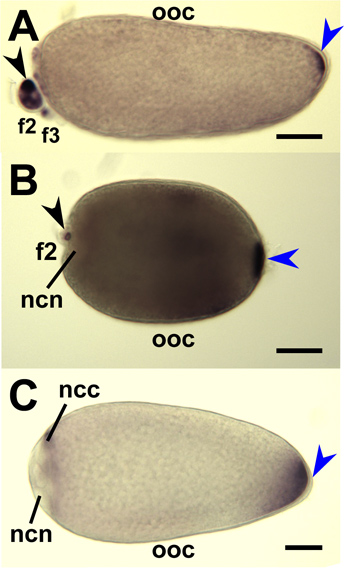
Abbildung 9. In-situ-Hybridisierung für Moskito Oskar Antisense-RNA-Sonden, um whole-mount Moskito Eizellen und Nährzellen. Stadium IV Oozyten (OOC) aus Eierstöcken von Ein seziert. gambiae (A), Ae. aegypti (B) und Cx. quinquefasciatus (C) und mit RNA-Sonden Targeting jeweiligen Moskito oskar mRNAs hybridisiert. Primärfollikel orientieren sich mit vorderen auf der linken Seite. Die Färbung am hinteren Pol (blaue Pfeilspitze) zeigen Oskar mRNAs angesammelt. Sekundäre (f2) und tertiäre (F3) Follikel werden gezeigt und Färbung (schwarz Pfeilspitze) zeigen Anhäufung von oskar mRNA im Zytoplasma Krankenschwester (NCC). Die Färbung wird von der Krankenschwester Zellkerne (NCN) ausgeschlossen. Bar = 50 um.
ad/3709/3709fig10.jpg "/>
Abbildung 10. In-situ-Hybridisierung für Moskito Oskar Antisense-RNA-Sonden, um whole-mount Moskito Embryonen. Embryonen sind ausgerichtet auf der linken vorderen. Cellular Blastodermstadium Embryonen der. gambiae (A) und Cx. quinquefasciatus (C) mit jeweiligen Mückenarten-spezifischen oskar RNA-Sonden hybridisiert. B) Ein Syncytial Blastodermstadium Ae. aegypti Embryo mit RNA-Sonden hybridisiert Targeting Ae. aegypti oskar Transkripts. Die Färbung ist in den hinteren Pol Zellen aller Embryonen erkennbar, was darauf hinweist Lokalisation und Akkumulation von Moskito oskar mRNA in diesen Zellen. Bar = 50 um.

Tabelle 1. Lösungen und Puffer für Formaldehyd-Gelelektrophorese, Fixierung und Hybridisierung in situ.
ftp_upload/3709/3709table2.jpg "/>
Tabelle 2. Entwicklungsbiologie Ereignisse und morphologische Beobachtungen entsprechend aufeinander folgenden Stufen während der Embryogenese Mücke.

Tabelle 3. Zusammenfassung der wesentlichen Unterschiede in der Vor-Hybridisierung Schritte für verschiedene Gewebearten.
Diskussion
Die Hybridisierung in situ und kolorimetrischen Färbeprotokoll präsentiert hier für whole-mount Moskito Gewebe und Embryonen ist eine nützliche Technik für die Lokalisierung von spezifischen Transkripte in Organen und Zelltypen. Diese Verfahren sind eine Verbesserung gegenüber den bereits zuvor gemeldeten Methoden, die beide bei der Straffung umfangreiche Waschschritte und zusätzliche technische Details und Reagenz Quellen.
Nach unserer Erfahrung ist kolorimetrischen Nachweis der Hybridisierungssignale überlegen in der Empfindlichkeit und Klarheit der Hybridisierung Signal im Vergleich zu Fluoreszenz-basierte Erkennung Systeme. Außerdem kolorimetrischen Nachweis umgeht Probleme mit Signal Diskriminierung in Embryonen, die von Natur aus Auto-Fluoreszenz assoziiert sind. Einschränkungen bei der Aufdeckung von Hybridisierungssignale auftreten, wenn Low-Transkripte Fülle ausgerichtet sind und Hintergrundfärbung ist evident. Eine Erhöhung der Hybridisierungstemperatur auf 65 ° C wurde gefunden, zurück zu verringernBoden Hybridisierungssignale, ist aber nicht eine vorgeschlagene Ersatz für die Planung von einzigartigen Ziel-spezifischen RNA-Sonden.
Dieses Protokoll wurde verwendet, um in situ Hybridisierung von Gesamt-Halterung Speicheldrüsen von Aedes aegypti und der Eierstöcke und Embryonen von Anopheles gambiae, Anopheles stephensi, Ae durchzuführen. aegypti und Culex quinquefasciatus. Dieses Verfahren ist auch auf andere Gewebe Moskitos, und vermutlich auch von anderen Insekten. Zusätzlich haben wir zum ersten Mal vergleichenden Leitlinien für die Inszenierung der embryonalen Entwicklung in drei Vektor-Mücken, Ae zusammengestellt. aegypti, ein. gambiae und Cx. fatigans. Die Beobachtungen wurden für spezifische Stämme von diesen drei Arten, unter diskret Haltungsbedingungen berichtet worden. Es ist wichtig zu beachten, dass die Entwicklungszeit natürlich können verschiedene Stämme von Stechmückenarten und unter verschiedenen Haltungsbedingungen variieren. In situ Hybridisierungen Ergänzung der laufenden Bemühungen um die analysieren die Transkriptome Mücken und anderen Arthropoden, und kann ein besseres Bild von der Regulation der Genexpression in diesen Organismen bieten.
Offenlegungen
Die Autoren haben keinerlei Angaben.
Danksagungen
Die Autoren bedanken sich bei Marika Walters für Beratung bei der Entwicklung von in-situ-Hybridisierung danken Methoden für Weichteile und Yury Goltsev für die Diskussion von Protokollen für die Hybridisierung in situ von Anopheles gambiae Embryonen, die anschließend angepasst und wurden modifiziert, um die hier beschriebene Protokoll für die Hybridisierung in Entwicklung situ von Aedes und Culex Embryonen. Wir erkennen auch hilfreiche Empfehlungen von Adam Paré und David Kosman gegeben. Wir bedanken uns bei Osvaldo Marinotti für wissenschaftliche Diskussion und Bearbeitung der Text-Protokoll.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| 0,5 M EDTA | Ambion | AM9261 | |
| 1 M Tris-HCl | Ambion | AM9855G | pH 8,0 |
| 10X PBS | Ambion | AM9625 | |
| 20X SSC | Ambion | AM9763 | |
| 1,5 ml Mikrozentrifugenröhrchen | Ambion | AM12400 | Weniger undurchsichtig als herkömmliche Röhren; Hilfsmittel bei der Visualisierung von Proben |
| Deionisiertem Formamid | Ambion | AM9342 | Lagerung bei 4 ° C |
| DEPC-Wasser | Ambion | AM9932 | |
| Proteinase K | Ambion | AM2546 | |
| 5,25% Natriumhypochlorit | Austins | A-1 Marke | |
| T3-RNA-Polymerase-Plus | Ambion | AM2733 | Lagerung bei -20 ° C |
| T7-RNA-Polymerase | Ambion | AM2082 | Lagerung bei -20 ° C |
| 95% Ethanol | Fisher Scientific | AC61511-0040 | |
| Fisherbrand Einweg-Polyethylen Transferpipetten | Fisher Scientific | 13 bis 711-7M | |
| 37% Formaldehyd | Fisher Scientific | F79-500 | |
| HPLC-Methanol | Fisher Scientific | A452-1 | |
| Magnesiumchlorid | Fisher Scientific | M87-500 | |
| Mikroskop Deckglas | Fisher Scientific | 12-542A | 18 x18 mm |
| N-Heptan | Fisher Scientific | H350-1 | |
| P-Xylol | Fisher Scientific | O5082-500 | |
| Pyrex-9-und Tüpfelplatte | Fisher Scientific | 13-748b | 100x85 mm |
| Kochsalz | Fisher Scientific | AC32730-0025 | |
| Natriumhydroxid | Fisher Scientific | SS255-1 | |
| Superfrost / Plus Objektträger | Fisher Scientific | 12-550-15 | 25x75x1.0 mm |
| Davlyn Red Clear-Liner Toupee Tape | Hair Direct | RED-75R12 | Poly / Haut-Basismaterial in 0,75 x 12 m Klebebandrolle |
| TOPOTA Cloning Kit für Sequening mit One Shot Top10 chemisch-kompetente E. coli | Invitrogen | K457501 K457540 | 20 Reaktionen 40 Reaktionen |
| Beschallte Lachssperma-DNA | Invitrogen | 15632-011 | Lagerung bei -20 ° C |
| Anti-Digoxigenin-AP Fab-Fragmente | Roche Applied Science | 1093274 | Lagerung bei 4 ° C |
| DIG RNA Labeling Mix | Roche Applied Science | 1277073 | Lagerung bei -20 ° C |
| NBT / BCIP-Stammlösung | Roche Applied Science | 1681451 | Lagerung bei 4 ° C |
| Western Blocking Reagent | Roche Applied Science | 11921673001 | Lagerung bei 4 ° C |
| Saatilene Hitech Polyester-Mesh (330,130) | Saati Drucken | 330,34 UO PW | 330 Fäden / inch, 34 Mikron Gewindedurchmesser, Farbe orange |
| Glycerin | Sigma | G6279-1 | 70% in PBT |
| Heparin-Natrium-Salz | Sigma | H3393 | |
| Tween 20 | Sigma | P1379-500 | |
| 37% Formaldehyd | Ted Pella | 18508 | 10 ml-Portionen in Ampullen Bernstein |
| 16 Unzen Solo Papier Behälter mit Deckel | Das Paper Company | SOLOKH16AJ8000 | |
| Borosilikatglas scintillatIonen-Flasche mit Schraubverschluss ungebunden | VWR International | 66022-128 | 20 ml Fall von 500 |
| Sealed Air Luftpolsterfolie celluar Polstermaterial | VWR International | 500018-081 | 10-Fuß-/ Rolle 0,188 Zoll dick |
| Hühnerserum | Vollblut wurde entweder vom Flügel Vene oder durch Herzpunktion aus einer juvenilen Hühnern gesammelt. Das Blut wurde bei 37 ° C für 1 h bis koaguliert und dann auf Eis für 30 min inkubiert angeordnet. Das Serum wurde gesammelt und bei 3000 × g für 10 Minuten zentrifugiert. Der resultierende Überstand (geklärte Serum) wurde gesammelt und bei -20 ° C bis zur Verwendung. |
Tabelle 4. Tabelle Reagenzien und Ausrüstung für die in situ Hybridisierung.
Referenzen
- Juhn, J. Spatial mapping of gene expression in the salivary glands of the dengue vector mosquito, Aedes aegypti. Parasit. Vectors. 4, 1 (2011).
- Coleman, J., Juhn, J., James, A. A. Dissection of midgut and salivary glands from Ae. aegypti mosquitoes. J. Vis. Exp. (5), e228 (2007).
- Benedict, M. Q. Dissecting Plasmodium-infected Mosquitoes: Salivary Glands, Chapter. 5.4.2. Methods in Anopheles Research. , (2007).
- Sappington, T. W., Brown, M. R., Raikhel, A. S. Culture and analysis of insect ovaries, Chapter. 42.3. The Molecular Biology of Insect Disease Vectors: A methods manual. , (1997).
- Goltsev, Y., Hsiong, W., Lanzaro, G., Levine, M. Different combinations of gap repressors for common stripes in Anopheles and Drosophila embryos. Dev. Biol. 275, 435-446 (2004).
- Benedict, M. Q. Anopheles Embryo Fixation, Chapter. 3.7. Methods in Anopheles Research. Malaria Research and Reference Reagent Resource Center (MR4). , (2007).
- Juhn, J., James, A. A. oskar gene expression in the vector mosquitoes, Anopheles gambiae and Aedes aegypti. Insect Mol. Biol. 15, 363-372 (2006).
- Juhn, J., Marinotti, O., Calvo, E., James, A. A. Gene structure and expression of nanos (nos) and oskar (osk) orthologues of the vector mosquito, Culex quinquefasciatus. Insect Mol. Biol. 17, 545-552 (2008).
- Raminani, L. N., Cupp, E. W. Early Embryology of Aedes aegypti (L.) (Diptera: Culicidae). Int. J. Insect Morphol. & Embryol. 4, 517-528 (1975).
- Raminani, L. N., Cupp, E. W. Embryology of Aedes aegypti (L.) (Diptera: Culicidae): Organogenesis. Int. J. Insect morphol. & Embryol. 7, 273-296 (1978).
- Ivanova-Kazas, O. M. Embryonic development of Anopheles maculipennis Mg. Izv. Akad. Nauk SSSR ser. Biol. 2, 140-170 (1949).
- Goltsev, Y. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Dev. Biol. 330, 462-470 (2009).
- Papatsenko, D., Levine, M., Goltsev, Y. Clusters of temporal discordances reveal distinct embryonic patterning mechanisms in Drosophila and Anopheles. PLoS Biol. 9, e1000584 (2011).
- Davis, C. W. C. A comparative study of larval embryogenesis in the mosquito Culex fatigans Wiedemann (Diptera: Culicidae) and the sheep-fly Lucilla seriata Meigen (Diptera: Calliphoridae) I. Description of embryonic development. Aust. J. Zool. 15, 547-579 (1967).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten