Method Article
Гибридизация
В этой статье
Резюме
Временные и пространственные анализ экспрессии гена играют важную роль в области функциональной геномики. Всего монтажа гибридизации На месте Используется для определения локализации транскриптов в тканях и субклеточных отсеков. Здесь мы приводим гибридизации На месте Протокол с изменениями конкретных тканях в комаров.
Аннотация
Комары являются переносчиками разнообразных возбудителей арбовирусов в том числе, простейшие паразиты и нематод. Исследование протоколов и генной регуляторов, которые выражаются в тканях, в котором хозяин комаров и возбудителей взаимодействуют, и в органах, участвующих в воспроизводстве представляют большой интерес для стратегии сокращения комарами передачи заболевания и нарушить развитие яиц. Ряд инструментов были использованы для изучения и проверки временных и тканеспецифические регуляции экспрессии генов. Здесь мы рассмотрим протоколы, которые были разработаны для получения пространственной информации, которая усиливает наше понимание того, где конкретные гены экспрессируются и продуктов их накапливать. Протокол описан был использован для проверки выражения и определения накопления моделей протоколов в тканях, связанные с комарами возбудитель передачи, такие, как женщина слюнных желез, а также субклеточном отсеков яичников и эмбрионов, которые повторнопоздно, чтобы комар воспроизводства и развития.
Следующая процедура представляет собой оптимизированный методологию, которая повышает эффективность различных шагов в протокол без потери целевой конкретные сигналы гибридизации. Руководство по подготовке РНК зонд, рассечение мягких тканей и общий порядок фиксации и гибридизации описаны в Части А, в то время как конкретные шаги по сбору, фиксации, предварительно гибридизации и гибридизации эмбрионов комаров подробно в части В.
протокол
А. гибридизации на месте для мягких тканей: слюнные железы комара и яичников
Рецепты для решения и буферы, необходимые для следующих процедур приведены в Таблице 1.
1. РНК-зонд Подготовка и анализ качества
- Дизайн праймеров для ПЦР усилить запись объектом интереса. Рекомендуется ампликона составляет ≥ 600 нуклеотидов в длину и более важно, что ампликона последовательность является уникальным для целевой стенограммы. Последовательности, которые не являются уникальными можно избежать, чтобы исключить возможность генерации перекрестно-реактивный РНК-зонды.
- Клонирование ПЦР-продукта в pCR4-TOPO вектор, или аналогичный вектор клонирования. PCR4-TOPO клонирование вектор содержит T7 и T3 РНК-полимеразы грунтовки сайтов, которые позволяют производить как смысл и антисмысловых стоки продукты транскрипции из одного клона.
- Последовательность клонированных ампликона проверить последовательность FIDelity и ориентации в вектор плазмиды.
- Выполнение реакции ограничение дайджест фермент подходит для производства антисмысловых в продукт транскрипции пробирке. Плазмиды линеаризация производится просто выбрав ограничение участке, расположенном в нескольких области клонирования TOPO pCR4-вектор, таких как Spe I, Pst я или не я Убедитесь, что выбранный сайт ограничение не присутствует в клонированного фрагмента. То же клон может быть использован для создания ощущения нитей РНК зонд, который служит фоном управления. Гибридизации на месте с чувством зонд должен дать мало или нет сигнала, когда по сравнению с дополнительным датчиком антисмысловых.
- Проверьте с помощью гель-электрофореза, что pCR4-TOPO клон полностью линеаризуется.
- Очисти линеаризованной плазмиды ДНК, выполняя фенол-хлороформом, а затем осаждением этанолом. Когда осаждения плазмидной ДНК рекомендуется использовать окончательный концентрациямирационе 2 М ацетата аммония с 2,5 объемами этанола для уменьшения переноса остаточной соли в реакции транскрипции пробирке.
- Подготовка дигоксигенин (DIG)-меченных одноцепочечной РНК зонд, выполняя стоки в реакцию транскрипции пробирке, используя 1 мкг линеаризованной плазмидной ДНК в качестве шаблона. Подготовка реакцию с РНК-полимераза, транскрипция буфера и DIG РНК маркировке смеси, как описано в инструкции производителя.
- Очисти DIG-маркировку, в продуктах пробирке транскрипции осаждения этанолом и ресуспендируют гранулированный РНК в DEPC обработанные дистиллированной воды.
- Проверка качества и ожидаемого молекулярного веса очищенного DIG-меченым зондом РНК формальдегида гель-электрофореза. Подготовленный зонд РНК можно разделить на порции и хранили при -80 ° C до использования.
2. Препарирование слюнные железы комара и яичников
- Проанализируйте комаров слюнных ГланDS с помощью зонда и щипцы, как описано выше для Ae. aegypti. Для 1,2. gambiae, слюнных желез можно разрезать, как описано для Ae. aegypti, или же, как описано в MR4 Методы исследования Anopheles руководство 3.
- Проанализируйте комаров яичников с помощью щипцов, как описано выше для Ae. aegypti 4. Короче говоря, использовать одну пару щипцов, чтобы понять, грудной клетки, а другая пара щипцов снимает предпоследнего сегмента брюшка, чтобы освободить яичников.
- Соберите расчлененный слюнные железы или яичников в Ambion РНКазы без микроцентрифужную 1,5 мл пробирки, содержащие по 50 мкл PBS.
- Поддержание образцы на льду до фиксации.
3. Фиксация
- Исправить расчлененный тканей свежеприготовленные мягкий решение фиксации тканей (табл. 1) при комнатной температуре нутации в течение 30 мин до 1 часа. Фиксация раствор готовят свежие, чтобы предотвратить oxidatионных формальдегида фиксатором. Фиксация в течение 1-1,5 часа рекомендуется для слюнных желез. Минимальный объем 1 мл Рекомендуется для фиксации тканей в 1,5 трубки микроцентрифужную мл.
- Дайте ткани осели на дно микроцентрифужную трубку. Это важный шаг, который следит за всеми изменениями решения в протокол и позволит свести к минимуму значительные потери образца.
- Декантируйте фиксации решение тщательным пипетирования, оставив 50-100 мкл объема микроцентрифужную трубки, а затем промыть 3 × 5 мин каждый с PBT.
- Дополнительные действия для равновесия тканей хранения. Поэтапное промыть PBT либо этанол или метанол. Выполнить поэтапный промывок PBT / спирт (3:1, 1:1 и 1:3, 5 минут каждый). Хранить в 100% (200 доказательств) спирта при температуре -20 ° C. Ткани могут быть сохранены в течение нескольких месяцев без ухудшения ткани ультраструктура. Перед выполнением последующих шагов протокола, ткани должны быть возвращены PBT ступенчатой равновесия с алкоголем / PBT (3:1, 1:1,1:3, 5 минут каждый).
- Выполните PBT моет 3 × 5 мин каждый.
- Выполните переваривания белков с 0,01 мг / мл протеиназы К / PBT, 5 мин при комнатной температуре. Кроме того, если оба immunolocalization белка цели и гибридизации на месте РНК желательны, яичников может быть инкубировали с 80% ацетон / H 2 O при температуре -20 ° С в течение 10 мин, а лечение с протеиназы К.
Протеиназы К лечению опущен для подготовки слюнных желез. Перейдите к пункту 3.10. - Сразу перелить пищеварения решение тщательным пипетирования. Вымойте 2 × 5 мин каждый с ледяной PBT прекратить пищеварение.
- Выполнение дополнительных PBT моет 2 × 5 мин каждый при комнатной температуре.
- После исправить в мягкие ткани решение фиксации при комнатной температуре нутации в течение 30 мин. После фиксации шаги не выполняются в слюнных железах.
- Выполните PBT моет 5 × 5 мин каждый.
4. Гибридизация
- равновесие тканей в гибридизации решение (Hyb) путем инкубации при комнатной температуре с 1 мл Hyb / PBT (1:1) в течение 30 мин с нутации.
- Переливать столько Hyb / PBT насколько это возможно. Добавить 1 мл Hyb в каждой пробирки.
- Оберните пробирку в запечатанных воздухе защитная упаковка (пузырчатая пленка) и место в гибридизации бутылку. Закройте флакон с крышкой бутылки гибридизации.
- Предварительно гибридизации и гибридизации шаги могут быть легко в гибридизации печи. Выполните предварительно гибридизации при 55 ° С в течение 30 мин с вращением.
- Подождите, пока ткани осели на дно микроцентрифужную трубку, как Hyb более плотная, чем PBT. Аккуратно перелить предварительной гибридизации решение. Ткани могут стать прозрачными и трудно себе представить. Пример потери можно уменьшить, оставив 50-100 мкл раствора объемом в каждой пробирки.
- Добавить 50 мкл объема Hyb в пробирку и сохранить в жару блока при температуре 55 ° C.
- Денатурации РНК зонд при 85 ° C в течение 5-10 мин. Немедленно поместите денатурированный зонд на льду в течение 5 мин.
- Пипетировать РНК зонд в пробирку. Зонд РНК будет плавать на поверхности Hyb. Смешать, щелкая трубке мягко.
- Выполните гибридизации в общем объеме 50-100 мкл Hyb в образце. Инкубируйте образцы в фиксированной стойке микроцентрифужную в гибридизации печи, или в плавающее стойки микроцентрифужную пробирку на водяной бане, при температуре 55 ° С в течение 16-24 часов.
5. РНКазы лечение
- Удалить Hyb содержащие зонда. Это важно для поддержания образцов при 55 ° C во время стирки меры по снижению неспецифического связывания остаточного несвязанного зонда. Если несколько образцов гибридизовали, рекомендуется хранить образцы труб в тепло блок установлен на уровне 55 ° С для поддержания температуры в гибридизации промывки.
- Быстрое мытье с Hyb с помощью пипетки 1 мл раствора в ванне микроцентрифужнуюэлектронной и обращения трубки образца 5-6 раз.
Все последующие быстрой мойки в протокол выполняется аналогичным образом, добавляя необходимые решения и обращения пробирки несколько раз. - Выполните два дополнительных промывок Hyb при 55 ° С, 30 мин каждый с вращением в гибридизации печи.
- Равновесие в PBT путем инкубации при комнатной температуре Hyb / PBT (1:1) в течение 15 мин с нутации.
- Выполните PBT моет 5 × 5 мин каждый.
- Подготовить свежие РНКазы буфера. Выполните РНКазы лечение путем инкубации в 20 мкг / мл РНКазы / PBT при 37 ° С в течение 30 мин. РНКазы расщепляет одноцепочечной РНК и приведет к деградации РНК unhybridized зонда.
- Переливать РНКазы буфера и выполнить быстро промыть PBT.
- Выполните PBT моет 3 × 5 мин каждый.
6. Антитела Инкубационный
- Подготовить свежие блокирующим раствором (5% куриного сыворотки / 1% западных Блокирование реагент / PBT) и блок образцы инкубацииТин в 1 мл раствора в течение 30 мин при комнатной температуре нутации.
- Добавить 200 мкл 1:1000 разбавления анти-DIG-щелочной фосфатазы (AP), конъюгированных антител в блокировании решения. Инкубировать при температуре 4 ° C, ночью с нутации.
7. Щелочная фосфатаза Окрашивание
- Удаление антител и блокирует решение.
- Быстрое мытье с PBT.
- Выполнение дополнительных PBT моет 5 × 10 минут каждый. В качестве альтернативы образцы можно мыть 3x, 10 мин каждый следуют расширенные стирка при 4 ° С, ночью с нутации.
- Подготовить свежее окрашивание AP буфера.
- Выполнить быстро промыть буфер окрашивания AP.
- Выполнение дополнительных промывок AP окрашивания буфер 3 × 5 мин каждый нутации.
- Подготовка, в соответствии с инструкциями производителя, свежие окрашивание раствора, содержащего AP НБТ AP подложка / BCIP.
- Инкубируйте каждого образца 500 мкл раствора AP окрашивания при комнатной температурногое с нутация, в темное время суток. Образцы можно инкубировать на покрытие труб с непрозрачной емкости или алюминиевой фольги. Реакция прогрессии следует контролировать каждые 1-2 минут для формирования фиолетовый осадок. В зависимости от датчика концентрации, концентрации РНК-мишени и наличие неспецифических задач, окрашивание может протекать в течение нескольких минут до нескольких часов.
- Удалить столько окрашивание решение насколько это возможно. Неудовлетворительные результаты декантации в формировании белый хлопьевидный осадок в течение последующих этапах стирки.
- Окрашивание полностью прекратились, выполнив два быстрых промывок PBT.
- Выполнение дополнительных PBT моет 3 × 5 мин каждый.
8. Глицерин монтажа
- Использование большого диаметра 200 мкл кончика пипетки, передача образцов микроцентрифужную труб в отдельные круглым дном скважины пластины место Pyrex.
- Осторожно выньте из образца, поскольку значительная часть PBT в качестве возможного.
- Внесите в верхней части образца 70% глицерина / H 2 O. Позвольте глицерин проникать в образец ткани при температуре 4 ° C в течение ночи. Глицерин лечение предотвращает высыхание тканей во время слайд-монтаж.
- Подготовка предметных стекол, протирая поверхность очистить слайд с Kimwipes. Примените к слайду две части невидимой лентой параллельно друг с другом так, что они образуют узкий канал (рис. 2).
- Используя художественные кисти, забрать образцы один за одним и разместить их по всей длине канала, позиционирование каждого образца с той же ориентацией, по отношению к передней / задней и спинной / вентральной выравнивания.
- После размещения каждого образца использовать Kimwipe тампон, чтобы поглотить избыток раствора глицерина окружающие ткани (рис. 3). Удаление избыточного глицерин важно предотвратить образование пузырей, когда герметизация установлены образцы на слайде под покровным стеклом.
- Центр и место тщательно переменного токапо скольжению на канал, содержащий соответствие образцам. Прикрепите крышку скольжения semipermanently на слайд, вытирая углы скольжения крышки с прозрачным лаком для ногтей.
- С помощью 200 мкл пипетки, внесите медленно в один конец канала, достаточно 70% глицерина, чтобы заполнить под действием капиллярных сил на всем пространстве канала и площади под покровным стеклом.
- Постоянно уплотнения установлены образцы применения лака для ногтей по всем четырем сторонам покровным стеклом. Дайте лак для ногтей, чтобы высушить достаточно перед фотографированием гибридизированных все крепления ткани. Рекомендуется, чтобы сфотографировать изображение образцов сразу после монтажа.
Б. Гибридизация на месте для комаров эмбрионов
Решения и буферов, необходимых для гибридизации на месте для комаров эмбрионов описаны (табл. 1). Фиксация и гибридизации процедуры, представленные здесь, были изменены с Thosэлектронной впервые сообщили на Anopheles gambiae, Aedes aegypti 5,6 7 и Culex quinquefasciatus 8.
1. Эмбрион коллекции
- Эмбрионы собираются от 300 вязка, взрослые самки комаров (можно спариваться с самцами в течение 48 часов, 3-х дней после появления всходов) через 72 часа после питания кровью. Комары ведутся на 3 М раствора сахарозы, в целях предотвращения откладки яиц до предполагаемого периода сбора.
- Подготовить контейнеры эмбрионов, выстраиваясь в 16 унций. бумажный стаканчик с Saatilene Hitech сетки, так что внутреннюю поверхность чаши покрывается полностью. Сетка может быть прикреплена с помощью одной основной. Используя эту модель значительно снижает волокнистых загрязнений, которые присутствуют при Whatman фильтровальной бумаги или бумажных полотенец используется.
- Наполните контейнер наполовину дистиллированной водой.
- Эмбрионы собираются в течение 1 часа, установив для сбора мусора в клетке, который впоследствии покрытына темной ткани, чтобы стимулировать яйцекладки.
- Сборник эмбрионы могут созреть до желаемой стадии развития вне клетки в стандартных условиях выращивания (85% относительной влажности / 26 ° C). Созревание эмбрионов разных этапах могут быть связаны по времени (часов после откладки яиц) после приблизительный ход развития эмбриональных время описываемых событий (табл. 2). В данной таблице представлены основные события в эмбриональном развитии Aedes aegypti для, сообщает Raminani и Капп, 9,10 Anopheles gambiae описано сначала Иванова-Казас 11 и уточнены Гольцев и коллег, 12,13 и Culex quinquefasciatus сообщила Дэвис 14. время курса описанных предназначены для использования в качестве начальной оценки, а не абсолютные моменты времени, для сбора эмбрионов на определенных этапах развития.
2. Dechorionation, фиксации и EndochoriНарушения на
- Трансфер эмбрионов для сбора мусора в dechorionation Saatilene сетки улова трубки (рис. 3).
Для Aedes эмбрионов, разместить улова трубку в стакан, наполненный достаточно дистиллированной водой так, чтобы объем улова трубы половину полон. Художественный кисть может быть использована, чтобы выбить из эмбрионов сетки Saatilene и передавать их в воду, заполненные улова трубку.
Для эмбрионов Anopheles, отсоедините Saatilene сетки от сбора мусора и складывать сетки тщательно сформировать воронку. Проведение сетки воронку с одной стороны, использовать другой стороны, отказаться от дистиллированной воды через шприц бутылку полиэтилен по краям воронки мыть эмбрионов в улове трубку. Этот метод может быть применен к Anopheles эмбрионов, потому что у них нет клеящего вещества на поверхности эмбриона Aedes, которая позволяет яйца придерживаться яйцекладки субстратов. - Prepare 40 мл dechorionation раствор (1 часть 5.25% гипохлорита натрия: 3 объема дистиллированной воды). Залейте раствор в 100 мм блюдо Петри.
- Подготовить 100 мл стакан, содержащий 50 мл дистиллированной воды и отложите в сторону. Dechorionation шаг является срочным и сразу после лечения гипохлоритом натрия эмбрионы будут погружены в воду, чтобы разбавить dechorionation решение.
- Dechorionate эмбрионов в сетку поймать трубку, поместив трубку в чашку Петри заполнены dechorionation решение. Использование одноразовых полиэтиленовых передачи пипетки или пипетки Пастера мыть эмбрионов, а закрученной улова флакон так, что эмбрионы оставаться под водой и перемешивают в dechorionation решение.
Максимум 35 секунд требуется для dechorionation эмбрионов Aedes, а 75 секунд достаточно для Anopheles и Culex эмбрионов (табл. 3). Dechorionation является одним из наиболее чувствительных шагах протocol и чрезмерное расширение лечения гипохлоритом натрия, в частности, для Aedes эмбрионы будут препятствовать надлежащему крекинга хориона. - Немедленно погрузите улова пузырек в стакан с водой.
- Смыть оставшийся раствор dechorionation из эмбрионов путем удаления улова трубку с водой стакана и ополаскивания от внутренних и внешних стен улова трубки с дистиллированной водой из шприца бутылку или кран оснащен трубкой.
- Dechorionation может быть проверена путем визуализации эмбрионов с рассечения микроскопом при малом увеличении. Dechorionated эмбрионов Aedes не хватает сетки, как exochorion и только гладкой, полированной поверхностью черного endochorion очевидно для dechorionated эмбрионов Anopheles, exochorionic поплавки и хребет структуры отсутствуют (рис. 4).
- Используя художественные кисти, передает dechorionated эмбрионов в сцинтилляционный флакон 5 мл дистиллированной ватер (рис. 5-1). Если несколько образцов готовятся, поддерживать улова труб в воду, чтобы предотвратить высыхание эмбрионов.
- Пусть эмбрионов оседают на базе сцинтилляционных флакон и удалить как можно больше воды из флакона насколько это возможно.
- Добавьте 5 мл гептана в сцинтилляционный флакон (рис. 5-2). Удалите остатки воды, которая остается в сцинтилляционный флакон.
- Добавить в сцинтилляционный флакон 5 мл свежеприготовленного решение фиксации эмбрионов (табл. 1).
- Закрепите эмбрионов в течение 30 мин с инверсией, чтобы органической и водной фаз тщательно перемешать, но не сильно.
- Удалить фиксации решения с использованием стекла пипетки Пастера, стараясь не нарушить интерфазе, который содержит эмбрионов (рис. 5-3).
- Смыть остаточной решение фиксацию, заполняя сцинтилляционный флакон с таким большим количеством дистиллированной воды, как это возможно. Переверните флакон 5 разЗатем удалите все дистиллированную воду.
- Заполните сцинтилляционный флакон с 20 мл дистиллированной воды и перемешать путем обращения флакон в течение 30 мин.
- Удалите всю воду из сцинтилляционных флаконе.
- Добавьте достаточно кипящей дистиллированной воды в сцинтилляционный флакон так, что неорганические гептан фазы достигает верхней части флакона.
- Выдержите в течение 30 секунд, а затем удалить все кипятком.
- Добавить ледяной дистиллированной водой до неорганической фазы достигает верхней части флакона. Инкубируйте флакон во льду в течение 10 мин.
- Удалите сначала водных и органических фаз. Гептан появится непрозрачные на этот шаг (рис. 5-4).
- Добавить 5 мл гептана в новый флакон. Удалите все остатки воды из флакона.
- Добавьте 5 мл метанола в флаконе. Swirl флакон 1-2 раз энергично, без встряхивания (рис. 6). Если неорганических гептана и органические фазы метанола сильно встряхивать эмбрионов шбудете уничтожены во endochorion разрыва. Стоит отметить, отметить, что мы наблюдали изменение в эффективности endochorion нарушение различных штаммов Aedes aegypti эмбрионов.
- Инкубируйте при комнатной температуре в течение 15-20 мин. На этой стадии, фазы станет мутной за счет выпуска компонентов желтка (рис. 5-5).
- Удаление органических и неорганических фаз и промыть метанолом 3 раза, чтобы удалить все остатки гептана.
- Эмбрионы могут храниться в метаноле при -20 ° C в течение нескольких месяцев.
3. Пилинг
- Поместите кусочек двусторонней лентой парик в центре 3 см чашке Петри. Тупейный лента используется потому, что клей устойчив в присутствии метанола и этанола.
- Использование большого диаметра (около 3 мм в диаметре) 200 мкл кончика пипетки, передача эмбрионов из метанола на двухсторонний скотч.
- Позвольте 1-2 мин для эмбрионов для проведения расчетов и АДГпрежде чем к поверхности ленты.
- Слейте избыток метанола и дайте поверхности высохнуть немного на 1-2 мин.
- Добавить 4 мл 95% (190 доказательств) этанола в чашке Петри.
- Внесите 600 мкл дистиллированной воды в этаноле и вихревые перемешать. Лента станет непрозрачным цветом. Добавление дистиллированной воды приведет к тому, чтобы стать лента липкая и иммобилизации эмбрионов во время пилинга. Этот шаг можно пропустить, если это необходимо.
- Используйте 27,5 иглы прикреплен к 1 мл шприца шелушиться трещины endochorion (рис. 7). После выпуска белого эмбрион из черного остатки endochorion, передает эмбрионов с ленты на этанол резервуара чашки Петри с помощью тонкого кончика художественной кисти. Использование 3-мм отверстие наконечника пипетки, перенесите эмбрионы в Ambion 1,5 мл отцентрифугировать пробирку, содержащую 500 мкл 200 доказательство этанола.
Очищенные эмбрионы не должны оставаться на ленте в течение длительного периода времени, потому что они могут придерживаться вmanently на ленту. - Выполните 2-3 быстро моет со 100% (200 доказательств) этанола и хранения эмбрионов в педантичный этанола при -20 ° C. Очищенные эмбрионы могут храниться при -20 ° C в течение нескольких месяцев, не затрагивая морфологию или последующий сигнал гибридизации.
4. Разъяснение желток
- Быстрое мытье 200 доказательство этанола. Педантичный этанола должен использоваться для всех последующих этапов стирки и для приготовления р-ксилола решение разъяснения желток.
- Выполните одно этанола стирки, 5 мин с нутации.
- Инкубируйте в P-xylene/ethanol (9:1) при комнатной температуре в течение 1-1,5 ч, нутации. Ксилол шаг позволяет уточнение массы желток для повышения отношения сигнал-шум.
- Удалить ксилол-спиртового раствора и выполняют две быстрые мойки с этанолом.
- Выполните одно этанола стирки, 5 мин с нутации.
- Выполните два быстрых мойки с метанолом, следуют один метанол стирки, 5 миннутации.
- Равновесие на 4%-ный раствор формальдегида фиксации промывкой раз с метанолом / формальдегид фиксации раствора (1:1).
5. Фиксация и гибридизации на месте
Фиксация и гибридизации на месте процедуры идентичны тем, которые описаны в протоколе раздел A.
С представителем Результаты
Гибридизации на месте протокол, описанный здесь, приводит к окрашиванию цветных моделей, которые указывают на наличие и локализацию целевой мРНК. Важно подчеркнуть, что относительные уровни запись изобилие не может быть определена путем гибридизации на месте. Гибридизация результаты зависят от конкретного датчика мРНК используется для гибридизации процедуры, обилие целевой мРНК в гибридизированных ткани, а также концентрации зонда и гибридизации температуры. Сравнение тканей гибридизации с антисмысловой и соответствующих датчиков мРНК смысле делает возможным точное толкование окрашивания образцов.
Гибридизации на месте целых монтирования слюнных желез женской Aedes aegypti с мРНК зонды, предназначенные amylase1 (AAEL006719), D7s2 (AAEL006423) и D7L2 (AAEL006424) указывают на аккумуляцию этих протоколов в проксимальных-боковой, дистальный, латеральный, и дистальных- боковое / медиальной доли, соответственно (рис. 8). 1 Всего монтажа яичников трех видов комаров гибридизовали с мРНК зонды, которые конкретно соответствующих ортологичных стенограммы Оскар (рис. 9). 7,8 гибридизации на месте целых монтажа эмбрионов от Ae. aegypti,. gambiae и Cx. quinquefasciatus проводили с использованием антисмысловых РНК-зонды ориентации соответствующих комаров Оскар ортологичных транскриптов (рис. 10). 7,8
igure 1 "SRC =" / files/ftp_upload/3709/3709fig1.jpg "/>
Рисунок 1. Схема после гибридизации монтаж установки.
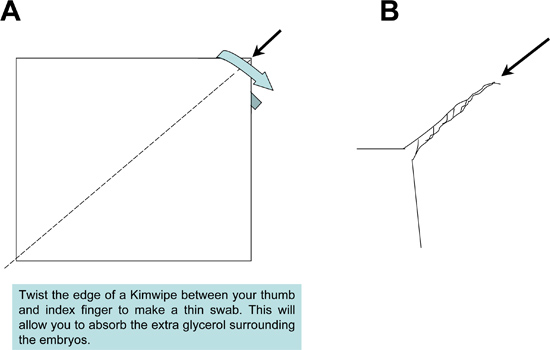
Рисунок 2. Подготовка Kimwipe швабры используется во время установки образца. Kimwipe ткань плотно скручены, чтобы произвести с острым концом швабры, чтобы поглотить избыточное монтаж среды от образцов и слайдов.
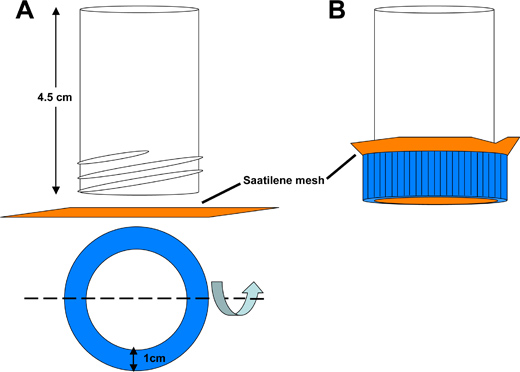
Рисунок 3. Схема Saatilene сетки трубы улова dechorionation.) В нижней части 50 мл полистирола конической трубы отрезали, получая полые трубки 4,5 см в длину, открытый с обоих концов. Круглое отверстие вырезается из конической крышкой трубки позволяют жидкости можно мыть через 6,5 см 2 квадратный кусок сетки Saatilene. 330 нитей на дюйм, 34 микрон диаметром резьбы меш сохраняет комаров эмбрионов. B) Assembled поймать трубку.

Рисунок 4. Aedes aegypti и Anopheles gambiae яйца, до и после dechorionation.) Aedes aegypti яйца до dechorionation. Сетка типа exochorion лежит выше черной endochorion и дает яйцо текстурированный вид (вставка расширения). После удаления exochorion только гладкой и полированной endochorion остается (B и вставка расширения). C) Яйца Anopheles gambiae до dechorionation. Exochorion структуры, такие как поплавки видны (стрелки). D) гладкой и полированной поверхности endochorion видна после dechorionation. Бар = 100 мкм.

Рисунок 5. Ряд последовательных шагов для фиксации и endochorion нарушение Ae. aegypti яйца.) Наклонная-вид спередии б) боковой вид сцинтилляционных флаконах, содержащих Ae. aegypti яйца во время последовательных шагов фиксации и endochorion нарушения. 1) Эмбрионы в дистиллированной воде. 2) эмбрионы плавают в интерфазе между верхней гептан фазы и нижней водной фазы. 3) После фиксации эмбрионов упаковать вместе в круглом массы. Эмбрионы остаются в интерфазе между гептана и фиксатором фазы решения. 4) После обработки кипятком и инкубации в лед, гептан фазе становится немного непрозрачной. 5) Эмбрионы с нарушенной endochorions приведены в интерфазе между непрозрачным гептан фазы и прозрачной фазы метанола.

Рисунок 6. Endochorion нарушение основных Ae. aegypti яйца. А) Сразу после энергичного закрученного гептана и метанол фазы, образование пузырьков и разрушение endochorion могут быть визуализированы. B) Followiнг пять минут инкубации при комнатной температуре.
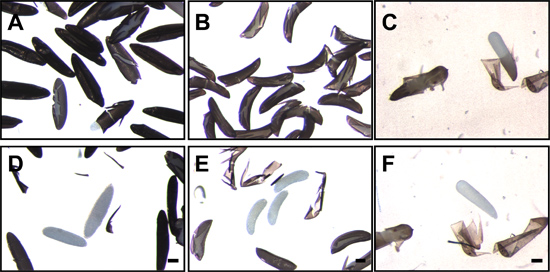
Рисунок 7. Mosquito яйца после разрушения и удаления endochorion. Яйца Ae. aegypti (А). gambiae (B) и Cx. quinquefasciatus (C) фиксация следующее и разрушение endochorion. Белые, полупрозрачные эмбрионы можно увидеть в трещины endochorion. После удаления endochorion, полупрозрачные зародыши Ae. aegypti (D). gambiae (E) и Cx. quinquefasciatus (F) четко видны. Бар = 100 мкм.
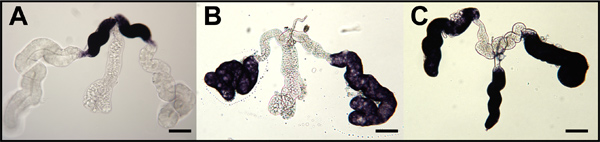
Рисунок 8. Гибридизации на месте в течение трех генов, в разных долях целого горе, женщина Ae. aegypti слюнных желез. Окрашивание свидетельствует о локализации и накопления amylase1 (AAE L006719) (A), D7s2 (AAEL006423) (B) и D7L2 (AAEL006424) (B). Бар = 100 мкм.
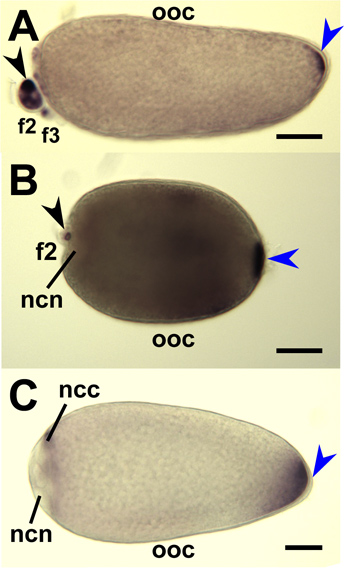
Рисунок 9. Гибридизации на месте для комаров Оскар антисмысловых РНК-зондов на все крепления комаров ооцитов и медсестра клеток. Стадия IV ооцитов (МНК) расчлененный из яичников. gambiae (А), Ае. aegypti (B) и Cx. quinquefasciatus (C) и гибридизации с РНК-зондов ориентации соответствующих мРНК Оскар комара. Первичные фолликулы ориентированы передней слева. Окраска у заднего полюса (синяя стрелка) указывают на накопленный Оскар мРНК. Вторичные (f2) и третичные (f3) фолликулов показали и окраски (черная стрелка) показывают накопление Оскар РНК в цитоплазме клетки медсестра (НКК). Окрашивание исключен из ядра клетки медсестра (НКС). Bar = 50 мкм.
ad/3709/3709fig10.jpg "/>
Рисунок 10. Гибридизации на месте для комаров Оскар антисмысловых РНК-зондов на все крепления эмбрионов комара. Эмбрионы ориентированы передней слева. Сотовые бластодерма стадии эмбрионов. gambiae (А) и Cx. quinquefasciatus (C) гибридизации с соответствующими комаров конкретных видов Оскар РНК-зондов. B) синцитиальный Ae этап бластодерма. aegypti эмбриона гибридизации с РНК-зондов ориентации Ae. aegypti Оскар стенограммы. Окрашивание проявляется в заднем полюсе клетки всех эмбрионов, с указанием локализации и накопления мРНК Оскар комаров в этих клетках. Bar = 50 мкм.

Таблица 1. Решения и буферов для формальдегида гель-электрофорез, гибридизация и фиксации на месте.
ftp_upload/3709/3709table2.jpg "/>
Таблица 2. Развития событий и морфологические наблюдения соответствующих последовательных этапах эмбриогенеза комаров.

Таблица 3. Краткое изложение основных различий в предварительной гибридизации шаги для разных типов ткани.
Обсуждение
Гибридизации на месте и колориметрические окрашивания протокол, представленные здесь целых монтажа комаров тканях и эмбрионах полезный прием для локализации протоколов в конкретных органах и типы клеток. Эти процедуры лучше, чем наши сообщалось ранее методы, как в рационализации обширной шаги стирки и предоставление дополнительных технических деталей и реагентов источников.
По нашему опыту, колориметрический обнаружение гибридизации сигналов превосходит по чувствительности и четкости сигнала гибридизации по сравнению с флуоресценцией на основе схемы обнаружения. Кроме того колориметрических обнаружения обходит вопросы, связанные с сигналом дискриминации в эмбрионы, которые по своей сути самофлюоресцирующими. Ограничения в обнаружении сигналов гибридизации происходит, когда низкого обилия стенограммы и направлены фоне окрашивание очевидна. Увеличение гибридизации температуры до 65 ° C была обнаружена уменьшить назадземли гибридизации сигналы, но не предложил заменить проектирование уникальной целевой РНК с зондами.
Этот протокол используется для выполнения гибридизации на месте целых монтажа слюнных желез Aedes aegypti, и яичники и эмбрионы Anopheles gambiae, Anopheles stephensi, Ae. aegypti и Culex quinquefasciatus. Этот метод также применим и к другим тканям комара, и, возможно, других насекомых. Кроме того, мы собрали в первый раз сравнительный руководящие принципы для постановки эмбрионального развития в трех комаров, Ae. aegypti,. gambiae и Cx. fatigans. Наблюдения были получены для конкретного штамма из этих трех видов, под сдержанный условий выращивания. Важно отметить, что развитие учебного времени может варьироваться для разных штаммов комаров вида и при разных условиях выращивания. Гибридизации на месте дополнения текущих усилий по аначуждой transcriptomes комаров и других членистоногих, и может обеспечить более четкое представление о регуляции экспрессии генов в этих организмах.
Раскрытие информации
Авторы не имеют раскрытия информации.
Благодарности
Авторы хотели бы поблагодарить Марика Уолтерс за советом в развивающихся гибридизации на месте методы мягких тканей и Юрий Гольцев для обсуждения протоколов для гибридизации на месте от Anopheles gambiae эмбрионов, которые впоследствии были адаптированы и изменены, чтобы разработать протокол описанный здесь для гибридизации месте из Aedes и Culex эмбрионов. Мы также признаем, полезные советы, даваемые Адам Паре и Дэвид Косман. Мы благодарим Освальдо Marinotti для научного обсуждения и редактирования текста протокола.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии (опционально) |
| 0,5 М ЭДТА | Ambion | AM9261 | |
| 1М Трис-HCl | Ambion | AM9855G | pH8.0 |
| 10х PBS | Ambion | AM9625 | |
| 20-кратный SSC | Ambion | AM9763 | |
| Пробирки на 1,5 мл микроцентрифужную | Ambion | AM12400 | Менее непрозрачным, чем стандартные трубки; помогает в визуализации образцов |
| Деионизированная формамида | Ambion | AM9342 | Хранение при 4 ° C |
| DEPC воды | Ambion | AM9932 | |
| Протеиназы K | Ambion | AM2546 | |
| 5,25% гипохлорит натрия | Остин | A-1 марка | |
| T3 РНК-полимеразы-Plus | Ambion | AM2733 | Хранение при температуре -20 ° C |
| Т7 РНК-полимеразы | Ambion | AM2082 | Хранение при температуре -20 ° C |
| 95% этанола | Fisher Scientific | AC61511-0040 | |
| Fisherbrand одноразовые пипетки передачи полиэтилена | Fisher Scientific | 13-711-7М | |
| 37% формальдегида | Fisher Scientific | F79-500 | |
| ВЭЖХ-класса метанола | Fisher Scientific | A452-1 | |
| Хлорид магния | Fisher Scientific | M87-500 | |
| Стекло микроскопа крышкой | Fisher Scientific | 12-542A | 18 x18 мм |
| N-гептан | Fisher Scientific | H350-1 | |
| P-ксилол | Fisher Scientific | O5082-500 | |
| Pyrex 9-а пластинки с лунками | Fisher Scientific | 13-748B | 100x85 мм |
| Хлористый натрий | Fisher Scientific | AC32730-0025 | |
| Едкий натр | Fisher Scientific | SS255-1 | |
| SuperFrost / Plus слайды микроскопом | Fisher Scientific | 12-550-15 | 25x75x1.0 мм |
| Davlyn Красной Clear-лайнер Тупейный лента | Волосы прямые | RED-75R12 | Poly / Кожа материальная база 0,75 х 12 ярд ролл лента |
| TOPOTA Cloning Kit для Sequening с одного выстрела Top10 химически компетентных E. палочки | Invitrogen | K457501 K457540 | 20 реакций 40 реакций |
| Ультразвуком ДНК спермы лосося | Invitrogen | 15632-011 | Хранение при температуре -20 ° C |
| Anti-дигоксигенин-AP Fab фрагментов | Roche Applied Science | 1093274 | Хранение при 4 ° C |
| DIG РНК маркировке смеси | Roche Applied Science | 1277073 | Хранение при температуре -20 ° C |
| NBT / BCIP маточного раствора | Roche Applied Science | 1681451 | Хранение при 4 ° C |
| Западные Блокирование реагентов | Roche Applied Science | 11921673001 | Хранение при 4 ° C |
| Saatilene Hitech полиэфирной сетки (330,130) | Саати для печати | 330,34 UO PW | 330 нитей / дюйм, 34 микрон диаметр резьбы, оранжевый цвет |
| Глицерин | Сигма | G6279-1 | 70% PBT |
| Гепарин натриевая соль | Сигма | H3393 | |
| Твин-20 | Сигма | P1379-500 | |
| 37% формальдегида | Тед Пелла | 18508 | 10 мл порциями в янтаре ампулах |
| 16 унций. Соло бумаги контейнеры с крышками | Бумаги компании | SOLOKH16AJ8000 | |
| Боросиликатного стекла scintillatионных флакон с завинчивающейся крышкой одиноких | VWR International | 66022-128 | 20 мл случае 500 |
| Sealed Air Bubble Wrap клеточные прокладочного материала | VWR International | 500018-081 | 10 фут / рулон 0,188 дюймов |
| Куриные сыворотке | Цельная кровь была собрана как из крыла вены или пункции сердца с несовершеннолетними курицы. Кровь инкубировали при 37 ° С в течение 1 ч до свертывают и помещают на льду в течение 30 мин. Сыворотки собирали и центрифугировали при 3000 мкг в течение 10 мин. В результате супернатант (топленое сыворотки) собирали и хранили при температуре -20 ° C до использования. |
Таблица 4. Таблица специфических реагентов и оборудования для гибридизации на месте.
Ссылки
- Juhn, J. Spatial mapping of gene expression in the salivary glands of the dengue vector mosquito, Aedes aegypti. Parasit. Vectors. 4, 1 (2011).
- Coleman, J., Juhn, J., James, A. A. Dissection of midgut and salivary glands from Ae. aegypti mosquitoes. J. Vis. Exp. (5), e228 (2007).
- Benedict, M. Q. Dissecting Plasmodium-infected Mosquitoes: Salivary Glands, Chapter. 5.4.2. Methods in Anopheles Research. , (2007).
- Sappington, T. W., Brown, M. R., Raikhel, A. S. Culture and analysis of insect ovaries, Chapter. 42.3. The Molecular Biology of Insect Disease Vectors: A methods manual. , (1997).
- Goltsev, Y., Hsiong, W., Lanzaro, G., Levine, M. Different combinations of gap repressors for common stripes in Anopheles and Drosophila embryos. Dev. Biol. 275, 435-446 (2004).
- Benedict, M. Q. Anopheles Embryo Fixation, Chapter. 3.7. Methods in Anopheles Research. Malaria Research and Reference Reagent Resource Center (MR4). , (2007).
- Juhn, J., James, A. A. oskar gene expression in the vector mosquitoes, Anopheles gambiae and Aedes aegypti. Insect Mol. Biol. 15, 363-372 (2006).
- Juhn, J., Marinotti, O., Calvo, E., James, A. A. Gene structure and expression of nanos (nos) and oskar (osk) orthologues of the vector mosquito, Culex quinquefasciatus. Insect Mol. Biol. 17, 545-552 (2008).
- Raminani, L. N., Cupp, E. W. Early Embryology of Aedes aegypti (L.) (Diptera: Culicidae). Int. J. Insect Morphol. & Embryol. 4, 517-528 (1975).
- Raminani, L. N., Cupp, E. W. Embryology of Aedes aegypti (L.) (Diptera: Culicidae): Organogenesis. Int. J. Insect morphol. & Embryol. 7, 273-296 (1978).
- Ivanova-Kazas, O. M. Embryonic development of Anopheles maculipennis Mg. Izv. Akad. Nauk SSSR ser. Biol. 2, 140-170 (1949).
- Goltsev, Y. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Dev. Biol. 330, 462-470 (2009).
- Papatsenko, D., Levine, M., Goltsev, Y. Clusters of temporal discordances reveal distinct embryonic patterning mechanisms in Drosophila and Anopheles. PLoS Biol. 9, e1000584 (2011).
- Davis, C. W. C. A comparative study of larval embryogenesis in the mosquito Culex fatigans Wiedemann (Diptera: Culicidae) and the sheep-fly Lucilla seriata Meigen (Diptera: Calliphoridae) I. Description of embryonic development. Aust. J. Zool. 15, 547-579 (1967).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены