Method Article
Ibridazione
In questo articolo
Riepilogo
Temporali e spaziali analisi di espressione genica hanno un ruolo cruciale nella genomica funzionale. Whole-mount ibridazione In situ È utile per determinare la localizzazione dei trascritti all'interno dei tessuti e compartimenti subcellulari. Qui delineare una ibridazione In situ con modifiche di tessuti specifici in zanzare.
Abstract
Le zanzare sono vettori di un insieme diversificato di agenti patogeni tra cui arbovirus, parassiti protozoi e nematodi. Indagine su trascrizioni e regolatori genici, che si espresse in tessuti in cui l'host zanzara e interagiscono patogeno, e in organi coinvolti nella riproduzione di grande interesse per le strategie per ridurre trasmessa dalle zanzare trasmissione della malattia e interrompere lo sviluppo delle uova. Un certo numero di strumenti sono stati impiegati per studiare e convalidare la regolazione temporale e tessuto-specifica dell'espressione genica. Qui, descriviamo protocolli che sono stati sviluppati per ottenere informazioni spaziali, che aumenta la nostra comprensione di geni specifici in cui sono espressi e loro prodotti accumulano. Il protocollo descritto è stato usato per convalidare espressione e determinare i modelli di accumulo di trascritti in tessuti correlate a dalle zanzare trasmissione del patogeno, come femmina ghiandole salivari, nonché compartimenti subcellulari di ovaie e embrioni, che ritardi per la riproduzione della zanzara e dello sviluppo.
Le procedure che seguono rappresentano un metodo ottimizzato che migliora l'efficienza di vari passaggi del protocollo senza perdita di bersaglio-specifici segnali di ibridazione. Linee guida per la preparazione sonda di RNA, la dissezione dei tessuti molli e procedura generale per la fissazione e l'ibridazione sono descritte nella parte A, mentre i passi specifici per la raccolta, fissazione, pre-ibridazione e ibridazione di embrioni zanzare sono dettagliati nella Parte B.
Protocollo
A. ibridazione in situ per tessuti molli: Mosquito ghiandole salivari e ovaie
Le ricette per soluzioni e tamponi necessari per le seguenti procedure sono descritte in Tabella 1.
1. RNA Probe preparazione e l'analisi della qualità
- Primer design alla PCR amplifica l'obiettivo trascrizione di interesse. Si raccomanda che l'amplicone è ≥ 600 nucleotidi di lunghezza e più importante che la sequenza amplicone è unico per la trascrizione di destinazione. Sequenze che sono non-unici sono evitati, per eliminare la possibilità di generare cross-reattivi sonde di RNA.
- Clone il prodotto di PCR in pCR4-TOPO vector, o vettore di clonaggio simili. Il pCR4-TOPO vettore di clonazione contiene T7 e T3 RNA polimerasi siti di adescamento che consentono la produzione sia di senso e antisenso run-off prodotti di trascrizione da un singolo clone.
- Sequenza l'amplicone clonato per verificare sequenza FIDelity e orientamento all'interno del plasmide vettore.
- Eseguire una reazione di digestione di restrizione con un enzima adatto per produrre un prodotto di trascrizione antisenso in vitro. Linearizzazione del plasmide è semplice selezionando un sito di restrizione situato nella regione di clonaggio multiplo del vettore pCR4-TOPO come Spe I, Pst I o Not I. Assicurarsi che il sito di restrizione selezionato non è presente nel frammento clonato. Lo stesso clone può essere usato per generare un senso filamento sonda di RNA, che serve da controllo sfondo. L'ibridazione in situ con una sonda senso dovrebbe dare segnale poca o nessuna, rispetto a quella della sonda antisenso complementare.
- Verificare mediante elettroforesi su gel che la pCR4-TOPO clone è completamente linearizzata.
- Purificare il DNA plasmide linearizzato eseguendo un fenolo-cloroformio estrazione, seguita da precipitazione con etanolo. Quando precipitare il DNA plasmidico è consigliabile utilizzare un concent finalerazione di acetato di ammonio 2 M con 2,5 volumi di etanolo per ridurre il riporto di sale residuo nella reazione di trascrizione in vitro.
- Preparare la digossigenina (DIG)-marcato singolo filamento sonda RNA eseguendo un run-off nella reazione di trascrizione in vitro, utilizzando 1 mg del DNA plasmidico linearizzato come modello. Preparare la reazione con RNA polimerasi, tampone trascrizione e DIG RNA mix etichettatura secondo le istruzioni del produttore.
- Purificare il DIG-marcato, in prodotti di trascrizione in vitro da precipitazione con etanolo e risospendere le RNA pellettizzate in acqua trattata con DEPC distillata.
- Verificare la qualità e prevista peso molecolare del DIG-sonda marcata RNA purificato mediante elettroforesi su gel di formaldeide. La sonda preparato RNA può essere suddiviso in aliquote e conservato a -80 ° C fino all'utilizzo.
2. Dissezione di Mosquito ghiandole salivari e ovaie
- Dissect zanzara Glan salivareds utilizzando una sonda e pinze come descritto in precedenza per Ae. aegypti. 1,2 per An. gambiae, ghiandole salivari possono essere sezionati come descritto per Ae. aegypti, o alternativamente come descritto nelle MR4 Metodi per Anopheles ricerca manuale. 3
- Dissect ovaie zanzara con una pinzetta, come descritto in precedenza per Ae. aegypti. 4 In breve, utilizzare una coppia di pinze per afferrare al torace, mentre un altro paio di pinze tira fuori dal penultimo segmento addominale per liberare le ovaie.
- Raccogliere sezionati ghiandole salivari o ovaie nelle Ambion RNasi-free microcentrifuga provette da 1,5 ml contenenti 50 microlitri di PBS.
- Mantenere i campioni sul ghiaccio fino fissazione.
3. Fissazione
- Fissare tessuti sezionati in soluzione appena preparata fissaggio del tessuto molle (Tabella 1) a temperatura ambiente con nutazione per 30 minuti a 1 ora. La soluzione di fissaggio è preparato fresco per evitare oxidatione del fissativo formaldeide. Di fissaggio per 1-1,5 ore è consigliato per le ghiandole salivari. Un volume minimo di 1 ml è raccomandato per fissare i tessuti in una provetta per microcentrifuga 1,5 ml.
- Lasciare i tessuti di depositarsi sul fondo della provetta per microcentrifuga. Questo è un passo importante, che segue tutti i cambiamenti di soluzioni nel protocollo e minimizzare la perdita significativa del campione.
- Decantare la soluzione di fissaggio pipettando attenzione, lasciando 50-100 microlitri di volume nella provetta da microcentrifuga e poi lavare la 3 ×, 5 min ciascuno con PBT.
- Fasi di equilibrazione opzionali per la conservazione dei tessuti. Graduale risciacquare PBT sia con etanolo o metanolo. Eseguire graduale lavaggi con PBT / alcool (3:1, 1:1 e 1:3, 5 min ciascuna). Conservare in 100% (200 proof) di alcol a -20 ° C. I tessuti possono essere conservati per diversi mesi, senza degradazione della ultrastruttura tessuto. Prima di eseguire le fasi successive del protocollo, i tessuti devono essere restituiti a PBT dal graduale equilibrio con l'alcol / PBT (3:1, 1:1,01:03, 5 min ciascuna).
- Eseguire 3 × PBT lava, 5 min ciascuno.
- Eseguire la digestione delle proteine con 0,01 mg / ml proteinasi K / PBT, 5 min a temperatura ambiente. In alternativa, se entrambi immunolocalizzazione di proteine target e ibridazione in situ di RNA sono desiderate, ovaie può essere incubato con 80% acetone / H 2 O a -20 ° C per 10 minuti invece di trattamento con proteinasi K.
Proteinasi K è omesso il trattamento per la preparazione delle ghiandole salivari. Procedere direttamente al punto 3.10. - Immediatamente decantare la soluzione digestione pipettaggio attento. Lavare 2 ×, 5 min ciascuno con ghiacciato PBT per fermare la digestione.
- Eseguire ulteriori PBT lava 2 ×, ogni 5 min a temperatura ambiente.
- Post-fissare in soluzione di fissazione dei tessuti molli a temperatura ambiente con nutazione per 30 min. Post-fissazione passaggi non vengono eseguiti per ghiandole salivari.
- Eseguire PBT lava 5 ×, 5 min ciascuno.
4. Ibridazione
- Equilibrare tessuti nella soluzione di ibridazione (Hyb) incubando a temperatura ambiente con 1 ml di ibridazione / PBT (1:1) per 30 min con nutazione.
- Decantare il più Hyb / PBT possibile. Aggiungere 1 ml di ibridazione in ogni provetta.
- Avvolgere la provetta sigillata in aria imballaggio protettivo (pellicola a bolle) e posto all'interno di una bottiglia di ibridazione. Sigillare la bottiglia con un tappo di bottiglia ibridazione.
- Fasi di pre-ibridazione e l'ibridazione può essere eseguita facilmente in un fornetto. Eseguire pre-ibridazione a 55 ° C per 30 minuti con rotazione.
- Lasciare il tempo sufficiente per i tessuti di depositarsi sul fondo della provetta per microcentrifuga, come ibridazione è più densa PBT. Con cautela decantare il pre-ibridazione soluzione. I tessuti possono diventare trasparente e difficile da visualizzare. Perdita di campione può essere ridotto lasciando 50-100 pl di volume di soluzione in ogni provetta.
- Aggiungere 50 pl di volume di ibridazione nella provetta e mantenere in un blocco di calore a 55 ° C.
- Denaturare la sonda di RNA a 85 ° C per 5-10 min. Immediatamente, posizionare la sonda denaturata su ghiaccio per 5 min.
- Pipettare la sonda RNA nella provetta campione. La sonda RNA galleggia sulla superficie del Hyb. Mescolare delicatamente sfogliando il tubo.
- Eseguire ibridazione in un volume totale di 50-100 pl di ibridazione per campione. Incubare i campioni in un rack microcentrifuga fissa all'interno di un forno ibridazione, o in un rack galleggiante provetta da microcentrifuga in un bagno d'acqua, a 55 ° C per 16-24 hr.
5. RNAse Un trattamento
- Rimuovere il Hyb contenente la sonda. È importante mantenere i campioni a 55 ° C durante le fasi di lavaggio per ridurre il legame non specifico della sonda non legata residua. Se diversi campioni sono ibridate, si raccomanda di mantenere provette per campioni in un blocco di fissaggio a caldo a 55 ° C per mantenere la temperatura di ibridazione durante le fasi di lavaggio.
- Eseguire un lavaggio rapido con Hyb pipettando 1 ml di soluzione in vasca microfugee e invertendo la provetta del campione 5-6 volte.
Tutti i successivi lavaggi veloci nel protocollo vengono eseguite similmente aggiungendo la soluzione richiesta e invertendo volte il tubo del campione diversi. - Eseguire due lavaggi addizionali con ibridazione a 55 ° C, 30 min ciascuno con rotazione in forno ibridazione.
- Equilibrare in PBT incubando a temperatura ambiente con Hyb / PBT (1:1) per 15 min con nutazione.
- Eseguire PBT lava 5 ×, 5 min ciascuno.
- Preparare fresca RNAse A buffer. Eseguire un trattamento mediante incubazione a 20 ug / ml RNasi A / PBT a 37 ° C, per 30 min RNAse. RNasi A scinde RNA a singolo filamento e porterà alla degradazione della sonda non ibridata RNA.
- Decantare RNAse Un buffer ed eseguire un lavaggio rapido con PBT.
- Eseguire 3 × PBT lava, 5 min ciascuno.
6. Incubazione
- Preparare fresca soluzione bloccante (5% siero di pollo / 1% occidentali Reagente Bloccante / PBT) campioni e blocco per incubating in 1 ml di soluzione per 30 minuti a temperatura ambiente con nutazione.
- Aggiungere 200 pl di una diluizione di 1:1000 anti-DIG-fosfatasi alcalina (AP)-coniugato anticorpo in soluzione bloccante. Incubare a 4 ° C, una notte con nutazione.
7. Colorazione fosfatasi alcalina
- Rimuovere l'anticorpo e soluzione bloccante.
- Eseguire un lavaggio rapido con PBT.
- Eseguire ulteriori PBT lava 5 ×, 10 min ciascuno. In alternativa, i campioni possono essere lavati 3x, 10 min ciascuno seguito da un lavaggio prolungato a 4 ° C, una notte con nutazione.
- Preparare fresca colorazione buffer di AP.
- Eseguire un rapido lavaggio con tampone colorazione AP.
- Eseguire lavaggi supplementari con tampone colorazione AP × 3, 5 min ciascuno con nutazione.
- Preparare, secondo le istruzioni del produttore, freschi soluzione colorante AP contenente il substrato NBT AP / BCIP.
- Incubare ciascun campione con 500 ml di soluzione colorazione AP a Temperatura ambientee con nutazione, al buio. I campioni possono essere incubati coprendo i tubi con un contenitore opaco o alluminio. Progressione di reazione deve essere monitorata ogni 1-2 minuti per la formazione di un precipitato viola. A seconda della concentrazione di sonda, la concentrazione di RNA bersaglio e presenza di non-specifici obiettivi, la colorazione può procedere per diversi minuti a diverse ore.
- Rimuovere la maggior quantità della soluzione di colorazione il più possibile. Decantazione risultati insoddisfacenti nella formazione di un precipitato bianco flocculante durante le fasi di lavaggio successive.
- La colorazione è fermato completamente eseguendo due lavaggi rapidi con PBT.
- Eseguire ulteriori PBT lava 3 ×, 5 min ciascuno.
8. Glicerolo di montaggio
- Utilizzando un grosso calibro 200 microlitri punta della pipetta, i campioni di trasferimento da tubi microcentrifuga in singoli round-fondo pozzetti di una piastra posto Pyrex.
- Rimuovere con cautela dal campione in quanto gran parte del PBT possibile.
- Pipettare sulla parte superiore del campione 70% glicerolo / H 2 O. Lasciare glicerolo di permeare il tessuto campione a 4 ° C, una notte. Trattamento Glicerolo previene l'essiccazione dei tessuti durante il montaggio di diapositive.
- Preparare vetrini da microscopio pulendo la superficie del vetrino pulire con Kimwipes. Applicare al vetrino due pezzi di nastro parallelo invisibili l'uno all'altro così da formare un canale stretto (Figura 2).
- Utilizzando un pennello artistico, raccogliere campioni uno per uno e metterli lungo la lunghezza del canale, posizionando ciascun campione con lo stesso orientamento, rispetto agli allineamenti anteriore / posteriore e dorsale / ventrale.
- Dopo posizionamento di ogni campione, utilizzare un tampone Kimwipe per assorbire l'eccesso di soluzione di glicerolo i tessuti circostanti (Figura 3). La rimozione del glicerolo eccesso è importante per evitare la formazione di bolle, quando sigillando i campioni montati sul vetrino sotto un vetrino coprioggetto.
- Centro di cura e luogo acsopra scivolare sul canale contenente i campioni allineati. Fissare il coperchio scivolare semipermanente sul vetrino tamponando gli angoli del coprioggetto con smalto trasparente.
- Usando un pipettatore 200 microlitri, dispensare lentamente in una estremità del canale 70% glicerolo sufficiente a riempire per capillarità l'intero spazio del canale e l'area sotto la copertura antiscivolo.
- Sigillare in modo permanente i campioni montati mediante l'applicazione di smalto lungo tutti i quattro lati del vetrino coprioggetto. Lasciare che il smalto si asciughi a sufficienza prima di fotografare delle ibridizzati whole-mount tessuti. Si raccomanda di fotografare immagini dei campioni immediatamente dopo il montaggio.
B. ibridazione in situ per gli embrioni Mosquito
Soluzioni e tamponi necessari per l'ibridazione in situ per embrioni zanzara sono descritti (Tabella 1). Le procedure di fissaggio e ibridazione qui presentati sono stati modificati da those prima segnalati per Anopheles gambiae, 5,6 Aedes aegypti 7 e Culex quinquefasciatus 8.
1. Raccolta di embrioni
- Gli embrioni vengono raccolti da 300 ravvicinate, le zanzare adulte di sesso femminile (il permesso di accoppiarsi con i maschi per 48 ore, 3 giorni post-emergenza) 72 ore dopo il pasto di sangue. Le zanzare sono mantenuti in soluzione 3 M di saccarosio, per evitare deposizione prima del periodo di raccolta previsto.
- Preparare i contenitori di raccolta degli embrioni, allineando uno 16 once bicchiere di carta con Saatilene Hitech maglia in modo che la superficie interna della coppa è coperto completamente. La rete può essere apposto utilizzando una singola graffetta. L'utilizzo di questa rete riduce notevolmente contaminanti fibrosi che sono presenti, se Whatman carta da filtro o tovaglioli di carta sono utilizzati.
- Riempire il serbatoio mezzo pieno con acqua distillata.
- Gli embrioni vengono raccolti per 1 ora posizionando il contenitore di raccolta della gabbia, che viene successivamente ricopertada un panno scuro per stimolare la deposizione delle uova.
- Gli embrioni raccolti sono autorizzati a maturare al desiderati stadi di sviluppo al di fuori della gabbia in condizioni di allevamento standard (85% di umidità relativa / 26 ° C). Maturazione di embrioni da vari stadi può essere correlata al tempo (ore dopo la deposizione delle uova), seguendo il corso tempo approssimativo di sviluppo degli eventi descritti embrionali (Tabella 2). Questa tabella riassume gli eventi più importanti nello sviluppo embrionale per Aedes aegypti, riportato da Raminani e Cupp, 9,10 Anopheles gambiae descritto prima Ivanova-Kazas 11 e ulteriormente elaborato da Goltsev e colleghi, 12,13 e quinquefasciatus Culex riportato da Davis. Il 14 corsi a tempo descritte sono intese a servire come stime iniziali, piuttosto che gli intervalli di tempo assoluti, per la raccolta di embrioni in fasi particolari di sviluppo.
2. Dechorionation, Fissazione e Endochorisulle perturbazioni
- Trasferire embrioni dal contenitore di raccolta in un tubo di cattura maglia Saatilene dechorionation (Figura 3).
Per gli embrioni Aedes, posizionare il tubo di cattura in un becher che viene riempito con acqua distillata in modo che il volume del tubo cattura è un mezzo completo. Una spazzola artistico può essere utilizzato per rimuovere gli embrioni dalla maglia Saatilene e trasferirli in acqua-tubo riempito di cattura.
Per gli embrioni Anopheles, staccare la maglia Saatilene dal contenitore di raccolta e piegare la maglia attentamente per formare un imbuto. Tenendo l'imbuto maglia con una mano, utilizzare l'altra mano per erogare acqua distillata attraverso una spruzzetta polietilene lungo i lati del imbuto per lavare gli embrioni nel tubo di cattura. Questo metodo può essere applicato a embrioni Anopheles perché non hanno la sostanza adesiva presente sulla superficie di embrioni Aedes, che consente di rispettare le uova substrati deposizione. - Prepare 40 ml di soluzione dechorionation (1 volume di ipoclorito di sodio 5,25%: 3 volumi di acqua distillata). Versare la soluzione in una capsula Petri 100 millimetri.
- Preparare un becher da 100 ml contenente 50 ml di acqua distillata e mettere da parte. Il passo è dechorionation time-sensitive e immediatamente dopo il trattamento con ipoclorito di sodio, gli embrioni saranno immersi in questa acqua, per diluire la soluzione dechorionation.
- Dechorionate gli embrioni nel tubo di maglia cattura ponendo la provetta in una capsula di Petri riempito con soluzione dechorionation. Utilizzare una pipetta di trasferimento usa e getta in polietilene o pipetta Pasteur per lavare gli embrioni, mentre il flaconcino cattura in modo che gli embrioni rimangono sommerse e agitato nella soluzione dechorionation.
Un massimo di 35 sec è richiesto per dechorionation di embrioni Aedes, mentre 75 sec è sufficiente per Anopheles e Culex embrioni (Tabella 3). Dechorionation è uno dei punti più sensibili del protocol e sovra-estensione del trattamento di ipoclorito di sodio, in particolare per gli embrioni Aedes impedirà di cracking propri della corion. - Immediatamente immergere il flacone fermo nel bicchiere contenente acqua.
- Lavare la soluzione rimanente dechorionation dagli embrioni rimuovendo il tubo di cattura del bicchiere pieno d'acqua e sciacquare le pareti interna ed esterna del tubo di cattura con acqua distillata da una spruzzetta o rubinetto dotato di tubo.
- Dechorionation può essere verificata da visualizzare gli embrioni con un microscopio da dissezione a basso ingrandimento. Dechorionated embrioni Aedes manca la rete-come exochorion e solo la superficie liscia e levigata del endochorion nero è evidente per dechorionated embrioni Anopheles, i carri e le strutture exochorionic cresta sono assenti (Figura 4).
- Utilizzando un pennello artistico, trasferire gli embrioni dechorionated in una fiala di scintillazione contenente 5 ml di acqua distillatater (Figura 5-1). Se i campioni sono più in fase di preparazione, di mantenere i tubi di cattura in acqua per prevenire l'essiccamento degli embrioni.
- Sia gli embrioni sedimentare sul fondo della fiala di scintillazione e rimuovere quantità d'acqua dalla fiala possibile.
- Aggiungere 5 ml di eptano nella fiala di scintillazione (Figura 5-2). Rimuovere qualsiasi acqua residua che rimane nella fiala di scintillazione.
- Aggiungere nel scintillazione fiala 5 ml di soluzione appena preparata embrione fissaggio (Tabella 1).
- Fissare gli embrioni per 30 min con inversione in modo che le fasi organica e acquosa miscelare accuratamente, ma non vigorosamente.
- Rimuovere la soluzione di fissaggio con una pipetta Pasteur di vetro, facendo attenzione a non disturbare l'interfase, che contiene gli embrioni (Figura 5-3).
- Lavare la soluzione residua fissazione riempiendo la fiala di scintillazione con la quantità di acqua distillata possibile. Capovolgere il flaconcino e 5 voltequindi rimuovere tutta l'acqua distillata.
- Riempire la fiala di scintillazione con 20 ml di acqua distillata e mescolare capovolgendo la fiala per 30 min.
- Rimuovere tutta l'acqua dalla fiala di scintillazione.
- Aggiungere abbastanza acqua distillata bollente nella fiala di scintillazione in modo che la fase inorganica eptano raggiunge la parte superiore del flacone.
- Incubare per 30 sec e quindi rimuovere tutta l'acqua bollente.
- Aggiungere ghiaccio acqua distillata fredda fino alla fase inorganica raggiunge la parte superiore della fiala. Incubare la provetta in ghiaccio per 10 min.
- Rimuovere prima la fase acquosa e poi organici. Il eptano appariranno opachi in questa fase (Figura 5-4).
- Aggiungere 5 ml di eptano nuovo nel flaconcino. Togliere tutta l'acqua residua dal flaconcino.
- Aggiungere 5 ml di metanolo nel flaconcino. Agitare il flacone 1-2 volte energicamente, senza agitare (Figura 6). Se le fasi metanolo eptano inorganici e organici sono agitato vigorosamente gli embrioni wiverrà distrutta durante la rottura endochorion. È da segnalare che abbiamo osservato variazione della efficienza di interruzione endochorion per diversi ceppi di Aedes aegypti embrioni.
- Incubare a temperatura ambiente per 15-20 min. Durante questa fase, le fasi diventeranno torbida a causa del rilascio di componenti tuorlo (Figura 5-5).
- Rimuovere entrambe le fasi organici ed inorganici e lavare 3 volte con metanolo per rimuovere tutti i residui di eptano.
- Gli embrioni possono essere conservati in metanolo a -20 ° C fino a diversi mesi.
3. Peeling
- Collocare un pezzo di nastro biadesivo parrucchino al centro di una capsula Petri 3 centimetri. Toupee nastro viene usato perché l'adesivo è stabile in presenza di metanolo ed etanolo.
- Utilizzando un foro di grandi dimensioni (circa 3 mm di diametro) 200 microlitri punta della pipetta, embrioni di trasferimento da metanolo sul nastro biadesivo.
- Lasciare 1-2 min per gli embrioni di stabilirsi e di ADHere alla superficie del nastro.
- Decantare metanolo in eccesso e lasciare asciugare la superficie leggermente per 1-2 min.
- Aggiungere 4 ml di 95% (190 proof) di etanolo nella capsula di Petri.
- Pipettare 600 ul di acqua distillata nel etanolo e mescolare. Il nastro diventa opaco di colore. L'aggiunta di acqua distillata farà sì che il nastro diventi appiccicoso e immobilizzare gli embrioni durante peeling. Questo passaggio può essere omesso se desiderato.
- Utilizzare un 27,5 ago attaccato ad una siringa da 1 ml per rimuovere la endochorion cracking (Figura 7). Dopo aver rilasciato l'embrione bianca dai resti endochorion neri, trasferire gli embrioni dal nastro al serbatoio di etanolo del piatto Petri con una punta di pennello fine-artistico. Utilizzando una punta di 3 mm alesaggio pipetta, trasferire gli embrioni in una provetta da microcentrifuga Ambion 1,5 ml contenente 500 microlitri di 200 etanolo prova.
Gli embrioni pelati non dovrebbe rimanere sul nastro per un lungo periodo di tempo perché possono aderire perpermanentemente sul nastro. - Eseguire 2-3 lavaggi veloci con il 100% (200 proof) etanolo e conservare gli embrioni in etanolo puntiglioso a -20 ° C. Embrioni pelati possono essere conservati a -20 ° C per alcuni mesi senza influenzare la morfologia o il segnale di ibridazione successiva.
4. Chiarimento di tuorlo
- Eseguire un lavaggio rapido con 200 etanolo prova. Etanolo puntigliosa deve essere utilizzato per tutte le successive operazioni di lavaggio e per la preparazione del P-xilene soluzione chiarificazione tuorlo.
- Eseguire un lavaggio etanolo, 5 min con nutazione.
- Incubare a P-xylene/ethanol (9:1) a temperatura ambiente per 1-1,5 ore con nutazione. Il passo xilene permette chiarimento della massa tuorlo per migliorare il rapporto segnale rumore.
- Rimuovere la soluzione di xilene-etanolo ed eseguire due lavaggi rapidi con etanolo.
- Eseguire un lavaggio etanolo, 5 min con nutazione.
- Eseguire due lavaggi rapidi con metanolo, seguito da un lavaggio metanolo, 5 min connutazione.
- Equilibrare in soluzione di formaldeide al 4% fissaggio mediante lavaggio una volta con metanolo / formaldeide soluzione di fissazione (1:1).
5. Fissazione e ibridazione in situ
Fissazione e ibridazione in situ procedure sono identiche a quelle descritte nel protocollo punto A.
C. rappresentativi Risultati
L'ibridazione in situ protocollo descritto qui, i risultati in pattern di colorazione colorati che indicano la presenza e la localizzazione del mRNA bersaglio. È importante sottolineare che i livelli relativi di abbondanza trascrizione non può essere determinato mediante ibridazione in situ. Risultati di ibridazione dipendono dalla sonda mRNA specifico utilizzato per la procedura di ibridazione, l'abbondanza di mRNA nel tessuto bersaglio ibridato, così come sonda di concentrazione e temperatura di ibridazione. Confronto di tessuti ibridato con antisenso e corrispondenti sonde mRNA senso rendere possibile l'interpretazione accurata dei pattern di colorazione.
Ibridazione in situ whole-mount di ghiandole salivari di Aedes aegypti femminili con sonde di mRNA che amylase1 target (AAEL006719), D7s2 (AAEL006423), e D7L2 (AAEL006424) indicano accumulo di queste trascrizioni in-laterale prossimale, distale-laterale, e distale- lobi laterali / mediale, rispettivamente (Figura 8). 1 Whole-mount ovaie di tre specie di zanzare sono stati ibridati con sonde di mRNA che si rivolgono specificamente le trascrizioni rispettivi ortologhi di Oskar (Figura 9). 7,8 ibridazione in situ whole-mount di embrioni di Ae. aegypti, An. gambiae e Cx. quinquefasciatus è stata eseguita utilizzando sonde di RNA antisenso per combattere le rispettive trascritti Oskar ortologhi zanzara (Figura 10). 7,8
IGURA 1 "src =" / files/ftp_upload/3709/3709fig1.jpg "/>
Figura 1. Schema di post-ibridazione di montaggio set-up.
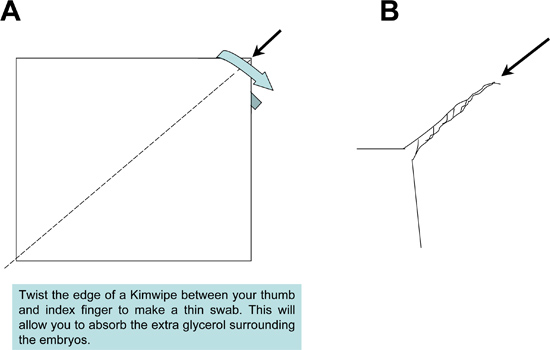
Figura 2. Preparazione del Kimwipe mop campione utilizzato durante il montaggio. Un tessuto Kimwipe è attorcigliato strettamente per produrre una punta sottile straccio per assorbire l'eccesso di soluzione di montaggio a partire dai campioni e far scorrere.
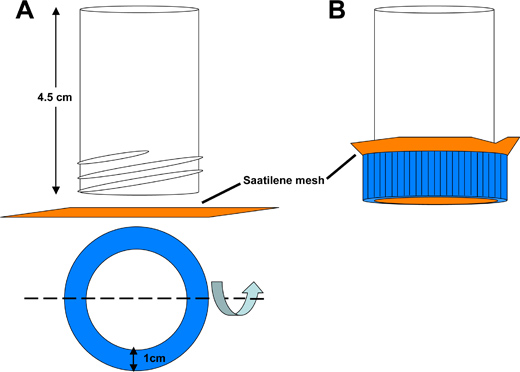
Figura 3. Schema di tubo Saatilene catture dechorionation maglia. A) Il fondo di una provetta conica da 50 ml polistirolo viene tagliato per produrre un tubo cavo 4,5 cm di lunghezza, aperto alle due estremità. Un'apertura circolare è tagliato fuori dal coperchio tubo conico per consentire liquido da lavato attraverso un cm 6.5 2 pezzo quadrato di maglia Saatilene. Le 330 fili per pollice, 34 micron di diametro schermo filo maglia conserva gli embrioni zanzare. B) Assembled cattura tubo.

Figura 4. Aedes aegypti e Anopheles gambiae uova, prima e dopo dechorionation. A) Aedes aegypti uova prima dechorionation. La rete-come exochorion si trova sopra la endochorion nera e dà l'uovo un aspetto strutturato (allargamento riquadro). Dopo la rimozione del exochorion, solo il endochorion rimane liscia e levigata (allargamento B e riquadro). C) Le uova di Anopheles gambiae prima dechorionation. Strutture Exochorion quali galleggianti sono visibili (frecce). D) La superficie liscia e levigata del endochorion è visibile dopo dechorionation. Bar = 100 micron.

Figura 5. Una serie di passi sequenziali per la fissazione e la rottura endochorion di Ae. uova aegypti. A) Slanted-vista frontalee B) visione laterale di fiale contenenti scintillazione Ae. uova aegypti durante le fasi sequenziali di fissazione e la rottura endochorion. 1) Gli embrioni in acqua distillata. 2) Embrioni galleggiare nell'interfase tra la fase superiore eptano e la fase acquosa. 3) Dopo la fissazione degli embrioni confezionare insieme in una massa rotonda. Gli embrioni rimangono nella interfase tra le fasi di soluzione di eptano e fissativo. 4) Dopo il trattamento con acqua bollente e incubazione in ghiaccio, la fase eptanica diventa leggermente opaca. 5) Embrioni con endochorions interrotti sono mostrati nella interfase tra una fase e fase opaco eptano metanolo trasparente.

Figura 6. Interruzione Endochorion di Ae fisso. aegypti uova. A) Immediatamente dopo energica vorticoso di eptano e fasi di metanolo, la formazione di bolle e l'interruzione del endochorion può essere visualizzato. B) following cinque minuti di incubazione, a temperatura ambiente.
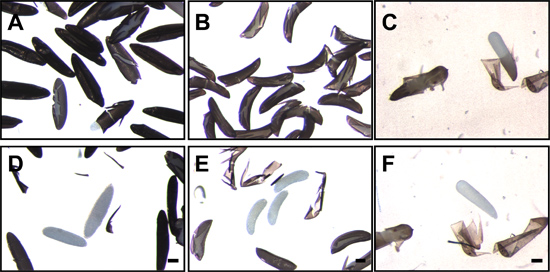
Figura 7. Uova di zanzara dopo interruzione e la rimozione del endochorion. Uova di Ae. aegypti (A), An. gambiae (B) e Cx. quinquefasciatus (C) fissazione seguente e disgregazione della endochorion. Bianchi traslucidi, gli embrioni possono essere visti all'interno del endochorion incrinato. Dopo la rimozione del endochorion, gli embrioni traslucide del Ae. aegypti (D), An. gambiae (E) e Cx. quinquefasciatus (F) sono chiaramente visibili. Bar = 100 micron.
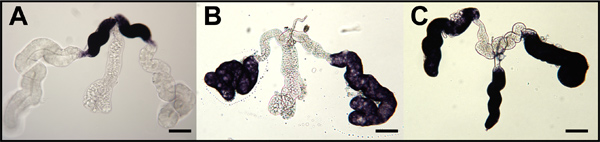
Figura 8. Ibridazioni in situ per tre geni espressi in diversi lobi del whole-mount, femmina Ae. aegypti ghiandole salivari. La colorazione è indicativa di localizzazione e l'accumulo di amylase1 (AAE L006719) (A), D7s2 (AAEL006423) (B) e D7L2 (AAEL006424) (B). Bar = 100 micron.
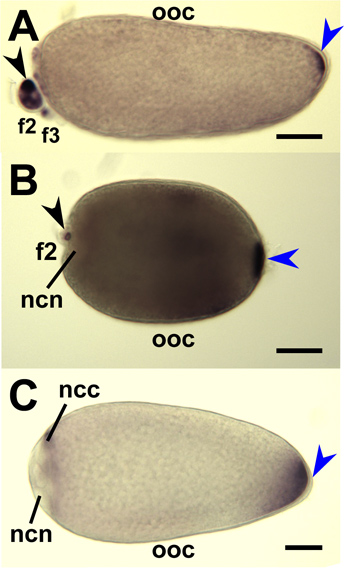
Figura 9. Ibridazione in situ per la zanzara Oskar sonde di RNA antisenso a whole-mount ovociti zanzare e le cellule infermiere. Fase IV ovociti (OOC) sezionato dalle ovaie di An. gambiae (A), Ae. aegypti (B) e Cx. quinquefasciatus (C) e ibridato con sonde di RNA destinati rispettivi mRNA Oskar zanzara. Follicoli primari sono orientati con anteriore sinistra. La colorazione al polo posteriore (freccia blu) indicano accumulato mRNA Oskar. Secondari (f2) e terziario (F3) follicoli sono mostrati e la colorazione (nero punta di freccia) indica l'accumulo di mRNA Oskar nel citoplasma cellulare infermiera (ncc). La colorazione è escluso dai nuclei delle cellule infermiera (NCN). Bar = 50 pm.
ad/3709/3709fig10.jpg "/>
Figura 10. Ibridazione in situ per la zanzara Oskar sonde di RNA antisenso a whole-mount embrioni zanzare. Gli embrioni sono orientati con anteriore sinistra. Cellulari stadio embrioni Blastoderm di An. gambiae (A) e Cx. quinquefasciatus (C) sono ibridate con rispettive specie di zanzara-specifici Oskar sonde di RNA. B) A sinciziale Ae Blastoderm palco. embrione aegypti ibridato con sonde di RNA di targeting Ae. aegypti Oskar trascrizione. La colorazione è evidente nelle cellule polo posteriore di tutti gli embrioni, indicando la localizzazione e l'accumulo di mRNA Oskar zanzara in queste cellule. Bar = 50 pm.

Tabella 1. Soluzioni e buffer per elettroforesi su gel di formaldeide, la fissazione e l'ibridazione in situ.
ftp_upload/3709/3709table2.jpg "/>
Tabella 2. Eventi dello sviluppo e osservazioni morfologiche corrispondenti a fasi consecutive durante l'embriogenesi zanzara.

Tabella 3. Sintesi delle principali differenze tra le pre-ibridazione passaggi per vari tipi di tessuto.
Discussione
L'ibridazione in situ protocollo di colorazione e colorimetrico qui presentati per intero montaggio tessuti zanzare ed embrioni è una tecnica utile per la localizzazione di organi specifici entro trascritti e tipi di cellule. Queste procedure sono un miglioramento rispetto i nostri metodi precedentemente riportati, sia nel razionalizzare le fasi di lavaggio ampi e fornire ulteriori dettagli tecnici e le fonti dei reagenti.
Nella nostra esperienza, la rilevazione colorimetrica dei segnali di ibridazione è superiore in sensibilità e la chiarezza del segnale di ibridazione rispetto a fluorescenza a base di schemi di rilevazione. Inoltre rilevamento colorimetrico elude le questioni connesse con la discriminazione del segnale in embrioni, che sono intrinsecamente auto-fluorescente. Limitazioni di rilevare segnali di ibridazione si verificano, quando a bassa abbondanza trascrizioni sono mirate e colorazione di fondo è evidente. Aumentando la temperatura di ibridazione a 65 ° C è stato trovato per ridurre indietroterra segnali di ibridazione, ma non è un sostituto suggerito per la progettazione di destinazione univoco sonde specifiche RNA.
Questo protocollo è stato utilizzato per eseguire ibridazione in situ whole-mount di ghiandole salivari di Aedes aegypti, e ovaie ed embrioni di Anopheles gambiae, Anopheles stephensi, Ae. aegypti e Culex quinquefasciatus. Questo metodo è applicabile anche ad altri tessuti zanzara, e presumibilmente quelli di altri insetti. Inoltre, abbiamo compilato per la prima volta le linee guida di confronto per la messa in scena dello sviluppo embrionale in tre zanzare vettore, Ae. aegypti, An. gambiae e Cx. fatigans. Le osservazioni sono state riportate per i ceppi specifici di queste tre specie di allevamento, in condizioni discrete. È importante notare che il decorso di tempo di sviluppo può variare per i diversi ceppi di specie di zanzara e in diverse condizioni di allevamento. Ibridazioni in situ supplemento in corso sforzi per anaLyze le trascrittomi di zanzare ed altri artropodi, e può fornire un quadro migliore della regolazione dell'espressione genica in questi organismi.
Divulgazioni
Gli autori non hanno informativa.
Riconoscimenti
Gli autori desiderano ringraziare Marika Walters per la consulenza in ibridazione in situ lo sviluppo di metodi per i tessuti molli e Goltsev Yury per la discussione di protocolli per l'ibridazione in situ su embrioni Anopheles gambiae, che sono stati successivamente adattati e modificati per sviluppare il protocollo descritto qui per ibridazione in situ di Aedes e di embrioni Culex. Riconosciamo anche utili raccomandazioni fornite da Adam e David Paré Kosman. Ringraziamo Osvaldo Marinotti per la discussione scientifica e la modifica del testo del protocollo.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Commenti (opzionale) |
| 0,5 M EDTA | Ambion | AM9261 | |
| 1M Tris-HCl | Ambion | AM9855G | pH8.0 |
| 10X PBS | Ambion | AM9625 | |
| 20X SSC | Ambion | AM9763 | |
| Provette per microcentrifuga da 1,5 ml | Ambion | AM12400 | Meno opaco di tubi standard; aiuti a visualizzare campioni |
| Formammide deionizzata | Ambion | AM9342 | Conservazione a 4 ° C |
| DEPC acqua | Ambion | AM9932 | |
| Proteinasi K | Ambion | AM2546 | |
| Ipoclorito di sodio 5,25% | Austin | A-1 Marca | |
| RNA polimerasi T3-Plus | Ambion | AM2733 | Conservazione a -20 ° C |
| T7 RNA polimerasi | Ambion | AM2082 | Conservazione a -20 ° C |
| 95% etanolo | Fisher Scientific | AC61511-0040 | |
| FISHERBRAND usa e getta in polietilene pipette di trasferimento | Fisher Scientific | 13-711-7M | |
| 37% formaldeide | Fisher Scientific | F79-500 | |
| HPLC-grade metanolo | Fisher Scientific | A452-1 | |
| Magnesio cloruro | Fisher Scientific | M87-500 | |
| Microscopio copertura in vetro | Fisher Scientific | 12-542A | 18 x18 millimetri |
| N-eptano | Fisher Scientific | H350-1 | |
| P-xilene | Fisher Scientific | O5082-500 | |
| Pyrex 9-Spot e piastra | Fisher Scientific | 13-748B | 100x85 millimetri |
| Cloruro di sodio | Fisher Scientific | AC32730-0025 | |
| Idrossido di sodio | Fisher Scientific | SS255-1 | |
| SuperFrost / Plus vetrini | Fisher Scientific | 12-550-15 | 25x75x1.0 millimetro |
| Davlyn Rosso trasparente-liner Toupee tape | Capelli diretta | RED-75R12 | Poly / base materiale della pelle in 0,75 x 12 rotolo di nastro m |
| Kit per la clonazione TOPOTA Sequening con un solo colpo Top10 chimicamente competenti E. coli | Invitrogen | K457501 K457540 | 20 reazioni 40 reazioni |
| Sonicato salmone DNA degli spermatozoi | Invitrogen | 15632-011 | Conservazione a -20 ° C |
| Anti-digossigenina-AP frammenti Fab | Roche Applied Science | 1093274 | Conservazione a 4 ° C |
| DIG RNA etichettatura mix | Roche Applied Science | 1277073 | Conservazione a -20 ° C |
| NBT / BCIP soluzione stock | Roche Applied Science | 1681451 | Conservazione a 4 ° C |
| Occidentale Reagente Bloccante | Roche Applied Science | 11921673001 | Conservazione a 4 ° C |
| Saatilene Hitech poliestere mesh (330,130) | Saati Print | 330,34 UO PW | 330 fili / cm, diametro della filettatura 34 micron, colore arancio |
| Glicerina | Sigma | G6279-1 | 70% in PBT |
| Sale di sodio eparina | Sigma | H3393 | |
| Tween 20 | Sigma | P1379-500 | |
| 37% formaldeide | Ted Pella | 18508 | Aliquote da 10 ml in fiale color ambra |
| 16 once Contenitori di carta Solo con coperchi | Il Paper Company | SOLOKH16AJ8000 | |
| Vetro borosilicato scintillatfiala di ioni con tappo a vite senza legami | VWR International | 66022-128 | 20 ml di 500 caso |
| Sealed Air Bubble Wrap celluar materiale ammortizzante | VWR International | 500018-081 | 10 piedi / roll 0,188 pollici di spessore |
| Siero di pollo | Il sangue intero è stato raccolto dalla vena o ala o mediante puntura cardiaca da un pollo giovanile. Il sangue è stato incubato a 37 ° C per 1 h fino coagulata e poi poste su ghiaccio per 30 min. Il siero è stato raccolto e centrifugato a 3000 xg per 10 min. Il supernatante risultante (chiarificato siero) è stato raccolto e conservato a -20 ° C fino all'uso. |
Tabella 4. Tabella dei reagenti e attrezzature specifiche per l'ibridazione in situ.
Riferimenti
- Juhn, J. Spatial mapping of gene expression in the salivary glands of the dengue vector mosquito, Aedes aegypti. Parasit. Vectors. 4, 1 (2011).
- Coleman, J., Juhn, J., James, A. A. Dissection of midgut and salivary glands from Ae. aegypti mosquitoes. J. Vis. Exp. (5), e228 (2007).
- Benedict, M. Q. Dissecting Plasmodium-infected Mosquitoes: Salivary Glands, Chapter. 5.4.2. Methods in Anopheles Research. , (2007).
- Sappington, T. W., Brown, M. R., Raikhel, A. S. Culture and analysis of insect ovaries, Chapter. 42.3. The Molecular Biology of Insect Disease Vectors: A methods manual. , (1997).
- Goltsev, Y., Hsiong, W., Lanzaro, G., Levine, M. Different combinations of gap repressors for common stripes in Anopheles and Drosophila embryos. Dev. Biol. 275, 435-446 (2004).
- Benedict, M. Q. Anopheles Embryo Fixation, Chapter. 3.7. Methods in Anopheles Research. Malaria Research and Reference Reagent Resource Center (MR4). , (2007).
- Juhn, J., James, A. A. oskar gene expression in the vector mosquitoes, Anopheles gambiae and Aedes aegypti. Insect Mol. Biol. 15, 363-372 (2006).
- Juhn, J., Marinotti, O., Calvo, E., James, A. A. Gene structure and expression of nanos (nos) and oskar (osk) orthologues of the vector mosquito, Culex quinquefasciatus. Insect Mol. Biol. 17, 545-552 (2008).
- Raminani, L. N., Cupp, E. W. Early Embryology of Aedes aegypti (L.) (Diptera: Culicidae). Int. J. Insect Morphol. & Embryol. 4, 517-528 (1975).
- Raminani, L. N., Cupp, E. W. Embryology of Aedes aegypti (L.) (Diptera: Culicidae): Organogenesis. Int. J. Insect morphol. & Embryol. 7, 273-296 (1978).
- Ivanova-Kazas, O. M. Embryonic development of Anopheles maculipennis Mg. Izv. Akad. Nauk SSSR ser. Biol. 2, 140-170 (1949).
- Goltsev, Y. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Dev. Biol. 330, 462-470 (2009).
- Papatsenko, D., Levine, M., Goltsev, Y. Clusters of temporal discordances reveal distinct embryonic patterning mechanisms in Drosophila and Anopheles. PLoS Biol. 9, e1000584 (2011).
- Davis, C. W. C. A comparative study of larval embryogenesis in the mosquito Culex fatigans Wiedemann (Diptera: Culicidae) and the sheep-fly Lucilla seriata Meigen (Diptera: Calliphoridae) I. Description of embryonic development. Aust. J. Zool. 15, 547-579 (1967).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon