Method Article
Hybridation
Dans cet article
Résumé
Temporelles et spatiales analyses d'expression génique ont un rôle crucial dans la génomique fonctionnelle. Tout le montage d'hybridation In situ Est utile pour déterminer la localisation des transcrits dans les tissus et les compartiments subcellulaires. Nous exposons ici une hybridation In situ avec des modifications pour les tissus cibles spécifiques chez les moustiques.
Résumé
Les moustiques sont des vecteurs pour un ensemble diversifié de pathogènes, y compris les arbovirus, des parasites protozoaires et les nématodes. Enquête sur les transcriptions et les régulateurs des gènes qui sont exprimés dans les tissus où le moustique hôte et d'interagir des agents pathogènes, et dans les organes impliqués dans la reproduction d'un grand intérêt pour les stratégies visant à réduire la transmission de maladies transmises par les moustiques et de perturber le développement des œufs. Un certain nombre d'outils ont été utilisés pour étudier et valider la régulation temporelle et tissu-spécifique de l'expression génique. Ici, nous décrivons les protocoles qui ont été développés pour obtenir des informations spatiales, ce qui améliore notre compréhension de l'endroit où les gènes spécifiques sont exprimés et leurs produits s'accumulent. Le protocole décrit a été utilisé pour valider l'expression et de déterminer des modèles d'accumulation des transcrits dans les tissus liés à moustiques transmission d'agents pathogènes, tels que les femmes les glandes salivaires, ainsi que des compartiments subcellulaires des ovaires et des embryons, qui a rouverttard pour la reproduction des moustiques et le développement.
Les procédures suivantes représentent une méthodologie optimisée qui améliore l'efficacité des différentes étapes du protocole, sans perte des signaux d'hybridation spécifiques à la cible. Lignes directrices pour la préparation sonde d'ARN, la dissection des tissus mous et la procédure générale pour la fixation et l'hybridation sont décrites dans la partie A, tandis que des mesures spécifiques pour la collecte, la fixation, de pré-hybridation et l'hybridation des embryons de moustiques sont détaillés dans la partie B.
Protocole
A. L'hybridation in situ pour les tissus mous: Mosquito glandes salivaires et les ovaires
Recettes pour des solutions et tampons nécessaires pour les procédures suivantes sont décrites dans le tableau 1.
1. Sonde d'ARN Préparation et analyse de la qualité
- Amorces de conception pour amplifier par PCR la cible transcrit d 'intérêt. Il est recommandé que l'amplicon est ≥ 600 nucléotides de long et plus important encore que la séquence amplicon est unique à la transcription cible. Les séquences qui ne sont pas uniques, sont évitées, afin d'éliminer la possibilité de générer des réactions croisées des sondes d'ARN.
- Cloner le produit de PCR dans le vecteur pCR4-TOPO, ou vecteur de clonage similaire. Le vecteur de clonage TOPO-pCR4 contient T7 et T3 des sites d'ARN polymérase d'amorçage qui permettent la production de sens et antisens produits de transcription run-off à partir d'un clone unique.
- Séquence de l'amplicon cloné afin de vérifier la séquence fidelity et l'orientation dans le vecteur plasmidique.
- Effectuer une réaction de digestion par restriction avec une enzyme appropriée pour produire un antisens produit de transcription in vitro. Linéarisation plasmide est faite directement en sélectionnant un site de restriction situé dans la région de clonage multiple du vecteur pCR4-TOPO tels que Spe I, Pst I ou non I. Faire en sorte que le site de restriction sélectionné n'est pas présent dans le fragment cloné. Le même clone peut être utilisé pour générer une sonde sens brin d'ARN, qui sert de témoin de fond. Hybridation in situ avec une sonde sens devrait donner le signal que peu ou pas, par rapport à celui de la sonde antisens complémentaire.
- Vérifiez par électrophorèse sur gel que le clone pCR4-TOPO est complètement linéarisé.
- Purifier l'ADN plasmide linéarisé en effectuant une extraction phénol-chloroforme, suivie par précipitation à l'éthanol. Lorsque la précipitation de l'ADN plasmidique, il est recommandé d'utiliser un concent finaleration de 2 M d'acétate d'ammonium avec 2,5 volumes d'éthanol afin de réduire le report de sel résiduel dans la réaction de transcription in vitro.
- Préparer la digoxigénine (DIG)-simple brin marqué sonde d'ARN en effectuant un run-off réaction de transcription in vitro, en utilisant 1 ug de l'ADN plasmidique linéarisé comme un modèle. Préparer la réaction avec l'ARN polymérase, tampon de transcription et l'ARN DIG étiquetage mélange tel que décrit par les instructions du fabricant.
- Purifier le DIG marqué, dans les produits de transcription in vitro par précipitation à l'éthanol et remettre en suspension les granulés dans l'ARN eau traitée au DEPC distillée.
- Vérifier la qualité et prévue poids moléculaire de l'purifié DIG sonde marquée ARN par électrophorèse sur gel de formaldéhyde. La sonde préparée ARN peut être divisé en aliquotes et conservés à -80 ° C jusqu'à son utilisation.
2. Dissection des glandes salivaires des moustiques et des ovaires
- Disséquer les moustiques gland salivaireds l'aide d'une sonde et une pince comme décrit précédemment pour Ae. aegypti. 1,2 Pour Une. gambiae, les glandes salivaires peut être disséqué comme décrit pour Ae. aegypti, ou bien comme décrit dans les méthodes pour MR4 Anopheles recherche d'emploi 3.
- Disséquer les ovaires des moustiques en utilisant des pinces comme décrit précédemment pour Ae. aegypti. 4 En bref, utiliser une paire de forceps pour saisir le thorax, tandis que l'autre paire de pince arrache l'avant dernier segment abdominal de libérer les ovaires.
- Recueillir disséqués glandes salivaires ou des ovaires dans Ambion RNAse-libres 1.5 microtubes ml contenant 50 ul de PBS.
- Maintenir les échantillons sur la glace jusqu'à ce que la fixation.
3. Fixation
- Fixer les tissus disséqués dans une solution fraîchement préparée de tissus mous de fixation (tableau 1) à température ambiante avec nutation pendant 30 min à 1 h. La solution de fixation est préparé immédiatement pour empêcher oxidationique du fixateur du formaldéhyde. Fixation pendant 1-1,5 h est recommandée pour les glandes salivaires. Un volume minimum de 1 ml est recommandée pour la fixation de tissus dans un tube de 1,5 ml de micro.
- Autoriser les tissus à se déposer au fond du tube de micro centrifugeuse. Il s'agit d'une étape importante, qui suit tous les changements de solutions dans le protocole et de minimiser les pertes échantillon significatif.
- Décanter la solution de fixation par pipetage attention, laissant 50-100 ul de volume dans le tube de centrifugeuse, puis laver 3 x, 5 min chacun avec PBT.
- Étapes d'équilibration en option pour le stockage de tissus. Pas à pas rincer PBT, avec l'éthanol ou du méthanol. Effectuer l'étape-sages lavages avec PBT / alcool (3:1, 1:1 et 1:3, 5 minutes chacun). Entreposer dans 100% (200 preuve) d'alcool à -20 ° C. Les tissus peuvent être conservés pendant plusieurs mois sans dégradation de l'ultrastructure des tissus. Avant d'effectuer les étapes suivantes du protocole, les tissus doivent être retournés à PBT par équilibration progressive avec de l'alcool / PBT (3:1, 1:1,1:3, 5 min chacun).
- Effectuer PBT lave 3 ×, 5 minutes chacun.
- Effectuer la digestion des protéines avec 0,01 mg / ml de protéinase K / PBT, 5 min à température ambiante. En variante, lorsque les deux immunolocalisation de cibles protéiques et hybridation in situ de l'ARN sont désirés, des ovaires peut être incubées avec de l'acétone à 80% / H 2 O à -20 ° C pendant 10 min au lieu de traiter avec la protéinase K.
Protéinase K traitement est omis pour la préparation des glandes salivaires. Passez directement à l'étape 3.10. - Immédiatement décanter la solution de digestion par pipetage attention. Lavez 2 × 5 min chacun avec glacée pour arrêter la digestion PBT.
- Effectuer supplémentaires PBT lave 2 x, 5 min de chaque à la température ambiante.
- Post-fixer dans les tissus solution de fixation souple à température ambiante avec nutation pendant 30 min. Post-fixation étapes ne sont pas effectués pour les glandes salivaires.
- Effectuer PBT lave 5 ×, 5 minutes chacun.
4. Hybridation
- Equilibrer les tissus dans une solution d'hybridation (Hyb) par incubation à température ambiante avec 1 ml de Hyb / PBT (1:1) pendant 30 min avec la nutation.
- Décanter autant Hyb / PBT que possible. Ajouter 1 ml de Hyb dans chaque tube échantillon.
- Envelopper le tube de prélèvement dans des contenants scellés d'air emballage de protection (bulles) et place à l'intérieur d'une bouteille d'hybridation. Scellez la bouteille avec un bouchon de bouteille d'hybridation.
- Étapes de pré-hybridation et l'hybridation peut être réalisée facilement dans une étuve. Réalisez un pré-hybridation à 55 ° C pendant 30 min avec rotation.
- Prévoyez suffisamment de temps pour les tissus à se déposer au fond du tube de centrifugeuse, comme le Hyb est plus dense que PBT. Décanter avec précaution la solution de pré-hybridation. Les tissus peuvent devenir translucide et difficiles à visualiser. Perte d'échantillon peut être réduite par laissant 50 à 100 pl de volume de solution est pour chaque tube d'échantillon.
- Ajouter un volume de 50 ul de Hyb dans le tube d'échantillon et de maintenir dans un bloc chauffant à 55 ° C.
- Dénaturer la sonde ARN à 85 ° C pendant 5-10 min. Immédiatement, placez la sonde dénaturée sur la glace pendant 5 min.
- Introduire à la pipette de la sonde d'ARN dans le tube échantillon. La sonde d'ARN va flotter à la surface de la Hyb. Mélanger en tapotant doucement le tube.
- Effectuer une hybridation dans un volume total de 50-100 ul de Hyb par échantillon. Incuber les échantillons dans un rack de micro fixe à l'intérieur d'un four d'hybridation, ou dans un rack microtube flottant dans un bain d'eau, à 55 ° C des 16-24 ans h.
5. RNAse Un traitement
- Retirez le Hyb contenant la sonde. Il est important de maintenir les échantillons à 55 ° C au cours des étapes de lavage afin de réduire la liaison non spécifique de la sonde non liée résiduelle. Si plusieurs échantillons sont hybridées, il est recommandé de conserver les tubes échantillons dans un bloc chauffant réglé à 55 ° C pour maintenir la température d'hybridation à travers les étapes de lavage.
- Effectuer un lavage rapide avec Hyb par pipetage 1 ml de solution dans la cuve de centrifugeusee et inverseuse tube de l'échantillon 5-6 fois.
Tous les lavages suivants rapides dans le protocole sont effectués de la même en ajoutant la solution requise et inversion fois le tube échantillon plusieurs. - Effectuer deux lavages avec addition Hyb à 55 ° C, 30 min chacun avec une rotation dans le four d'hybridation.
- Equilibrer en PBT par incubation à température ambiante avec Hyb / PBT (1:1) pendant 15 min avec la nutation.
- Effectuer PBT lave 5 ×, 5 minutes chacun.
- Préparer une nouvelle solution de RNAse Un tampon. Effectuer RNAse Un traitement par incubation dans 20 pg / ml de RNAse A / PBT à 37 ° C, pendant 30 min. RNAse A clive l'ARN simple brin et se traduira par la dégradation de l'ARN non hybridée de la sonde.
- Décanter RNAse Un tampon et d'exécuter un lavage rapide avec PBT.
- Effectuer PBT lave 3 ×, 5 minutes chacun.
6. Incubation Anticorps
- Préparer une nouvelle solution de blocage (5% de poulet sérum / 1% occidentaux réactif de blocage / PBT) des échantillons et le bloquer en incubationting dans 1 ml de la solution pendant 30 min à température ambiante avec la nutation.
- Ajouter 200 pi d'une dilution de 1:1000 de l'anti-DIG-phosphatase alcaline (AP)-conjugué anticorps dans la solution de blocage. Incuber à 4 ° C, pendant une nuit avec la nutation.
7. Coloration phosphatase alcaline
- Retirer l'anticorps et une solution de blocage.
- Effectuer un lavage rapide avec PBT.
- Effectuer supplémentaires PBT lave 5 ×, 10 min à chaque fois. Alternativement, les échantillons peuvent être lavés 3x, 10 min chacune suivie par un lavage prolongé à 4 ° C, pendant une nuit avec la nutation.
- Préparer une nouvelle solution tampon de coloration AP.
- Effectuer lavage rapide avec un tampon de coloration AP.
- Effectuer les lavages supplémentaires avec le tampon de coloration AP 3 ×, 5 min chacun avec nutation.
- Préparer, conformément aux instructions du fabricant, une nouvelle solution de coloration AP contenant le substrat NBT AP / BCIP.
- Incuber chaque échantillon avec 500 pi de solution de coloration AP à températur ambiantee avec la nutation, dans l'obscurité. Les échantillons peuvent être incubées en couvrant les tubes avec un récipient opaque ou une feuille d'aluminium. La progression de la réaction doit être surveillée toutes les 1-2 minutes pour la formation d'un précipité pourpre. En fonction de la concentration de la sonde, la concentration de l'ARN cible et la présence de non-cibles spécifiques, la coloration peut procéder pendant plusieurs minutes à plusieurs heures.
- Retirez autant de la solution de coloration que possible. Résultats insatisfaisants de décantation dans la formation d'un précipité blanc floconneux au cours des étapes de lavage subséquentes.
- La coloration est complètement arrêtée en effectuant deux lavages rapides avec PBT.
- Effectuer supplémentaires PBT lave 3 ×, 5 minutes chacun.
8. Glycérol de montage
- L'utilisation d'un gros calibre 200 pi pointe de la pipette, des échantillons de transfert à partir des microtubes en individuels à fond rond puits d'une plaque à godets en Pyrex.
- Retirez délicatement de l'échantillon comme une grande partie de l'évaluation PBT que possible.
- Pipette sur le dessus du glycérol 70% échantillon / H 2 O. Permettez-glycérol à imprégner le tissu échantillon à 4 ° C, pendant la nuit. Le traitement de glycérol empêche le dessèchement des tissus lors du montage de diapositives.
- Préparer des lames de microscope en essuyant la surface de glissement nettoyer avec Kimwipes. Appliquer sur au coulisseau deux pièces de bande parallèlement invisible à l'autre de manière qu'elles forment un canal étroit (figure 2).
- Utilisation d'une brosse artistique, prélever des échantillons un par un et les placer sur la longueur du canal, le positionnement de chaque échantillon avec la même orientation, par rapport à l'alignement antérieures / postérieures et dorsale / ventrale.
- Après le positionnement de chaque échantillon, utilisez un coton-tige pour absorber Kimwipe solution de glycérol excès entourant les tissus (Figure 3). Enlèvement de l'excès de glycérol est important pour empêcher la formation de bulles, lors de la fermeture des échantillons montés sur la lame sous une lamelle.
- Centre et le lieu avec soin acau cours de glissement sur le canal contenant des échantillons alignés. Fixez le couvercle glisse sur la lame semi-permanente en tamponnant les coins de la lamelle avec du vernis à ongle transparent.
- Aide d'une pipette 200 pi, passer lentement dans une extrémité du canal assez 70% de glycérol à remplir par capillarité tout l'espace du canal et la zone sous la lamelle.
- Sceller de façon permanente les échantillons montés en appliquant le vernis à ongles sur les quatre côtés de la lamelle. Laisser le vernis à ongles pour sécher suffisamment avant de photographier des hybrides tout-montage des tissus. Il est recommandé de photographier des images des échantillons immédiatement après le montage.
Hybridation in situ B. pour les embryons de moustiques
Solutions et tampons nécessaires pour l'hybridation in situ pour les embryons de moustiques sont décrits (tableau 1). Procédures de fixation et l'hybridation présentées ici ont été modifiés à partir those abord signalée dans Anopheles gambiae, Aedes aegypti 5,6 7 et Culex quinquefasciatus. 8
1. Collection d'embryons
- Les embryons sont collectés à partir de 300 accouplées, les moustiques femelles adultes (autorisé à s'accoupler avec des mâles pour 48 h, 3 jours de post-levée) 72 h après le repas de sang. Les moustiques sont maintenus sur une solution de saccharose 3 M, afin d'empêcher la ponte avant la période de collecte destiné.
- Préparer des conteneurs de collecte d'embryons par revêtement d'un 16 oz. gobelet en papier avec Saatilene Hitech mailles de telle sorte que la surface intérieure de la coupelle est complètement recouverte. Le maillage peut être apposée à l'aide d'une agrafe unique. L'utilisation de ce maillage réduit considérablement les contaminants fibreux qui sont présents, si papier filtre Whatman, ou des serviettes en papier sont utilisées.
- Remplissez le récipient à moitié plein avec de l'eau distillée.
- Embryons sont collectées pendant 1 heure en plaçant le récipient de collecte dans la cage, qui est ensuite recouvertepar un tissu sombre pour stimuler la ponte.
- Embryons collectés sont autorisés à échéance à des stades de développement souhaités en dehors de la cage dans des conditions d'élevage standard (85% d'humidité relative / 26 ° C). Maturation des embryons à des stades différents peuvent être corrélés au temps (heures de post-ponte) en suivant le cours du temps de développement approximative des événements embryonnaires décrits (tableau 2). Ce tableau résume les événements majeurs dans le développement embryonnaire pour Aedes aegypti, rapporté par Raminani et Cupp, 9,10 Anopheles gambiae décrite en premier par Ivanova-Kazas 11 et précisées par Goltsev et ses collègues, 12,13 et Culex quinquefasciatus rapporté par Davis 14. Le des cours à temps décrits sont destinés à servir de premières estimations, plutôt que des points de temps absolu, pour la collecte d'embryons à des stades particuliers du développement.
2. Dechorionation, fixation, et Endochorisur la perturbation
- Transfert d'embryons à partir du récipient de collecte dans un tube de maille Saatilene captures dechorionation (Figure 3).
Pour les embryons du genre Aedes, placer le tube de capture dans un bécher qui est rempli avec de l'eau distillée suffisante pour que le volume du tube hic, c'est un demi-pleine. Une brosse artistique peut être utilisé pour déloger les embryons à partir du maillage Saatilene et les transférer dans l'eau tube rempli de capture.
Pour les embryons d'anophèles, détacher le filet Saatilene du récipient de collecte et de plier le maillage soigneusement pour former un entonnoir. Tenir l'entonnoir maillage avec une seule main, utiliser l'autre main pour distribuer de l'eau distillée à travers une une bouteille en polyéthylène le long des côtés de l'entonnoir pour se laver les embryons dans le tube de capture. Cette méthode peut être appliquée aux embryons Anopheles parce qu'ils n'ont pas la substance adhésive présente sur la surface de l'embryon du genre Aedes, qui permet d'œufs de s'en tenir à des substrats de ponte. - Prepare 40 ml de solution dechorionation (1 volume de l'hypochlorite de sodium à 5,25%: 3 volumes d'eau distillée). Verser la solution dans un plat de 100 mm de Petri.
- Préparer un bécher de 100 ml contenant 50 ml d'eau distillée et mis de côté. L'étape dechorionation est temps sensible et immédiatement après traitement à l'hypochlorite de sodium les embryons seront plongés dans cette eau, pour diluer la solution dechorionation.
- Dechorionate les embryons dans le maillage de capture du tube en plaçant le tube dans la boîte de Petri, rempli de solution dechorionation. Utilisez un transfert jetable en polyéthylène pipette ou une pipette Pasteur pour se laver les embryons, tout en agitant le flacon de capture de sorte que les embryons restent submergés et agité dans la solution dechorionation.
Un maximum de 35 secondes est nécessaire pour dechorionation des embryons du genre Aedes, tandis que 75 sec est suffisant pour Anopheles et Culex embryons (Tableau 3). Dechorionation est l'une des étapes les plus sensibles de la protocol et la sur-extension du traitement d'hypochlorite de sodium, en particulier pour les embryons du genre Aedes sera de prévenir les fissures propres du chorion. - Immédiatement plonger le flacon de capture dans le bécher contenant de l'eau.
- Laver la solution restante à partir dechorionation les embryons en retirant le tube de capture du bécher rempli d'eau et rincer les parois interne et externe du tube prises avec de l'eau distillée à partir d'un robinet ou une bouteille muni d'tube.
- Dechorionation peut être vérifiée en visualisant les embryons avec un microscope à dissection à faible grossissement. Dechorionated embryons Aedes n'ont pas la exochorion filet-like et que la surface lisse et polie de la endochorion noir est apparente Pour les embryons d'anophèles dechorionated, les flotteurs et les structures faîtières exochorionic sont absents (figure 4).
- Utiliser une brosse artistique, de transférer les embryons dechorionated dans un flacon à scintillation contenant 5 ml d'eau distilléeter (figure 5-1). Si plusieurs échantillons sont en cours de préparation, de maintenir les tubes de capture dans l'eau pour éviter la dessiccation des embryons.
- Laisser les embryons se déposent au fond du flacon à scintillation et enlever de l'eau à partir du flacon que possible.
- Ajouter 5 ml d'heptane dans le flacon à scintillation (figure 5-2). Retirer toute l'eau résiduelle qui reste dans le flacon à scintillation.
- Ajouter dans le flacon de scintillation 5 ml de solution fraîchement préparée de fixation embryon (Tableau 1).
- Fixer les embryons pendant 30 min avec une inversion de sorte que les phases organique et aqueuse mélanger, mais pas vigoureusement.
- Retirer la solution de fixation utilisant un pipette Pasteur en verre, en faisant attention de ne pas perturber l'interphase, qui contient les embryons (Figure 5-3).
- Laver la solution de fixation résiduelle en remplissant le flacon à scintillation avec de l'eau distillée, autant que possible. Retourner le flacon et 5 foispuis retirez tout de l'eau distillée.
- Remplissez le flacon à scintillation avec 20 ml d'eau distillée et mélanger en retournant le flacon pendant 30 min.
- Retirer toute l'eau du flacon à scintillation.
- Ajouter suffisamment d'ébullition de l'eau distillée dans le flacon à scintillation de telle sorte que la phase inorganique heptane atteint le sommet du flacon.
- Incuber pendant 30 secondes puis retirez tout de l'eau bouillante.
- Ajouter l'eau glacée distillée jusqu'à ce que la phase inorganique atteint le sommet du flacon. Incuber le flacon dans la glace pendant 10 min.
- Retirer d'abord les phases aqueuse et ensuite organiques. L'heptane apparaîtra opaque à cette étape (figure 5-4).
- Ajouter 5 ml de nouvelle heptane dans le flacon. Retirer toute l'eau restant dans le flacon.
- Ajouter 5 ml de méthanol dans le flacon. Agiter le flacon 1-2 fois énergiquement, sans agitation (Figure 6). Si les phases inorganiques et organiques du méthanol heptane sont secoués vigoureusement les embryons wiserez détruits lors de la rupture endochorion. Il est important de mentionner que nous avons observé une variation de l'efficacité de la perturbation endochorion pour différentes souches d'embryons Aedes aegypti.
- Incuber à température ambiante pendant 15-20 min. Durant cette phase, les phases deviendra trouble due à la libération de composants jaune (figure 5-5).
- Retirez les deux phases organiques et inorganiques et les laver avec du méthanol 3 fois pour enlever tous les résidus heptane.
- Les embryons peuvent être conservés dans du méthanol à -20 ° C pendant plusieurs mois.
3. Peeling
- Placez un morceau de ruban adhésif double-face toupee dans le centre d'un plat de 3 cm de Petri. Bande Toupee est utilisée parce que l'adhésif est stable en présence de méthanol et d'éthanol.
- L'utilisation d'un gros calibre (diamètre d'environ 3 mm) 200 pointe de pipette de transfert, les embryons ul de méthanol sur le ruban adhésif double face.
- Laisser 1-2 min pour les embryons de s'installer et adhavant à la surface de bande.
- Décanter le méthanol en excès et laissez la surface sécher légèrement pendant 1-2 min.
- Ajouter 4 ml de 95% (190 preuve) éthanol dans la boîte de Pétri.
- Introduire à la pipette 600 ul d'eau distillée dans l'éthanol et agiter pour mélanger. La bande deviendra une couleur opaque. L'addition d'eau distillée fera la bande de devenir collant et immobiliser les embryons au cours pelage. Cette étape peut être omise si désiré.
- Utiliser une aiguille de calibre 27,5 attachée à une seringue de 1 ml pour décoller le endochorion craqué (Figure 7). Après libération de l'embryon blanc à partir des restes endochorion noirs, transférer les embryons à partir de la bande vers le réservoir d'éthanol de la boîte de Petri aide d'une brosse fine pointe artistique. En utilisant une pointe de 3 mm alésage pipette, transférer les embryons dans un tube de 1,5 Ambion microcentrifugeuse ml contenant 500 ul d'éthanol de 200 preuve.
Les embryons pelées ne doit pas rester sur la bande pendant une période prolongée de temps, car ils peuvent adhérer parmanière permanente à la bande. - Effectuer 2-3 lavages rapides avec 100% (200 preuve) d'éthanol et de stocker les embryons dans l'éthanol pointilleux à -20 ° C. Embryons pelées peuvent être stockés à -20 ° C pendant quelques mois sans affecter la morphologie ou le signal d'hybridation ultérieure.
4. Clarification de jaune d'oeuf
- Effectuer un lavage rapide avec 200 d'éthanol preuve. L'éthanol pointilleuse devrait être utilisé pour toutes les étapes de lavage subséquentes et pour la préparation de la solution P-xylène éclaircissements jaune.
- Effectuer un lavage éthanol, 5 min à nutation.
- Incuber dans P-xylene/ethanol (9:1) à température ambiante pendant 1 à 1,5 h avec nutation. L'étape consistant xylène permet la clarification de la masse jaune d'améliorer le rapport signal sur bruit.
- Retirez la solution dans le xylene-éthanol et d'effectuer deux lavages rapides avec de l'éthanol.
- Effectuer un lavage éthanol, 5 min à nutation.
- Effectuer deux lavages rapides avec du méthanol, suivie par un lavage au methanol, 5 min avecnutation.
- Equilibrer en solution de formaldéhyde fixation 4% par lavage une fois avec une solution de fixation méthanol / formaldéhyde (1:1).
5. Fixation et hybridation in situ
Fixation et l'hybridation in situ dans les procédures sont identiques à celles décrites dans le protocole Section A.
C. des résultats représentatifs
L'hybridation in situ dans le protocole décrit ici, les résultats dans les habitudes de coloration de couleur qui indiquent la présence et la localisation de l'ARNm ciblé. Il est important de souligner que les niveaux relatifs d'abondance transcription ne peut être déterminée par hybridation in situ. Les résultats d'hybridation dépendent de la sonde d'ARNm spécifique utilisé pour la procédure d'hybridation, l'abondance de l'ARNm cible dans le tissu hybride, ainsi que la concentration de la sonde et la température d'hybridation. Comparaison des tissus hybridée avec antisens et correspondant sondes ARNm sens rendre possible l'interprétation exacte des motifs de coloration.
Hybridation in situ de l'ensemble de monter les glandes salivaires d'Aedes aegypti femelles avec des sondes d'ARNm qui amylase1 cible (AAEL006719), D7s2 (AAEL006423), et D7L2 (AAEL006424) indiquent l'accumulation de ces transcrits dans proximale-latérale, distale-latérale, et distale- lobes latéraux / médial, respectivement (figure 8). 1 entier montage ovaires de trois espèces de moustiques ont été hybridées avec des sondes d'ARNm qui ciblent spécifiquement les transcriptions respectives orthologues de Oskar (figure 9). 7,8 hybridation in situ de l'ensemble du montage embryons d'Ae. aegypti, un. gambiae et Cx. quinquefasciatus a été réalisée en utilisant des sondes d'ARN antisens ciblant les transcriptions respectives oskar moustiques orthologues (Figure 10). 7,8
igure 1 "src =" / files/ftp_upload/3709/3709fig1.jpg "/>
Figure 1. Schéma de post-hybridation de montage set-up.
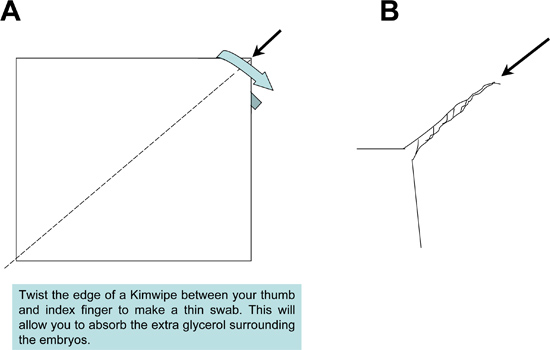
Figure 2. Préparation de Kimwipe vadrouille utilisé pendant échantillon de montage. Un tissu Kimwipe est tordu étroitement afin de produire un balai à pointe fine pour absorber l'excès de milieu de montage à partir des échantillons et des diaporamas.
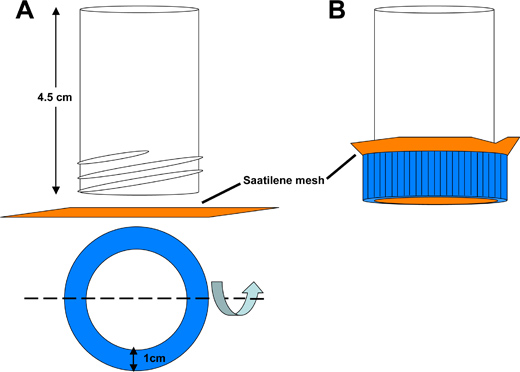
Figure 3. Schéma de Saatilene maillage tube de capture dechorionation. A) Le fond d'un tube de 50 ml polystyrène conique est coupée pour obtenir un tube creux de 4,5 cm de longueur, ouvert aux deux extrémités. Un ouverture circulaire est découpée dans le couvercle tube conique pour permettre au liquide d'être lavé à travers une pièce de 6,5 cm 2 carré de maillage Saatilene. Les 330 fils par pouce, 34 microns de diamètre en maille filet écran conserve les embryons de moustiques. B) Assembled rattraper tube.

Figure 4. Aedes aegypti et Anopheles gambiae oeufs, avant et après dechorionation. A) Aedes aegypti oeufs avant dechorionation. Le exochorion maillé situe au-dessus de la endochorion noir et donne à l'œuf un aspect texturé (élargissement de l'encadré). Après le retrait de l'exochorion, seul le endochorion lisse et polie reste (l'élargissement et B en médaillon). C) Les œufs d'Anopheles gambiae avant dechorionation. Structures telles que les flotteurs exochorion sont visibles (flèches). D) La surface lisse et polie de la endochorion est visible après dechorionation. Bar = 100 um.

Figure 5. Une série d'étapes séquentielles pour la fixation et la perturbation endochorion de Ae. oeufs aegypti. A) Slanted-vue frontaleet B) latérale vue de flacons à scintillation contenant Ae. oeufs aegypti au cours des étapes séquentielles de la fixation et la perturbation endochorion. 1) Les embryons dans l'eau distillée. 2) embryons flotter dans l'interphase entre la phase supérieure heptane et la phase aqueuse inférieure. 3) Après fixation des embryons rassembler dans une masse ronde. Les embryons restent dans l'interphase entre les phases solution d'heptane et du fixateur. 4) Après le traitement avec de l'eau bouillante et l'incubation dans la glace, la phase heptane devient légèrement opaque. 5) Les embryons avec endochorions perturbé sont présentés dans l'interphase entre une phase et la phase opaque heptane méthanol transparente.

Figure 6. Perturbations endochorion de Ae fixe. oeufs aegypti. A) immédiatement après énergétique tourbillonnant d'heptane et les phases de méthanol, la formation de bulles et de la perturbation de l'endochorion peuvent être visualisées. B) following cinq minutes d'incubation, à la température ambiante.
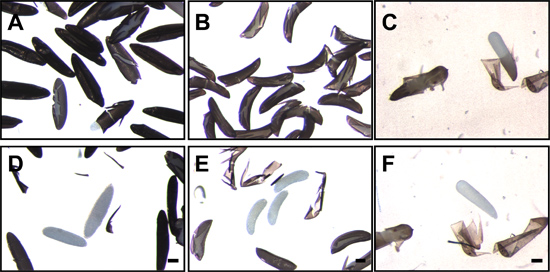
Figure 7. Oeufs de moustiques qui suivent la perturbation et la suppression de l'endochorion. Oeufs de Ae. aegypti (A), Une. gambiae (B) et Cx. quinquefasciatus (C) suivant la fixation et la perturbation de l'endochorion. Blanc, translucide embryons peuvent être vus dans l'endochorion craqué. Après le retrait de l'endochorion, les embryons translucides de Ae. aegypti (D), Une. gambiae (E) et Cx. quinquefasciatus (F) sont clairement visibles. Bar = 100 um.
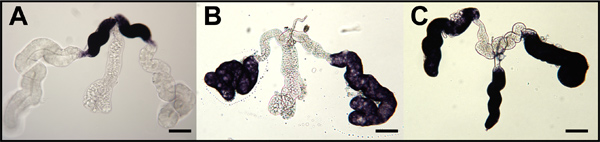
Figure 8. Des hybridations in situ pour les trois gènes exprimés dans les différents lobes de l'ensemble du montage, des femmes Ae. glandes salivaires. aegypti La coloration est indicative de la localisation et l'accumulation de amylase1 (AAE L006719) (A), D7s2 (AAEL006423) (B) et D7L2 (AAEL006424) (B). Bar = 100 um.
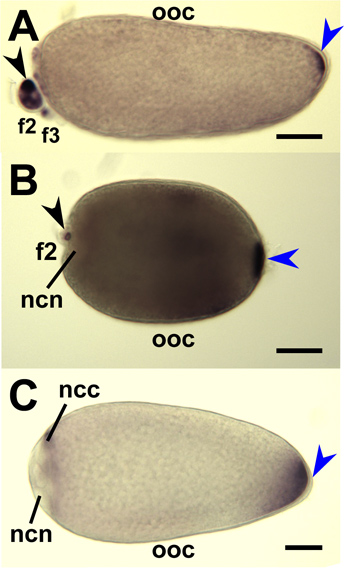
Figure 9. Hybridation in situ pour les moustiques sondes oskar ARN antisens à des ovocytes de moustiques toute-montage et des cellules nourricières. Etape IV ovocytes (OOC) disséqué à partir d'ovaires de Une. gambiae (A), Ae. aegypti (B) et Cx. quinquefasciatus (C) et hybridé avec des sondes d'ARN ciblant respectifs ARNm oskar moustiques. Follicules primaires sont orientés avec antérieure à gauche. Coloration au pôle postérieur (bleu tête de flèche) indiquent accumulée ARNm oskar. Secondaires (f2) et tertiaire (F3) et les follicules sont montrés coloration (tête de flèche noire) indiquer une accumulation de l'ARNm oskar dans le cytoplasme de la cellule infirmière (CCN). Coloration est exclu de la noyaux cellulaires infirmière (NCN). Bar = 50 um.
ad/3709/3709fig10.jpg "/>
Figure 10. Hybridation in situ pour les moustiques sondes oskar ARN antisens à des embryons de moustiques toute-montage. Embryons sont orientés avec antérieure à gauche. Cellulaires embryons au stade blastoderme d'An. gambiae (A) et Cx. quinquefasciatus (C) sont hybridées avec respectifs spécifiques d'espèces de moustiques sondes d'ARN oskar. B) Un Ae stade blastoderme syncytial. embryon aegypti hybridées avec des sondes d'ARN ciblant Ae. aegypti oskar transcription. La coloration est évident dans les cellules du pôle postérieur de tous les embryons, ce qui indique la localisation et l'accumulation de l'ARNm oskar moustiques dans ces cellules. Bar = 50 um.

Tableau 1. Solutions et tampons pour une électrophorèse sur gel de formaldéhyde, la fixation et l'hybridation in situ.
ftp_upload/3709/3709table2.jpg "/>
Tableau 2. Événements du développement et des observations morphologiques correspondant à des étapes consécutives cours de l'embryogenèse des moustiques.

Tableau 3. Résumé des principales différences entre pré-hybridation étapes pour différents types de tissus.
Discussion
L'hybridation in situ dans le protocole de coloration et colorimétriques présentées ici pour les tissus de moustiques toute-montage et d'embryons est une technique utile pour la localisation des relevés de notes au sein des organes spécifiques et des types de cellules. Ces procédures sont une amélioration par rapport à nos méthodes précédemment signalées, tant dans la rationalisation des étapes de lavage et de fournir de vastes détails techniques supplémentaires et des sources de réactifs.
Dans notre expérience, la détection colorimétrique des signaux d'hybridation est supérieure à la sensibilité et la clarté de signal d'hybridation par rapport à des modèles de détection basées sur la fluorescence. En outre la détection colorimétrique contourne les questions liées à la discrimination du signal dans les embryons, qui sont par nature auto-fluorescence. Limitations dans la détection des signaux d'hybridation se produire, quand à faible abondance transcriptions sont ciblées et une coloration de fond est évident. L'augmentation de la température d'hybridation à 65 ° C a été trouvée pour réduire retoursignaux d'hybridation au sol, mais n'est pas un substitut pour la conception unique de suggéré spécifiques à la cible des sondes d'ARN.
Ce protocole a été utilisé pour effectuer l'hybridation in situ de l'ensemble du montage glandes salivaires d'Aedes aegypti, et les ovaires et les embryons d'Anopheles gambiae, Anopheles stephensi, Ae. aegypti et Culex quinquefasciatus. Cette méthode est également applicable aux tissus de moustiques d'autres, et probablement ceux d'autres insectes. En outre, nous avons compilé pour les lignes directrices pour la première fois comparatifs pour la mise en scène du développement embryonnaire dans trois moustiques vecteurs, Ae. aegypti, un. gambiae et Cx. fatigans. Les observations ont été rapportées pour les souches spécifiques de ces trois espèces, dans des conditions d'élevage discrets. Il est important de noter que le cours du temps de développement peuvent varier pour différentes souches d'espèces de moustiques et sous différentes conditions d'élevage. Des hybridations in situ en supplément sur les efforts en cours pour analyser les transcriptomes de moustiques et autres arthropodes, et peut fournir une meilleure idée de la régulation de l'expression des gènes dans ces organismes.
Déclarations de divulgation
Les auteurs n'ont aucune divulgation.
Remerciements
Les auteurs tiennent à remercier Marika Walters pour obtenir des conseils dans l'élaboration d'hybridation in situ dans les méthodes pour les tissus mous et Goltsev Yury de discussion sur les protocoles pour l'hybridation in situ d'embryons Anopheles gambiae, qui ont ensuite été adaptés et modifiés pour développer le protocole décrit ici pour l'hybridation dans in situ des Aedes et Culex embryons. Nous reconnaissons également des recommandations utiles donnés par Adam Paré et David Kosman. Nous remercions Osvaldo Marinotti pour le débat scientifique et de l'édition du texte du protocole.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| 0,5 M d'EDTA | Ambion | AM9261 | |
| Tris-HCl 1M | Ambion | AM9855G | pH 8,0 |
| PBS 10X | Ambion | AM9625 | |
| 20X SSC | Ambion | AM9763 | |
| 1,5 ml microtubes | Ambion | AM12400 | Moins opaque que les tubes standard; aides à visualiser des échantillons |
| Formamide déionisé | Ambion | AM9342 | Stockage à 4 ° C |
| De l'eau DEPC | Ambion | AM9932 | |
| Protéinase K | Ambion | AM2546 | |
| L'hypochlorite de sodium à 5,25% | Austin | A-1 Marque | |
| T3 ARN polymérase-Plus | Ambion | AM2733 | Le stockage à -20 ° C |
| T7 RNA polymérase | Ambion | AM2082 | Le stockage à -20 ° C |
| Éthanol à 95% | Fisher Scientific | AC61511-0040 | |
| Fisherbrand jetables pipettes de transfert en polyéthylène | Fisher Scientific | 13-711-7M | |
| Formaldéhyde 37% | Fisher Scientific | F79-500 | |
| Méthanol pour HPLC | Fisher Scientific | A452-1 | |
| Le chlorure de magnésium | Fisher Scientific | M87-500 | |
| Couvercle en verre Microscope | Fisher Scientific | 12-542A | 18 x18 mm |
| N-Heptane | Fisher Scientific | H350-1 | |
| P-xylène | Fisher Scientific | O5082-500 | |
| Plaque Pyrex spot 9-bien | Fisher Scientific | 13-748B | 100x85 mm |
| Le chlorure de sodium | Fisher Scientific | AC32730-0025 | |
| L'hydroxyde de sodium | Fisher Scientific | SS255-1 | |
| Des lames de microscope Superfrost / Plus | Fisher Scientific | 12-550-15 | 25x75x1.0 mm |
| Davlyn Rouge ruban Toupee Clear-liner | Cheveux direct | RED-75R12 | Poly / matériau de base avec la peau 0,75 po x 12 m rouleau de ruban |
| Kit de clonage TOPOTA pour Sequening avec One Shot Top10 chimiquement compétente E. coli | Invitrogen | K457501 K457540 | 20 réactions 40 réactions |
| Soniqué l'ADN de sperme de saumon | Invitrogen | 15632-011 | Le stockage à -20 ° C |
| Anti-digoxigénine-AP fragments Fab | Roche Applied Science | 1093274 | Stockage à 4 ° C |
| DIG ARN étiquetage mélange | Roche Applied Science | 1277073 | Le stockage à -20 ° C |
| Solution stock NBT / BCIP | Roche Applied Science | 1681451 | Stockage à 4 ° C |
| Western Blocking Reagent | Roche Applied Science | 11921673001 | Stockage à 4 ° C |
| Saatilene Hitech maille polyester (330.130) | Saati Imprimer | 330,34 UO PW | 330 fils / cm, 34 microns de diamètre du fil, couleur orange |
| Glycérol | Sigma | G6279-1 | 70% en PBT |
| Sel de sodium d'héparine | Sigma | H3393 | |
| Tween 20 | Sigma | P1379-500 | |
| Formaldéhyde 37% | Ted Pella | 18508 | Aliquotes de 10 ml dans de l'ambre ampoules |
| 16 oz Contenants en papier solo avec couvercles | Le Paper Company | SOLOKH16AJ8000 | |
| Le verre borosilicate scintillatflacon avec bouchon à vis d'ions seules | VWR International | 66022-128 | 20 ml de 500 cas |
| Sealed Air à bulles matériau de rembourrage celluar | VWR International | 500018-081 | 10 pieds / rouleau 0,188 pouces d'épaisseur |
| De sérum de poulet | Le sang total ont été recueillies soit à partir de la veine de l'aile ou par ponction cardiaque à partir d'un poulet pour mineurs. Du sang a été incubées à 37 ° C pendant 1 h jusqu'à ce que coagulé et ensuite placé sur la glace pendant 30 min. Le sérum a été prélevé et centrifugé à 3000 xg pendant 10 min. Le surnageant résultant (a précisé le sérum) a été collecté et conservé à -20 ° C jusqu'à son utilisation. |
Tableau 4. Table des réactifs spécifiques et des équipements pour l'hybridation in situ.
Références
- Juhn, J. Spatial mapping of gene expression in the salivary glands of the dengue vector mosquito, Aedes aegypti. Parasit. Vectors. 4, 1(2011).
- Coleman, J., Juhn, J., James, A. A. Dissection of midgut and salivary glands from Ae. aegypti mosquitoes. J. Vis. Exp. (5), e228(2007).
- Benedict, M. Q. Dissecting Plasmodium-infected Mosquitoes: Salivary Glands, Chapter. 5.4.2. Methods in Anopheles Research. , Malaria Research and Reference Reagent Resource Center (MR4). (2007).
- Sappington, T. W., Brown, M. R., Raikhel, A. S. Culture and analysis of insect ovaries, Chapter. 42.3. The Molecular Biology of Insect Disease Vectors: A methods manual. , Chapman & Hall. London. (1997).
- Goltsev, Y., Hsiong, W., Lanzaro, G., Levine, M. Different combinations of gap repressors for common stripes in Anopheles and Drosophila embryos. Dev. Biol. 275, 435-446 (2004).
- Benedict, M. Q. Anopheles Embryo Fixation, Chapter. 3.7. Methods in Anopheles Research. Malaria Research and Reference Reagent Resource Center (MR4). , (2007).
- Juhn, J., James, A. A. oskar gene expression in the vector mosquitoes, Anopheles gambiae and Aedes aegypti. Insect Mol. Biol. 15, 363-372 (2006).
- Juhn, J., Marinotti, O., Calvo, E., James, A. A. Gene structure and expression of nanos (nos) and oskar (osk) orthologues of the vector mosquito, Culex quinquefasciatus. Insect Mol. Biol. 17, 545-552 (2008).
- Raminani, L. N., Cupp, E. W. Early Embryology of Aedes aegypti (L.) (Diptera: Culicidae). Int. J. Insect Morphol. & Embryol. 4, 517-528 (1975).
- Raminani, L. N., Cupp, E. W. Embryology of Aedes aegypti (L.) (Diptera: Culicidae): Organogenesis. Int. J. Insect morphol. & Embryol. 7, 273-296 (1978).
- Ivanova-Kazas, O. M. Embryonic development of Anopheles maculipennis Mg. Izv. Akad. Nauk SSSR ser. Biol. 2, 140-170 (1949).
- Goltsev, Y. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Dev. Biol. 330, 462-470 (2009).
- Papatsenko, D., Levine, M., Goltsev, Y. Clusters of temporal discordances reveal distinct embryonic patterning mechanisms in Drosophila and Anopheles. PLoS Biol. 9, e1000584(2011).
- Davis, C. W. C. A comparative study of larval embryogenesis in the mosquito Culex fatigans Wiedemann (Diptera: Culicidae) and the sheep-fly Lucilla seriata Meigen (Diptera: Calliphoridae) I. Description of embryonic development. Aust. J. Zool. 15, 547-579 (1967).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon