Method Article
ハイブリダイゼーション
要約
時間的·空間的遺伝子発現解析は、ゲノム機能解析において重要な役割を持っています。ホールマウントハイブリダイゼーションその場で組織や細胞内コンパートメント内での転写産物の局在を決定するために有用である。ここでは、ハイブリダイゼーションを概説その場でプロトコル。
要約
蚊はアルボウイルス、原虫や線虫を含む病原体の多様なセットのベクトルです。蚊の宿主と病原体相互作用の組織で発現し、臓器に繁殖に関与している転写産物や遺伝子レギュレータの調査では、戦略は蚊が媒介する病気の感染を減らすと卵の開発を混乱させるための大きな関心である。ツールの数は、遺伝子発現の時間的および組織特異的調節を研究し、検証するために用いられてきた。ここでは、特定の遺伝子が発現し、それらの製品が蓄積されている場所の我々の理解を高め、空間情報を取得するために開発されているプロトコルについて説明します。記述されているプロトコルは、再され、式を検証し、そのような女性の唾液腺と同様に、卵巣および胚の細胞内コンパートメントなど蚊が媒介する病原体の伝播に関連した組織では転写産物の蓄積パターンを決定するために使用されています蚊の再生と発展に遅い。
次の手順では、ターゲット固有のハイブリダイゼーションシグナルを失わずにプロトコルのさまざまなステップの効率を向上させる最適化された方法論を表しています。 RNAプローブの調製のためのガイドライン、軟組織と固定とハイブリダイゼーションのための一般的な手順の解剖は、蚊の胚の収集、固定、プレハイブリダイゼーションおよびハイブリダイゼーションのための具体的な手順は、パートBに記載されていながら、パートで説明されています
プロトコル
軟部組織のためにin situで A.ハイブリダイゼーション:蚊唾液腺、卵巣
次の手順に必要なソリューションとバッファのレシピを表1に概説されています。
1。 RNAプローブの調製と品質分析
- PCRのプライマーを設計は、目的の転写産物のターゲットを増幅する。これは、アンプリコンは≥600ヌクレオチドの長さで、より重要なアンプリコン配列が標的転写産物に固有であることであることをお勧めします。固有ではありません配列は交差反応性RNAプローブを生成する可能性を排除するため、回避されます。
- を、pCR4-TOPOベクター、または類似のクローニングベクターにPCR産物をクローニングします。 pCR4-TOPOでクローニングベクターは、センスおよびアンチセンスの両方の生産は、単一のクローンから転写産物をオフを実行可能にするT7およびT3 RNAポリメラーゼのプライミングサイトが含まれます。
- シーケンスシーケンスFIDを確認するには、クローニングされたアンプリコンプラスミドベクター内elityと向き。
- in vitroでの転写産物のアンチセンスを生成するのに適した酵素で制限酵素消化反応を行う。プラスミド線形化は、そのようなSPE I、 はPst I となかろうI.などを、pCR4-TOPOベクターのマルチクローニング領域に位置する制限部位を選択することによって簡単に行われます選択した制限部位がクローニングされた断片に存在しないことを確認してください。同じクローンは、バックグラウンドコントロールとしてセンス鎖RNAプローブを生成するために使用することができます。センスプローブを用いた in situ ハイブリダイゼーションは、相補的なアンチセンスプローブのそれに比べてほとんど、あるいはまったく信号を与える必要があります。
- pCR4-TOPO中のクローンが完全に線形化されていることをゲル電気泳動により確認してください。
- エタノール沈殿、続いてフェノール·クロロホルム抽出を実行することにより、直鎖状プラスミドDNAを精製する。プラスミドDNAを沈殿させるとき、それは最終的なコンセントを使用することを推奨しますin vitro転写反応で中に残存する塩のキャリーオーバー低減するためのエタノールを2.5倍量の2 M酢酸アンモニウムの比。
- ジゴキシゲニン(DIG)ラベルされたテンプレートとして直鎖状プラスミドDNA 1μgを用いて、in vitro転写反応でランオフを行うことにより、一本鎖RNAプローブを準備します。として、製造元の指示によって記述されたRNAポリメラーゼ、転写バッファーとDIG RNAラベリングミックスとの反応を準備します。
- エタノール沈殿によりin vitroでの転写産物には 、DIG標識を精製し、DEPC処理蒸留水でペレット化したRNAを再懸濁します。
- ホルムアルデヒドゲル電気泳動により精製したDIG標識RNAプローブの品質と予想される分子量を確認します。調製したRNAプローブはアリコートに分割し、使用するまで-80℃で保存することができます。
2。蚊唾液腺、卵巣の解剖
- 蚊唾液GLANを分析としてAE用前述したプローブと鉗子を用いたDS。のためにネッタイシマカ。1,2。ヨンエについて説明したようにハマダラカ 、唾液腺を解剖することができます。ハマダラカ研究マニュアルのMR4方法に記載したように交互にネッタイシマカ 、または3。
- AE用前述のように鉗子を用いて蚊の卵巣を解剖する。ネッタイシマカ 4簡単に言うと、鉗子の別のペアが卵巣を解放するために最後から二番目の腹部のセグメントをオフに引っ張りながら、胸郭を把握するために鉗子の一組を使用しています。
- PBS50μlを含むAmbion社のRNase-freeの1.5 mlマイクロチューブに解剖唾液腺や卵巣を収集します。
- 固定するまで氷上でサンプルを維持します。
3。固定
- 30分〜1時間の章動と室温で新たに調製した軟部組織の固定液( 表1)解剖組織を固定します。固定液をoxidatを防止するために新たに調製されたホルムアルデヒド固定液のイオン。 1から1.5時間のための固定は、唾液腺をお勧めします。 1ミリリットルの最小体積は1.5mlマイクロチューブに組織を固定することをお勧めします。
- 組織が微量遠心チューブの底に沈殿することができます。これは、プロトコルのソリューションのすべての変更を、以下の重大なサンプルの損失を最小限に抑えることが重要なステップです。
- マイクロチューブ内容積の50〜100μlの溶液を残して、慎重にピペットで固定液をデカントし、3×、PBTで5分間ずつ洗浄する。
- 組織のストレージ用のオプションの平衡化手順を実行します。段階は、エタノールまたはメタノールのいずれかでPBTをすすいでください。 PBT /アルコール(3:1、1:1と1:3、各5分)と段階的な洗浄を行います。 -20℃で100%(200プルーフ)アルコールの店舗組織は組織の微細構造の劣化させずに数ヶ月間保存することができます。プロトコルの後続の手順を実行する前に、組織は、アルコール/ PBT(3:1、1:1、で段階的に平衡でPBTに返さなければなりません1:3、各5分)。
- PBTは3×各5分間洗浄を実行します。
- 0.01 mg / mlのプロテイナーゼK / PBT、室温で5分とタンパク質の消化を行います。 RNAのin situで標的タンパク質とのハイブリダイゼーションの両方の免疫局在が望まれている場合あるいは、卵巣は10分の代わりにプロテイナーゼKで処理し、-20°Cで80%アセトン/ H 2 Oとインキュベートすることができます
プロテイナーゼK処理は、唾液腺の準備のために省略されています。 3.10ステップに直接進んで下さい。 - すぐに注意してピペッティングによる消化液をデカント。消化を停止するには、氷冷PBT 2×、5分ごとに洗浄します。
- 実行する追加のPBTは、2×、室温で5分間ずつを洗う。
- 30分間、章動と室温で軟部組織の固定液で後固定します。ポスト固定ステップは、唾液腺のために実行されていません。
- PBTは、5×、5分ごとに洗う実行します。
4。ハイブリダイゼーション
- の章動で30分間Hyb中/ PBT(1:1)1mlを室温でインキュベートすることにより、ハイブリダイゼーション溶液(HYB)に組織を平衡化させます。
- デカントHyb中/ PBT、できるだけ多くの。各サンプルチューブにHyb中の1ミリリットルを追加します。
- ハイブリダイゼーションボトル内部に密封された空気の保護包装(プチプチ)と、場所に試料管をラップします。ハイブリダイゼーションボトルキャップとボトルをシールします。
- プレハイブリダイゼーションおよびハイブリダイゼーションのステップは、ハイブリダイゼーションオーブンで簡単に行うことができます。回転で30分間55℃でプレハイブリダイゼーションを行います。
- Hyb中ではPBTよりも密であるように、遠心チューブの底に沈殿するために組織のために十分な時間を許可します。慎重にプレハイブリダイゼーション溶液をデカント。組織は半透明の可視化が困難になる可能性があります。サンプルの損失は、各サンプルチューブに溶液量の50〜100μlを残すことによって減らすことができます。
- 55℃でヒートブロックにサンプルチューブにHyb中の50μlのボリュームを追加し、維持する
- 5〜10分間85℃でRNAプローブを変性させる。すぐに、氷上で5分間変性したプローブを配置します。
- サンプルチューブにRNAプローブをピペット。 RNAプローブは、Hyb中の表面に浮かぶでしょう。軽くチューブをフリックで混ぜる。
- サンプルあたりのHyb中の50〜100μlの総量でハイブリダイゼーションを行います。ハイブリダイゼーションオーブン内の固定マイクロラック、または55℃の水浴中で浮動小数点マイクロチューブのラック、°16から24時間のためにCでサンプルをインキュベートします。
5。 RNase A処理
- プローブを含むHybを削除します。それは、残留非結合プローブの非特異的結合を減らすために洗浄工程の間に55°Cでサンプルを維持することが重要です。いくつかのサンプルをハイブリダイズさせる場合には、洗浄ステップを通してハイブリダイゼーション温度を維持するために55℃に設定ヒートブロックにサンプルチューブを保持することをお勧めします。
- マイクロ浴槽に溶液1mlをピペッティングによりHyb中で迅速に洗浄を行うeと5-6回のサンプルチューブを反転。
プロトコルのすべての後続のクイック洗浄が必要なソリューションと反転サンプルチューブを数回追加することにより、同様に実行されます。 - 55 Hyb中で2つの追加の洗浄°C、30分間ハイブリダイゼーションオーブン内の回転に伴って各手順を実行してください。
- 章動と15分間Hyb中/ PBT(1:1)で、室温でインキュベートすることにより、PBTに平衡化します。
- PBTは、5×、5分ごとに洗う実行します。
- 新鮮なRNase Aをバッファを準備します。 RNase Aを30分間20μgの37 / mlのRNase Aを/ PBT°Cでインキュベートすることにより治療を行います。 RNアーゼ切断、一本鎖RNAとハイブリダイズしたRNAプローブの分解になります。
- デカントRNase緩衝液とPBTとの迅速な洗浄を行います。
- PBTは3×各5分間洗浄を実行します。
6。抗体インキュベーション
- インキュベーションによって新鮮なブロッキング溶液(5%ニワトリ血清/ 1%西洋ブロッキング試薬/ PBT)とブロックのサンプルを準備します。章動と室温で30分間溶液1mlでティン。
- ブロッキング溶液中の抗DIG-アルカリホスファターゼ(AP)標識抗体の1:1000希釈液200μlを追加します。章動で一晩、4℃でインキュベートします。
7。アルカリホスファターゼ染色
- 抗体とブロッキング液を除去します。
- PBTと迅速な洗浄を行います。
- 実行する追加のPBTは、5×、10分ごとを洗う。あるいは、サンプルは3倍、10分各4で拡張された洗浄°C、章動と一晩続いて洗浄することができます。
- 新鮮なAP染色バッファーを準備します。
- AP染色用緩衝液で迅速に洗浄を行います。
- AP染色バッファ3で追加洗浄×、5分間の章動の各手順を実行してください。
- 製造元の指示に従って、APの基質NBT / BCIPを含む新鮮なAP染色液によると、準備します。
- 部屋temperaturでAP染色液500μlの各サンプルをインキュベート暗闇の中で章動を持つe、。サンプルは、不透明な容器またはアルミホイルでチューブを覆うことによって培養することができます。反応の進行は、紫色の沈殿物を形成するためのすべての1-2分を監視する必要があります。プローブ濃度、標的RNAの濃度と非特定のターゲットの存在に応じて、染色は、数分から数時間のために進むことができます。
- できるだけ染色液の限りを削除します。その後の洗浄工程の間に白い綿状沈殿の形成に不満足なデカンテーションの結果。
- 染色は、PBTを持つ2つの迅速な洗浄を行うことにより、完全に停止されています。
- 実行する追加のPBTは、3×、それぞれ5分間洗浄する。
8。取付グリセロール
- パイレックススポットプレートの個々の丸底ウェルにマイクロチューブから大口径200μlのピペットチップ、転送のサンプルを使用します。
- 慎重に、できるだけPBTの多くは、サンプルから削除。
- サンプルを70%グリセロール/ H 2 Oの上にピペット一晩、4℃でサンプルを組織に浸透しグリセロールを許可します。グリセロール治療はスライドマウントの間に組織の乾燥を防ぎます。
- 摺動面がキムワイプで拭いて拭いて顕微鏡スライドを準備します。お互いに見えないテープに平行二枚なので狭いチャネル( 図2)を形成しているスライドに適用されます。
- 芸術のブラシを使用して、サンプルを一つずつをピックアップし、後方/前方と背/腹アライメントに関しては、同じ向きで、各サンプルの位置決めは、チャネルの長さに沿って配置します。
- 各サンプルを配置した後、組織( 図3)周囲の過剰なグリセロール溶液を吸収するためにキムワイプ綿棒を使用しています。過剰なグリセロールの除去はカバースリップの下にスライド上にマウントされたサンプルを密封するとき、気泡の形成を防止することが重要です。
- センターと場所を慎重にAC整列サンプルを含むチャネルを介してスリップオーバー。接辞カバーは透明なマニキュアでカバースリップの四隅を軽くたたくことによってスライド上に半永久的にスリップ。
- 200μlのピペッターを使用して、十分に70%グリセロールは、毛細管現象により、チャネル全体のスペースとカバースリップの下の領域を埋めるために、チャネルの一方の端にゆっくりと分注する。
- 恒久的にカバースリップのすべての4つの辺に沿ってマニキュアを適用することにより、マウントされたサンプルを密封します。マニキュアは、ハイブリダイズしたホールマウント組織の撮影前に十分乾燥することができます。それはすぐにマウントした後のサンプルの画像を撮影することをお勧めします。
モスキート胚のin situで B.ハイブリダイゼーション
蚊胚のin situでのハイブリダイゼーションのために必要な溶液とバッファーは、( 表1)に記載されている。ここに提示さ固定とハイブリダイゼーション手順はthosから変更された電子は、最初にハマダラカ 、5,6 ネッタイシマカ 7とネッタイイエカのために報告した。8
1。胚コレクション
- 胚は300交尾雌成虫蚊(48時間、3日後に出現するための雄と交尾を許可)吸血後72時間から収集されます。蚊は、意図された収集期間に先立って産卵を防ぐために、3 Mのショ糖溶液で維持されます。
- 16オンスの内側を覆うことにより胚の回収容器を準備します。カップの内側の面が完全に覆われるようにSaatileneハイテックメッシュの紙コップ。メッシュは、単一のステープルを使用して貼付することができます。このメッシュを使用すると、大幅にワットマン濾紙、または紙タオルが使用されている場合に存在する繊維状の夾雑物を減らすことができます。
- 蒸留水で半分フルコンテナを記入してください。
- 胚はその後覆われているケージ内のコレクションコンテナを配置することにより、1時間に収集され暗い布で産卵を刺激する。
- 収集された胚は、標準的な飼育条件(相対湿度85%/ 26°C)でケージの外に望ましい発達段階に成熟するために許可されています。様々な段階に胚の成熟は、( 表2)に記載の胚性イベントのおおよその発達の時間経過後の時間(数時間後産卵)に相関することができます。このテーブルはRaminaniとCuppによって報告されたネッタイシマカのための胚発生の主要イベントをまとめて、9,10 ハマダラカはイワノワ-Kazas 11で最初に説明し、さらにGoltsevや同僚、12,13とDavisによって報告されたアカイエカネッタイイエカによって産生され14説明する時間のコースは、開発の特定の段階で胚の収集のために、最初の見積もりではなく、絶対時間ポイントとして機能することを意図しています。
2。 Dechorionation、ボール、そしてEndochori中断に
- Saatileneメッシュdechorionationキャッチチューブに回収容器( 図3)からの胚を転送します。
ヒトスジシマカの胚については、キャッチ·チューブのボリュームが完全に半分になるように十分な蒸留水で満たされているビーカーにキャッチチューブを配置します。芸術のブラシはSaatileneメッシュから胚を取り除くと水で満たされたキャッチ·チューブにそれらを転送するために使用することができます。
ハマダラカの胚については、回収容器からSaatileneメッシュを切り離し、漏斗を形成するために慎重にメッシュを折る。片手メッシュ漏斗を保持するには、キャッチ·チューブに胚を洗浄するために漏斗の側面に沿ってポリエチレン噴出ボトルを介して蒸留水を分配するためにもう一方の手を使用しています。彼らが産卵基質に付着する卵を可能にするヒトスジシマカの胚の表面上に存在する粘着性物質を欠いているため、このメソッドは、 ハマダラカの胚に適用することができます。 - PRdechorionationソリューションのepare 40ミリリットル(1巻5.25%次亜塩素酸ナトリウム:蒸留水の3巻)。 100ミリメートルのペトリ皿に溶液を注ぐ。
- 蒸留水50mlを含む100mlのビーカーを用意して脇に置きます。 dechorionationステップは、胚をdechorionation液を希釈し、この水に浸漬される時間に依存するとすぐに次の次亜塩素酸ナトリウム処理である。
- dechorionation液で満たされたペトリ皿にチューブを配置することによって、メッシュキャッチチューブ内に胚をDechorionate。キャッチ·バイアルを旋回しながら胚はdechorionation溶液に浸漬し、攪拌残るように、胚を洗浄する使い捨てポリエチレン転送ピペットやパスツールピペットを使用しています。
75秒は、 ハマダラカとアカイエカ胚( 表3)のために十分ですが35秒の最大数は、 ヒトスジシマカ胚の dechorionationするために必要です。 Dechorionationはprotの最も敏感なステップの一つであるocol次亜塩素酸ナトリウム処理の過拡張は、具体的にはヒトスジシマカの胚のために絨毛膜の適切な割れを防ぐことができます。 - 水を含むビーカーにすぐに水没キャッチバイアル。
- 水で満たされたビーカーからキャッチ·チューブを取り外して、チューブを装着し、噴霧ボトルや蛇口から蒸留水でキャッチ管の内壁と外壁をオフに洗浄することにより胚から、残りのdechorionationソリューションを洗い流してください。
- Dechorionationは、低倍率で解剖顕微鏡で胚を可視化することにより確認することができます。 Dechorionated ヒトスジシマカの胚では、網のようなexochorionが不足していると黒endochorionの唯一の、滑らかで洗練された表面はdechorionated ハマダラカの胚については、exochorionicフロートとリッジ構造は( 図4)は存在しないは明白である。
- 芸術のブラシを使用して、蒸留WAの5ミリリットルを含むシンチレーションバイアルにdechorionated胚を転送するTER( 図5-1)。複数のサンプルが用意されている場合は、胚の乾燥を防ぐために、水中でキャッチ管を維持します。
- 胚はシンチレーションバイアルの底に沈殿し、可能な限り、バイアルからできるだけ水を除去しましょう。
- シンチレーションバイアル( 図5-2)にヘプタンの5ミリリットルを追加します。シンチレーションバイアルに残っている残留水を除去する。
- シンチレーションバイアル中に新たに調製した胚の固定液( 表1)5ミリリットルを追加します。
- 有機相と水相を徹底的にミックスではなく、積極的になるように反転した30分間胚を修正します。
- ( 図5-3)の胚を含む中間相を乱さないように注意しながら、ガラスパスツールピペットを用いて固定液を除去します。
- できるだけ多くの蒸留水でシンチレーションバイアルを充填することにより、残留固定液を洗い流してください。バイアルを5回反転させるとその後、蒸留水をすべて削除します。
- 30分間反転バイアルによって蒸留水と混合20mlのシンチレーションバイアルを記入してください。
- シンチレーションバイアルからの水のすべてを削除します。
- 無機ヘプタン相はバイアルの上部に到達するようにシンチレーションバイアルに十分に沸騰蒸留水を追加します。
- 30秒間インキュベートした後沸騰したお湯をすべて削除します。
- 無機相はバイアルの上部に到達するまで氷冷蒸留水を追加します。 10分間氷中にバイアルをインキュベートします。
- まず水相および有機相を除去します。ヘプタンは、このステップ( 図5-4)で不透明に表示されます。
- バイアルに新しいヘプタン5mlを追加します。バイアルから残りのすべての水を除去する。
- バイアル瓶にメタノール5mlを追加します。 1-2回精力的に渦巻バイアルを振とうせず( 図6)。無機と有機ヘプタン、メタノール相は胚のWi激しく振盪している場合endochorion破裂時に破壊されるでしょう。それは我々がネッタイシマカの胚の異なる株に対してendochorion破壊の効率の変化を観察していることについて言及することは注目に値する。
- 15から20分間室温でインキュベートします。この段階では、フェーズが卵黄成分( 図5-5)の放出に起因する濁りになります。
- 有機および無機相の両方を削除し、すべての残留ヘプタンを除去するためにメタノールで3回洗浄します。
- 数ヶ月までのための胚は-20℃でメタノールに格納することができます。
3。剥離
- 3センチメートルペトリ皿の中央にある両面かつらテープの部分を配置します。接着剤は、メタノールとエタノールの存在下で安定であるため、かつらテープが使用されています。
- 大口径(約3 mm径)200μlのピペットチップ、両面テープの上にメタノールからの転送の胚を用いた。
- 胚の1〜2分が安定することを許可するとADHテープ表面にERE。
- デカント過剰のメタノールと表面が1〜2分間少し乾燥させます。
- ペトリ皿に95%(190プルーフ)エタノール4 mlのを追加します。
- エタノールと混合する渦に蒸留水600μlをピペット。テープは、色で不透明になります。蒸留水の添加は、テープは粘着性となり、剥離時に胚を固定するようになります。必要に応じてこのステップを省略することができます。
- ひびの入ったendochorion( 図7)剥離に1 mlのシリンジバレルに接続されている27.5ゲージの針を使用しています。黒endochorion残骸から白い胚を解放した後、テープから微先端芸術のブラシを使用して、ペトリ皿のエタノールタンクに胚を転送します。 3 mmのボアピペットチップを使用して、200プルーフエタノール500μlを含むAmbionの1.5mlマイクロチューブに胚を移す。
彼らは当たり付着する可能性があるため、剥離胚は長時間テープに残っているべきではありませんmanentlyテープへ。 - 100%(200プルーフ)エタノールを2〜3クイック洗浄を行い、-20℃で堅苦しいエタノールで胚を保存する剥離胚が形態またはそれ以降のハイブリダイゼーションシグナルに影響を与えることなく、数ヶ月間-20℃で保存することができます。
4。卵黄の明確化
- 200プルーフエタノールで迅速に洗浄を行います。堅苦しいエタノールは、後続のすべての洗浄工程およびP-キシレン卵黄浄化液の調製に使用する必要があります。
- 1エタノール洗浄、章動で5分間実行します。
- 章動の1から1.5時間室温でP-xylene/ethanol(9:1)でインキュベートする。キシレンのステップは、信号対雑音比を高めるために卵黄塊の明確化を可能にします。
- キシレン·エタノール溶液を除去し、エタノールで2つの迅速な洗浄を行います。
- 1エタノール洗浄、章動で5分間実行します。
- 1メタノール洗浄、続いてメタノールを持つ2つのクイック洗浄、と5分を実行します。章動。
- メタノール/ホルムアルデヒド固定液(1:1)で一度洗浄することにより、4%ホルムアルデヒド固定液中に平衡化します。
5。 in situで固定とハイブリダイゼーション
現場の手順で固定とハイブリダイゼーションは、プロトコルセクションAに記載されているものと同じです。
C.描写結果
現場プロトコルのハイブリダイゼーションは、ここで標的mRNAの存在および局在を示す色の染色パターンの結果を説明します。転写産物の存在量の相対的なレベルがin situでのハイブリダイゼーションにより決定することができないことを強調することが重要です。ハイブリダイゼーションの結果は、ハイブリダイゼーションの手順については、使用される特定のmRNAプローブ、ハイブリダイズ組織における標的mRNAと同様に、プローブ濃度、ハイブリダイゼーションの温度を豊富に依存しています。アンチセンスとハイブリダイズ組織の比較と対応するセンスmRNAのプローブは、染色パターンの正確な解釈を可能にします。
ターゲットamylase1(AAEL006719)、D7s2(AAEL006423)、およびD7L2(AAEL006424)は遠位側、近位側でこれらの転写産物の蓄積を示すことmRNAプローブの女性ネッタイシマカの全体のマウント唾液腺の in situ ハイブリダイゼーション、および遠位3蚊種の内側/外側それぞれのローブ、( 図8)。1ホールマウント卵巣は、特にオスカーのそれぞれのオルソログの転写産物を対象とします( 図9)のmRNAプローブとハイブリダイズさせた。ホールマウント胚のin situで 7,8ハイブリダイゼーションAEの。ネッタイシマカ、。ハマダラカとCx。ネッタイイエカは、それぞれの蚊オスカーオルソロガス転写( 図10)を標的とするアンチセンスRNAプローブを用いて行った。7,8
igure 1 "SRC =" / files/ftp_upload/3709/3709fig1.jpg "/>
図1。ハイブリダイゼーション後の模式図では、セットアップ取り付け。
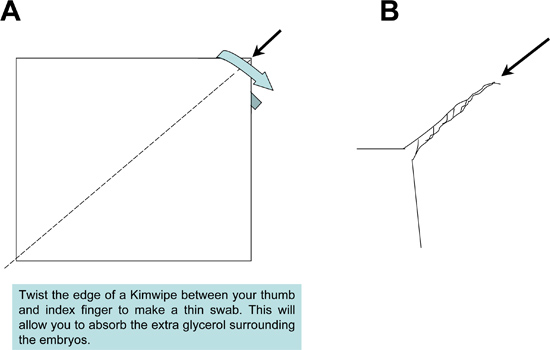
図2。キムワイプモップの調製は、サンプルの取り付け時に使用される。キムワイプ組織をサンプルとスライドから余分な封入剤を吸収するために先の細いモップを生成するためにしっかりとツイストされています。
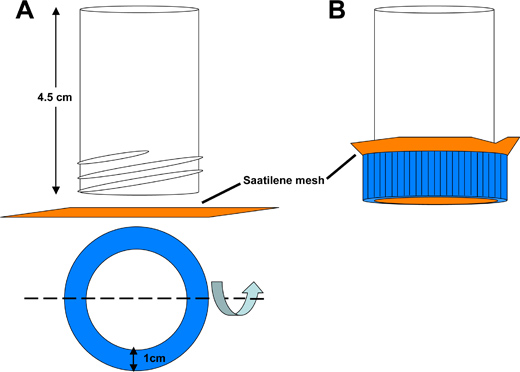
図3。 Saatileneメッシュdechorionationキャッチ管の概略図。)50 mlのポリスチレンコニカルチューブの底部は両端の長さは4.5センチ、開いた中空管を得るために切断されています。円形の開口部はSaatileneメッシュの6.5 cm 2の正方形片を洗浄する液体を許可するコニカルチューブの蓋から切り取られています。インチあたり330のスレッド、34ミクロン径のスレッドのメッシュスクリーンは、蚊の胚を保持します。 B)お尻チューブをキャッチembled。

4 ネッタイシマカやハマダラカの卵、dechorionation前後) ネッタイシマカの卵前dechorionationの図 。メッシュ状のexochorionは黒endochorion上に位置し、卵の質感の外観(挿入図の拡大)を与えます。 exochorionの除去に続いて、唯一の、滑らかで洗練されたendochorionは(Bとはめ込み拡大)のまま。 C)dechorionation前にハマダラカの卵。浮動小数点数などのExochorion構造(矢印)は表示されます。 D)endochorionの滑らかで洗練された表面はdechorionation後に表示されます。バー= 100μmである。

図5。 AEの固定とendochorion混乱の順次一連の手順。ネッタイシマカの卵)傾斜、正面と AE を含むシンチレーションバイアルのB)側面ビュー。固定とendochorionの混乱の連続工程中のネッタイシマカの卵。蒸留水の1)胚。 2)胚は、上部ヘプタン相と下層の水相との間の相間に浮かんでいる。 3)以下の固定胚は丸い塊に一緒にパックします。胚は、ヘプタンおよび固定液相間相間に残っています。 4)氷の沸騰したお湯とインキュベーションで処理した後、ヘプタン相はわずかに不透明になります。 5)中断endochorionsを持つ胚は不透明ヘプタン相と透明なメタノール相との間の相間に示されています。

図6。固定AEのEndochorionの中断。ネッタイシマカの卵 。 A)直後には、エネルギッシュなヘプタン、メタノール相から渦巻く、気泡の形成とendochorionの混乱を可視化することができます。 B)Followi室温でのインキュベーションのngの5分。
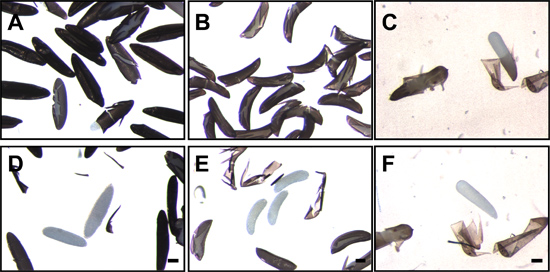
図7。混乱とendochorionを除去した後蚊の卵。 ヒトスジシマカの卵。ネッタイシマカ(A)、。ハマダラカ (B) とCx。ネッタイイエカ (C)は、以下の固定とendochorionの破壊。白、半透明の胚が割れendochorion内で見ることができます。 endochorionを除去した後、AEの半透明の胚。ネッタイシマカ(D)、。ハマダラカ (E) とCx。ネッタイイエカ (F)がはっきりと見える。バー= 100μmである。
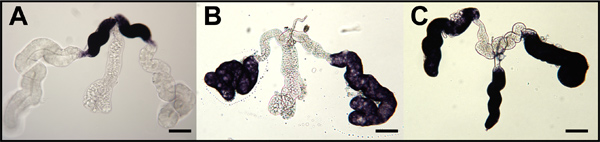
図8。全マウント、メスAEの異なる葉で表現3遺伝子のin situでのハイブリダイゼーション。ネッタイシマカ唾液腺 。染色はamylase1の局在と蓄積の指標である(AAE L006719)()、D7s2(AAEL006423)(B)とD7L2(AAEL006424)(B)。バー= 100μmである。
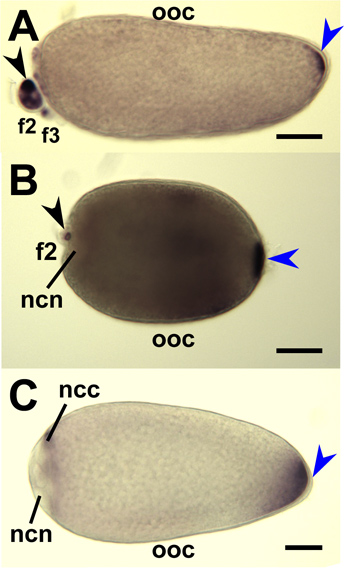
図9。全体のマウント蚊の卵母細胞と看護師細胞への蚊オスカーアンチセンスRNAプローブのin situでのハイブリダイゼーション 。 IV期の卵母細胞(OOC)は、卵巣から解剖した。ハマダラカ(A)、AE。ネッタイシマカ (B) とCx。ネッタイイエカ (C)とそれぞれの蚊オスカーmRNAを標的RNAプローブでハイブリダイズした。主な卵胞は、左の前方の指向です。後極での染色(青矢印)が蓄積されたオスカー mRNAを示しています。二次(F2)および第三(F3)卵胞が示され、染色(黒矢印)は、看護師の細胞質(NCC)でオスカーmRNAの蓄積を示しています。染色は、看護師の細胞核(NCN)から除外されます。バーは=50μmである。
ad/3709/3709fig10.jpg "/>
図10。全体のマウント蚊の胚に蚊オスカーアンチセンスRNAプローブのin situでのハイブリダイゼーション 。胚は、左側前方の指向です。の細胞性胞胚期の胚。ハマダラカ () とCx。ネッタイイエカ (C)はそれぞれの蚊種特異オスカー RNAプローブとハイブリダイズされています。 B)シンシチウム胚盤葉期のAe。ネッタイシマカの胚は 、AE を標的RNAプローブでハイブリダイズした。ネッタイシマカオスカー転写。染色は、これらの細胞における蚊オスカーmRNAの局在化および蓄積を示す、すべての胚の後極細胞では明らかである。バーは=50μmである。

表1:in situでのホルムアルデヒドゲル電気泳動、固定とハイブリダイゼーションのためのソリューションおよびバッファ。
ftp_upload/3709/3709table2.jpg "/>
表2。蚊胚形成の間に連続した段階に対応した発達のイベントや形態学的観察。

表3種々の組織の種類のプレハイブリダイゼーションステップの主な相違点のまとめ。
ディスカッション
全体のマウント蚊組織および胚のためにここで紹介する場と比色染色プロトコールでのハイブリダイゼーションは、特定の臓器や細胞型内転写産物の局在のために有用な技術である。これらの手順は、私たちの以前に報告された方法に比べて、両方の広範な洗浄工程の合理化と技術的な詳細および試薬ソースを提供することで改善されています。
我々の経験では、ハイブリダイゼーションシグナルの比色検出は、蛍光ベースの検出方式に比べてハイブリダイゼーションシグナルの感度と透明性に優れています。また、比色検出は、本質的に自動蛍光性である胚の信号差別に関連する問題を回避します。低濃度の転写産物をターゲットにされている場合ハイブリダイゼーションシグナルを検出するのに制限が発生し、バックグラウンド染色は明白である。 65ハイブリダイゼーション温度を上昇させる°Cは、バック減らすことが見出されているグラウンドハイブリダイゼーションシグナルが、固有のターゲットに特異的なRNAプローブを設計するための提案代わるものではありません。
このプロトコルは、全マウント唾液ネッタイシマカの腺、卵巣、 ハマダラカ、ハマダラカ、AEの胚の in situ ハイブリダイゼーションを行うために使用されています。ネッタイシマカとネッタイイエカ 。また、このメソッドは、他の蚊の組織に適用されると、おそらく他の昆虫のものです。さらに、我々は3つのベクトル蚊、 ヒトスジシマカにおける胚発生のステージングのための最初の時間の比較のガイドラインについては、コンパイルされます。ネッタイシマカ、。ハマダラカとCx。 fatigans。観測は控えめな飼育条件下では、これら3種の特定の株が報告されている。開発時間のコースは蚊種の異なる株のために、異なる飼育条件下で異なることに注意することが重要です。 ANAへの努力継続的にその場サプリメントでハイブリダイゼーション蚊やその他の節足動物のトランスクリプトームをlyze、これらの生物における遺伝子発現の調節の良い画像を提供することがあります。
開示事項
著者らは開示しません。
謝辞
著者らは、その後にハイブリダイゼーションのためにここで記述されたプロトコルを開発するために適応し、変更された、 ハマダラカの胚の in situ ハイブリダイゼーションのためのプロトコルの議論のための軟組織とユーリGoltsevその場の方法でハイブリダイゼーションの開発に助言をマリカ·ウォルターズに感謝したいと思いますヒトスジシマカとアカイエカの胚の in situ。我々はまた、アダム·パレとDavid Kosmanによって与えられた有用な提言を認める。我々は科学的な議論とプロトコルのテキストを編集するためのオズワルドMarinottiに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(オプション) |
| 0.5 M EDTA | Ambionの | AM9261 | |
| 1MのTris-HCl | Ambionの | AM9855G | pH8.0 |
| 10×PBS | Ambionの | AM9625 | |
| 20X SSC | Ambionの | AM9763 | |
| 1.5mlマイクロチューブ | Ambionの | AM12400 | 可視化サンプル中のエイズ、標準のチューブよりも小さい不透明な |
| 脱イオン化ホルムアミド | Ambionの | AM9342 | 4°Cでの保存 |
| DEPC水 | Ambionの | AM9932 | |
| プロテイナーゼK | Ambionの | AM2546 | |
| 5.25%次亜塩素酸ナトリウム | オースティンの | A-1ブランド | |
| T3 RNAポリメラーゼプラス | Ambionの | AM2733 | -20°Cでの貯蔵 |
| T7 RNAポリメラーゼ | Ambionの | AM2082 | -20°Cでの貯蔵 |
| 95%エタノール | フィッシャー·サイエンティフィック | AC61511-0040 | |
| Fisherbrand使い捨てポリエチレン転送ピペット | フィッシャー·サイエンティフィック | 13から711-7M | |
| 37%ホルムアルデヒド | フィッシャー·サイエンティフィック | F79-500 | |
| HPLCグレードのメタノール | フィッシャー·サイエンティフィック | A452-1 | |
| 塩化マグネシウム | フィッシャー·サイエンティフィック | M87-500 | |
| 顕微鏡のカバーガラス | フィッシャー·サイエンティフィック | 12-542A | 18×18ミリメートル |
| n-ヘプタン | フィッシャー·サイエンティフィック | H350-1 | |
| P-キシレン | フィッシャー·サイエンティフィック | O5082-500 | |
| パイレックス9ウェルスポットプレート | フィッシャー·サイエンティフィック | 13-748B | 100x85ミリメートル |
| 塩化ナトリウム | フィッシャー·サイエンティフィック | AC32730-0025 | |
| 水酸化ナトリウム | フィッシャー·サイエンティフィック | SS255-1 | |
| Superfrost /プラス顕微鏡スライド | フィッシャー·サイエンティフィック | 12-550-15 | 25x75X1.0ミリメートル |
| Davlynレッドクリアライナーかつらテープ | 直接髪 | RED-75R12 | ポリ/ X 12ヤードテープロールのスキン基材0.75 |
| ワントップ10化学的にコンピテントE.とSequeningためのTOPOTAクローニングキット大腸菌 | インビトロジェン | K457501 K457540 | 20反応 40反応 |
| 超音波処理サケ精子DNA | インビトロジェン | 15632-011 | -20°Cでの貯蔵 |
| 抗ジゴキシゲニン-AP、Fabフラグメント | ロシュ·ダイアグノスティックス | 1093274 | 4°Cでの保存 |
| DIG RNAラベリングミックス | ロシュ·ダイアグノスティックス | 1277073 | -20°Cでの貯蔵 |
| NBT / BCIPストック溶液 | ロシュ·ダイアグノスティックス | 1681451 | 4°Cでの保存 |
| 西部のブロッキング試薬 | ロシュ·ダイアグノスティックス | 11921673001 | 4°Cでの保存 |
| Saatileneハイテックポリエステルメッシュ(330.130) | Saatiプリント | 330.34 UO PW | 330スレッド/インチ、34ミクロンのネジ径、オレンジ色 |
| グリセロール | シグマ | G6279-1 | PBTの70% |
| ヘパリンナトリウム塩 | シグマ | H3393 | |
| Tween 20を | シグマ | P1379-500 | |
| 37%ホルムアルデヒド | テッド·ペラ | 18508 | 琥珀色のアンプルに10 mlのアリコート |
| 16オンス蓋つきのソロ紙容器 | ペーパーカンパニー | SOLOKH16AJ8000 | |
| ホウケイ酸ガラスscintillatアタッチされていないスクリューキャップ付きバイアルイオン | VWRインターナショナル | 66022-128 | 500の20ミリリットルの場合 |
| シールドエアーバブルラップcelluar緩衝材 | VWRインターナショナル | 500018-081 | 10フィート/ロール0.188インチの厚さ |
| 鶏血清 | 全血は、どちらの翼静脈から、または幼若鶏から心臓穿刺により採取した。血液が凝固して、30分間氷上に置いたまでは1時間37℃でインキュベートした。血清を10分間3000×gで収集し、遠心分離した。得られた上清(明らかに血清)を使用するまで-20℃で収集し、格納されていました。 |
表4。in situでのハイブリダイゼーションの特異的試薬および機器の表。
参考文献
- Juhn, J. Spatial mapping of gene expression in the salivary glands of the dengue vector mosquito, Aedes aegypti. Parasit. Vectors. 4, 1 (2011).
- Coleman, J., Juhn, J., James, A. A. Dissection of midgut and salivary glands from Ae. aegypti mosquitoes. J. Vis. Exp. (5), e228 (2007).
- Benedict, M. Q. Dissecting Plasmodium-infected Mosquitoes: Salivary Glands, Chapter. 5.4.2. Methods in Anopheles Research. , (2007).
- Sappington, T. W., Brown, M. R., Raikhel, A. S. Culture and analysis of insect ovaries, Chapter. 42.3. The Molecular Biology of Insect Disease Vectors: A methods manual. , (1997).
- Goltsev, Y., Hsiong, W., Lanzaro, G., Levine, M. Different combinations of gap repressors for common stripes in Anopheles and Drosophila embryos. Dev. Biol. 275, 435-446 (2004).
- Benedict, M. Q. Anopheles Embryo Fixation, Chapter. 3.7. Methods in Anopheles Research. Malaria Research and Reference Reagent Resource Center (MR4). , (2007).
- Juhn, J., James, A. A. oskar gene expression in the vector mosquitoes, Anopheles gambiae and Aedes aegypti. Insect Mol. Biol. 15, 363-372 (2006).
- Juhn, J., Marinotti, O., Calvo, E., James, A. A. Gene structure and expression of nanos (nos) and oskar (osk) orthologues of the vector mosquito, Culex quinquefasciatus. Insect Mol. Biol. 17, 545-552 (2008).
- Raminani, L. N., Cupp, E. W. Early Embryology of Aedes aegypti (L.) (Diptera: Culicidae). Int. J. Insect Morphol. & Embryol. 4, 517-528 (1975).
- Raminani, L. N., Cupp, E. W. Embryology of Aedes aegypti (L.) (Diptera: Culicidae): Organogenesis. Int. J. Insect morphol. & Embryol. 7, 273-296 (1978).
- Ivanova-Kazas, O. M. Embryonic development of Anopheles maculipennis Mg. Izv. Akad. Nauk SSSR ser. Biol. 2, 140-170 (1949).
- Goltsev, Y. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Dev. Biol. 330, 462-470 (2009).
- Papatsenko, D., Levine, M., Goltsev, Y. Clusters of temporal discordances reveal distinct embryonic patterning mechanisms in Drosophila and Anopheles. PLoS Biol. 9, e1000584 (2011).
- Davis, C. W. C. A comparative study of larval embryogenesis in the mosquito Culex fatigans Wiedemann (Diptera: Culicidae) and the sheep-fly Lucilla seriata Meigen (Diptera: Calliphoridae) I. Description of embryonic development. Aust. J. Zool. 15, 547-579 (1967).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved